Известия РАН. Серия биологическая, 2020, № 6, стр. 581-585
Необычное поведение полового тельца (ПТ) в сперматогенезе у мышей, подвергшихся мутагенному воздействию
С. Т. Захидов 1, Н. М. Муджири 1, *, И. В. Макарова 2, Л. Е. Андреева 2
1 Московский государственный университет им. М.В. Ломоносова, биологический ф-т
119991 Москва, Ленинские горы, 1, стр. 12, Россия
2 Институт молекулярной генетики РАН
123182 Москва, пл. Акад. Курчатова, 2, Россия
* E-mail: mnatalie91@mail.ru
Поступила в редакцию 29.03.2019
После доработки 21.01.2020
Принята к публикации 13.02.2020
Аннотация
Впервые показано, что у мышей-гибридов F1 CBA × C57BL/6, подвергшихся воздействию химического мутагена дипина, формируются пахитенные сперматоциты с половыми тельцами (ПТ), лежащими за пределами основных ядер. Обнаружены изолированные от ядер ПТ в популяции сперматид. Установлено, что у контрольных и подопытных мышей-гибридов частоты встречаемости таких генетически аномальных пахитенных сперматоцитов составили соответственно 0.22 и 2.9%, а аберрантных округлых сперматид – соответственно 0 и 2.84%. В сперматогенезе у мутантных мышей линии 129 выявлена похожая картина нарушений поведения ПТ, причем как в контроле, так и в опыте. Доли генетически аномальных пахитенных сперматоцитов составили соответственно 0.67 и 0.25%, тогда как доли аберрантных округлых сперматид – 0.1 и 0.17%. Установленные различия между двумя линиями мышей по реакции ПТ на действие дипина могут быть связаны с тем, что у мышей линии 129, подвергшихся мутагенному воздействию, гибель генетически поврежденных развивающихся мужских половых клеток на стадиях, предшествующих пахитенным сперматоцитам и округлым сперматидам, выше, чем у мышей-гибридов F1 CBA × C57BL/6.
У самцов млекопитающих в сложной профазе I мейоза процессам синапсиса гомологичных хромосом, образования синаптонемных комплексов, синтеза РНК и уникальных белковых молекул сопутствуют сильная гетерохроматинизация и компартментализация половых хромосом XY, образование так называемых половых телец (ПТ). На стадии пахитены консолидированные биваленты XY обособляются и располагаются на периферии ядра, занимая только им принадлежащий “домен”. Такое избранное положение ПТ можно рассматривать как одну из главных цитогенетических закономерностей, установленных в свое время в мейозе у гетерогаметного пола. В отличие от аутосом, для которых характерны парность и хромосомный перекрест, половая хромосома не имеет парного гомолога и обладает крайне малым весом кроссинговера. Спаривание и рекомбинация между гетероморфными половыми хромосомами происходят только в небольших участках, в так называемых псевдоаутосомных районах (PAR), расположенных на дистальных концах Y-хромосомы. ПТ, представляющее собой замкнутую специализированную структуру, транскрипционно неактивно. Правда, на стадиях пахитены и диакинеза, метафазы I были выявлены потенциально активные хроматиновые участки (теломерные сегменты X- и Y-хромосом и два внутренних сегмента на X-хромосоме). В ряде случаев, когда инактивации и обособления X- и Y-хромосом не происходит, половой бивалент может ассоциироваться с аутосомами и осуществлять “внеплановую транскрипцию”. В этом случае развитие мейоцитов может сильно нарушаться и в дальнейшем приводить к продукции генетически аномальных гамет, а как следствие, к снижению плодовитости животных (Solari, 1974; Rosenmann et al., 1985; Richler et al., 1987; Handel, 2004; Богданов, Коломиец, 2007; Guichaoua et al., 2009; Рапопорт, 2010; Sciurano et al., 2017; Hu et al., 2018).
В последние годы в целях выяснения причин мужского бесплодия существенное значение приобретают исследования, направленные, в частности, на детализацию характера изменений структуры и поведения половых хромосом в условиях эксперимента или после воздействий экстремальных факторов окружающей среды (Богданов, Коломиец, 2007).
Цель работы – анализ впервые представленных данных, характеризующих неординарное поведение ПТ в развивающихся мужских половых клетках у мышей, подвергшихся мутагенному воздействию.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах были использованы половозрелые самцы мышей-гибридов F1 CBA × C57BL/6 и мышей линии 129/JY (J – Jackson Laboratory, Bar Harbor, CA, USA; Y – питомник в Светлых горах, Россия) с нонсенс-мутацией в гене ДНК-полимеразы йота. Эксперименты на животных проводили в соответствии с требованиями Приказа МЗ РФ № 267 от 19.06.2003 “Об утверждении правил лабораторной практики” и этических норм, изложенных в Правилах лабораторной практики (GLP) Хельсинской декларации (2000).
Мыши были разделены на контрольные и подопытные группы, каждая из которых состояла из четырех самцов. Животные содержались в стандартных условиях вивария (температура воздуха 18–22°C, световой день 12 ч) и получали пищу и воду ad libitum. Контрольным мышам внутрибрюшинно вводили 0.2 мл физиологического раствора, тогда как мышам из подопытных групп также внутрибрюшинно инъецировали химический мутаген дипин (противоопухолевый агент, тетраэтиленамид-1,4-пиперазиндифосфорной кислоты) в генетически активной дозе 30 мг/кг (разбавление в физиологическом растворе). При выбранных условиях эксперимента дипин не обнаружил сильно выраженного угнетающего действия на жизнеспособность животных. Дипин был любезно предоставлен нам И.В. Урываевой (Институт биологии развития им. Н.К. Кольцова РАН).
Мышей из контрольных и подопытных групп забивали путем дислокации шейных позвонков на 14-е сут после начала эксперимента. Извлекали семенники, из которых выделяли конгломераты семенных канальцев, помещали их в 7%-ный раствор поливинилпирролидона (ПВП), максимально разделяли их, затем переносили на предметное стекло в каплю ПВП, покрывали полиэтиленовой пленкой и готовили давленые препараты. После охлаждения в парах жидкого азота, удаляли полиэтиленовые пленки с поверхности, полученные препараты высушивали на воздухе и фиксировали в 10%-ном забуференном растворе формалина (рН 7.2) в течение 10–15 мин. Фиксированные препараты отмывали в проточной, а затем в дистиллированной воде, высушивали на воздухе и окрашивали методом Фельгена.
Цитогенетически анализировались популяции пахитенных сперматоцитов и округлых сперматид, которые в момент воздействия мутагена находились соответственно на стадиях активно пролиферирующих сперматогониев и прелептотены-лептотены профазы I мейоза. Для каждой мыши-гибрида CBA × C57BL/6 подсчитывали 200–500 пахитенных сперматоцитов и 300–600 округлых сперматид. Для каждой мыши линии 129/JY подсчитывали соответственно 100–1000 пахитенных сперматоцитов и 800–1300 округлых сперматид. Частоту встречаемости клеток с отделенными от основного ядра ПТ выражали в процентах.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Мыши-гибриды F1 CBA × C57BL/6. Светооптические наблюдения сперматогенных клеток у животных, испытавших на себе действие химического мутагена дипина, выявили в популяции пахитенных сперматоцитов клетки двух основных типов: клетки c ПТ, занимающими строго фиксированное положение на периферии ядра (норма), и клетки, ПТ которых располагались изолированно от ядер или были связаны с последними тонкими хроматиновыми нитями (рис. 1а, б); изредка встречались ядра с двумя ПТ (рис. 1в). ПТ, расположенные за пределами ядер, были обнаружены также в популяциях округлых сперматид (рис. 1г, д) и среди незрелых спермиев (рис. 1е).
Рис. 1.
Ядра сперматогенных клеток у мутагенизированных мышей-гибридов F1 CBA × C57BL/6. а–в – пахитенные сперматоциты; г, д – округлые сперматиды; е – спермии. Н – нормально расположенные ПТ; стрелками указаны ПТ, отделившиеся от основных ядер; двойная стрелка – ядро с двумя ПТ; ХМ – хромосомный мост; МЯ – микроядро; КС – клетка Сертоли. Окраска методом Фельгена; для рис. 1 и 2.
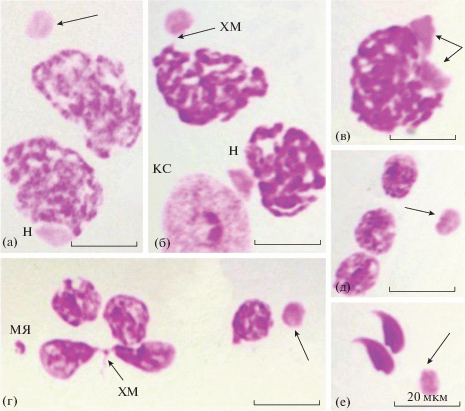
Подсчеты показали, что у контрольных и подопытных мышей-гибридов F1 CBA × C57BL/6 частоты встречаемости пахитенных сперматоцитов, ядра которых утратили ПТ, составили соответственно 0.0, 0.0, 0.6, 0.3% (0.22%) и 2.0, 1.0, 5.7% (2.9%), а частоты встречаемости аберрантных округлых сперматид – соответственно 0.0, 0.0, 0.0, 0.0% (0.0%) и 2.2, 0.6, 6.0, 2.7% (2.84%). В семенниках у одной из изученных подопытных особей пахитенные сперматоциты встречались в единичных случаях.
Мутантные мыши линии 129. В сперматогенезе у особей данной линии была выявлена схожая картина нарушений в поведении ПТ, причем как в контроле (рис. 2а–г), так и в опыте (рис. 2д–з). Согласно проведенным подсчетам, у контрольных и подопытных мышей доли таких генетически аномальных пахитенных сперматоцитов составили соответственно 1.6, 0.25, 0.4, 0.4% (0.67%) и 0.5, 0.0% (0.25%), тогда как доли аберрантных округлых сперматид – соответственно 0.2, 0.11, 0.09, 0.0% (0.1%) и 0.13, 0.23, 0.15% (0.17%).
Рис. 2.
Ядра сперматогенных клеток контрольных (а–г) и мутагенизированных (д–з) мышей линии 129. а, б, д–ж – пахитенные сперматоциты; в, з – округлые и удлиняющиеся сперматиды соответственно; г – незрелые спермии.
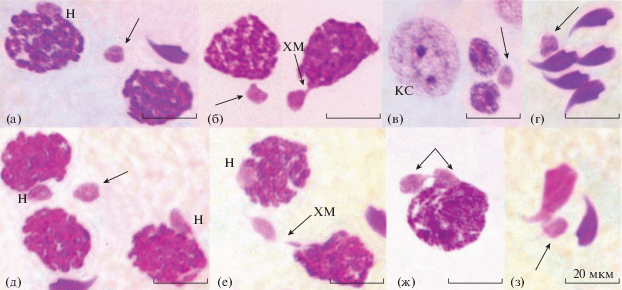
К изложенному следует добавить, что в семенниках у двух из четырех изученных подопытных мышей пахитенные сперматоциты встречались крайне редко, что исключало возможность подсчета числа клеток с нарушениями в поведении ПТ. Тот факт, что у самцов под влиянием дипина частота встречаемости пахитенных сперматоцитов с ПТ, расположенными за пределами ядер, оказалась в 2.7 раза ниже, чем у контрольных животных, свидетельствует о том, что значительная доля сперматогониев, испытавших на себе повреждающее действие дипина, элиминирует, прежде чем достигнет стадии пахитены в профазе I мейоза.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Показано, что воздействие химического мутагена дипина на стадии развития сперматогониальных клеток у мышей-гибридов F1 CBA × C57BL/6 индуцировало резкое изменение в поведении ПТ на стадии профазы I мейоза. Так, на 14-е сут после начала эксперимента у мутагенизированных животных в популяции пахитенных сперматоцитов многократно, более чем в 10 раз по сравнению с контролем, увеличивалось число ядер, утративших ПТ. Пространственная изоляция ПТ от основного генома, однако, не приводила к их скорой деградации и гибели. Напротив, изолированные ПТ сохраняли топологическую цельность и способность проходить через оба деления созревания. В постмейотических, спермиогенных клетках ПТ, избежавшие выбраковки в мейозе, морфологически мало видоизменялись. По сути ПТ тождественны по конфигурации классическим микроядрам, представляющим собой или фрагменты хромосом, или даже целые хромосомы, не вошедшие в основные ядра после клеточных делений (Fenech et al., 2011; Luzhna et al., 2013). Повышенная жизнеспособность и автономность ПТ, скорее всего, обеспечиваются благоприятными условиями цитоплазматического окружения половых клеток, существенными для поддержания наследственных структур и развития гамет в целом (Рапопорт, 1980).
Несколько иная экспериментальная картина наблюдалась в аналогичном опыте, выполненном на мышах линии 129, характеризующихся отсутствием активности специализированной высокоошибочной ДНК-полимеразы йота, играющей важную роль в обеспечении стабильности генома в организме (Генинг и др., 2004; Макарова и др., 2008; Казаков и др., 2010; Kazachenko et al., 2016). Согласно результатам наших наблюдений в отличие от мышей-гибридов F1 CBA × C57BL/6, подвергшихся мутагенному воздействию, у мутантных мышей линии 129 на 14-е сут после введения дипина доля пахитенных сперматоцитов с нарушениями в поведении ПТ не увеличивалась, а, напротив, даже оказалась заметно меньше характерной для контроля. В популяции округлых сперматид, которые произошли от клеток, находившихся в момент воздействия мутагена преимущественно на стадии ранних сперматоцитов I порядка, доля аберрантных ядер также не увеличивалась и была близка к уровню, наблюдаемому в контроле. С известным допущением установленные различия можно связать с тем, что у мутантных мышей линии 129, подвергшихся мутагенному воздействию, уровень выживания генетически поврежденных сперматогониев и ранних сперматоцитов, т.е. клеток, предшествующих соответственно пахитенным сперматоцитам и округлым сперматидам, ниже, чем у мышей-гибридов F1 CBA × C57BL/6. С этой точки зрения ясно, что гибель большого числа клеток с видимыми проявлениями нарушений в структуре хромосомного материала может существенно отразиться на результатах количественной оценки цитогенетических эффектов сильных мутагенов. Более того, как отмечалось выше, в семенниках у двух из четырех изученных подопытных самцов мышей линии 129 практически полностью отсутствовали пахитенные сперматоциты.
Заслуживает внимания и тот факт, что спонтанные нарушения в поведении ПТ чаще наблюдались в популяции пахитенных сперматоцитов у мутантных мышей линии 129, чем у нормальных, физиологически устойчивых мышей-гибридов F1 CBA × C57BL/6.
Одна из наиболее вероятных причин появления в популяции пахитенных сперматоцитов клеток с аномалиями в поведении ПТ – нарушение внутриядерных физико-химических взаимодействий, в норме обеспечивающих фундаментальную устойчивость и упорядоченность активных наследственных структур в клетках, движущихся по сложной G2-фазе мейотического цикла.
Итак, в результате наших исследований сперматогенеза у подопытных мышей F1 CBA × C57BL/6 и мутантных мышей линии 129, дефектных по гену ДНК-полимеразы йота, впервые установлен новый тип хромосомной аномалии, выявляемой во время профазы I мейоза. Это – индивидуализация ПТ, его резкое отделение от основного генома в пахитенных сперматоцитах и сохранение в постмейотических клетках. Столь крупномасштабная аномалия в структуре хромосомного материала, хотя и изменяет общий хромосомный баланс уже на стадии профазы I мейоза, во многих случаях, возможно, не ведет к нарушению процесса созревания постмейотических, спермиогенных клеток и, как следствие, формированию спермиев, анеуплоидных по половым хромосомам XY.
Дальнейшие экспериментальные исследования, в том числе с привлечением современных методов иммуноцитохимии, ультраструктурной цитогенетики, позволяющих детально изучать хромосомы, очевидно, необходимы для понимания структурно-функциональных особенностей и поведения половых бивалентов XY в условиях индуцированного химического мутагенеза. Эти исследования позволят получить новые, очень важные данные о том, способны ли организованные в ПТ половые хромосомы, утратившие контакт с основным ядром, действовать в цитоплазматической среде мужских половых клеток как самостоятельный генетический модуль, т.е. участвовать в процессах репликации, транскрипции, деления.
Список литературы
Богданов Ю.Ф., Коломиец О.Л. Синаптонемный комплекс – индикатор динамики мейоза и изменчивости хромосом. М.: КМК, 2007. 358 с.
Генинг Л.В., Петроченков А.Н., Решетняк А.Б., Андреева Л.Е., Тарантул В.З. Активность, характерная для ДНК-полимеразы йота, в экстрактах клеток из разных органов мыши // Биохимия. 2004. Т. 69. С. 537–543.
Казаков А.А., Гришина Е.Е., Тарантул В.З., Генинг Л.В. Влияние злокачественного перерождения клеток человека на активность ДНК-полимеразы // Биохимия. 2010. Т. 75. С. 1031–1039.
Макарова А.В., Генинг Л.В., Макарова И.В., Тарантул В.З. Активность склонной к ошибкам ДНК-полимеразы йота в разные периоды онтогенеза домовой мыши Mus musculus // Онтогенез. 2008. Т. 39. С. 367–373.
Рапопорт И.А. Хромосомы в репарационном процессе // Химический мутагенез и иммунитет. М.: Наука, 1980. С. 3–35.
Рапопорт И.А. Микрогенетика. М.: Наука, 2010. 530 с.
Fenech M., Kirsch-Volders M., Natarajan A.T., Surralles J., Crott J.W., Parry J., Norppa H., Eastmond D.A., Tucker J.D., Thomas P. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells // Mutagenesis. 2011. V. 26. P. 125–132.
Guichaoua M.R., Geoffroy-Siraudin C., Tassistro V., Ghalamoun-Slaimi R., Perrin J., Metzler-Guillemain C. Sex chromosomes and meiosis // Gynecol. Obstet. Fertil. 2009. V. 37. P. 895–900.
Handel M.A. The XY body: a specialized meiotic chromatin domain // Exp. Cell Res. 2004. V. 296. P. 57–63.
Hu J., Sun F., Hande M.A. Nuclear localization of EIF4G3 suggests a role for the XY body in translational regulation during spermatogenesis in mice // Biol. Reprod. 2018. V. 98. P. 102–114.
Kazachenko K.Y., Miropolskaya N.A, Gening L.V., Tarantul V.Z., Makarova A.V. Alternative splicing at exon 2 results in the loss of the catalytic activity of mouse DNA polymerase iota in vitro // DNA Repair. 2016. V. 50. P. 77–82.
Luzhna L., Kathiria P., Kovalchuk O. Micronuclei in genotoxicity assessment: From genetics to epigenetics and beyond // Front. Genet. 2013. V. 4. P. 131.
Richler C., Uliel E., Kerem B.S., Wahrman J. Regions of active chromatin conformation in 'inactive' male meiotic sex chromosomes of the mouse // Chromosoma. 1987. V. 95. P. 167–170.
Rosenmann A., Wahrman J., Richler C., Voss R., Persitz A., Goldman B. Meiotic association between the XY chromosomes and unpaired autosomal elements as a cause of human male sterility // Cytogenet. Cell Genet. 1985. V. 39, P. 19–29.
Sciurano R.B., De Luca G., Rahn I.M., Solari A.J. The XY body of the cat (Felis catus): structural differentiations and protein immunolocalization // Cytogenet. Genome Res. 2017. V. 152. P. 137–147.
Solari A.J. The behavior of the XY pair in mammals // Int. Rev. Cytol. 1974. V. 38. P. 273–317.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


