Известия РАН. Серия биологическая, 2021, № 1, стр. 103-112
Пространственное распределение беспозвоночных животных в почвах юго-восточной части Большеземельской тундры
А. А. Таскаева 1, *, Т. Н. Конакова 1, А. А. Колесникова 1, А. А. Кудрин 1, А. Н. Панюков 1, Е. М. Лаптева 1
1 Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: taskaeva@ib.komisc.ru
Поступила в редакцию 20.02.2018
После доработки 07.04.2020
Принята к публикации 20.07.2020
Аннотация
Дана характеристика пространственного распределения почвенной биоты (нематод, микроартропод, крупных почвенных беспозвоночных) в растительных фитоценозах юго-восточного сектора Большеземельской тундры (Республика Коми, окрестности г. Воркуты). Для всех исследуемых групп почвенных беспозвоночных отмечено агрегированное распределение, в котором определенную роль играет размерность организма. Показано, что уровень влажности в почвах тундровых экосистем не оказывает существенного влияния на пространственное распределение различных групп почвенных организмов.
На протяжении последних 20 лет изучение пространственного распределения почвенных организмов остается одной из главных задач в почвенной экологии (Ettema, Wardle, 2002; Покаржевский и др., 2007; Decaëns, 2010; и др.). В 1970-х гг. было показано, что для популяции большей части почвенной фауны характерно агрегированное распределение (Usher, 1969). Согласно данным, полученным для комплексов нематод (Viketoft et al., 2013), панцирных клещей (Borcard, Legendre, 1994), коллембол (Ponge et al., 2006; Saraeva et al., 2015), дождевых червей (Joschko et al., 2006), пауков (Puzin et al., 2018) и ряда других таксонов, почвенные организмы распределены не случайным образом, а представляют собой структурированные сообщества в разных пространственных масштабах и на разных уровнях организации (Guo et al., 2019). При этом организация сообществ обусловлена главным образом географическим фактором на уровне региона и неоднородностью окружающей среды, биотическими взаимоотношениями на уровне биогеоценоза (Покаржевский и др., 2007). Однако важно понимать, что результаты, полученные для природных местообитаний, расположенных в условиях субконтинентального и умеренного климата, могут отличаться от таковых в тундровых экосистемах, для которых характерна мозаичность растительного покрова, связанная со спецификой криогенного микрорельефа, а также с избыточным увлажнением и дефицитом тепла. При этом именно дефицит тепла − ведущий лимитирующий фактор в евро-азиатском секторе Арктики (Бабенко, 1993).
Известно, что распределение нематод в высоких широтах агрегировано (Powers et al., 1995) и может определяться не только температурными условиями (Nielsen et al., 2014), но и влажностью (Mills, Adl, 2011), а также составом растительного покрова (Viketoft, 2013), размножением, конкуренцией (Ettema, Wardle, 2002). Распределение коллембол в экосистемах высоких широт, по данным одних авторов (Convey, 2003), обусловлено наличием определенной влажности летом, а не экcтремальными температурами зимой, по данным других (Petersen, 2011; Bokhorst et al., 2012), наоборот, не зависит от влажности. Для пауков и жуков изменения влажности и растительного покрова − важные факторы, как и температура (Hansen, 2016; Høye et al., 2018). Более того, наличие определенной влажности в почве − неотъемлемая стратегия зимовки многих крупных арктических членистоногих (Block, 1996). Ранее было отмечено, что в тундровых экосистемах различия в растительном покрове, влажности и температуре почвы очень важны для распределения почвенных беспозвоночных (Hodkinson et al., 2013).
Большую роль при оценке пространственного распределения могут играть размеры самих организмов, их биомасса (Ettema, Wardle, 2002; Turnbull et al., 2014; Turnbull, Lindo, 2015). Животные разных размерных групп имеют неодинаковые параметры метаболизма, онтогенеза, размера популяций (Woodward et al., 2005). Например, продолжительность онтогенеза крупных форм больше, чем мелких. Кроме того, они нуждаются в большем количестве пищи, чем мелкие (Гиляров, 1944). Следовательно, жизненное пространство крупных организмов должно быть шире такого пространства мелких, причем размеры самого организма относятся к определяющим при его реакции на многие факторы среды (Holland et al., 2005). Так, для более крупных почвенных беспозвоночных (например, дождевых червей) эдафические условия (pH, влажность почвы) играют более важную роль в объяснении их неоднородного распределения, чем для мелких организмов (Joschko et al., 2006).
Нами было выдвинуто предположение, что пространственное распределение почвенных беспозвоночных в тундровых экосистемах будет неоднородным, на что может влиять мозаичность растительного покрова, связанная с избыточным увлажнением и дефицитом тепла, а агрегированность будет выражена сильнее у групп, имеющих бóльшие размеры тела.
Цель работы − оценка пространственного распределения почвенных беспозвоночных, отличающихся своими размерами (нематод, коллембол и мезофауны), в тундровых фитоценозах.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика района исследований. Большеземельская тундра расположена на крайнем северо-востоке европейской территории России. Район исследований относится к атлантико-арктической климатической области с умеренно-континентальным климатом. Среднегодовая температура воздуха по данным ближайшей метеостанции “Воркута” −6.0°С. Период с отрицательными температурами составляет в среднем 239 сут, среднемесячная температура самого холодного месяца (январь) –20.3°С, самого теплого (июль) +12.4°С. Период с биологически активными температурами (≥10°С) ∼1.5 мес. За год выпадает ∼550 мм осадков, из которых ∼46% приходится на теплое время года с положительными среднемесячными температурами воздуха (июнь–сентябрь). Территория района исследований характеризуется распространением преимущественно сплошной многолетней мерзлоты, усиливающей суровость климатических условий.
Пространственное распределение различных групп почвенных беспозвоночных изучали на уровне ландшафта. Для решения данной задачи были выбраны три участка, приуроченных к различным ландшафтным условиям междуречья Усы и ее правого притока – р. Воркуты (табл. 1). На каждом участке были выделены площадки 20 × × 20 м, в пределах которых в июле 2015 г. было отобрано по 25 проб площадью 100 см2 по регулярной сетке через каждые 5 м для учета численности и идентификации почвенных беспозвоночных животных, а в июле 2016 г. – дополнительно по 10 почвенных проб для учета нематод.
Таблица 1.
Краткая характеристика исследуемых ключевых участков (КУ)
| КУ | Положение в рельефе | Абсолютная высота, м над ур. м. | Координаты | Растительное сообщество, тундра | Микрорельеф | Тип, подтип почвы | Строение почвенного профиля | Мощность органогенного горизонта, см | Глубина залегания мерзлоты, см | Влажность почвы, %* |
|---|---|---|---|---|---|---|---|---|---|---|
| КУ-1 | Водораздел рек Усы и Воркуты, плоская вершина гряды Нерусовей-мусюр | 210–220 | 67°31′45′′ с.ш., 64°08′13′′ в.д. |
Крупно-ерниковая, кустарничково-моховая | Пятнисто-бугорковатый | Глеезем криомета-морфический типичный | О–G–CRM–BCg–Cg⊥ | 1(2)−10(15) | 150−180 | $\frac{{119.3 \pm 29.5}}{{47.8 \pm 8.4}}$ |
| КУ-2 | Долина р. Воркуты, вторая надпойменная терраса | 140–150 | 67°25′51′′ с.ш., 63°50′21′′ в.д. |
Мелкоерниковая, кустарничково-моховая | Бугорковатый | Глеезем криомета-морфический криогенно-ожелезненный | О–GcF–CRM–CRM⊥ | 8(9)−10(15) | 100−120 | $\frac{{283.2 \pm 136.9}}{{82.4 \pm 31.6}}$ |
| КУ-3 | Долина р. Воркуты, первая надпойменная терраса | 100–120 | 67°26′03′′ с.ш., 63°49′35′′ в.д. |
Кустарничковая, лишайниково-моховая | Мелко- бугорковатый |
Криомета-морфическая грубогумусовая глееватая | АО–Bcrm–CRMg–CRMg⊥ | 8(10)−20(30) | 80−100 | $\frac{{280.6 \pm 119.0~}}{{149.4 \pm 46.1}}$ |
Первый ключевой участок (КУ-1) занимает вершину водораздельной гряды Нерусовей-мусюр и представлен крупноерниковым кустарничково-моховым сообществом. Такие фитоценозы наиболее характерны для подзоны южных кустарниковых тундр. В кустарниковом ярусе таких сообществ господствует Betula nana L., содоминанты − Salix lanata L., Salix phylicifolia L., Salix glauca L. Сомкнутость кустарникового яруса 0.5–0.7, а высота 0.7–1.0 м. Кустарничковый ярус четко выражен, хотя и разрежен, состоит преимущественно из Empetrum hermafroditum (Lange) Hagerup, Vaccinium vitis-idaea L., Vaccinium uliginosum L. Из травянистых видов можно отметить Carex arctisibirica (Jurtz.) Czer., Carex globularis L., Chamaenerion angustifoluim (L.) Scop, Solidago virgaurea L., Euphrasia frigida Pugsl., Festuca ovina L., Veratrum lobelianum Bernh. Моховой покров почти сплошной, состоит главным образом из комплекса зеленых мхов. Почвенный покров образуют глееземы криометаморфические (табл. 1).
КУ-2 выделен в долине р. Воркуты в пределах второй надпойменной террасы, полого наклоненной в сторону русла реки. Растительный покров образует сообщество мелкоерниковой кустарничково-моховой тундры (табл. 1). По видовому составу растений данный участок близок к КУ-1. Кустарниковый ярус также образует B. nana при участии S. lanata и S. phylicifolia, однако вклад последних существенно менее выражен по сравнению с таковым на КУ-1. Сомкнутость кустарникового яруса 0.6–0.8, его высота 0.5–0.7 м. Кустарничковый ярус разреженный, состоит преимущественно из V. uliginosum, V. vitis-idaea, Ledum decumbens (Ait.) Lodd. ex Staud., E. hermafroditum. Травянистые виды C. arctisibirica, Ch. angustifoluim, S. virgaurea, Pedicularis lapponica L. немногочисленны. В сообществе присутствуют также виды Rubus chamaemorus L. и Petasites frigidus (L.) Fries., характерные для влажных местообитаний. Моховой покров хорошо развит, практически сплошной, состоит главным образом из Hylocomium proliferum (Brid.) Lindb, отмечены также политриховые мхи. На бугорках преимущественно небольшими пятнами встречаются кустистые и листоватые лишайники, в микропонижениях − пятна сфагновых мхов, достигающих 10% общего проективного покрытия (ОПП). Почвенный покров образуют глееземы криометаморфические криогенно-ожелезненные (табл. 1).
КУ-3 располагается на относительно выровненной первой надпойменной террасе р. Воркуты, также полого наклоненной в сторону русла реки (табл. 1). Растительность этого участка – кустарничковое лишайниково-моховое сообщество. В отличие от сообществ, расположенных выше по рельефу (КУ-1 и КУ-2), здесь отсутствует сомкнутый кустарниковый ярус. Высота присутствующих отдельных экземпляров B. nana не превышает 0.3 м. В сообществе несколько содоминантов. В основном это кустарнички V. uliginosum, Arctous alpina (L.) Niedz, V. vitis-idaea. Из трав обильны C. arctisibirica, Eriophorum vaginatum L., Eriophorum scheuchzeri Hoppe, Calamagrostis nrglecta (Ehrh.) Gaerth. ОПП травянисто-кустарничкового яруса 40–50%. Лишайниково-моховый покров сплошной. Лишайники в основном Cetraria, Cladina и Cladonia, располагаются рассеянно, однако в целом занимают до 30% поверхности. До 80% поверхности покрывают зеленые и сфагновые мхи, что свидетельствует о достаточно высокой степени (и даже о некоторой застойности) увлажнения на данном участке. Почва данного участка отнесена нами к типу криометаморфических грубогумусовых, к подтипу глееватых.
Почвы рассмотренных участков характеризуются кислой реакцией среды, обусловленной высокой концентрацией обменного алюминия, низким содержанием обменных оснований, насыщенностью верхних минеральных горизонтов влагой (Kudrin et al., 2019).
Почвенно-зоологические параметры. Для оценки численности нематод их экстракцию осуществляли с помощью модифицированного метода Бермана с экспозицией 48 ч. Нематод фиксировали горячим (80°С) раствором формалина (массовая доля 4%). На основе классификации Итса с соавт. (Yeates et al., 1993) они были разделены на трофические группы: бактериотрофы, микотрофы, политрофы, хищники и фитотрофы. Для оценки численности микроартропод и крупных почвенных беспозвоночных экстракцию проводили по общепринятой методике с использованием эклекторов Берлезе–Тульгрена. Классификацию жизненных форм коллембол осуществляли по системе Стебаевой (Стебаева, 1970). Степень агрегированности особей оценивали с помощью индекса Кэйси (IK) (Saraeva et al., 2015). Также для всех проб рассчитывали значения полевой влажности почв. Для характеристики вариабельности определяемых параметров использовали коэффициент вариации (СV, %). Для оценки связи пространственного распределения нематод и коллембол с их размерами измеряли биомассу. Приведены средние показатели (http://plpnemweb.ucdavis.edu/nemaplex/Ecology/nematode_weights.htm). Средние показатели биомассы для коллембол были рассчитаны для трех массовых видов (Folsomia quadrioculata, Isotomiella minor, Parisotoma notabilis) путем измерения длины и ширины десяти экземпляров каждого из них из разных проб (Turnbull, Lindo, 2015). Всего было отобрано 105 почвенных образцов и извлечено ∼25 тыс. экз. нематод, 48 тыс. экз. микроартропод и 700 экз. крупных почвенных беспозвоночных. Коллемболы, многоножки, черви и имаго жуков были определены до вида, нематоды – до уровня рода.
Статистическая обработка данных. Для каждого параметра рассчитывали его среднее значение на участок и стандартную ошибку. Для оценки значимости различий между выборками использовали непараметрический критерий Манна–Уитни при p < 0.05. Связь пространственного распределения почвенных беспозвоночных с влажностью почвы оценивали с помощью коэффициента корреляции Спирмена (r), анализ которого проводился на основе логарифмированных данных по численности всех рассмотренных групп (таксономических и трофических) педобионтов и показателям влажности (x = ln(n + 1), где n – первичные данные). Связь пространственного распределения нематод и коллембол с их размерами проводили на основе логарифмированных данных значений IK и биомассы конкретного организма. Все расчеты были выполнены с помощью пакета программ PAST 1.89 и Statistica 6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Пространственное распределение почвенных беспозвоночных. Для всех рассмотренных групп (нематод, панцирных, мезостигматических клещей, коллембол, крупных почвенных беспозвоночных) были выявлены агрегированные распределения (табл. 2−4), которые, однако, различались в отмеченных таксономических и трофических группах. Среди нематод наибольшие значения IK были отмечены у хищников. Степени агрегированности мико- и политрофов были незначительны и слабо различались между исследованными участками. Для бактериотрофов максимальные значения агрегированности были выявлены в мелкоерниковой тундре (КУ-2), тогда как на других участках степень их варьирования была ниже (табл. 2). Пространственное распределение доминирующих родов нематод приведено на рис. 1. У всех жизненных форм коллембол IK > 0.3. Особенно отличался таксоцен коллембол крупноерниковой тундры (КУ-1), для которого характерно “очаговое” распределение почвенных видов (IK > 1) за счет доминирования I. minor S., 1896 и Willemia anophthalma B., 1901 (табл. 3). Распределение массовых видов ногохвосток на всех участках также оказалось агрегированным (рис. 1). Среди трофических групп мезофауны наибольшая степень агрегированности была отмечена для фитофагов на всех участках, где IK = 2.9−6.3 (табл. 4). Для зоофагов и сапрофагов минимальные значения были зарегистрированы в почве кустарничковой тундры (КУ-3). Для таксономических групп на всех участках IK > 1 (рис. 1).
Таблица 2.
Численность (экз./100 г) трофических групп нематод в исследуемых тундрах
| Параметры | M ± m | CV, % | min–max | IK |
|---|---|---|---|---|
| Крупноерниковая кустарничково-моховая тундра (КУ-1) | ||||
| Общая численность | 4598 ± 841 | 57 | 1574–8678 | 0.33 |
| бактериотрофы | 1452 ± 374 | 81 | 206–3706 | 0.66 |
| микотрофы | 2623 ± 423 | 51 | 914–4706 | 0.26 |
| политрофы | 204 ± 41 | 64 | 25–413 | 0.40 |
| хищники | 16 ± 7 | 136 | 0–51 | 1.78 |
| паразиты | 207 ± 92 | 140 | 0–992 | 1.96 |
| Мелкоерниковая кустарничково-моховая тундра (КУ-2) | ||||
| Общая численность | 5148 ± 1239 | 76 | 2295–15 556 | 0.58 |
| бактериотрофы | 3207 ± 1103 | 109 | 1250–12 716 | 1.18 |
| микотрофы | 1043 ± 207 | 63 | 240–2222 | 0.39 |
| политрофы | 274 ± 55 | 63 | 0–586 | 0.40 |
| хищники | 54 ± 21 | 122 | 0–154 | 1.47 |
| паразиты | 488 ± 76 | 49 | 171–846 | 0.24 |
| Кустарничковая мохово-лишайниковая тундра (КУ-3) | ||||
| Общая численность | 5362 ± 877 | 30 | 1893–10 000 | 0.27 |
| бактериотрофы | 2511 ± 507 | 64 | 921–5600 | 0.41 |
| микотрофы | 1470 ± 257 | 55 | 286–2778 | 0.30 |
| политрофы | 1038 ± 266 | 81 | 210–2500 | 0.66 |
| хищники | 72 ± 43 | 189 | 0–444 | 3.50 |
| паразиты | 66 ± 27 | 130 | 0–250 | 1.68 |
Примечание. M ± m – среднее арифметическое и ошибка; CV – коэффициент вариации; min–max – минимальное и максимальное значения численности; КУ – ключевые участки; IK – индекс Кэйси; для табл. 2−5.
Рис. 1.
Значения индекса Кэйси для массовых родов нематод, видов коллембол, различных групп мезофауны в исследуемых тундрах. 1 – крупноерниковая кустарничково-моховая, 2 – мелкоерниковая кустарничково-моховая, 3 – кустарничковая мохово-лишайниковая тундра; для рис. 1 и 2.
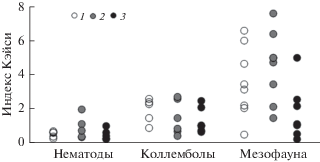
Таблица 3.
Численность (тыс. экз./м2) микроартропод и жизненных форм коллембол в исследуемых тундрах
| Параметры | M ± m | CV, % | min–max | IK |
|---|---|---|---|---|
| Крупноерниковая кустарничково-моховая тундра (КУ-1) | ||||
| Все микроартроподы | 25.3 ± 3.5 | 69 | 4.3–67.8 | 0.47 |
| Oribatida | 14.3 ± 2.6 | 92 | 2.0–49.2 | 0.85 |
| Mesostigmata | 1.2 ± 0.2 | 80 | 0–3.5 | 0.65 |
| Collembola | 9.8 ± 1.3 | 65 | 1.6–22.5 | 0.42 |
| поверхностно-обитающая | 3.1 ± 0.4 | 64 | 0.1–6.8 | 0.41 |
| гемиэдафическая | 3.4 ± 0.6 | 90 | 0.2–11.5 | 0.81 |
| эуэдафическая | 3.2 ± 0.7 | 109 | 0.4–15.9 | 1.19 |
| Мелкоерниковая кустарничково-моховая тундра (КУ-2) | ||||
| Все микроартроподы | 64.7 ± 6.1 | 47 | 2.5–129.3 | 0.22 |
| Oribatida | 36.2 ± 4.0 | 55 | 1.2–74.2 | 0.30 |
| Mesostigmata | 3.1 ± 0.4 | 65 | 0.1–8.8 | 0.42 |
| Collembola | 25.3 ± 2.6 | 51 | 1.1–51.1 | 0.26 |
| поверхностно-обитающая | 8.3 ± 1.4 | 85 | 0.1–26.1 | 0.73 |
| гемиэдафическая | 6.4 ± 1.1 | 85 | 0.1–26.9 | 0.73 |
| эуэдафическая | 9.9 ± 1.5 | 76 | 0.1–31.0 | 0.57 |
| Кустарничковая мохово-лишайниковая тундра (КУ-3) | ||||
| Все микроартроподы | 103.4 ± 16.1 | 78 | 1.8–426.4 | 0.60 |
| Oribatida | 57.4 ± 15.6 | 136 | 1.3–400.0 | 1.84 |
| Mesostigmata | 2.1 ± 0.2 | 57 | 0–4.8 | 0.32 |
| Collembola | 43.9 ± 4.4 | 50 | 0.5–90.0 | 0.25 |
| поверхностно-обитающая | 12.2 ± 1.5 | 61 | 0.4–32.1 | 0.37 |
| гемиэдафическая | 18.9 ± 3.5 | 92 | 0–71.1 | 0.84 |
| эуэдафическая | 12.8 ± 1.5 | 60 | 0.1–34.9 | 0.36 |
Таблица 4.
Численность (экз./м2) трофических групп крупных почвенных беспозвоночных в исследуемых тундрах
| Параметры | M ± m | CV, % | min–max | IK |
|---|---|---|---|---|
| Крупноерниковая кустарничково-моховая тундра (КУ-1) | ||||
| Все животные | 282 ± 41 | 73 | 0–700 | 0.53 |
| зоофаги | 155 ± 31 | 101 | 0–500 | 1.01 |
| сапрофаги | 64 ± 19 | 150 | 0–400 | 2.23 |
| фитофаги | 64 ± 22 | 172 | 0–400 | 2.93 |
| Мелкоерниковая кустарничково-моховая тундра (КУ-2) | ||||
| Все животные | 1220 ± 298 | 122 | 100–6400 | 1.50 |
| зоофаги | 116 ± 26 | 110 | 0–400 | 1.21 |
| сапрофаги | 1048 ± 303 | 144 | 0–6200 | 2.09 |
| фитофаги | 56 ± 28 | 253 | 0–600 | 6.38 |
| Кустарничковая мохово-лишайниковая тундра (КУ-3) | ||||
| Все животные | 1192 ± 124 | 52 | 0–2300 | 0.27 |
| зоофаги | 336 ± 54 | 80 | 0–1000 | 0.64 |
| сапрофаги | 716 ± 105 | 74 | 0–1800 | 0.54 |
| фитофаги | 140 ± 48 | 171 | 0–900 | 2.93 |
Связь пространственного распределения почвенных беспозвоночных с влажностью почвы. Совместный анализ всех исследованных биотопов позволил выявить отрицательную корреляцию влажности почвы с микотрофными нематодами и положительную с численностью политрофных нематод, панцирных, мезостигматических клещей, коллембол, спектра жизненных форм коллембол, а также мезофауны в целом (табл. 5). Анализ массовых родов нематод и видов коллембол не показал значительной их взаимосвязи с влажностью почвы.
Таблица 5.
Оценка влияния влажности на численность таксономических и трофических групп почвенных беспозвоночных (корреляция Спирмена)
| Группа | КУ-1 | КУ-2 | КУ-3 | Тундры в целом |
|---|---|---|---|---|
| Таксономическая группа | ||||
| Микроартроподы в целом | − | − | − | 0.52** |
| Панцирные клещи | − | − | 0.41* | 0.46** |
| Мезостигматические клещи | − | − | 0.41* | 0.45** |
| Коллемболы | − | − | − | 0.45** |
| Мезофауна в целом | − | 0.46* | − | − |
| Личинки двукрылых | − | 0.46* | − | 0.50** |
| Трофическая группа | ||||
| Микотрофные нематоды | − | − | − | –0.36* |
| Политрофные нематоды | − | − | − | 0.59** |
| Поверхностно-обитающие коллемболы | − | − | − | 0.31** |
| Гемиэдафические коллемболы | − | − | − | 0.29* |
| Эуэдафические коллемболы | − | − | 0.49* | 0.56** |
| Сапрофаги, мезофауна | − | 0.45* | − | 0.65** |
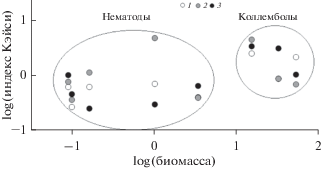
Связь пространственного распределения почвенных беспозвоночных с биомассой организма. Влияние биомассы тела на степень агрегированности массовых родов нематод и видов коллембол статистически значимо (r = 0.46 при p < 0.05). Результаты показывают определенную тенденцию к увеличению значений IK с укрупнением организмов (рис. 2). При этом ни одна из рассмотренных групп не является достоверным фактором распределения другой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о высокой агрегированности таксономических и трофических групп крупных почвенных беспозвоночных по сравнению с таковыми у микроартропод и нематод (рис. 1, табл. 2−4). С одной стороны, это может быть связано с факторами окружающей среды, а с другой − с размерами самих организмов. Известно, что на пространственное распределение почвенных беспозвоночных влияет растительный покров (Viketoft et al., 2013; Hansen, 2016; Høye et al., 2018; Kudrin et al., 2019; Wu, Wang, 2019). Так, представители мезофауны в основном питаются подстилкой, их распределение напрямую зависит от ее качественного и количественного состава (Scherber et al., 2010). Например, в лесных экосистемах крупные беспозвоночные сосредоточены у стволов деревьев, создавая “прикомлевой эффект” (Szujecki, 1987). Это дает возможность предположить, что данный эффект присутствует в крупноерниковой и мелкоерниковой тундрах. В то же время монотонность кустарничково-мохово-лишайникового покрова на КУ-3 обеспечивает более равномерное их распределение в пространстве (рис. 1, табл. 4). Кроме того, в тундрах большую роль играет мозаичность моховой дернины, особенно если в ней преобладают лишайники и мхи, образующие плотные куртины, которые практически не заселяются животными (Чернов, 1964). Возможно, именно этим обусловлено распределение панцирных клещей в кустарничковой мохово-лишайниковой тундре (табл. 3).
Вместе с тем исследования в арктических местообитаниях показали, что пространственное распределение сообщества микроартропод зависит от такового у определенных видов растений (Coulson et al., 2003). Нематоды также демонстрируют связь с растительностью (табл. 2, рис. 1), проявляющуюся в увеличении разнообразия и численности с ростом обилия растительного покрова в тундрах (Kudrin et al., 2019), а в лесных экосистемах формируют пятна диаметром от одного до нескольких метров в зоне влияния деревьев (Klironomos et al., 1999). Но паттерны распределения почвенных организмов могут быть подвержены воздействию абиотических факторов, например влажности (Mills, Adl, 2011; Saraeva et al., 2015). Однако причины агрегированности различных групп почвенных беспозвоночных не удалось связать с данным фактором, что вполне ожидаемо, так как в пределах всех трех типов тундр влажность изменяется незначительно (CV < 25%). Полученными данными подтверждаются результаты аналогичных работ по лесным местообитаниям (Кудрин и др., 2014; Saraeva et al., 2015).
Неоднородность размещения рассмотренных представителей почвенной биоты может быть связана также с размерностью организмов, которая была предложена как “универсальный индикатор” его экологической роли в первую очередь для водных беспозвоночных (Petchey, Belgrano, 2010), но в последнее время широко применяется и в почвенной зоологии (Turnbull et al., 2014; Turnbull, Lindo, 2015). На примере двух таксономических групп (нематод и коллембол, биомассы которых в среднем 0.95 и 33.48 мкг соответственно) показано, что чем больше размеры тела животного, тем выше их агрегированность (средние значения IK = 0.86 и 2.16 для нематод и коллембол соответственно).
Ранее (Ettema, Wardle, 2002) основными факторами, определяющими агрегированность организмов, считали расселение, размножение и конкуренцию. С одной стороны, нематоды, населяя капельки почвенной воды, рассеиваются медленно при транспортировке водных и воздушных потоков в почве (Nkem et al., 2006). Активное расселение ногохвосток, среди которых выделяются медленно и быстро расселяющиеся виды (Ponge et al., 2006), также сильно ограничено, но их пассивное расселение ветром, водой или посредством форезии может быть огромно (Покаржевский и др., 2007). С другой стороны, к усилению агрегаций коллембол может приводить их объединение при совместной откладке яиц, линьке, защите от хищников (Saraeva et al., 2015). Распределение микроартропод также тесно связано с распределением грибного мицелия (Klironomos, Kendrick, 1995). Среди нематод, напротив, существуют разные трофические группы (Yeates et al., 1993), следовательно, конкуренция за пищевые ресурсы ниже. Кроме того, особенности динамики численности населения также могут определять гетерогенность распределения (Ettema, Wardle, 2002). В дополнение к стратегиям расселения и конкуренции стратегия криптобиоза может быть важным свойством, определяющим способность почвенных организмов выживать (Покаржевский и др., 2007), особенно в тундровых экосистемах с суровым климатом. В экспериментах по влиянию различных абиотических факторов среды на сообщества педобионтов показано, что обилие крупноразмерных особей сокращается при повышении температуры (Lindo, 2015; Turnbull, Lindo, 2015), а при антропогенной нагрузке снижается доля как мелко-, так и крупноразмерных таксонов (George, Lindo 2015), т.е. размеры самого организма − определяющие при его реакции на многие факторы среды, в том числе и на размещение в пространстве (Holland et al., 2005). Нематоды благодаря морфологической пластичности, физиологической адаптации очень устойчивы к различным условиям окружающей среды (Tahseen, 2012). Коллемболы, напротив, чувствительны к ним, что, по-видимому, и определяет их более агрегированное распределение.
Таким образом, в ходе проведенного исследования пространственного размещения почвенных беспозвоночных в южных тундрах Республики Коми обнаружено, что таксономические группы, относящиеся к разным размерным группам, неодинаково распределены в растительных сообществах. Влажность не является существенным фактором их пространственного размещения. Нематоды и коллемболы менее агрегированы, чем представители мезофауны, что свидетельствует об определенной роли размеров самих организмов.
Авторы благодарны Ю.В. Холопову и А.А. Рудь (Институт биологии) за помощь в отборе проб.
Работа выполнена в рамках государственного задания по темам “Распространение, систематика и пространственная организация фауны и населения животных таежных и тундровых ландшафтов и экосистем европейского северо-востока России” (№ Гр РК АААА-А17-117112850235-2) и “Выявление общих закономерностей формирования и функционирования торфяных почв на территории Арктического и Субарктического секторов Европейского Северо-Востока России” (№ Гр АААА-А17-117122290011-5).
Список литературы
Бабенко А.Б. Адаптации коллембол к температурным условиям высоких широт // Успехи соврем. биологии. 1993. Т. 113. С. 223–227.
Гиляров М.С. Соотношение размеров и численности почвенных животных // Докл. АН СССР. 1944. Вып. 6. С. 283−285.
Кудрин А.А., Долгин М.М., Колесникова А.А., Конакова Т.Н., Таскаева А.А. Особенности пространственного распределения почвенной фауны в сосновых лесах северной тайги (Республика Коми) // Вестн. Северного Аркт. федер. ун-та. 2014. № 1. С. 72–83.
Покаржевский А.Д., Гонгальский К.Б., Зайцев А.С., Савин Ф.А. Пространственная экология почвенных животных / Отв. ред. Добровольский Г.В. М.: КМК, 2007. 174 с.
Стебаева С.К. Жизненные формы ногохвосток (Collembola) // Зоол. журн. 1970. Т. 49. Вып. 10. С. 1437–1455.
Чернов Ю.И. Зависимость состава животного населения почв и дернины от характера растительного покрова в некоторых типах тундр // Проблемы Севера. 1964. № 8. С. 254–267.
Block W. Cold or drought: the lesser of two evils for terrestrial arthropods? // Eur. J. Entomol. 1996. V. 93. P. 325–340.
Bokhorst S., Phoenix G.K., Bjerke J.W., Callaghan T.V., Huyer-Brugman F., Berg M.P. Extreme winter warming events more negatively impact small rather than large soil fauna: shift in community composition explained by traits not taxa // Global Change Biol. 2012. V. 18. P. 1152–1162. https://doi.org/10.1111/j.1365-2486.2011.02565.x
Borcard D., Legendre P. Environmental control and spatial structure in ecological communities: an example using oribatid mites (Acari, Oribatei) // Environ. Ecol. Statist. 1994. V. 1. P. 37–61.
Convey P., Block W., Peat H.J. Soil arthropods as indicators of water stress in Antarctic terrestrial habitats? // Global Change Biol. 2003. V. 9. P. 1718–1730. https://doi.org/10.1046/j.1529-8817.2003.00691.x
Coulson S.J., Hodkinson I.D., Webb N.R. Microscale distribution patterns in high Arctic soil microarthropod communities: the influence of plant species within the vegetation mosaic // Ecography. 2003. V. 26. P. 801–809.
Decaëns T. Macroecological patterns in soil communities // Global Ecol. Biogeogr. 2010. V. 19. P. 287–302. https://doi.org/10.1111/j.1466-8238.2009.00517.x
Ettema C.H., Wardle D.A. Spatial soil ecology // Trends Ecol. Evol. 2002. V. 17. P. 177–183.
George P.B.L., Lindo Z. Application of body size spectra to nematode trait-index analyses // Soil Biol. Biochem. 2015. V. 84. P. 15–20. https://doi.org/10.1016/j.soilbio.2015.02.007
Guo Y., Gao M., Liu J., Zaitsev A.S., Wu D. Disentangling the drivers of ground-dwelling macro-arthropod metacommunity structure at two different spatial scales // Soil Biol. Biochem. 2019. V. 130. P. 55–62. https://doi.org/10.1016/j.soilbio.2018.12.002
Hansen R.R., Hansen O.L.P., Bowden J.J., Treier U.A., Normand S., Høye T. Meter scale variation in shrub dominance and soil moisture structure Arctic arthropod communities // Peer J. 2016. P. 1−18. https://doi.org/10.7717/peerj.2224
Hodkinson I.D., Babenko A., Behan-Pelletier V., Böcher J., Boxshall G., Brodo F., Coulson S.J., De Smet W., Dózsa-Farkas K., Elias S., Fjellberg A., Fochetti R., Foottit R., Hessen D., Hobaek A., Holmstrup M., Koponen S., Liston A., Makarova O., Marusik Y.M., Michelsen V., Mikkola K., Mustonen T., Pont A., Renaud A., Rueda L.M., Savage J., Smith H., Samchyshyna L., Velle G., Viehberg F., Vikberg V., Wall D.H., Weider L.J., Wetterich S., Yu Q., Zinovjev A. Terrestrial and freshwater invertebrates // Arctic Biodiversity Assessment. Status and trends in arctic biodiversity / Ed. Meltofte H. Akureyri: CAFF, 2013. P. 195–223.
Holland J.D., Fahrig L., Cappuccino N. Body size affects the spatial scale of habitat-beetle interactions // Oikos. 2005. V. 110. P. 101–108.
Høye T.T., Bowden J.J., Hansen O.L.P., Hansen R.R., Henriksen T.N., Niebuhr A., Skytte M.G. Elevation modulates how Arctic arthropod communities are structured along local environmental gradients // Polar Biol. 2018. V. 41. P. 1555–1565. https://doi.org/10.1007/s00300-017-2204-2
Joschko M., Fox C.A., Lentzsch P., Kiesel J., Hierold W., Kruck S., Timmer J. Spatial analysis of earthworm biodiversity at the regional scale // Agricult. Ecosyst. Environ. 2006. V. 112. P. 367–380. https://doi.org/10.1016/j.agee.2005.08.026
Klironomos J.N., Kendrick B. Relationships among microarthropods, fungi, and their environment // Plant Soil. 1995. V. 170. P. 183–197.
Klironomos J.N., Rillig M.C., Allen M.F. Designing belowground field experiments with the help of semi-variance and power analyses // Appl. Soil Ecol. 1999. V. 12. P. 227–238.
Kudrin A.A., Konakova T.N., Taskaeva A.A. Communities of soil nematodes of various tundra phytocenoses differing in the development level of the shrub layer // Russ. J. Ecol. 2019. V. 50. P. 526–534. https://doi.org/10.1134/S1067413619060092
Lindo Z. Warming favours small-bodied organisms through enhanced reproduction and compositional shifts in belowground systems // Soil Biol. Biochem. 2015. V. 91. P. 271–278. https://doi.org/10.1016/j.soilbio.2015.09.003
Mills A.A.S., Adl M.S. Changes in nematode abundances and body length in response to management intensive grazing in a low-input temperate pasture // Soil Biol. Biochem. 2011. V. 43. P. 150–158. https://doi.org/10.1016/j.soilbio.2010.09.027
Nielsen U.N., Ayres E., Wall D.H., Li G., Bardgett R.D., Wu T., Garey J.R. Global-scale patterns of assemblage structure of soil nematodes in relation to climate and ecosystem properties // Clobal Ecol. Biogeogr. 2014. V. 23. P. 968−978. https://doi.org/10.1111/geb.12177
Nkem J.N., Wall D.H., Virginia R.A., Barrett J.E., Broos E.J., Porazinska D.L., Adams B.J. Wind dispersal of soil invertebrates in the McMurdo Dry Valleys, Antarctica // Polar Biol. 2006. V. 29. P. 346–352. https://doi.org/10.1007/s00300-005-0061-x
Petchey O.L., Belgrano A. Body-size distributions and size-spectra: universal indicators of ecological status? // Biol. Lett. 2010. V. 6. P. 434–437. https://doi.org/10.1098/rsbl.2010.0240
Petersen H. Collembolan communities in shrublands along climatic gradients in Europe and the effect of experimental warming and drought on population density, biomass and diversity // Soil Organisms. 2011. V. 83 (3). P. 463–488.
Ponge J.-F., Dubs F., Gillet S., Sousa J.P., Lavelle P. Decreased biodiversity in soil springtail communities: the importance of dispersal and landuse history in heterogeneous landscapes // Soil Biol. Biochem. 2006. V. 38 (5). P. 1158–1161. https://doi.org/10.1016/j.soilbio.2005.09.004
Powers L.E., Freckman D.W., Virginia R.A. Spatial distribution of nematodes in polar desert soils of Antarctica // Polar Biol. 1995. V. 15. P. 325–333.
Puzin C., Bonte D., Pétillon J. Influence of individual density and habitat availability on long-distance dispersal in a saltmarsh spider // Ethol. Ecol. Evol. 2018. V. 31 (1). P. 28–37. https://doi.org/10.1080/03949370.2018.1486888
Saraeva A.K., Potapov M.B., Kuznetsova N.A. Different-scale distribution of Collembola in homogenous ground vegetation: sphagnum moss // Entomol. Rev. 2015. V. 95. P. 557–577. https://doi.org/10.7868/S0044513415050098
Scherber C., Eisenhauer N., Weisser W.W., Schmid B., Voigt W., Schulze E.-D., Roscher C., Weigelt A., Allan E., Beßler H., Bonkowski M., Buchmann N., Buscot F., Clement L.W., Ebeling A., Engels C., Fischer M.S., Halle S., Kertscher I., Klein A.-M., Koller R., König S., Kowalski E., Kummer V., Kuu A., Lange M., Lauterbach D., Middelhoff C., Migunova V.D., Milcu A., Müller R., Partsch S., Petermann J.S., Renker C., Rottstock T., Sabais A., Scheu S., Schumacher J., Temperton V.M., Tscharntke T. Bottom-up effects of plant diversity on multitrophic interactions in a biodiversity experiment // Nature. 2010. V. 468 (7323). P. 553–556. https://doi.org/10.1038/nature09492
Szujecki A. Ecology of forest insects. Warszawa: Springer, 1987. 600 p.
Tahseen Q. Nematodes in aquatic environments: adaptations and survival strategies // Biodiversity J. 2012. V. 3(1). P. 13–40.
Turnbull M.S., Lindo Z. Combined effects of abiotic factors on Collembola communities reveal precipitation may act as a disturbance // Soil Biol. Biochem. 2015. V. 82. P. 36–43. https://doi.org/10.1016/j.soilbio.2014.12.007
Turnbull M.S., George P.B.L., Lindo Z. Weighing in: Size spectra as a standard tool in soil community analyses // Soil Biol. Biochem. 2014. V. 68. P. 366–372. https://doi.org/10.1016/j.soilbio.2013.10.019
Usher M.B. Some properties of the aggregations of soil arthropods: Collembola // J. Animal Ecol. 1969. V. 38. P. 607–622.
Viketoft M. Determinants of small-scale spatial patterns: importance of space, plants and abiotics for soil nematodes // Soil Biol. Biochem. 2013. V. 62. P. 92–98. https://doi.org/10.1016/j.soilbio.2013.03.012
Woodward G., Ebenman B., Emmerson M., Montoya J.M., Olesen J.M., Valido A.,Warren P.H. Body size in ecological networks // Trends Ecol. Evol. 2005. V. 20 (7). P. 402–409. https://doi.org/10.1016/j.tree.2005.04.005
Wu P., Wang Ch. Differences in spatiotemporal dynamics between soil macrofauna and mesofauna communities in forest ecosystems: The significance for soil fauna diversity monitoring // Geoderma. 2019. V. 337. P. 266–272. https://doi.org/10.1016/j.geoderma.2018.09.031
Yeates G.W., Bongers T., de Goede R.G.M., Freckman D.W., Georgieva S.S. Feeding habits in soil nematode families and genera: An outline for soil ecologists // J. Nematol. 1993. V. 25. P. 315–331.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая