Известия РАН. Серия биологическая, 2021, № 4, стр. 373-388
Особенности формирования микробиомов двух типов почв под географическими культурами кедровых сосен Pinus sibirica Du Tour и Pinus koraiensis Siebold et Zucc.
И. Д. Гродницкая 1, *, Г. В. Кузнецова 1, О. Э. Пашкеева 1, Г. И. Антонов 1
1 Институт леса им. В.Н. Сукачева СО РАН
660036 Красноярск, Академгородок, 50/28, Россия
* E-mail: igrod@ksc.krasn.ru
Поступила в редакцию 15.07.2019
После доработки 14.06.2020
Принята к публикации 22.12.2020
Аннотация
Проведено сравнение влияния географических культур кедровых сосен Pinus sibirica Du Tour, Pinus koraiensis Siebold et Zucc., созданных в Красноярском и Хабаровском краях, на химические и биологические показатели серой лесной и бурой лесной почв в ризосфере и между рядами посадок. Показано, что межвидовая гетерогенность кедровых сосен оказывала влияние на химический состав почвы, ферментативную и микробиологическую активность, формирование прокариотных микробиомов. Отмечено, что биоразнообразие прокариот в большей степени определили типовые особенности почвы, чем меж- и внутривидовая гетерогенность кедровых сосен и влияние их корней. Установлено, что доминируют бактерии фил Proteobacteria, Acidobacteria и Actinobacteria, совместно составляющие 75–85% общего числа типоспецифичных последовательностей генов 16S рРНК в каждой почве.
Специфика изменений растений и их приспособление к новым условиям существования зависят от сочетания природно-климатических факторов. Для изучения географической изменчивости наследственных свойств видов древесных растений и факторов, влияющих на их устойчивость и выживаемость в различных почвенно-климатических условиях, создают географические культуры – уникальные экспериментальные объекты для разносторонних исследований (Ирошников, 1977; Кузнецова, 2010). Главную роль в адаптационных процессах растений играют эдафические (механический и химический состав почвы, ее водный и температурный режим) и биологические (биохимические процессы, структура и активность микробных сообществ) факторы. Химические показатели почвы – довольно “консервативная” составляющая, в то время как биологические (микробиологические) меняются достаточно быстро – микробиота активно участвует в круговороте органического вещества и питательных элементов. Микробные сообщества являются уникальным источником генетического и фенотипического разнообразия, важным фактором биологической устойчивости почв, интенсивности и направленности биохимических процессов, а также инструментом почвенной биодиагностики (Чернов и др., 2015).
Основной источник углерода и энергии для большей части почвенных микроорганизмов – растительный материал, поступающий с наземным и корневым опадом и корневыми выделениями. Количество и качество растительного материала зависят от меж- и внутривидовой гетерогенности, продукционных, физиологических и биохимических особенностей основных видов фитоценоза, а также от их изменения под воздействием внешних факторов (патогенов, рекреационной нагрузки и т.п.) (Hobbie et al., 2010; Hansson et al., 2011). Разграничить влияние почвы на растения и наоборот влияние растений на почву довольно сложно. В этой связи актуально изучение влияния химических и микробиологических процессов, происходящих в почве, на древесные виды растений и влияния этих растений на биодинамику почв.
В географических культурах кедровых сосен, созданных в удаленных географических точках, предоставляется возможность изучения влияния меж- и внутривидовой генотипической изменчивости деревьев на химические и микробиологические свойства почвы в системе почва–растение, описания структуры почвенных микробиомов с использованием молекулярно-генетических методов анализа метагеномной ДНК (Kakirde et al., 2010; Гродницкая и др., 2016; Першина и др., 2016; Наумова и др., 2018).
Цель исследования – сравнение влияния географических культур кедра корейского и сибирского на химические, биохимические, респираторные показатели, а также на структуру и состав прокариотных микробиомов серой лесной и бурой лесной почв в зоне ризосферы и между рядами посадок кедровых сосен в двух местах тестирования – Красноярском и Хабаровском регионах.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Обследовали почву под посадками географических культур кедровых сосен Pinus sibirica Du Tour и Pinus koraiensis Siebold et Zucc. в двух местах тестирования: на юге Красноярского края и в Хабаровском крае. Перед закладкой географических культур в обоих районах землю распахивали, т.е. почва на исследуемых участках антропогенно-трансформированная. В Красноярском крае географические культуры P. sibirica и P. koraiensis расположены в Ермаковском лесничестве, в предгорье смешанных лесов Алтае-Саянской провинции, на высоте 500 м над уровнем моря (у.м.) (53°10′ с.ш. и 95°20′ в.д.). Культуры были созданы в 1983 г. и представлены ермаковским (Е) климатипом кедра сибирского (Красноярский край), а также облученским (О) (Еврейская автономная область (ЕАО)) и чугуевским (Ч) (Приморский край) климатипами кедра корейского (Кузнецова, 2010). Тип леса осочко-вейниковый, почва перед закладкой опыта была определена как серая лесная неоподзоленная, легкосуглинистая, мощная (Классификация…, 1977), а в настоящее время – как агросерая гетерогенная (Рarg-AEL-BEL-BT-C) (Классификация…, 2004), по международной классификации Phaeozems (Anthric) (WRBSR, 2015); далее по тексту – серая лесная почва.
В Хабаровском крае географические культуры были заложены в 1977 г. (Штейникова, Ковалева, 1982) в Парковом лесничестве Хехцирского лесхоза (далее по тексту – Хехцирское лесничество) на равнинных участках и холмисто-увалистых предгорьях (высота от 100 до 300 м над у.м.) (48°16′ с.ш. и 135°02′ в.д.). Культуры представлены также ермаковским (Е) климатипом кедра сибирского (Красноярский край) и двумя климатипами кедра корейского: облученским (О) и чугуевским (Ч). Хехцирское лесничество по своим лесорастительным условиям входит в зону хвойно-широколиственных лесов. Участок лесных культур до закультивирования представлял собой вырубку 1930–1935 гг. и расположен на юго-восточном склоне крутизной 2–3°. Тип леса до рубки – разнокустарниковый кедровник с липой и дубом. Перед закладкой опыта почва была определена как бурая лесная оподзоленная (Классификация…, 1977), в настоящее время – агробурозем гетерогенный (Parg-BM-C) (Классификация…, 2004), материнская порода – сланцы, по WRB – Cambisols (Anthric) (WRBSR, 2015); далее по тексту – бурая лесная почва. Хвойные породы занимают в лесхозе 36% покрытой лесами площади, из них 10% приходится на кедр корейский; средний бонитет кедра III, 6.
В Красноярском крае потомство каждого климатипа занимает по одной делянке на трех соседствующих участках. В Хабаровском крае опыт в настоящее время проводят в одной повторности.
Методы исследования. Почву для агрохимического, микробиологического и ферментативного анализов отбирали из органогенного слоя 0–15…0–20 см (сразу под подстилкой) между рядами посадок (далее междурядья), на расстоянии 60 см от ряда, в пределах подкроновой зоны и в зоне ризосферы кедровых сосен (Weber, Bardgett, 2011). Один смешанный образец почвы составляли из 5–6 монолитов, отобранных случайным образом по делянке климатипа. Ризосферную почву отбирали непосредственно снятием с корней и в прикорневой зоне растений (Zao et al., 2010). Температуру почвенных слоев измеряли непосредственно в момент отбора образцов на опытных участках портативным цифровым термометром HANNA ChekTemp1 с выносным датчиком. После доставки образцов в лабораторию в них были измерены значения рН портативным потенциометром Аквилон–410, для чего 1 г почвы заливали 10 мл дистиллированной воды и настаивали в течение 1 ч.
В образцах почвы определяли содержание Cорг по методике И.В. Тюрина в модификации В.М. Никитина колориметрическим методом (Методы…, 2003). Содержание гумуса высчитывали из содержания Cорг. Общий азот в почве определяли сжиганием в смеси серной и хлорной кислот с последующей отгонкой. Фракционный состав азота определяли титриметрическим методом с помощью ступенчатого щелочного гидролиза способом Корнфильда: в чашках Конвея из почвы последовательно извлекали трудногидролизуемые соединения азота с помощью 6Н NaOH, а затем с помощью 1Н NaOH – легкогидролизуемые соединения (Методы…, 2003).
Качественный состав почвенных бактерий. Идентификацию прокарит определяли молекулярно-генетическими методами (NGS – метагеномный сиквенс). Геномную ДНК выделяли из 250 мг почвы с помощью набора FastDNA SPIN Kit for Soil (MP Biomedicals, США). Полученную общую ДНК амплифицировали с использованием универсальных бактериальных праймеров 343F (5'-CTCCTACGGRRSGCAGCAG-3') и 806R (5'-GGACTACNVGGGTWTCTAAT-3'). Секвенирование ампликонов и сравнительный анализ нуклеотидных последовательностей выполняли в ЦКП “Геномика” СО РАН (г. Новосибирск) с помощью секвенатора MiSeq Illumina (Ilumina Inc., San Diego, California, США).
Полученные ПЦР-продукты очищали от ПЦР-смеси, определяли их концентрацию и визуализировали в агарозном геле. Для приготовления библиотеки ДНК использовали 300 нг каждого образца.
Детализация родового/видового состава основных представителей микробных сообществ почв была проведена на основе секвенирования генов 16S рРНК, выявление доминантных и минорных видов бактерий – качественной оценкой их соотношений. Полученные в результате секвенирования сходные нуклеотидные последовательности (сиквенсы) гена 16S рРНК объединяли в операционные таксономические единицы (ОТЕ), которые затем относили к филогенетическим таксонам различного уровня (типы, классы, роды). Уровень сходства нуклеотидных последовательностей варьировал от 97 до 99%
Индексы видового богатства. Для оценки разнообразия прокариот применяли различные индексы – показатели, которые рассчитывали на основании числа таксонов в сообществе и числа особей (сиквенсов) в разных таксонах. Индекс видового разнообразия Бергера–Паркера (d) определяли по формуле (Количественные …, 2005)
Индекс разнообразия Шеннона (HN) определяли по формуле (Количественные …, 2005; Алексанов, 2017)
Индекс разнообразия Симпсона (D) определяли по формуле (Количественные…, 2005)
Индексы видового богатства, не учитывающие относительное обилие таксонов, Маргалефа (DMg) и Менхиника (DMn), определяли по формулам (Алексанов, 2017)
Ферментативную активность почвы определяли разными методами (Хазиев, 2005). С использованием фотоэлектроколориметра КФК-3 определяли активность гидролитических ферментов (инвертазу, протеазу, уреазу) при компостировании в термостате при 30–38°С и экспозиции от 3–24 ч. Активность ферментов окислительно-восстановительной группы (ПО – пероксидаза, ПФО – полифенолоксидаза) определяли колориметрическими методами с предварительным получасовым компостированием при 30°С. Активность инвертазы выражали в мг глюкозы/г почвы за 3 ч, протеазы – мг глицина/г почвы за 24 ч, уреазы – мг N-NH4/г почвы за 24 ч, пероксидазы и полифенолоксидазы – мг 1.4-бензохинона/г почвы за 30 мин. По соотношению активности ПФО и ПО рассчитывали коэффициент гумификации (Kг), позволяющий судить об интенсивности процессов минерализации гумуса (Методы…, 2003; Хазиев, 2005).
Респираторную активность – микробную биомассу (Смик), базальное дыхание (БД), микробный респираторный коэффициент (QR) почвенных микробоценозов – определяли методом субстратиндуцированного дыхания (СИД) (Anderson, Domsch, 1978; Sparling, 1995). СИД почвы оценивали по скорости начального максимального дыхания микроорганизмов после добавления в почву глюкозоминеральной смеси (ГМС, мг/мл: глюкоза (200); K2НРО4 (20); (NH4)2SO4 (20) (Методы…, 1991). В стеклянные флаконы (250 мл) помещали 2 г почвы и добавляли 0.1 мл ГМС. Конечная концентрация глюкозы в почве – 10 мг/г. Флаконы герметично закрывали пробками, фиксировали время и инкубировали при 25°С. Спустя 3 ч после закрытия флакона регистрировали СИД: пробу воздуха из флакона (1 мл) отбирали шприцем и вводили в газовый хроматограф Agilent Technologies 6890 N Network GC (США), снабженный пламенно-ионизационным детектором и метанатором (Hewlet-Packard, США). Во время анализа использовали колонку Supelco 10182004 из нержавеющей стали (внутренний диаметр 3.175 мм, длина 1828.8 мм, адсорбент 80/100 Porapak Q).
Скорость СИД выражали в мкг С–СО2/(г почвы ⋅ ч) (Anderson, Domsch, 1978). Смик почвенного образца определяли (Sparling, 1995) путем пересчета скорости СИД по формуле Смик (мкг С/г почвы) = 50.4 ⋅ СИД (мкг С–СО2/(г почвы ⋅ ч). Фоновое БД измеряли по скорости выделения СО2 почвой за 24 ч ее инкубации при 25°С. Скорость продуцирования СО2 определяли хроматографически, как описано для определения СИД, только вместо ГМС в почву вносили воду. Скорость БД выражали в мкг С–СО2/(г почвы ⋅ ч). По соотношению БД и СИД рассчитывали дыхательный коэффициент QR (Anderson, Domsch, 1990; Ананьева, 2003).
Вклад микробного углерода в общее органическое вещество рассчитывали следующим образом: Смик(%) × 100/Сорг.
Статистический анализ. Для выявления взаимосвязей между активностью микробиологических и ферментативных показателей с гидротермическими и химическими параметрами почв (ризосферной и междурядной) был проведен корреляционный анализ; рассматривали коэффициенты корреляции (r), статистически значимые при p ≤ 0.05. С помощью кластерного анализа определяли различия прокариотного микробиома двух типов почв по индексам биоразнообразия. Для подтверждения различий между химическими, микробиологическими и биохимическими параметрами исследуемых почв использовали метод главных компонент (PCA). При обработке полученных данных использовали программы Microsoft Excel 2007, Statistica 12, Past 3.25.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Агрохимические и микробиологические характеристики серой лесной и бурой лесной подзолистой почв. Исследования географических культур кедровых сосен показали, что в новых условиях произрастания темп роста климатипов обусловлен не только наследственными особенностями, но и адаптивной реакцией растений на местный климат. Наиболее существенное влияние оказывали два климатических фактора: сумма эффективных температур выше 5°С (r = 0.32) и продолжительность вегетационного периода в местах их произрастания (r = 0.31) (Гродницкая и др., 2016; Кузнецова, Грек, 2016).
Химические анализы показали, что серая лесная почва (юг Красноярского края) под посадками разных климатипов кедровых сосен, отличалась от бурой лесной (Хабаровский край) меньшими значениями содержания гумуса (в 1.7–4.3 раза), валового азота (1.2–1.4 раза), гидролизуемого азота (в 1.4–3 раза), а также меньшей кислотностью (на 1.4–2.0 ед.). Серая лесная почва характеризовалась как слабокислая, а бурая лесная – как сильнокислая с более высоким содержанием гумуса и азота в верхних горизонтах (табл. 1).
Таблица 1.
Химические свойства почв в ризосфере (числитель) и междурядьях (знаменатель) под географическими культурами кедровых сосен в Ермаковском (Красноярский край) и Хехцирском (Хабаровский край) лесничествах
| Климатип сосны кедровой |
Гумус, % | Сорг, % | Nвал | NЛГ | NТГ | NНГ | C : N | рНвод | Влажность, % | Т, °С | Смик/ Сорг, % |
|---|---|---|---|---|---|---|---|---|---|---|---|
| смоль (экв)/кг | |||||||||||
| Ермаковское лесничество, серая лесная почва | |||||||||||
| Е | $\frac{{10.7}}{{7.0}}$ | $\frac{{6.2}}{{4.1}}$ | $\frac{{101.6}}{{102.2}}$ | $\frac{{5.1}}{{6.1}}$ | $\frac{{4.7}}{{4.2}}$ | $\frac{{91.8}}{{91.9}}$ | $\frac{{61}}{{40}}$ | $\frac{{6.66}}{{6.59}}$ | $\frac{{22.1}}{{19.3}}$ | $\frac{{13.7}}{{13.7}}$ | $\frac{{0.36}}{{0.27}}$ |
| О | $\frac{{5.5}}{{3.9}}$ | $\frac{{3.2}}{{2.3}}$ | $\frac{{82.7}}{{81.1}}$ | $\frac{{4.4}}{{4.4}}$ | $\frac{{2.8}}{{3.1}}$ | $\frac{{75.5}}{{73.6}}$ | $\frac{{39}}{{28}}$ | $\frac{{6.36}}{{6.42}}$ | $\frac{{22.6}}{{19.6}}$ | $\frac{{13.1}}{{13.3}}$ | $\frac{{0.22}}{{0.27}}$ |
| Ч | $\frac{{3.1}}{{2.2}}$ | $\frac{{1.8}}{{1.3}}$ | $\frac{{71.4}}{{69.2}}$ | $\frac{{3.3}}{{3.9}}$ | $\frac{{2.8}}{{3.9}}$ | $\frac{{65.3}}{{61.4}}$ | $\frac{{38}}{{19}}$ | $\frac{{6.26}}{{6.30}}$ | $\frac{{22.0}}{{20.5}}$ | $\frac{{13.4}}{{13.4}}$ | $\frac{{0.36}}{{0.49}}$ |
| Хехцирское лесничество, бурая лесная почва | |||||||||||
| Е | $\frac{{10.9}}{{7.1}}$ | $\frac{{6.3}}{{4.1}}$ | $\frac{{102.5}}{{115.6}}$ | $\frac{{10.3}}{{9.0}}$ | $\frac{{3.0}}{{5.7}}$ | $\frac{{86.7}}{{85.2}}$ | $\frac{{71}}{{41}}$ | $\frac{{4.66}}{{4.73}}$ | $\frac{{41.2}}{{33.9}}$ | $\frac{{8.8}}{{9.2}}$ | $\frac{{0.63}}{{0.54}}$ |
| О | $\frac{{11.0}}{{5.6}}$ | $\frac{{6.4}}{{3.2}}$ | $\frac{{102.8}}{{97.3}}$ | $\frac{{16.2}}{{8.4}}$ | $\frac{{9.6}}{{6.5}}$ | $\frac{{74.2}}{{85.0}}$ | $\frac{{72}}{{38}}$ | $\frac{{4.91}}{{4.68}}$ | $\frac{{32.2}}{{31.6}}$ | $\frac{{7.7}}{{8.0}}$ | $\frac{{0.39}}{{0.51}}$ |
| Ч | $\frac{{11.0}}{{5.9}}$ | $\frac{{6.4}}{{3.4}}$ | $\frac{{95.0}}{{100.2}}$ | $\frac{{13.3}}{{7.1}}$ | $\frac{{8.6}}{{4.0}}$ | $\frac{{78.0}}{{88.8}}$ | $\frac{{79}}{{40}}$ | $\frac{{4.64}}{{4.67}}$ | $\frac{{22.6}}{{23.3}}$ | $\frac{{7.1}}{{7.7}}$ | $\frac{{0.47}}{{0.82}}$ |
Примечание. NЛГ – легкогидролизуемый азот; NТГ – трудногидролизуемый азот; NНГ – негидролизуемый азот; Смик/Сорг – доля Смик в Сорг; для табл. 1, 4. Е, О, Ч – ермаковский, облученский, чугуевский климатипы соответственно; для табл. 1–3, 5.
Виды кедровых сосен оказывали разное влияние на химический состав почвы. В серой лесной почве под посадками P. sibirica и P. koraiensis между рядами и в зоне ризосферы были отмечены различия содержания гумуса и азота. Так, содержание гумуса под сосной сибирской в среднем превышало таковое под сосной корейской в 1.8–3.5, а содержание валового и подвижного азота – в 1.3–1.5 раза. Однако процессы минерализации органических веществ под климатипами сосны корейской проходили интенсивнее, чем под сосной сибирской, о чем свидетельствуют более узкие диапазоны соотношения С : N и меньшее содержание трудногидролизуемого и негидролизуемого азота (табл. 1).
В бурой лесной почве между рядами посадок P. sibirica формируется больше гумуса, чем под корейскими климатипами (в 1.2–1.3 раза), а в ризосфере содержание гумуса практически одинаковое c P. koraiensis. Валового азота, как и гидролизуемых форм, также больше под сосной сибирской (табл. 1). Содержание органического вещества почвы, судя по отношению C : N, в бурой лесной почве практически одинаковое под сибирским и корейскими климатипами (табл. 1), что может отражать схожую интенсивность минерализационных процессов.
Химический состав и тип почвы влияли на активность микробиологических процессов, поскольку деятельность почвенных микроорганизмов тесно связана с химическими, биохимическими и почвообразовательными процессами (Singh, Shekhar, 1986).
Качественный состав прокариот микробиомов почв. Тип почвы и климатические особенности в местах произрастания кедровых сосен оказывали влияние на формирование качественного состава микробных сообществ и их функциональные особенности. В почвенном микробиоме компоненты биоразнообразия – число таксонов и их относительное обилие, т.е. вклад конкретных таксонов (филоспецифичных нуклеотидных последовательностей) в общее число особей сообщества (Першина и др., 2016; Наумова и др., 2018).
Оценка и сравнение биоразнообразия прокариот микробных сообществ исследуемых почв проведены на уровне типов (фил), по отдельным классам и родам. Отмечено, что микробные сообщества двух типов почв сбалансированы, имеют довольно высокое видовое разнообразие, о чем свидетельствуют индексы таксономического обилия (Шеннона, Маргалефа) и структуры (относительное обилие) прокариот (Бергера–Паркера, Симпсона) (табл. 2). Большее, чем в зоне ризосферы, разнообразие (по классам и родам) прокариот в обоих типах почв формировалось между рядами посадок кедровых сосен независимо от их вида (табл. 2). По числу выделенных ОТЕ под разными климатипами серая лесная почва превосходит бурую в 3 раза (табл. 3). Однако наиболее таксономически сложное сообщество почвенных прокариот наблюдали в бурой подзолистой почве (в ризосфере и между рядами посадок), при этом под P. koraiensis формировалось более разнообразное сообщество прокариот, чем под P. sibirica в обоих лесничествах, о чем свидетельствуют индексы таксономического обилия (Шеннона, Менхиника, Маргалефа). В серой лесной почве отмечено заметное уменьшение разнообразия и увеличение степени доминирования нескольких (одного) родов, особенно под P. sibirica, что демонстрировали более высокие значения индексов Бергера–Паркера и Симпсона (табл. 2). Таким образом, отмечено, что в серой лесной почве формируется большее по численности, а в бурой лесной почве – большее родовое/видовое разнообразие прокариот.
Таблица 2.
Индексы разнообразия прокариотных сообществ в ризосфере (числитель) и междурядьях (знаменатель) двух типов почв Ермаковского и Хехцирского лесничеств
| Почва под климатипами | H | d | DMg | DMn | D |
|---|---|---|---|---|---|
| Ермаковское лесничество | |||||
| Е | $\frac{{2.43}}{{2.43}}$ | $\frac{{0.28}}{{0.28}}$ | $\frac{{3.49}}{{4.42}}$ | $\frac{{0.27}}{{0.31}}$ | $\begin{array}{*{20}{l}} {\frac{{0.94}}{{0.93}}} \end{array}$ |
| О | $\frac{{2.14}}{{2.24}}$ | $\frac{{0.38}}{{0.39}}$ | $\frac{{3.24}}{{3.30}}$ | $\frac{{0.21}}{{0.25}}$ | $\frac{{0.93}}{{0.95}}$ |
| Ч | $\frac{{2.33}}{{2.40}}$ | $\frac{{0.32}}{{0.32}}$ | $\frac{{3.80}}{{3.98}}$ | $\frac{{0.24}}{{0.24}}$ | $\frac{{0.88}}{{0.92}}$ |
| Хехцирское лесничество | |||||
| Е | $\frac{{3.37}}{{3.29}}$ | $\frac{{0.17}}{{0.17}}$ | $\frac{{10.41}}{{10.58}}$ | $\frac{{2.0}}{{1.85}}$ | $\frac{{0.87}}{{0.87}}$ |
| О | $\frac{{3.27}}{{3.38}}$ | $\frac{{0.19}}{{0.12}}$ | $\frac{{8.61}}{{10.17}}$ | $\frac{{1.58}}{{1.83}}$ | $\frac{{0.82}}{{0.81}}$ |
| Ч | $\frac{{2.93}}{{3.17}}$ | $\frac{{0.28}}{{0.22}}$ | $\frac{{10.03}}{{9.86}}$ | $\frac{{1.56}}{{1.52}}$ | $\frac{{0.85}}{{0.85}}$ |
Примечание. H, d, DMg, DMn, D – индексы Шеннона, Бергера–Паркера, Маргалефа, Менхиника, Симпсона соответственно; для табл. 2 и 6.
Таблица 3.
Наиболее многочисленные (по числу последовательностей гена 16S рРНК) филы доменов Bacteria и Archaea под кедровыми соснами в ризосфере (числитель) и междурядьях (знаменатель) серой лесной и бурой лесной почвах (0–10 см)
| Филогенетическая принадлежность (филум или тип) | Доля филоспецифичных ОТЕ, % общего числа полученных последовательностей | |||||
|---|---|---|---|---|---|---|
| Ермаковское лесничество | Хехцирское лесничество | |||||
| Е | О | Ч | Е | О | Ч | |
| Число ридов | $\frac{{17{\kern 1pt} 428}}{{21{\kern 1pt} 580}}$ | $\frac{{27~{\kern 1pt} 040}}{{26{\kern 1pt} 226}}$ | $\frac{{29{\kern 1pt} ~627}}{{30{\kern 1pt} 872}}$ | $\frac{{8~{\kern 1pt} 232}}{{10{\kern 1pt} 344}}$ | $\frac{{8~358}}{{9195}}$ | $\frac{{7~967}}{{8813}}$ |
| Proteobacteria | $\frac{{43.9}}{{43.3}}$ | $\frac{{50.4}}{{43.9}}$ | $\frac{{46.0}}{{44.1}}$ | $\frac{{21.2}}{{22.9}}$ | $\frac{{28.8}}{{24.8}}$ | $\frac{{32.3}}{{31.6}}$ |
| Acidobacteria | $\frac{{22.6}}{{22.6}}$ | $\frac{{18.7}}{{19.7}}$ | $\frac{{26.2}}{{21.7}}$ | $\frac{{32.6}}{{31.1}}$ | $\frac{{34.3}}{{32.2}}$ | $\frac{{31.0}}{{31.7}}$ |
| Actinobacteria | $\frac{{15.5}}{{15.1}}$ | $\frac{{16.7}}{{16.8}}$ | $\frac{{13.3}}{{14.1}}$ | $\frac{{6.7}}{{8.7}}$ | $\frac{{11.9}}{{11.3}}$ | $\frac{{10.4}}{{10.1}}$ |
| Verrucomicrobia | $\frac{{6.0}}{{10.7}}$ | $\frac{{4.4}}{{10.9}}$ | $\frac{{5.7}}{{11.3}}$ | $\frac{{5.5}}{{4.1}}$ | $\frac{{6.6}}{{6.2}}$ | $\frac{{6.5}}{{6.9}}$ |
| Bacterioidetes | $\frac{{8.8}}{{5.4}}$ | $\frac{{6.5}}{{5.6}}$ | $\frac{{4.5}}{{4.7}}$ | $\frac{{2.3}}{{2.9}}$ | $\frac{{2.3}}{{3.1}}$ | $\frac{{2.8}}{{4.2}}$ |
| Chloroflexi | $\frac{{1.2}}{{1.1}}$ | $\frac{{1.6}}{{1.2}}$ | $\frac{{2.1}}{{1.2}}$ | $\frac{{26.9}}{{26.4}}$ | $\frac{{12.7}}{{18.4}}$ | $\frac{{13.3}}{{10.5}}$ |
| Gemmatimonadetes | $\frac{{0.94}}{{0.77}}$ | $\frac{{0.40}}{{0.68}}$ | $\frac{{0.79}}{{1.11}}$ | $\frac{{1.17}}{{0.93}}$ | $\frac{{1.4}}{{1.07}}$ | $\frac{{0.74}}{{1.36}}$ |
| Firmicutes | $\frac{{0.37}}{{0.51}}$ | $\frac{{0.20}}{{0.75}}$ | $\frac{{0.65}}{{0.90}}$ | $\frac{{0.30}}{{0.28}}$ | $\frac{{0.10}}{{0.25}}$ | $\frac{{0.21}}{{0.27}}$ |
| Saccharibacteria (TM7) | $\frac{{0.40}}{{0.35}}$ | $\frac{{0.22}}{{0.42}}$ | $\frac{{0.33}}{{0.46}}$ | $\frac{{0.30}}{{0.41}}$ | $\frac{{0.41}}{{0.60}}$ | $\frac{{0.56}}{{0.84}}$ |
| Planctomycetes | $\frac{{0.11}}{{0.24}}$ | $\frac{{0.17}}{{0.19}}$ | $\frac{{0.29}}{{0.27}}$ | $\frac{{0.27}}{{0.24}}$ | $\frac{{0.31}}{{0.45}}$ | $\frac{{0.56}}{{0.42}}$ |
| Chlamydiae | $\frac{{0.006}}{{0.03}}$ | $\frac{{0.007}}{{0.01}}$ | $\frac{{0.02}}{{0.01}}$ | $\frac{{0.00}}{{0.02}}$ | $\frac{{0.00}}{{0.01}}$ | $\frac{{0.00}}{{0.01}}$ |
| Cyanobacteria/ Chloroplast |
$\frac{{0.05}}{{0.13}}$ | $\frac{{0.80}}{{0.06}}$ | $\frac{{0.06}}{{0.07}}$ | $\frac{{0.09}}{{0.46}}$ | $\frac{{0.14}}{{0.08}}$ | $\frac{{0.14}}{{1.02}}$ |
| Nitrospirae | $\frac{{0.00}}{{0.05}}$ | $\frac{{0.00}}{{0.03}}$ | $\frac{{0.003}}{{0.07}}$ | $\frac{{0.92}}{{0.58}}$ | $\frac{{0.20}}{{0.38}}$ | $\frac{{0.53}}{{0.52}}$ |
| Armatimonadetes | $\frac{{0.02}}{{0.06}}$ | $\frac{{0.04}}{{0.03}}$ | $\frac{{0.04}}{{0.01}}$ | $\frac{{0.18}}{{0.05}}$ | $\frac{{0.04}}{{0.12}}$ | $\frac{{0.09}}{{0.10}}$ |
| BRC1 | $\frac{{0.02}}{{0.00}}$ | $\frac{{0.004}}{{0.01}}$ | $\frac{{0.00}}{{0.02}}$ | $\frac{{0.04}}{{0.02}}$ | $\frac{{0.01}}{{0.03}}$ | $\frac{{0.05}}{{0.00}}$ |
| Crenarchaeota | $\frac{{0.00}}{{0.01}}$ | 0 | $\frac{{0.01}}{0}$ | 0 | 0 | 0 |
| Euryarchaeota | $\frac{{0.00}}{0}$ | 0 | $\frac{{0.00}}{{0.02}}$ | $\frac{{0.04}}{0}$ | $\frac{{0.01}}{{0.01}}$ | $\frac{{0.03}}{0}$ |
| Thaumarchaeota | 0 | 0 | 0 | $\frac{{0.26}}{{0.08}}$ | $\frac{{0.05}}{{0.13}}$ | $\frac{{0.18}}{{0.03}}$ |
| Latescibacteria (WS3) | $\frac{{0.13}}{{0.12}}$ | $\frac{{0.00}}{{0.12}}$ | $\frac{{0.003}}{{0.12}}$ | $\frac{{0.85}}{{0.69}}$ | $\frac{{0.49}}{{0.63}}$ | $\frac{{0.34}}{{0.32}}$ |
Кластерный анализ на основании индексов биологического разнообразия, проведенный методом Варда, с использованием в качестве меры различия евклидова расстояния, подтвердил различия прокариотного микробиома (по классам) двух типов почв (рис. 1). Кластеры разделились по географическому положению посадок кедра, а также по видовой принадлежности кедровых сосен. Так, в серой лесной почве P. sibirica (ризосфера и междурядье) формирует отличное от P. koraiensis прокариотное сообщество. В бурой лесной почве (Хехцирское лесничество) больший вклад в биологическое разнообразие вносит происхождение климатипа. Существует тесная связь (дистанция 0.43) между ризосферной и междурядной почвой облученского и чугуевского климатипов, в то время как P. sibirica ермаковского климатипа формирует отличный от P. koraiensis прокариотный микробиом (рис. 1).
Рис. 1.
Вертикальная древовидная диаграмма кластерного анализа по индексам разнообразия прокариотных сообществ в двух типах почв Ермаковского (Е) и Хехцирского (Х) лесничеств. Ериз(Е), Ориз(Е), Чриз(Е) – ермаковский, облученский, чугуевский климатипы соответственно, ризосфера; Емежд(Е), Омежд(Е), Чмежд(Е) – ермаковский, облученский, чугуевский климатипы соответственно, междурядья; Ериз(Х), Ориз(Х), Чриз(Х) – ермаковский, облученский, чугуевский климатипы соответственно, ризосфера; Емежд(Х), Омежд(Х), Чмежд(Х) – ермаковский, облученский, чугуевский климатипы соответственно, междурядья; для рис. 1 и 4.

Данные метагеномного анализа почв исследуемых лесничеств свидетельствуют о том, что в трансформации углерода, азота и других важных элементов принимает участие значительное число прокариот, в основном из домена Bacteria (99.9%), представители домена Archaea выделены в “минорном” числе (≥1%). Качественная характеристика и количественное соотношение последовательностей гена 16S рРНК (ОТЕ) бактерий по их типам (филам) представлены в табл. 3.
В серой лесной почве под посадками всех климатипов кедровых сосен формируется больше бактерий, чем в бурой лесной в среднем: в ризосфере – в 3, междурядьях – в 2.8 раза (табл. 3). В то же время число выделенных классов прокариот бурой лесной почвы в ризосфере составляло 37–46, в междурядьях – 46–47, а в серой лесной почве в зоне ризосферы было выделено 34–40, в междурядьях – 43–45 классов.
Минорные представители прокариотного микробиома археи (Archaea) были обнаружены в единичных количествах в обоих типах почв. В серой лесной почве были выявлены археи класса Thermoprotei (Crenarcheota), их присутствие отмечено в ризосфере чугуевского и между рядами посадок ермаковского климатипов (по 0.01%) (табл. 3). Бактерии класса Thermoprotei часто встречаются в лесных почвах, способны к метаболизму даже при низких температурах (до –2°C), многие из них хемолитоавтотрофы, которые получают энергию в процессе анаэробного серного дыхания (Bates et al., 2011). В бурой почве археи фил Euryarchaeota и Thaumarchaeota были отмечены в зоне ризосферы всех климатипов, особенно много под P. sibirica, и между рядами посадок, за исключением Euryarchaeota (табл. 3).
Доминантными представителями микробоценозов исследованных почв являются бактерии трех фил: Proteobacteria, Acidobacteria и Actinobacteria, на долю которых в серой лесной почве в зависимости от климатипа приходится 80–85%, а в бурой лесной почве – 60–75% общего числа последовательностей гена 16S рРНК. Содоминантами были представители фил Verrucomicrobia и Bacterioidetes, доля которых в зависимости от климатипов составляла 10–16% в серой лесной и 7–18% в бурой лесной почвах (табл. 3). Представители фил Bacterioidetes, Latescibacteria (ранее WS3) и Chlorobi, члены суперфилума Fibrobacteres–Chlorobi–Bacteroidetes (FCB), участвуют в трансформации углерода сложных органических полимеров. У Latescibacteria были обнаружены анаэробный ферментативный режим метаболизма, способность разлагать полисахариды (пектин, альгинат, ульван, фукан) и богатые гидроксипролином гликопротеины клеточных стенок зеленых (Charophyta и Chlorophyta) и коричневых (Phaeophycaea) водорослей, а также молекулы крахмала и трегалозы, внеклеточные полимерные вещества (Youssef et al., 2015).
Максимальное число прокариот филы Proteobacteria обнаружено в серой лесной почве. Особую роль, на наш взгляд, играли азотфиксирующие микроорганизмы – клубеньковые бактерии (класс Alphaproteobacteria), которые в исследованных почвах были представлены родами Bradyrhizobium, Rhizobium и Mesorhizobium. В серой лесной почве доля этих бактерий в общем числе последовательностей составляла 6.4–6.8% в ризосфере и 5.6–7.2% в междурядьях. В бурой лесной почве их было значительно меньше: в ризосфере кедровых сосен 0.66–1.23%, в почве междурядий 0.95–1.23%. При этом в обоих типах почв P. koraiensis формировал большее число последовательностей ризобактерий (в серой лесной – в 1.1–1.3, в бурой лесной – в 1.1–1.7 раза), чем P. sibirica. Таким образом, отмечено, что сосна корейская, активно растущая как в привычных для нее условиях Хабаровского края, так и при интродукции в Красноярском крае, стимулирует более интенсивное развитие азотфиксаторов в своей ризосфере, чем сосна сибирская.
В трансформации азота в почвах под климатипами кедровых сосен принимают участие также представители фил Nitrospirae и Thaumarchaeota Представители филы Nitrospirae участвуют в процессах нитрификации, причем, по мнению многих авторов, бактерии Nitrospirae способны осуществлять два этапа нитрификации, вплоть до полного окисления аммиака до нитрата. Ранее (van Kessel et al., 2015) было показано, что нитроспиры – хемолитоавтотрофы, для экономии энергии они кодируют в своих геномах все ферменты, необходимые для полного окисления аммиака через нитрит в нитрат. В серой лесной почве бактерии Nitrospirae представлены в незначительных количествах (0.03–0.007% в междурядьях), в то время как в бурой лесной почве их доля повышается до 0.58% (междурядья) и 0.92% (ризосфера), т.е. увеличивается в среднем более чем в 80 раз. При этом наибольшее их число встречается под ермаковским климатипом в ризосфере и между рядами посадок кедровых сосен (табл. 3). Кроме того, в бурой лесной почве под всеми климатипами в междурядьях и ризосфере отмечено присутствие архей рода Nitrososphaera филы Thaumarchaeota (табл. 3), которые играют главную роль в биологическом окислении аммония (AOA) (Stieglmeier et al., 2014). Число последовательностей представителей Nitrososphaera в почве междурядий и в ризосфере под кедровыми соснами коррелировало с содержанием Сорг (r = –0.88), NЛГ (r = 0.72 и –0.99), рН (r = –0.81), а также с ферментами уреазой (r = = 0.91 и 0.79) и протеазой (r = –0.91), что согласуется с ранее опубликованными данными (Bates et al., 2011; Stieglmeier et al., 2014; Oton et al., 2016).
Важную роль в минерализации органики играют представители филы Acidobacteria. В бурой лесной почве ацидофильные микроорганизмы доминируют, они характеризуются бόльшим числом и разнообразием, чем в серой лесной почве. Представители выявленных 20 классов (34 рода) в ризосферной почве кедровых сосен составляли 31–34%, а в междурядьях – 32–32%, в то время как в серой лесной почве были выявлены 18 классов (20 родов), доля которых в ризосфере составляла 19–26%, а в междурядьях – 20–22%.
Еще одна особенность бурой лесной почвы в Хабаровском крае – присутствие значительного числа споровых почкующихся бактерий из класса Ktedonobacteria (Chloroflexi) (Наумова и др., 2018). В обоих типах почв было выявлено 4–5 родов, из которых доминирующими были Ktedonobacter и Thermosporothrix. Для этих бактерий оптимальными условиями развития были повышенные значения влаги и температуры в почве. Поэтому их особенно много (26.4–26.9%) в почве под сосной сибирской ермаковского климатипа (из-за затапливаемости их участков), в то время как под сосной корейской формируется 10.5–18.4% (междурядье) и 12.7–13.3% (ризосфера) общего числа последовательностей. Кроме того, под P. sibirica также было отмечено повышенное содержание представителей филы Latescibacteria (табл. 3). Полагаем, что наличие в почве значительного числа вышеназванных бактерий может быть индикатором неблагоприятных для роста и развития кедровых сосен условий.
В процессах разложения органики в почвах немаловажную роль играют представители фил Actinobacteria и Firmicutes, обладающие мощным ферментативным аппаратом. Актиномицеты трансформируют и разрушают сложные органические соединения, не доступные многим другим микроорганизмам (целлюлозу, гумус, хитин, лигнин и др.), играют важную роль в процессах почвообразования и создания плодородия почв. По разнообразию и численности серая лесная почва более богата актиномицетами, чем бурая лесная (табл. 3). Представители трех классов составляли 62–76% общего числа актинобактерий (Actinobacteria, Thermoleophilia, Acidimicrobiia). В бурой лесной почве доминировали представители четырех классов, доля которых в общем числе актинобактерий составляла 75–84% (Rubrobacteria, Acidimicrobiia, Actinobacteria, Thermoleophilia).
Прокариоты филы Firmicutes в серой лесной почве представлены классами Bacilli (15 родов), Clostridia (6 родов), Negativicutes (р. Veillonella – единичное присутствие). Под всеми климатипами кедровых сосен доминировали споровые бактерии из родов Bacillus, Paenibacillus, Tumebacillus, Cohnella и Clostridium sensu stricto – 83–89% всех фирмикутов. При этом под посадками P. koraiensis формировалось в 3.2 раза больше всех выделенных последовательностей как в ризосфере, так и междурядьях по сравнению с таковыми под посадками P. sibirica. В бурой лесной почве Хехцирского лесничества представителей Firmicutes было существенно меньше, они встречались единично (табл. 3). Споровые бактерии из классов Bacilli (роды Bacillus и Paenibacillus) и Clostridia (роды Acetivibrio, Clostridium) были выявлены только в почве междурядий кедровых сосен. Бактерии класса Negativicutes (роды Sporomusa, Megasphaera, Megamonas) были обнаружены единично в ризосфере ермаковского климатипа P. sibirica.
Олиготрофная группа микроорганизмов представлена в почвах в основном неспорообразующими грамотрицательными бактериями часто необычной морфологии – многие из них имеют различные придатки, образуют выросты, простеки. К ним относится группа бактерий суперфилума PVC, состоящая из представителей трех фил, Planctomycetes–Verrucomicrobia–Chlamydiae. В серой лесной почве группа PVC представлена бόльшим разнообразием и количеством ОТЕ (табл. 3). Это аэробные и факультативно-анаэробные бактерии, вовлеченные в углеродные и азотные циклы, обладающие высоким гликолитическим потенциалом и участвующие в деградации полимеров растительного происхождения, экзоскелетов насекомых, а также экзополисахаридов, продуцируемых другими бактериями (Pilhofer et al., 2008; Pinos et al., 2016). В исследуемых почвах самая многочисленная фила Verrucomicrobia с доминирующими родами Spartobacteria и Subdivision3 (genera _incertae_sedis) “неопределенного положения”. В серой лесной почве бактерий Verrucomicrobia в ризосфере кедровых сосен выявлено в 2.4–3.3, а в междурядьях – в 5.6–5.9 раза больше, чем в бурой лесной почве. На долю Spartobacteria в серой лесной почве приходится 80.3–83.5% (ризосфера) и 91.3–93.1% (междурядья), Subdivision3 – 15.5–19.1% (ризосфера) и 6.5–8.2% (междурядья), а доля представителей родов Opitutus и Verrucomicrobium вместе составила >1% выявленных Verrucomicrobia. В бурой лесной почве на долю рода Spartobacteria приходится 68–84% (ризосфера) и 76–83% (междурядья), бактерий Subdivision3 – 30–18% (ризосфера) и 21–23% (междурядья), доля представителей рода Opitutus была более значима, чем в серой лесной почве – 2.6–2.5% (ризосфера) и 2.7–2.1% (междурядья). При этом отмечено, что под P. sibirica доминируют бактерии родов Opitutus и Subdivision3, а под P. koraiensis – Spartobacteria и Verrucomicrobium.
Таким образом, установлено, что тип почвы и межвидовая гетерогенность кедровых сосен оказывали влияние на формирование количественного и качественного состава прокариотных микробиомов в исследуемых почвах двух лесничеств.
Дыхательная активность почв под кедровыми соснами. Интенсивность выделения почвенными микроорганизмами углекислого газа указывает на энергию процесса разложения органических соединений и характеризует актуальную биологическую активность почв. Важнейшие показатели дыхательной активности почв – показатели микробного (базального) дыхания (БД) и микробной биомассы (МБ (Смик)). Сезонная динамика дыхания почвенных микроорганизмов контролируется (прямо или косвенно) температурой и влажностью почвы, фенофазами растительности (Sarathchandra et al., 1989; Raich, Schlesinger, 1992).
Сравнительная характеристика респираторной активности почвенных микроорганизмов позволила обнаружить, что, несмотря на повышенную кислотность бурой лесной почвы, значения МБ и БД в ней под всеми климатипами были значительно выше, чем в серой лесной почве юга Красноярского края. Судя по скорости выделения CO2, процессы минерализации органического вещества протекали интенсивнее в бурой лесной почве: в ризосфере – в 1.5, а в междурядьях – в 1.4 раза (рис. 2).
Рис. 2.
Микробные биомассы (МБ) и базальное дыхание (БД) микроорганизмов в ризосфере и междурядьях под кедровыми соснами в зависимости от географических климатипов (Ч – чугуевский, О – облученский, Е – ермаковский) и типа почв в Ермаковском и Хехцирском лесничествах; для рис. 2 и 3.
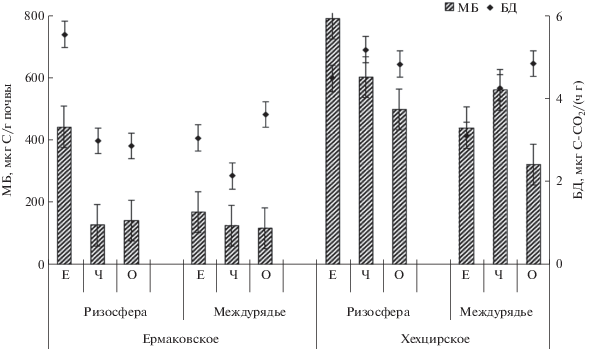
Корневые выделения кедра сибирского формировали большее содержание микробной биомассы, чем кедра корейского в обоих типах почв (серая лесная – в 3.1–3.4, бурая лесная – в 1.3–1.6 раза) (рис. 2). В почве между рядами посадок такой тенденции не обнаруживается, содержание МБ под климатипами различалось недостоверно (рис. 2).
Отмечено, что в серой лесной почве значения МБ и скорости БД зависели от рН и температуры, причем значения МБ в ризосфере и между рядами посадок положительно коррелировали с Сорг, Nвал, С : N. В бурой лесной почве значимые корреляционные зависимости в ризосфере были найдены между МБ и температурой почвы, Сорг и NЛГ. В почве междурядий значимые корреляционные зависимости были отмечены между БД и рН, БД и температурой и влажностью, между МБ и С : N (табл. 4).
Таблица 4.
Коэффициенты корреляции (r) зависимостей базального дыхания (БД), микробной биомассы (МБ), метаболического коэффициента (QR) от физико-химических показателей серой и бурой лесных почв под климатипами кедровых сосен в ризосфере (числитель) и между рядами посадок (знаменатель) в разных местах тестирования, n = 3 (p < 0.05)
| Показатель | рН | Т, °С | Сорг | Nвал | NЛГ | С : N |
|---|---|---|---|---|---|---|
| Ермаковское лесничество, серая лесная почва | ||||||
| МБ | $\frac{{0.98}}{{0.96}}$ | $\frac{{0.85}}{{0.93}}$ | $\frac{{0.96}}{{0.78}}$ | $\frac{{0.94}}{{--0.73}}$ | $\frac{{0.82}}{{0.69}}$ | $\frac{{0.999}}{{0.84}}$ |
| БД | $\frac{{0.96}}{{0.27}}$ | $\frac{{0.88}}{{--0.38}}$ | $\frac{{0.94}}{{0.62}}$ | $\frac{{0.91}}{{0.68}}$ | $\frac{{0.77}}{{0.72}}$ | $\frac{{0.997}}{{0.54}}$ |
| QR = БД/СИД | $\frac{{--0.995}}{{~0.06}}$ | $\frac{{--0.65}}{{--0.56}}$ | $\frac{{--0.999}}{{~0.44}}$ | $\frac{{--0.999}}{{~0.82}}$ | $\frac{{--0.95~}}{{0.56}}$ | $\frac{{--0.96}}{{0.36}}~$ |
| Хехцирское лесничество, бурая лесная почва | ||||||
| МБ | $\frac{{--0.73}}{{--0.16}}$ | $\frac{{0.75}}{{--0.22}}$ | $\frac{{--0.94}}{{0.21}}~$ | $\frac{{0.13}}{{0.14}}$ | $\frac{{--0.99}}{{--0.67}}$ | $\frac{{--0.27}}{{~0.65}}$ |
| БД | $\frac{{--0.07}}{{--0.88}}$ | $\frac{{--0.99}}{{--0.85}}$ | $\frac{{0.87}}{{--0.99}}$ | $\frac{{--0.85}}{{--0.98}}$ | $\frac{{0.51}}{{--0.48}}$ | $~\frac{{0.92}}{{--0.93}}$ |
| QR = БД/СИД | $\frac{{0.60}}{{--0.27}}$ | $\frac{{--0.85}}{{--0.21}}$ | $\frac{{0.98}}{{--0.60}}$ | $\frac{{--0.30}}{{--0.55}}$ | $\frac{{0.95}}{{0.30}}$ | $~\frac{{0.43}}{{--0.91}}$ |
Вклад микроорганизмов в углеродный пул в исследуемых почвах различен. В среднем в бурой лесной почве в ризосфере кедровых сосен доля Смик в Сорг составляла 0.5, в междурядьях – 0.62, а в серой лесной почве в ризосфере – 0.32, в междурядьях – 0.34%. Следовательно, вклад углерода микробной биомассы в общий органический углерод был выше в бурой лесной, чем в серой лесной почве в 1.6 (ризосфера) и в 1.9 (междурядья) раза (табл. 1).
Значения микробного метаболического коэффициента (QR), критерия устойчивости микробных сообществ и индикатора эффективности использования субстрата (Anderson, Domsch, 1990; Ананьева, 2003), были довольно низкими в обоих типах почв (QR < 0.5) (рис. 3). В бурой лесной почве значения QR были ниже, чем в серой лесной почве в 1.9 (междурядья) и 2.3 раза (ризосфера). Отмечено, что в серой лесной почве различия во влиянии разных климатипов кедров на удельную дыхательную активность микробных сообществ достоверны как в ризосфере, так и в почве междурядий. В бурой лесной почве такие различия отсутствуют, под всеми климатипами минерализация органики происходит практически с одинаковой скоростью и более интенсивно, чем в серой лесной почве, что подтверждается высокими значениями МБ и БД (рис. 2, 3).
Рис. 3.
Коэффициент удельного дыхания микроорганизмов (QR) в ризосфере и междурядьях под кедровыми соснами в зависимости от географических климатипов.

Зависимости QR от содержания Сорг и Nвал, а также от температуры, рН и влажности почвы различались по типам почв и зонам (табл. 4). В ризосфере климатипов серой лесной почвы дыхательная активность достоверно обратно коррелировала со всеми показателями, в бурой же, напротив, с большинством параметров корреляция была положительной (табл. 4). В целом значения микробного метаболического коэффициента QR обоих типов почв свидетельствуют о том, что их микробные сообщества адаптированы к данному режиму, функционируют в пределах природной вариабельности, процессы трансформации органики в них достаточно стабильны.
Ферментативная активность почв. Ферменты группы гидролаз и оксидоредуктаз оказывают наибольшее влияние на процессы разложения органических веществ и гумусонакопления в почве (Хазиев, 2005). Проявление в почвенных образцах довольно активных гидролитических ферментов (инвертазы, протеазы, уреазы), катализирующих расщепление высокомолекулярных органических соединений, также свидетельствует о высокой интенсивности мобилизационных процессов. Гидролазы, таким образом, участвуют в обогащении почвы доступными для растений и микроорганизмов питательными веществами. Оксидоредуктазная способность в почве под посадками кедровых сосен – дополнительная характеристика процессов синтеза и распада гумусовых веществ. Полифенолоксидазы и пероксидазы участвуют в процессах гумусообразования, отношение их содержания (ПФО/ПО) – условный коэффициент гумификации (Kг), который в определенной мере характеризует направленность этого процесса (Гулько, Хазиев, 1992).
Из-за существенной разницы климатических, географических и лесорастительных условий ферментативные активности почв двух регионов различались между собой. Активности различных ферментов различались по видам и климатипам кедровых сосен, а также по почвенным зонам (ризосфера, междурядье). В целом ферментативная активность серой лесной почвы превышала таковую бурой лесной в 1.6 (ризосфера) и 1.2 раза (междурядья). В серой лесной почве активности уреазы, инвертазы, ПФО были выше в ризосфере, чем между рядами посадок, а активности протеазы и ПО были более выражены в междурядьях. При этом под P. sibirica как в ризосфере, так и в междурядьях были отмечены более низкие протеазная и пероксидазная активности, чем под P. koraiensis (табл. 5). В бурой лесной почве в целом активность всех ферментов была выше в зоне ризосферы кедровых сосен, чем между рядами посадок. Под климатипом кедра сибирского активность всех ферментов, кроме инвертазы (в ризосфере), была снижена по сравнению с таковой под корейскими климатипами (табл. 5).
Таблица 5.
Ферментативная активность серой лесной и бурой лесной почв в ризосфере (числитель) и между рядами (знаменатель) под климатипами Pinus sibirica и Pinus koraiensis (n = 3)
| Вид сосны кедровой | Климатип | ПФО | ПО | Кг (ПФО/ПО) | Инвертаза, глюкоза |
Протеаза, глицин | Уреаза, N-NH4 |
|---|---|---|---|---|---|---|---|
| мг бензохинона/г почвы | мг/ г почвы | ||||||
| Серая лесная почва (Ермаковское лесничество) | |||||||
| P. sibirica | Е | $\frac{{0.37 \pm 0.07}}{{0.27 \pm 0.01}}$ | $\frac{{0.55 \pm 0.04}}{{0.45 \pm 0.04}}$ | $\frac{{0.67 \pm 0.21}}{{0.60 \pm 0.02}}$ | $\frac{{64.32 \pm 0.17}}{{72.17 \pm 0.97}}$ | $\frac{{0.40 \pm 0.03}}{{0.67 \pm 0.03}}$ | $\frac{{6.16 \pm 0.20}}{{5.72 \pm 0.20}}$ |
| P. koraiensis | Ч | $\frac{{0.36 \pm 0.07}}{{0.38 \pm 0.07}}$ | $\frac{{0.72 \pm 0.06}}{{0.61 \pm 0.03}}$ | $\frac{{0.49 \pm 0.18}}{{0.62 \pm 0.21}}$ | $\frac{{70.76 \pm 0.94}}{{44.11 \pm 0.13}}$ | $\frac{{1.13 \pm 0.13}}{{1.02 \pm 0.18}}$ | $\frac{{5.42 \pm 0.30}}{{3.82 \pm 0.70}}$ |
| О | $\frac{{0.43 \pm 0.05}}{{0.24 \pm 0.04}}$ | $\frac{{0.76 \pm 0.07}}{{1.26 \pm 0.07}}$ | $\frac{{0.57 \pm 0.20}}{{0.19 \pm 0.02}}$ | $\frac{{59.19 \pm 0.23}}{{50.22 \pm 2.30}}$ | $\frac{{0.83 \pm 0.05}}{{1.38 \pm 0.03}}$ | $\frac{{5.79 \pm 0.30}}{{5.26 \pm 0.30}}$ | |
| Бурая лесная почва (Хехцирское лесничество) | |||||||
| P. sibirica | Е | $\frac{{0.3 \pm 0.02}}{{0.14 \pm 0.02}}$ | $\frac{{0.29 \pm 0.02}}{{0.22 \pm 0.01}}$ | $\frac{{0.84 \pm 0.08}}{{0.66 \pm 0.12}}$ | $\frac{{65.09 \pm 0.95}}{{58.12 \pm 0.43}}$ | $\frac{{0.71 \pm 0.08}}{{0.43 \pm 0.03}}$ | $\frac{{3.80 \pm 0.24}}{{3.32 \pm 0.24}}$ |
| P. koraiensis | Ч | $\frac{{0.2 \pm 0.01}}{{0.31 \pm 0.06}}$ | $\frac{{0.33 \pm 0.04}}{{0.30 \pm 0.05}}$ | $\frac{{0.70 \pm 0.06}}{{1.04 \pm 0.04}}$ | $\frac{{59.38 \pm 0.68}}{{59.31 \pm 1.09}}$ | $\frac{{0.88 \pm 0.08}}{{0.59 \pm 0.04}}$ | $\frac{{4.30 \pm 0.55}}{{2.25 \pm 0.26}}$ |
| О | $\frac{{0.2 \pm 0.01}}{{0.25 \pm 0.04}}$ | $\frac{{0.37 \pm 0.05}}{{0.35 \pm 0.06}}$ | $\frac{{0.65 \pm 0.06}}{{0.78 \pm 0.06}}$ | $\frac{{59.19 \pm 0.45}}{{59.29 \pm 0.05}}$ | $\frac{{1.83 \pm 0.13}}{{0.63 \pm 0.08}}$ | $\frac{{4.00 \pm 0.53}}{{3.37 \pm 0.55}}$ | |
Несмотря на то что активности всех ферментов серой лесной почвы в междурядьях и ризосфере в целом превышали таковые бурой лесной, значения Kг были более высокими в бурой лесной почве (в 1.8 и 1.3 раза в междурядьях и ризосфере соответственно), что, скорее всего, свидетельствует о более высокой интенсивности накопления гумуса по сравнению с серой лесной почвой.
Анализ главных компонент, проведенный по микробиологическим, агрохимическим показателям и составу прокариотного микробиома, показал, что все параметры серой лесной почвы расположены в левой полуплоскости, а бурой лесной – в правой, что подтверждает различия между этими почвами (рис. 4). Обилие основных типов прокариот с основными микробиологическими и агрохимическими параметрами почвы, располагающихся в плоскости двух главных компонент, совместно отвечают за 63.5% общей дисперсии данных. Весомый вклад в первую главную компоненту внесли МБ, Смик, %. Наибольший вклад во вторую компоненту вносили Смик, %, C : N, доли типов Proteobacteria, Chloroflexi (класс Ktedonobacteria) и Actinobacteria.
Рис. 4.
Расположение параметров двух типов почв (серой лесной и бурой лесной) в плоскости двух главных компонент, полученных по основным почвенным характеристикам и обилию выявленных типов прокариот. Каждая точка характеризуется следующими почвенными параметрами: Т, °C, влажностью, рН, МБ, БД, QR, Смик, %, Cорг, Nвал, C : N, ферментами (инвертаза, протеаза, уреаза, пероксидаза, полифенолоксидаза) и Kг, а также наличием филоспецифичных типов бактерий: Proteobacteria, Actinobacteria, Acidobacteria, Chloroflexi (Ktedonobacteria), Verrucomicrobia, Planctomycetia, Bacteroidetes, Firmicutes, Gemmatimonadete.

Корреляционный анализ показал взаимосвязь между индексами биоразнообразия и основными почвенными параметрами. Высокие корреляционные связи (прямая и обратная) с микробиологическими, ферментативными и химическими анализируемыми почвенными параметрами (всего 17) были отмечены в Ермаковском лесничестве – с индексами Шеннона (15), Бергера–Паркера (14–15), Менхиника (13–16), а в Хехцирском лесничестве – с индексами Маргалефа (12–13), Менхиника (9–14), Симпсона (12–13) (табл. 6).
Таблица 6.
Корреляция индексов биоразнообразия с параметрами почв Ермаковского (в числителе) и Хехцирского (в знаменателе) лесничеств (p < 0.05)
| Параметр | H | d | DMg | DMn | D | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Р | М | Р | М | Р | М | Р | М | Р | М | |
| Температура | $\frac{{0.34}}{{0.89}}$ | $\frac{{0.42}}{{0.29}}$ | $\frac{{--0.40}}{{--0.87}}$ | $\frac{{--0.60}}{{--0.22}}$ | $\frac{{--0.55}}{{0.36}}~$ | $\frac{{0.63}}{{0.97}}$ | $\frac{{0.50}}{{0.95}}$ | $\frac{{0.99}}{{0.71}}$ | $\frac{{0.93}}{{0.55}}$ | $\frac{{0.05}}{{0.60}}$ |
| Влажность | $\frac{{--0.97}}{{0.75}}$ | $\frac{{--0.99}}{{0.13}}$ | $\frac{{0.98}}{{--0.78}}$ | $\frac{{0.99}}{{--0.21}}$ | $\frac{{--0.39}}{{--0.74}}$ | $\frac{{--0.99}}{{--0.80}}$ | $\frac{{--0.998}}{{0.06}}$ | $\frac{{--0.59}}{{--0.36}}$ | $\frac{{--0.22}}{{--0.58}}$ | $\frac{{0.84}}{{--0.87}}$ |
| рН | $\frac{{0.90}}{{0.36}}$ | $\frac{{0.89}}{{0.23}}$ | $\frac{{--0.92}}{{--0.41}}$ | $\frac{{--0.97}}{{--0.16}}$ | $\frac{{--0.18}}{{--0.96}}$ | $\frac{{0.98}}{{0.96}}$ | $\frac{{0.96}}{{--0.40}}$ | $\frac{{0.85}}{{0.67}}$ | $\frac{{0.42}}{{--0.89}}$ | $\frac{{--0.58}}{{0.64}}$ |
| Сорг | $\frac{{0.93}}{{--0.68}}$ | $\frac{{0.85}}{{--0.13}}$ | $\frac{{--0.95}}{{0.64}}$ | $\frac{{--0.95}}{{0.21}}$ | $\frac{{0.26}}{{--0.66}}$ | $\frac{{0.96}}{{0.79}}$ | $\frac{{0.98}}{{--0.999}}$ | $\frac{{0.88}}{{0.36}}$ | $\frac{{0.35}}{{--0.80}}$ | $\frac{{--0.52}}{{0.88}}$ |
| Nвал | $\frac{{0.95}}{{0.97}}$ | $\frac{{0.86}}{{--0.07}}$ | $\frac{{--0.97}}{{--0.98}}$ | $\frac{{--0.95}}{{0.15}}$ | $\frac{{0.31}}{{--0.35}}$ | $\frac{{0.96}}{{0.83}}$ | $\frac{{0.99}}{{0.51}}$ | $\frac{{0.88}}{{0.42}}$ | $\frac{{0.30}}{{--0.15}}$ | $\frac{{--0.53}}{{0.84}}$ |
| NЛГ | $\frac{{0.998}}{{--0.23}}$ | $\frac{{0.78}}{{0.73}}$ | $\frac{{--0.999}}{{0.18}}$ | $\frac{{--0.90}}{{--0.67}}$ | $\frac{{0.56}}{{--0.95}}$ | $\frac{{0.91}}{{0.96}}$ | $\frac{{0.99}}{{--0.86}}$ | $\frac{{0.94}}{{0.97}}$ | $\frac{{0.03}}{{--0.99}}$ | $\frac{{--0.40}}{{0.12}}$ |
| C : N | $\frac{{0.95}}{{--0.99}}$ | $\frac{{0.90}}{{--0.59}}$ | $\frac{{--0.97}}{{0.998}}$ | $\frac{{--0.97}}{{0.65}}$ | $\frac{{0.33}}{{0.21}}$ | $\frac{{0.98}}{{0.40}}$ | $\frac{{0.99}}{{--0.63}}$ | $\frac{{0.84}}{{--0.14}}$ | $\frac{{0.28}}{0}$ | $\frac{{--0.59}}{{1.00}}$ |
| МБ | $\frac{{0.79}}{{0.37}}$ | $\frac{{0.50}}{{--0.997}}$ | $\frac{{--0.83}}{{--0.33}}$ | $\frac{{--0.68}}{{0.999}}$ | $\frac{{--0.02}}{{0.88}}$ | $\frac{{0.70}}{{--0.43}}$ | $\frac{{0.89}}{{0.92}}$ | $\frac{{0.999}}{{--0.84}}$ | $\frac{{0.60}}{{0.96}}$ | $\frac{{--0.04}}{{0.65}}$ |
| БД | $\frac{{0.74}}{{--0.95}}$ | $\frac{{0.87}}{{0.25}}$ | $\frac{{--0.78}}{{0.94}}$ | $\frac{{--0.75}}{{--0.33}}$ | $\frac{{--0.09}}{{--0.20}}$ | $\frac{{0.72}}{{--0.71}}$ | $\frac{{0.85}}{{--0.89}}$ | $\frac{{0.03}}{{--0.24}}$ | $\frac{{0.65}}{{--0.40}}$ | $\frac{{--0.999}}{{--0.93}}$ |
| QR | $\frac{{--0.91}}{{--0.52}}$ | $\frac{{0.74}}{{0.87}}$ | $\frac{{0.94}}{{0.48}}$ | $\frac{{--0.57}}{{--0.91}}$ | $\frac{{--0.22}}{{--0.79}}$ | $\frac{{0.54}}{{0.01}}$ | $\frac{{--0.97}}{{--0.97}}$ | $\frac{{--0.20}}{{0.53}}$ | $\frac{{--0.38}}{{--0.90}}$ | $\frac{{--0.97}}{{--0.91}}$ |
| Смик, % | $\frac{{0.81}}{{0.40}}$ | $\frac{{0.62}}{{--0.88}}$ | $\frac{{--0.84}}{{--0.35}}$ | $\frac{{--0.78}}{{0.91}}$ | $\frac{{0.001}}{{0.87}}$ | $\frac{{0.80}}{{--0.03}}$ | $\frac{{0.90}}{{0.93}}$ | $\frac{{0.99}}{{--0.54}}$ | $\frac{{0.57}}{{0.95}}$ | $\frac{{--0.19}}{{0.90}}$ |
| ПФО | $\frac{{0.30}}{{0.73}}$ | $\frac{{--0.94}}{{--0.41}}$ | $\frac{{--0.24}}{{--0.70}}$ | $\frac{{0.84}}{{0.33}}$ | $\frac{{0.95}}{{0.60}}$ | $\frac{{--0.82}}{{--0.99}}$ | $\frac{{0.13}}{{0.999}}$ | $\frac{{--0.19}}{{--0.79}}$ | $\frac{{--0.96}}{{0.75}}$ | $\frac{{0.99}}{{--0.49}}$ |
| ПО | $\frac{{--0.64}}{{--0.19}}$ | $\frac{{0.19}}{{0.33}}$ | $\frac{{0.68}}{{0.14}}$ | $\frac{{0.03}}{{--0.41}}$ | $\frac{{0.24}}{{--0.96}}$ | $\frac{{--0.06}}{{--0.65}}$ | $\frac{{--0.76}}{{--0.83}}$ | $\frac{{--0.75}}{{--0.16}}$ | $\frac{{--0.76}}{{--0.999}}$ | $\frac{{--0.62}}{{--0.96}}$ |
| Кг | $\frac{{0.97}}{{0.46}}$ | $\frac{{--0.41}}{{--0.72}}$ | $\frac{{--0.98}}{{--0.42}}$ | $\frac{{0.02}}{{0.66}}$ | $\frac{{0.39}}{{0.84}}$ | $\frac{{--0.16}}{{--0.96}}$ | $\frac{{0.998}}{{0.95}}$ | $\frac{{0.58}}{{--0.96}}$ | $\frac{{0.22}}{{0.93}}$ | $\frac{{0.78}}{{--0.14}}$ |
| Уреаза | $\frac{{0.95}}{{--0.98}}$ | $\frac{{0.996}}{{0.92}}$ | $\frac{{--0.97}}{{0.97}}$ | $\frac{{--0.99}}{{--0.89}}$ | $\frac{{0.32}}{{--0.11}}$ | $\frac{{0.99}}{{0.80}}$ | $\frac{{0.99}}{{--0.84}}$ | $\frac{{0.59}}{{0.99}}$ | $\frac{{0.29}}{{--0.31}}$ | $\frac{{--0.84}}{{--0.23}}$ |
| Протеаза | $\frac{{--0.96}}{{0.17}}$ | $\frac{{--0.14}}{{0.15}}$ | $\frac{{0.98}}{{--0.22}}$ | $\frac{{0.35}}{{--0.23}}$ | $\frac{{--0.35}}{{--0.998}}$ | $\frac{{--0.38}}{{--0.78}}$ | $\frac{{--0.99}}{{--0.58}}$ | $\frac{{--0.92}}{{--0.34}}$ | $\frac{{--0.26}}{{--0.96}}$ | $\frac{{--0.33}}{{--0.89}}$ |
| Инвертаза | $\frac{{--0.69}}{{0.65}}$ | $\frac{{0.996}}{{--0.1}}$ | $\frac{{0.65}}{{--0.62}}$ | $\frac{{--0.95}}{{0.02}}$ | $\frac{{--0.99}}{{0.69}}$ | $\frac{{0.94}}{{--0.91}}$ | $\frac{{--0.56}}{{--0.998}}$ | $\frac{{0.44}}{{--0.56}}$ | $\frac{{0.74}}{{0.82}}$ | $\frac{{--0.92}}{{--0.74}}$ |
ЗАКЛЮЧЕНИЕ
Установлено, что виды и климатипы кедровых сосен P. sibirica и P. koraiensis оказывали влияние на химические и биологические свойства почв. Исследуемые почвы различались между собой интенсивностью процессов минерализации органики, трансформации С и N и направленностью почвенных процессов, что проявилось в количественных различиях содержания гумуса, валового и гидролизуемого азота, кислотности, скорости биохимических процессов, респираторной активности и формировании структуры микробных сообществ.
Микробиомы исследуемых почв под кедровыми соснами отличались качественно и количественно. На их формирование достоверно влияли тип почв (географическое расположение), физико-химические параметры, биохимические и респирометрические свойства почв, видовая принадлежность (корневые выделения) кедровых сосен. Основными типами бактерий в обоих типах почв были Acidobacteria, Proteobacteria и Actinobacteria, совместно составляющие в зависимости от почвы 75–85% общего числа типоспецифичных последовательностей генов 16S рРНК.
Размеры и таксономическое богатство микробных сообществ тесно связаны с количеством и качеством органического вещества, содержанием Сорг и N. В серой лесной почве под посадками всех климатипов кедровых сосен формировалось большее по численности, а в бурой лесной почве – большее родовое/видовое разнообразие прокариот. В зоне ризосферы P. koraiensis формировалось значительное содержание азотфиксаторов (ризобактерий) (Proteobacteria), актинобактерий (Actinobacteria), планктомицетов (Planctomycetes), цианобактерий (Cyanobacteria), а под P. sibirica – больше представителей фил Firmicutes, Bacterioidetes и Gemmatimonadetes (в серой лесной почве), Latescibacteria, Nitrospirae и Chloroflexi (в бурой лесной почве).
На наш взгляд, сосна корейская, активно растущая, как в привычных для нее условиях Хабаровского края, так и при интродукции в Красноярском крае, стимулирует развитие азотфиксаторов и трансформацию азота более интенсивно, чем сосна сибирская. Для популяции сосны сибирской лучшие условия произрастания отмечены в природном местообитании (Красноярский край). На систематически затопляемых участках бурой лесной почвы Хабаровского края ермаковская популяция P. sibirica находится в угнетенном состоянии. Индикаторами неблагоприятных условий для роста географических культур кедровых сосен, причиной их заболеваний могут служить повышенная численность, особенно в ризосфере, ацидофильных (Acidobacteria) и почкующихся бактерий класса Ktedonobacteria (Chloroflexi), а также Latescibacteria и Nitrospirae.
Исследования выполнены при финансовой поддержке РФФИ (грант 13-04-01671).
Список литературы
Алексанов В.В. Методы изучения биологического разнообразия. Калуга: ГБУ ДО КО ОЭБЦ, 2017. 70 с.
Ананьева Н.Д. Микробиологические аспекты самоочищения и устойчивости почв. М.: Наука, 2003. 222 с.
Гродницкая И.Д., Кузнецова Г.В., Антонов Г.И., Кондакова О.Э. Влияние географических культур кедровых сосен (Pinus sibiriсa Du Tour и Pinus koraiensis Siebold et Zucc.) на биологические свойства почвы на юге Красноярского края // Лесоведение. 2016. № 2. С. 135–147.
Гулько А.Е., Хазиев Ф.Х. Фенолоксидазы почв: продуцирование, иммобилизация, активность // Почвоведение. 1992. № 11. С. 55–67.
Ирошников А.И. Географические культуры хвойных в Южной Сибири // Географические культуры и плантации хвойных в Сибири / Ред. Минина Е.Г., Ирошников А.И. Новосибирск: Наука, 1977. С. 104–110.
Классификация и диагностика почв СССР / Ред. Егоров В.В., Иванова Е.Н., Фридланд В.М. М.: Колос, 1977. 225 с.
Классификация и диагностика почв России / Ред. Шишов Л.Л., Тонконогов В.Д., Лебедева И.И., Герасимова М.И. Смоленск: Ойкумена, 2004. 342 с.
Количественные методы экологии и гидробиологии (сборник научных трудов, посвященный памяти А.И. Баканова) / Отв. ред. Розенберг Г.С. Тольятти: СамНЦ РАН, 2005. 404 с.
Кузнецова Г.В. Рост, состояние и развитие кедровых сосен в географических культурах на юге Красноярского края // Хвойные бореальной зоны. 2010. Т. 27. № 1–2. С. 102–107.
Кузнецова Г.В., Грек В.С. Адаптация кедровых сосен (Pinus sibirica Du Tour и Pinus koraiensis Siebold et Zucc.) к различным экологическим факторам в местах их тестирования // Сиб. лес. журн. 2016. № 5. С. 63–71.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во МГУ, 1991. 303 с.
Методы оценки структуры, функционирования и разнообразия детритных пищевых сетей. Методическое руководство / Под ред. Покаржевского А.Д., Гонгальского К.Б., Зайцева А.С. М.: Ин-т проблем экологии и эволюции им. А.Н. Северцова РАН, 2003. 100 с.
Наумова Н.Б., Аликина Т.Ю., Кузнецова Г.В. Биоразнообразие бактериальных ансамблей в буроземе, элювиированном под сосной корейской // Почвы и окружающая среда. 2018. Т. 1. № 3. С. 151–168.
Першина Е.В., Иванова Е.А., Нагиева А.Г., Жиенгалиев А.Т., Чирак Е.Л., Андронов Е.Е., Сергалиев Н.Х. Сравнительный анализ микробиомов природных и антропогенно-нарушенных почв северо-западного Казахстана // Почвоведение. 2016. № 6. С. 720–732.
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Чернов Т.И., Тхакахова А.К., Кутовая О.В. Оценка различных индексов разнообразия для характеристики почвенного прокариотного сообщества по данным метагеномного анализа // Почвоведение. 2015. № 4. С. 462–468.
Штейникова В.И., Ковалева Г.Ф. Морфобиологические особенности кедра сибирского и кедра корейского различного географического происхождения в горных лесах Хабаровского края // Тр. ДальНИИ лесн. хоз-ва. Хабаровск, 1982. Вып. 24. С. 112–119.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biol. Biochem. 1978. V. 10. № 3. P. 314–322.
Anderson T.H., Domsch K.H. Application of eco-physiological quotients qCO2 and qD on microbial biomass from soils of different cropping histories // Soil Biol. Biochem. 1990. V. 22. P. 251–255.
Bates S., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // ISME J. 2011. V. 5. P. 908–917.
Hansson K., Olsson B.A., Olsson M., Johansson U., Kleja D.B. Differences in soil properties in adjacent stands of Scots pine, Norway spruce and silver birch in SW Sweden // For. Ecol. Manag. 2011. V. 262. № 3. P. 522–530.
Hobbie S., Oleksyn J., Eissenstat D., Reich P. Fine root decomposition rates do not mirror those of leaf litter among temperate tree species // Oecologia. 2010. V. 162. P. 505–513.
Kakirde K.S., Parsley L.C., Liles M.R. Size does matter: Application-driven approaches for soil metagenomics // Soil Biol. Biochem. 2010. V. 42. P. 1911–1923.
Oton E.V., Quince C., Nicol1 G.W., Prosser J.I., Gubry-Rangin C. Phylogenetic congruence and ecological coherence in terrestrial Thaumarchaeota // ISME J. 2016. V. 10. P. 85–96.
Pinos S., Pontarotti P., Raoult D., Baudoin J.P., Pagnier I. Compartmentalization in PVC superphylum: evolution and impact // Biol. Direct. 2016. 11:38. P. 1–12. https://doi.org/10.1186/s13062-016-0144-3
Pilhofer M., Rappl K., Eckl C., Bauer A.P., Ludwig W., Schleifer K.H., Petroni G. Characterization and evolution of cell division and cell wall synthesis genes in the bacterial phyla Verrucomicrobia, Lentisphaerae, Chlamydiae, and Planctomycetes and phylogenetic comparison with rRNA genes // J. Bacteriol. 2008. V. 190. № 9. P. 3192–3202.
Raich J.W., Schlesinger W.H. The global carbon dioxide flux in soil respiration and relationship to vegetation and climate // Tellus B. 1992. V. 44. P. 81–99.
Sarathchandra S.U., Perrott K.W., Liter R.A. Soil microbial biomass: Influence of simulated temperature changes on size, activity and nutrient-content // Soil Biol. Boichem. 1989. V. 21. № 8. P. 987–993.
Singh K.P., Shekhar C. Seasonal pattern of total soil respiration, its fractionation and carbon balance in a wheat-maize rotation cropland at Varanasi // Pedobiologia. 1986. V. 29. P. 305–318.
Sparling G.T. The substrate-induced respiration method / Eds Alef K., Nannipieri P. // Methods in applied soil microbiology and biochemistry. Acad. Press, London.1995. P. 397–404.
Stieglmeier M., Klingl A., Alves R.J., Rittmann S.K., Melcher M., Leisch N., Schleper C. Nitrososphaera viennensis gen. nov., sp. nov., an aerobic and mesophilic, ammonia-oxidizing archaeon from soil and a member of the archaeal phylum Thaumarchaeota // Intern. J. Systematic Evol. Microbiol. 2014. V. 64. P. 2738–2752.
Youssef N.H., Farag I.F., Rinke C., Hallam S.J., Woyke T., Elshahed M.S. In Silico Analysis of the Metabolic Potential and Niche Specialization of Candidate Phylum “Latescibacteria” (WS3) // PloS One. 2015. V. 10(6). P. 1–21. e0127499. https://doi.org/10.1371/journal.pone.0127499
van Kessel M.A.H.J., Speth D.R., Albertsen M., Nielsen P.H., Camp H.J.M.O., Kartal B., Jetten M.S.M., Lücker S. Complete nitrification by a single microorganism // Nature. 2015. 528(7583): 555–9. https://doi.org/10.1038/nature16459
Weber P., Bardgett R.D. Influence of single trees on spatial and temporal patterns of belowground properties in native pine forest // Soil. Biol. Biochem. 2011. V. 43. № 6. P. 1372–1378.
World Reference Base for Soil Resources 2014. International soil classification system for naming soils and creating legends for soil maps // World Soil Res. Rep. № 106. Update 2015. FAO, Rome. www.fao.org
Zhao Q., Zeng D.H., Fan Z.-P. Nitrogen and phosphorus transformations in the rhizospheres of three tree species in a nutrient-poor sandy soil // Appl. Soil Ecol. 2010. V. 46. № 3. P. 341–346.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


