Известия РАН. Серия биологическая, 2021, № 5, стр. 528-536
Возрастная изменчивость рекламной песни мухоловки-пеструшки (Ficedula hypoleuca) в условиях естественной и городской среды
А. Е. Бастрикова 1, *, С. И. Гашков 1, Н. С. Москвитина 1
1 Национальный исследовательский Томский государственный университет
634050 Томск, пр. Ленина, 36, Россия
* E-mail: bastrikova_a_e@mail.ru
Поступила в редакцию 31.01.2020
После доработки 23.06.2020
Принята к публикации 04.10.2020
Аннотация
Проанализирована возрастная изменчивость частотных и структурно-временных параметров рекламной песни самцов Ficedula hypoleuca в естественных местообитаниях и городской среде. В естественных условиях у самцов с третьего года жизни сокращается диапазон частот песни, понижается ее максимальная частота, уменьшается количество фигур и сокращается длина песни. Аналогичные возрастные изменения песни у птиц в городе отмечаются раньше – со второго года жизни. У городских птиц происходит повышение минимальной частоты песни, адаптирующей ее к условиям шумового загрязнения и усиливающееся с возрастом.
Для птиц из подотряда певчих воробьиных (Oscines) пение имеет большое биологическое значение, являясь одним из ведущих способов внутри- и межвидовой коммуникации. Оно обеспечивает ряд важных функций, таких как информирование о занятости и удержание территории (Smith 1976, 1979; Krebs, 1977; McDonald, 1989; Nowicki et al., 1998), привлечение половых партнеров (Eriksson, Wallin, 1986; Mountjoy, Lemon, 1991; Johnson, Searcy, 1996), этологической изоляции близких видов (Irwin, 2000), поддержание структуры поселения (Catchpole, Slater, 2008).
Известно, что самки певчих птиц при выборе партнера, наряду с прочими характеристиками самца, оценивают также и его песню (Eriksson, Wallin, 1986). Исходя из этого, можно полагать, что рекламная песня может нести информацию о самой поющей особи, в частности, отражать его иммунный статус (Møller et al., 2000; Беме и др., 2014), возраст (Garamszegi et al., 2005), как одну из характеристик репродуктивного потенциала самца.
Возрастная изменчивость пения представляет большой интерес, поскольку возраст несет информацию об опыте и жизнеспособности особей, что во многом определяет “качество” самца, т.е. его потенциальный репродуктивный успех. Взрослые самцы, реализовавшие свою жизнеспособность, имеют опыт и могут вносить больший вклад в выкармливание и воспитание потомства (Desrochers, 1992).
Возрастному изменению могут быть подвержены различные параметры песни. На скворце Sturnus vulgaris, (Eens et al., 1992), западном соловье Luscinia megarhynchos (Kiefer et al., 2009), мухоловке-белошейке Ficedula albicollis (Garamszegi et al., 2007) и ряде других видов была показана тенденция увеличения размера репертуара с возрастом. У самцов деревенских ласточек вероятными маркерами возраста могут выступать количество фигур в рекламной песне, ее продолжительность и некоторые частотные характеристики (Galeotti et al., 2001; Garamszegi et al., 2005).
Вопрос о ходе изменения параметров песни птиц с возрастом остается мало изученным. Во многом это обусловлено методическими трудностями, сопряженными со сложностями сбора материала такого рода и точного определения возраста особей. Большинство исследователей в своих работах используют косвенные методики определения возраста, основанные на морфологических признаках. При таком подходе (Ojanen, 1987; Высоцкий, 1989) возможно выделение лишь двух возрастных групп – subadultus (годовалые) и adultus (взрослые). Для некоторых видов данные методики не абсолютны, и имеют существенные погрешности в определении возраста (Lundberg, Alatalo, 1992; Артемьев, 2008). По нашим наблюдениям, использование с этой целью такого признака, как форма центральных рулевых перьев (Высоцкий, 1989), дает ошибку около 25%.
Это осложняет оценку различий даже между группами взрослых и молодых птиц, а возрастные изменения внутри группы adultus вообще остаются не учтенными (Adret-Hausberger, et al., 1990).
Нельзя не учитывать, что для видов, обитающих в измененных человеком условиях, появляются дополнительные факторы, способные оказывать заметное влияние на возрастную изменчивость пения. Особое значение в этом отношении может иметь антропогенное шумовое загрязнение, затрудняющее акустическую коммуникацию птиц, мешающее передаче и восприятию сигнала. На большом числе видов показано, что у птиц, обитающих в таких условиях, отмечен сдвиг частот и максимальной амплитуды песни в более высокочастотную область (Slabbekoorn, Peet, 2003; Luther, Baptista, 2010; Mendes et al., 2011; Nemeth et al., 2013; Иваницкий и др., 2014), что может быть объяснено избеганием перекрывания видовых сигналов с антропогенными шумами диапазона 1–3000 Гц (Slabbekoorn, Peet, 2003; Roca et al., 2016). Другим механизмом, повышающим эффективность передачи сигнала в зашумленных условиях, может служить исполнение более длинных и медленных песен, что отмечается, например, у Copsychus saularis (Hill et al., 2018).
В числе видов, отнесенных к модельным, мухоловка-пеструшка (Ficedula hypoleuca) отличается рядом “удобных” для исследователей свойств. Она легко привлекается в искусственные гнездовья, заселяя различные местообитания (Артемьев, 2008). Птицы толерантны к антропогенным факторам, в силу чего возможны манипуляции исследователей с птенцами без негативных последствий для выводка. Это обеспечивает возможность массового кольцевания и достаточно полного контроля популяции, в том числе ее возрастной структуры. Для самцов этого вида характерна также высокая верность месту гнездования (Соколов 1991; Гашков 2003; Куранов, 2017).
Томская популяция мухоловки-пеструшки, населяющая восточную периферию ареала, всесторонне изучается в течение многих лет. Данный вид был впервые зарегистрирован на гнездовании в окрестностях г. Томска в 1907 г. (Иоганзен, 1914; Иоганзен, 1916). С 1985 г. ведется мониторинг популяции, позволивший выявить особенности полиморфизма, филопатрии, миграции, полигинии (Гашков 2003; Куранов 2007, 2017; Grinkov et al., 2018). В отношении филопатрии показано, в частности, что для данной популяции мухоловки-пеструшки характерен высокий процент возврата птенцов на место рождения – 6.6–8.4% (Grinkov, Gashkov 2003; Гашков 2003; Куранов, 2017). Акустическая коммуникация этого вида на данной территории остается наименее изученной (Бастрикова, Гашков, 2016, 2019).
Цель настоящей работы – изучение возрастной изменчивости частотных и структурно-временных характеристик рекламной песни мухоловки-пеструшки в природных и городских условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор материалов, положенных в основу настоящего исследования осуществляли в период с первой по третью декаду мая 2014–2017 гг. на территории двух парков г. Томска – “Университетская роща” (площадью 34 га) и “Лагерный сад” (17 га) и на естественном участке обитания вида (20 га) в окрестностях с. Коларово Томского р-на Томской области (56°20′ с.ш. 84°56′ в.д.). Оба городских участка подвержены антропогенному шумовому воздействию. Основной вклад в шумовую нагрузку вносит автотранспорт. Так, к “Университетской роще” с восточной стороны примыкает крупная четырехполосная дорога с интенсивностью трафика 1300–2000 транспортных средств в час. “Лагерный сад” с северной стороны граничит с шестиполосным участком автотрассы регионального значения “Р 400”. Интенсивность трафика на участке составляет 2300–2400 транспортных средств в час. По данным на 2019 г. эквивалентный уровень шума вблизи обоих парков составляет 70–74 Дб (Коваль, 2019). Помимо автотранспорта, для городских участков характерны также непредсказуемые источники шума, связанные с присутствием человека (музыка, громкие голоса и т.п.). На контрольном участке антропогенная шумовая нагрузка минимальна и не постоянна. Единственным источником антропогенного шумового воздействия является примыкающая к участку с юго-восточной стороны автодорога областного значения "Коларовский тракт”. Движение на данном участке дороги малоинтенсивное – 55–67 транспортных средств в час (наши данные).
Для привлечения птиц на гнездование все участки снабжены дощатыми искусственными гнездовьями (ИГ) типа “малый синичник” (200 ИГ в “Университетской роще”; около 100 ИГ – в “Лагерном саду”; 200 ИГ – на контрольном участке). Плотность гнездования мухоловки-пеструшки в исследуемые годы в среднем составила: в “Университетской роще” – 1.3 пары/га, “Лагерном саду” – 2.5 пары/га, 8 пар/га – на естественном участке.
Звукозапись производили в сухую, безветренную погоду с 7:00 до 14:00. Записывали пение “холостых”, еще не образовавших пару, самцов. Для записи звука использовали диктофон Olympus LS-12 (“Olympus Corp.”, Япония) с помощью выносного параболического микрофона PRO-5 PIP (“Telinga Microphones”, Швеция).
По окончании записи самцов отлавливали ловушками типа “клапан”, “боек” либо паутинными сетями для получения данных о возрасте птиц. В исследование включены только те самцы, которые с уверенностью могли быть отнесены к определенной возрастной группе. Самые точные сведения о возрасте мы получали, если на исследуемых участках самцы были окольцованы птенцами стандартными номерными кольцами. Это позволяло оценивать их возраст при повторных отловах в последующие годы. Всего проанализированы записи пения 48 самцов, распределенных по трем возрастным группам – годовалые, двухлетние и самцы в возрасте от трех лет и старше (табл. 1).
Таблица 1.
Распределение самцов Ficedula hypoleuca по возрастным группам
| Место записи | Количество особей в каждой возрастной группе | ||
|---|---|---|---|
| I (1 год) | II (2 года) | III (3–7 лет) | |
| Город | 15 | 6 | 7 |
| Естественный участок | 8 | 7 | 5 |
| Итого | 23 | 13 | 12 |
В последней группе из 12 отловленных присутствовало 6 самцов с точно определенным возрастом (на естественном участке: 2 особи – 3 лет , 1 – 5 лет, 1 – 7 лет; в городе: 1 – 3 лет; 1 – 4 лет). Еще 6 птиц включены в третью группу без точно известного года рождения, но в возрасте 3+ (1 особь на естественном участке, 2 особи – в городе) и 4+ (3 особи в городе).
Анализ и визуализацию записей производили с использованием редактора Cool Edit Pro версия 2.1 (“Adobe”, США). Рекламное пение самцов F. hypoleuca состоит из отдельных единичных песен, разделенных паузами продолжительностью не менее 1 c. Каждая рекламная песня, в свою очередь, состоит из песенных фигур, представляющих из себя один непрерывный звук или несколько звуков с паузами менее 0.02 с (Espmark, Lampe, 1993; рис. 1).
Рис. 1.
Сонограмма записи рекламной песни самца Ficedula hypoleuca. Отдельные песенные фигуры обозначены буквами.

Для каждого самца проанализировали последовательность из 25 рекламных песен. Для каждой песни считывали следующие параметры:
1) максимальная частота песни, Гц;
2) минимальная частота песни, Гц;
3) диапазон частот рекламной песни, Гц (разница между максимальной и минимальной частотами песни);
4) продолжительность песни, мс;
5) количество фигур в песне.
Для статистической обработки данных использовали программу Statistica версия 10.0 (“Stat soft”, США). Для каждого параметра в разных возрастных группах рассчитывали среднее значение и стандартную ошибку среднего (SE). Оценку различий между разными возрастными группами по частотным и структурно-временным показателям песни производили с использованием непараметрического критерия Краскела–Уоллиса (H). Нами было принято решение отказаться от использования поправки Бонферрони для множественных сравнений, поскольку эта поправка является строгой и ее применение нецелесообразно для целей экологических и эколого-поведенческих исследований (Perneger, 1998; Moran, 2003; Nakagawa, 2004). При малом числе групп сравнения сильно увеличивается вероятность возникновения ошибок второго рода. При попарных сравнениях возрастных групп использовали U‑критерий Манна–Уитни (U).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изменение пения с возрастом в естественных местообитаниях. В условиях естественных местообитаний у самцов F. hypoleuca с возрастом происходят значимые изменения всех рассматриваемых параметров рекламной песни, за исключением минимальной частоты песни (Н(2, N= 500) = 1.386082; p > > 0.05; табл. 2; рис. 2a). Так, с возрастом у самцов наблюдалось сужение диапазона частот рекламной песни (H(2,N= 500) = 29.273; p < 0.0001; рис. 3a, обусловленное снижением максимальной частоты песни (H(2,N= 500) = 32.853; p < 0.0001; рис. 4a). Изменялась и структура рекламной песни – число песенных фигур уменьшалось (H(2,N= 500) = = 29.021; p < 0.0001; рис. 5a), а ее длина сокращалась (H(2,N= 500) = 29.714; p < 0.0001; pис. 6a).
Таблица 2.
Параметры песни мухоловки-пеструшки в возрастных группах самцов из естественных местообитаний с результатами попарного сравнения групп при помощи U-критерия Мана–Уитни. Z – пересчет значения U на стандартное нормальное распределение. Значимые результаты (р < 0.05) отмечены жирным шрифтом
| Среднее значение + SE | Сравнение между возрастными группами. U-критерий Мана-Уитни | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I 1 год |
II 2 года |
III 3–7 лет |
I–II | II–III | I–III | |||||||
| U | Z | p | U | Z | p | U | Z | p | ||||
| Диапазон частот песни, Гц | 5996.73 ± ± 58.68 | 5869.62 ± ± 63.76 | 5267.35 ± ± 107.42 | 16 049.50 | 1.38 | 0.17 | 7902.00 | –4.10 | ⪡0.01 | 8195.00 | 5.22 | ⪡0.01 |
| Максимальная частота, Гц | 8248.39 ± ± 52.33 | 8160.58 ± ± 57.79 | 7570.51 ± ± 95.78 | 16 327.50 | 1.12 | 0.26 | 7575.50 | –4.54 | ⪡0.01 | 7983.50 | 5.48 | ⪡0.01 |
| Минимальная частота, Гц | 2251.66 ± ± 15.92 | 2290.96 ± ± 13.40 | 2303.16 ± ± 25.81 | 16 390.00 | –1.06 | 0.29 | 10 684.00 | –0.34 | 0.73 | 11 787.00 | –0.87 | 0.39 |
| Длина песни, мс | 2306.08 ± ± 52.02 | 2214.07 ± ± 57.73 | 1855.45 ± ± 66.18 | 15 766.00 | 1.66 | 0.10 | 7895.00 | –4.11 | ⪡0.01 | 8216.00 | 5.20 | ⪡0.01 |
| Количество фигур в песне | 10.94 ± ± 0.24 | 10.52 ± ± 0.30 | 8.87 ± ± 0.27 | 15 736.50 | 1.68 | 0.09 | 8298.00 | –3.56 | ⪡0.01 | 8040.50 | 5.41 | ⪡0.01 |
Рис. 2.
Минимальная частота песни Ficedula hypoleuca разных возрастов: (а) – обитающих в городской среде; (б) – в естественных условиях.

Рис. 3.
Ширина диапазона частот рекламной песни Ficedula hypoleuca разных возрастов: (а) – обитающих в городской среде; (б) – обитающих в естественных условиях.
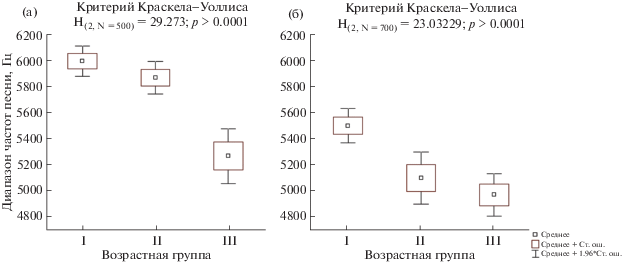
Рис. 4.
Максимальная частота песни самцов Ficedula hypoleuca разных возрастов: (а) – обитающих в городской среде; (б) – в естественных условиях.
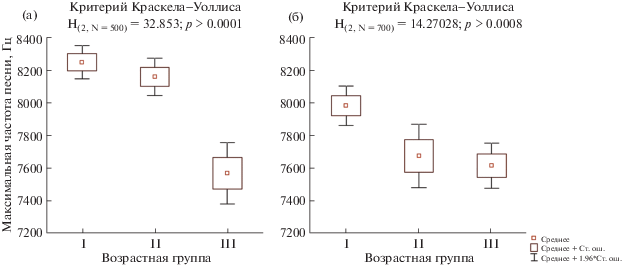
Рис. 5.
Количество фигур в рекламной песне самцов Ficedula hypoleuca разных возрастов: (а) – обитающих в городской среде; (б) – в естественных условиях.
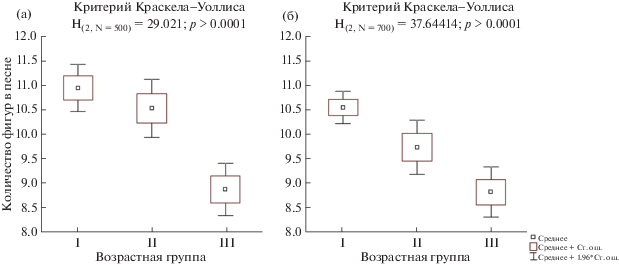
Следует отметить, что все фиксируемые изменения пения протекали при переходе из II возрастной группы в III (табл. 2). Таким образом, в условиях естественных местообитаний рекламная песня годовалых самцов была схожа с песней двухлетних, а все наблюдаемые возрастные изменения происходили в более зрелом возрасте.
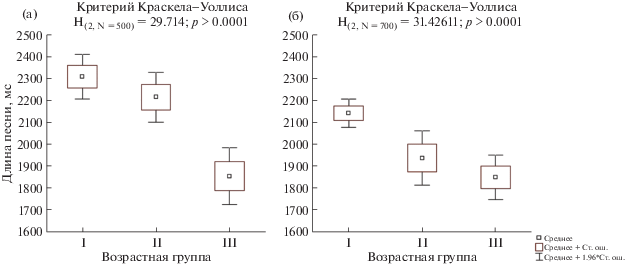
Аналогичная тенденция возрастной изменчивости песни показана в работе М.Н. Ивановой (1998) на Куршской косе: у самцов с известным точным возрастом показана значимая отрицательная корреляция количества фигур в песне с возрастом и слабая отрицательная корреляция – с длиной песни (p = 0.07). Таким образом, сокращение с возрастом числа фигур в песне и, как следствие, сокращение ее длины, можно рассматривать, как общую видовую характеристику, формирующуюся при переходе из II в III возрастную группу.
Изменение пения с возрастом в городской среде. В условиях города у самцов мухоловки-пеструшки происходит повышение минимальной частоты песни с возрастом (H(2,N= 700) = 43.19575; p < 0.0001; рис. 2б). Изменение данного параметра носит линейный характер – рост минимальной частоты пения отмечается как при переходе из I возрастной группы во вторую, так и из II в III (табл. 3). Следует подчеркнуть, что в естественных местообитаниях данный параметр возрастным изменениям не подвержен. Его изменение в урбанизированных местообитаниях носит не случайный характер и может быть следствием адаптации пения к антропогенному шумовому загрязнению, реализованному через снижение перекрывания видового сигнала низкочастотными городскими шумами. Ранее мы показали, что для городских группировок мухоловки-пеструшки в сравнении с естественными местообитаниями в целом характерна увеличенная минимальная частота песни (Бастрикова, Гашков, 2019).
Таблица 3.
Параметры песни мухоловки-пеструшки в возрастных группах самцов из городских местообитаний с результатами попарного сравнения групп при помощи U-критерия Мана–Уитни. Z – пересчет значения U на стандартное нормальное распределение. Значимые результаты (р < 0.05) отмечены жирным шрифтом
| Среднее значение + SE | Сравнение между возрастными группами. U-критерий Мана-Уитни | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I 1 год |
II 2 года |
III 3–7 лет |
I–II | II–III | I–III | |||||||
| U | Z | p | U | Z | p | U | Z | p | ||||
| Диапазон частот песни, Гц | 5502.93 ± ± 66.91 | 5101.71 ± ± 102.34 | 4972.63 ± ± 6.25 | 24 555.00 | 2.27 | 0.02 | 11 779.50 | –1.59 | 0.11 | 24 504.00 | 4.79 | ⪡0.01 |
| Максимальная частота, Гц | 7991.91 ± ± 61.91 | 7682.74 ± ± 98.99 | 7622.66 ± ± 5.33 | 26 100.50 | 1.29 | 0.20 | 11 568.50 | –1.84 | 0.07 | 26 187.00 | 3.82 | ⪡0.01 |
| Минимальная частота, Гц | 2488.98 ± ± 13.96 | 2581.03 ± ± 21.17 | 2650.03 ± ± 1.70 | 22 509.50 | –3.58 | ⪡0.01 | 11 049.50 | 2.46 | 0.01 | 21 941.00 | –6.26 | ⪡0.01 |
| Длина песни, мс | 2146.40 ± ± 32.54 | 1942.16 ± ± 62.64 | 1854.72 ± ± 3.92 | 22 444.00 | 3.62 | ⪡0.01 | 12 345.50 | –0.92 | 0.36 | 23 793.50 | 5.20 | ⪡0.01 |
| Количество фигур в песне | 10.55 ± ± 0.17 | 9.74 ± ± 0.28 | 8.83 ± ± 0.02 | 23 725.00 | 2.80 | <0.01 | 10 866.50 | –2.67 | 0.01 | 22 434.00 | 5.98 | ⪡0.01 |
Другие рассматриваемые параметры песни самцов F. hypoleuca в этих условиях изменяются схожим с естественными местообитаниями образом, однако в городе эти изменения начинаются у самцов раньше – со второго года жизни (табл. 3). С этого момента происходит сужение диапазона частот рекламной песни (H(2,N= 700) = 23.03229; p < 0.0001; рис. 3б) и понижение максимальной частоты песни (H(2,N= 700) = 14.27028; p = 0.0008; рис. 4б). Сокращается количество фигур в рекламной песне (H(2,N= 700) = 37.64414; p < 0.0001; рис. 5б) и уменьшается ее длина (H(2,N= 700) = = 31.42611; p < 0.0001; рис. 6б).
Рис. 6.
Длина рекламной песни самцов Ficedula hypoleuca разных возрастов: (а) – обитающих в городской среде; (б) – в естественных условиях.
Исключение составляет максимальная частота песни: значимые различия по данному параметру наблюдаются только между I и III возрастными группами (табл. 3). Вместе с тем некоторое снижение среднего значения этого признака отмечается уже при переходе ко II возрастной группе. Большая вариабельность значений данного признака внутри этой группы наводит на мысль, что приспособление к городской среде в этом возрасте происходит только у части птиц, что ведет к возрастанию дисперсии (рис. 4б). Раннее начало возрастных изменений параметров песни в городе, таким образом, является отличительной особенностью городских группировок мухоловки-пеструшки.
Способность изменять песню в ответ на воздействие шумового загрязнения говорит о высокой пластичности данного вида и может являться одной из потенций, обеспечивающих его высокую толерантность к городским условиям. Наличие иной стратегии преобразования песни с возрастом в городских группировках мухоловки-пеструшки в конечном итоге может привести к формированию новых песенных диалектов, обеспечивающих наиболее эффективную коммуникацию в условиях антропогенного шума. Так, в многолетних исследованиях на белоголовой зонотрихии (Zonotrichia leucophrys) показано, что рост шумового загрязнения на исследуемом участке за 30 лет привел к замене диалекта, содержащего низкочастотные песни, диалектом с высокой минимальной частотой песен (Luther, Baptista, 2010). В итоге это привело к тому, что при предъявлении самцам записи песен, сделанных около 40 лет назад и в настоящее время, они давали более слабую поведенческую реакцию на архивные песни. Самцы медленнее реагировали на воспроизведение таких записей, отвечали меньшим числом песен, реже подлетали к динамику (Luther, Derryberry, 2012). Индуцированная адаптацией к антропогенному шумовому загрязнению культурная эволюция коммуникативных сигналов со временем может способствовать поведенческой сегрегации популяций. По мнению А.С. Опаева (2010), изучавшего комплекс четырех видов камышовок, акустические признаки отличаются опережающими темпами эволюции по сравнению с морфологическими признаками и особенностями экологии и гнездовой биологии.
Таким образом, антропогенное шумовое загрязнение выступает важным параметром, влияющим на популяции птиц. Зашумление среды может способствовать постепенной поведенческой изоляции популяций, даже если какие-либо физические барьеры при этом отсутствуют (Berger-Tal, Saltz, 2019). Можно полагать, что эти изоляционные механизмы усиливаются по мере фрагментации среды. В случае с мухоловкой-пеструшкой, отличающейся толерантностью к городской среде и быстрой сменой поколений, эти факторы могут приводить к быстрому формированию внутрипопуляционных группировок.
* * *
На основе анализа рекламных песен самцов мухоловки-пеструшки с точно определенным возрастом показано, что возрастные изменения песни протекают по-разному в естественных и городских местообитаниях. В первом случае перестройка песни начинается с третьего года жизни, когда происходит сужение диапазона частот рекламной песни вследствие снижения максимальной частоты песни. Уменьшается количество фигур в песне, за счет чего сокращается ее длина. Характер изменения этих же параметров песни аналогичен и в городской среде, но перестройка начинается здесь раньше – со второго года жизни. Существенным отличием, кроме того, является повышение в условиях города минимальной частоты песни, усиливающееся с возрастом. В естественной среде этот параметр не подвержен возрастным изменениям.
Таким образом, мухоловка-пеструшка способна быстро перестраивать параметры песни в соответствии с условиями среды, адаптируя ее к условиям антропогенного шумового загрязнения. Ранние изменения песни в городе говорят о высокой этологической пластичности данного вида, что наряду с пространственной дифференциацией населения вида, может способствовать эволюционному преобразованию популяций.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-34-90080.
Список литературы
Артемьев А.В. Популяционная экология мухоловки-пеструшки в северной зоне ареала. М.: Наука, 2008. 272 с.
Бастрикова А.Е., Гашков С.И. Различия рекламной песни самцов мухоловки-пеструшки (Ficedula hypoleuca Pall.) разных возрастов // Принципы экологии. 2016. Т. 5. № 3(19). С. 25.
Бастрикова А.Е., Гашков С.И. Частотно-временные характеристики песни мухоловки-пеструшки (Ficedula hypoleuca) в условиях анропогенного шумового загрязнения // Экология и эволюция: новые горизонты: мат-лы Международного симпозиума, посвященного 100-летию академика С. С. Шварца, Екатеринбург, 1–5 апреля 2019 г. Екатеринбург: Гуманитарный ун-т, 2019. С. 12–14.
Беме И.Р., Горецкая М.Я., Москаленко В.Н. Иммунизация нереплицирующимся антигеном приводит к изменениям характеристик песни и уровня кортикостерона у воробьиных птиц // Докл. Акад. Наук. 2014. Т. 454. № 1. С. 111–114.
Высоцкий В.Г. Определение возраста мухоловки-пеструшки (Ficedula hypoleuca) в период размножения // Труды АН ЗИН СССР: “Фауна и экологии птиц Евразии”, 1989. Т. 197. С. 49–52.
Гашков С.И. Связь с территорией рождения и размножения мухоловки-пеструшки (Ficedula hypoleuca Pall.) на восточной периферии ареала // Вест. Томского гос. ун-та. Прил. № 8. 2003. С. 35–40.
Иваницкий В.В., Антипов В.А., Марова И.М. Восточный соловей (luscinia luscinia) в Москве и Подмосковье: городской шум влияет на частотные параметры песни // Зоологический журн. 2014. Т. 93. № 9. С. 1123–1130.
Иванова М.Н. Взаимозависимость типа окраски, возраста и акустических характеристик песни у самцов мухоловки-пеструшки // Орнитология. 1998. Т. 28. № 1–2. С. 126–135.
Иоганзен В.Г. Наблюдения над гнездованием мухоловки–пеструшки (Muscicapa atricapilla Linn.) близ Томска // Орнитологический вестник. 1914. № 4. С. 293–295.
Иоганзен Г.Э. Томская мухоловка-пеструшка // Орнитологический вестник. 1916. № 2. С. 101.
Коваль З.В. Оценка шумового загрязнения Кировского района г. Томска: магистерская дис. по направлению подготовки: 05.04.06 – Экология и природопользование. Томск: НИ ТГУ, 2019. 85 с.
Куранов Б.Д. Гнездовая биология урбанизированной популяции мухоловки-пеструшки (Ficedula hypoleuca) // Вест. Томского гос. ун-та. 2007. № 297. С. 192–200.
Куранов Б.Д. Сохраняемость мухоловки-пеструшки Ficedula hypoleuca у восточной границы распространения // Рус. орнитол. журн. 2017. Т. 26. В. 1425. С. 1291–1300.
Опаев А.С. Основные направления дивергенции криптических видов птиц: на примере комплекса “дроздовидная камышевка”: Автореф. дис. канд. биол. наук. М.: ИПЭЭ РАН, 2010. 24 с.
Соколов Л.В. Филопатрия и дисперсия птиц // Тр. Зоол. ин-та АН СССР. 1991. Т. 230. С. 1–232.
Adret-Hausberger M., Güttinger H.R., Merkel F.W. Individual life history and song repertoire changes in a colony of starlings (Sturnus vulgaris) // Ethology. 1990. V. 84. № 4. P. 265–280.
Berger-Tal O., Saltz D. Invisible barriers: anthropogenic impacts on inter-and intra-specific interactions as drivers of landscape-independent fragmentation // Philosoph. Trans. Royal Society B. 2019. V. 374. № 1781. C. 20180049.
Catchpole C.K., Slater P.J.B. Bird song: biological themes and variations. N.Y.: Cambridge University Press, 2008. 335 p.
Desrochers A. Age and foraging success in European blackbirds – variations between and within individuals // Animal Behaviour. 1992. V. 43. P. 885–894.
Eens M., Pinxten R., Verheyen R. No overlap in song repertoire size between yearling and older starlings, Sturnus vulgaris. // Ibis. 1992. V. 134. P. 72–76.
Eriksson D., Wallin L. Male bird song attracts females – a field experiment // Behav. Ecol. Sociobiol. 1986. V. 19. № 4. P. 297–299.
Espmark Y.O., Lampe H.M. Variations in the song of the pied flycatcher within and between breeding seasons // Bioacoustic. 1993. V. 5. P. 33–65.
Galeotti P., Saino N., Perani E., Sacchi R., Møller A.R. Age-related song variation in male barn swallows // Ital. J. Zoology. 2001. V. 68. P. 305–310.
Garamszegi L.Z., Heylen D., Møller A.P., Eens M., De Lope F. Age-dependent health status and song characteristics in the barn swallow // Behav. Ecology. 2005. V. 16. P. 580–591.
Garamszegi L.Z., Török J., Hegyi G., Szöllõsi E., Rosivall B., Eens M. Age-dependent expression of song in the collared flycatcher, Ficedula albicollis // Ethology. 2007. V. 113. № 3. P. 246–256.
Grinkov V.G., Gashkov S.I. Living on the edge: new data about the pied flycatcher (Ficedula hypoleuca) breeding in Western Siberia, Russia // Vogelwarte. 2003. V. 42. P. 3–27.
Grinkov V.G., Bauer A., Gashkov S.I., Sternberg H., Wink M. Diversity of social-genetic relationships in the socially monogamous pied flycatcher (Ficedula hypoleuca) breeding in Western Siberia // PeerJ. 2018. V. 6. P. e6059–e6059.
Hill S.D., Aryal A., Pawley M.D., Ji W. So much for the city: Urban–rural song variation in a widespread Asiatic songbird // Integrative zoology. 2018. V. 13. № 2. P. 194–205.
Irwin D. Song variation in avian ring species // Evolution. 2000. V. 54. P. 998–1010.
Johnson L.S., Searcy W.A. Female attraction to male song in house wrens (Troglodytes aedon) // Behaviour. 1996. V. 133. P. 357–366.
Kiefer S., Sommer C., Scharff C., Kipper S., Mundry R. Tuning towards tomorrow? Common nightingales Luscinia megarhynchos change and increase their song repertoires from the first to the second breeding season // J. Avian Biol. 2009. V. 40. P. 231–236.
Krebs J.R. The significance of song repertoires: the Beau Geste hypothesis // Anim. Behav. 1977. V. 25. P. 475–478.
Lundberg A., Alatalo R.V. The pied flycatcher. L: Poyser, 1992. 267 p.
Luther D.A., Baptista L. Does urban noise influence the cultural evolution of bird songs? // Proc. Royal Soc. London. B. 2010. V. 277. P. 469–473.
Luther D.A., Derryberry E.P. Birdsongs keep pace with city life: changes in song over time in an urban songbird affects communication //Anim. Behav. 2012. V. 83. № 4. P. 1059–1066.
McDonald M.V. Function of song in Scott’s seaside sparrow, Ammodramus maritimus peninsulae // Anim. Behav. 1989. V. 38. P. 468–485.
Mendes S., Colino-Rabanal V.J., Peris S.J. Diferencias en el canto de la ratona común (Troglodytes musculus) en ambientes con distintos niveles de influencia humana // El hornero. 2011. V. 26. № 2. P. 85–93.
Møller A.P., Henry P.Y., Erritzøe J. The evolution of song repertoires and immune defence in birds // Proc. Royal Soc. London. B. 2000. V. 267. № 1439. P. 165–169.
Moran M.D. Arguments for rejecting the sequential Bonferroni in ecological studies // Oikos. 2003. V. 100. P. 403–405.
Mountjoy D.J., Lemon R.E. Song as an attractant for male and female European starlings, and the influence of song complexity on their response // Behav. Ecol. Sociobiol. 1991. V. 28. P. 97–100.
Nakagawa S. A farewell to Bonferroni: the problems of low statistical power and publication bias // Behav. Ecol. 2004. V. 15. P. 1044–1045.
Nemeth E. et al. Bird song and anthropogenic noise: vocal constraints may explain why birds sing higher-frequency songs in cities // Proc. Royal Soc. London. B. 2013. V. 280. № 1754. P. 1–7.
Nowicki S., Searcy W.A., Hughes M. The territory defense function of song in song sparrows: a test with the speaker occupation design // Behaviour. 1998. V. 135. P. 615–628.
Ojanen M. A method for age determination of Pied Flycatcher Ficedula hypoleuca in spring // Acta Reg. Soc. Scien. Litter. Gothoburg. Zool. 1987. V. 14. P. 95–101.
Perneger T.V. What’s wrong with Bonferroni adjustments // Brit. Med. J. 1998.V. 316. P. 1236–1238.
Roca I.T., Desrochers L., Giacomazzo M., Bertolo A., Bolduc P., Deschesnes R., Martin C.A., Rainville V., Rheault G., Proulx R. Shifting song frequencies in response to anthropogenic noise: a meta-analysis on birds and anurans // Behav. Ecol. 2016. V. 27. № 5. P. 1269–1274.
Slabbekoorn H., Peet M. Birds sing at a higher pitch in urban noise – great tits hit the high notes to ensure that their mating calls are heard above the city’s din // Nature. 2003. V. 424. P. 267–268.
Smith D.G. An experimental analysis of the function of red-winged blackbird song // Behaviour. 1976. V. 56. P. 136–156.
Smith D.G. Male singing ability and territory integrity in red-winged blackbirds Agelaius phoeniceus // Behaviour. 1979. V. 68. P. 193–206.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


