Известия РАН. Серия биологическая, 2021, № 5, стр. 453-463
Химическая основа автотрофного палеометаболизма фиксации углерода
С. А. Маракушев 1, *, О. В. Белоногова 1, **
1 Институт проблем химической физики РАН
142432 Черниголовка, Московской обл., пр. Академика Н. Семенова, 1, Россия
* E-mail: marak@cat.icp.ac.ru
** E-mail: ovbel@icp.ac.ru
Поступила в редакцию 17.11.2019
После доработки 04.03.2021
Принята к публикации 04.03.2021
Аннотация
На основе биомиметического, филометаболического и термодинамического анализа современных путей ассимиляции СО2 проведена палеофенотипическая реконструкция древних систем автотрофного метаболизма. В качестве химической основы СО2-фиксирующего палеометаболизма рассматриваются метаболические сети, способные к самовоспроизведению и эволюции; главным фактором саморазвития этой сети является обратимость реакций трансформации ее интермедиатов. Вещества системы С–Н–О, парагенетически связанные с углеводородами, создают фазовое пространство, представляющее собой совокупность универсальных интермедиатов химической сети автотрофного палеометаболизма. Предлагается концепция двух стратегий зарождения и развития палеометаболизма автотрофной фиксации углерода в окислительном (СО2) и восстановительном (СН4) редокс режиме дегазации древней Земли. Показано, что Р-T и редокс условия гидротермальных систем раннего Архея были благоприятны для развития первичного метанотрофного метаболизма.
Палеометаболизм представляет собой метаболизм филогенетически выявленных эволюционно древних организмов, а также метаболизм, существовавший в вымерших предшественниках современных организмов. Фиксация неорганического углерода в органический материал (автотрофия) является предпосылкой для жизни и отправной точкой биологической эволюции, а палеометаболизм автотрофной ассимиляции углерода, очевидно, являлся источником биомассы и основой функционирования первых протоклеток на древней Земле.
В современном создающим биоорганические вещества автотрофном метаболизме углерод ассимилируется главным образом в виде двуокиси углерода и существующие биохимические СО2 фиксирующие пути являются фундаментом биомиметического моделирования автотрофного палеометаболизма на древней Земле. Однако существуют доказательства того, что атмосфера и гидросфера раннего Архея была обогащена водородом и метаном (Tian et al., 2005; Catling, Kasting, 2017; Zahnle et al., 2019), а континентальная кора раннего Архея по сравнению с современной была более восстановлена (Yang et al., 2014).
Восстановительная гидротермальная обстановка на древней Земле подразумевает возможность того, что первые автотрофные метаболические системы способны были использовать метан, как основной источник углерода, т.е. обладать метан-фиксирующим палеометаболизмом, который впоследствии был утерян в процессе эволюции или отброшен в экстремальные экологические ниши. В настоящей работе на основе биомиметического, филометаболического и термодинамического анализов углерод-фиксирующих путей рассматриваются химические модели систем пребиотической фиксации СО2 и СН4, являвшихся химической основой зарождающегося хемоавтотрофного палеометаболизма.
Палеометаболизм фиксации СО2. Природа использует альтернативные пути фиксации углерода и в настоящее время обнаружено шесть различных автотрофных СО2-фиксирующих путей, один линейный (восстановительный Вуда-Лунгдала (ВЛ) путь (метаногенный и ацетогенный ацетил-СоА путь в археях и бактериях соответственно) и пять циклических: восстановительный цитратный (ВЦ) цикл (восстановительный цикл трикарбоновых кислот, цикл Арнона–Баханана), 3-гидроксипропионатный (3-ГП) бицикл, восстановительный дикарбоксилатный/4-гидроксибутиратный, 3-гидроксипропионатный/4-гидроксибутиратный циклы и восстановительный пентозо-фосфатный (ВПФ) цикл (цикл Кальвина–Бенсона–Бассама). Все шесть известных путей фиксации СО2 являются окончательными ветвями эволюции предкового палеометаболического ядра последнего универсального общего предшественника (LUCA), который является подразумеваемым эволюционным интермедиатом, связывающим абиотическую фазу истории Земли с первыми следами микробной жизни (биологическая активность, строматолиты и микрофоссилии), которые обнаружены в породах с возрастом 3.7 млрд лет (Ga) (Nutman et al., 2016). Однако LUCA уже является невероятно сложной структурой, окруженной мембраной с развитыми управляемыми ферментами системами репликации и метаболизма (Martin et al., 2016; Weiss et al., 2018), который появился в результате эволюции химической системы С–Н–О в гидротермальных минеральных системах.
Современный ВЦ цикл, как один из самых эволюционно древних путей фиксации СО2 был предложен и обоснован в качестве модели первичной анаболической химической системы фиксации СО2 (Wächtershäuser, 1990, 1992; Smith, Morowitz, 2004; Hügler, Sievert, 2011). В то же время ряд аргументов свидетельствует о первичности ацето- и метаногенного ВЛ пути фиксации СО2 (Russell, Martin, 2004; Martin, Russell, 2007; Weiss et al., 2016 и др.) и 3-ГП бицикла фиксации СО2 (Маракушев, 2008; Маракушев, Белоногова, 2013б).
Появление функциональности автономных химических функциональных систем, очевидно находится в основе биологической эволюции (Ruiz–Mirazo et al., 2017). Формирование “самоподдерживающихся автокаталитических сетей” как химической основы возникающего палеометаболизма LUCA теоретически показано во многих исследованиях (напр., Hordijk, Steel, 2018), а погранично модулярная конструкция интермедиатов циклов фиксации СО2 позволила создать модели протометаболических систем в виде химической сети симбиоза конкретных путей (Маракушев, 2008; Маракушев, Белоногова, 2010, 2013а, 2013б; Marakushev, Belonogova, 2013; Braakman, Smith, 2012, 2013). В этих моделях точки разветвления (узлы бифуркации) определяют развитие химической сети в различных направлениях в зависящих от изменений физико-химических условий окружающей среды. Термодинамическими расчетами показана возможность функционирования автотрофных циклов в прямом и обратном направлении (Маракушев, Белоногова, 2009, 2012, 2013а, 2013б), т.е. возможность зарождения окислительных или восстановительных циклов, приводящих к появлению автотрофного, гетеротрофного и миксотрофного метаболизма. Филометаболическое сравнение метаболических ядер глубоко укорененных микроорганизмов с родственными организмами как внутри, так и между соседними ветвями, также привело к модели первичной модулярной комбинаторной сети фиксации СО2 (Braakman, Smith, 2012, 2013).
Минимальную комбинаторную химическую сеть автотрофного протометаболизма можно представить в виде комбинации ВЛ пути, ВЦ цикла и 3-ГП бицикла (рис. 1). Их сопряжение осуществляется в узловых реакциях изменения направления потока электронов. Реакция сукцинат ↔ фумарат связывает ВЦ и 3-ГП циклы, а реакцией ацетат ↔ пируват к этой сети добавляется ВЛ путь, состоящий из двух ветвей гидрогенотрофного (Ia) и метанотрофного (Ib) ацетогенеза. Карбоксилирование ацетата завершает ВЛ путь: CH3COOH (ацетат) + CO2 + H2 = CH3(CO)COOH (пируват) + H2O или инициирует 3-ГП бицикл: CH3COOH (ацетат) + CO2 = CH2(COOH)2 (малонат).
Рис. 1.
Химическая сеть протометаболизма, состоящая из трех биомиметически реконструированных путей фиксации СО2 с возможным коллективным автокатализом, как функциональное способное к развитию ядро. Реакции диспропорционирования малата, цитрата и цитрамалата показаны штрихпунктирными линиями. Биомиметические пути фиксации СО2: Ia – гидрогенотрофный и Ib – метанотрофный ацетогенез, II – цитратный цикл, III – 3-гидроксипропионатный бицикл. Показаны выявленные в биохимии (Mall et al., 2018) и модельных экспериментах (Muchowska et al., 2017, 2019; Ralser, 2018; Varma et al., 2018) обратимые реакции. Необратимые реакции фосфорилирования пирувата и оксалоацетата инициируют ВПФ цикл фиксации СО2 (образование фосфоенолпирувата).
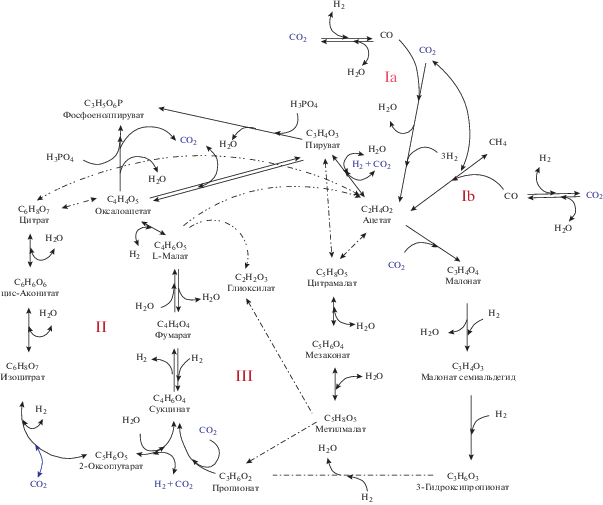
Таблица 1.
Свободные энергии Гиббса для реакций карбоксилирования, гидратации, гидрогенизации и расщепления в ВЦ и 3-ГП циклах и ВЛ пути в водных растворах при температурах 298 и 473 К и давлении насыщения паров воды (PНАС)
| Реакции интермедиатов СО2 фиксирующей сети | $\Delta G_{{{\text{298}}}}^{0}$, кДж | $\Delta G_{{{\text{473}}}}^{0}$, кДж | |
|---|---|---|---|
| ВЛ путь | CO2 + H2 = CO + H2O | 11.04 | 13.51 |
| CO2 + CO + 3H2 = CH3COOH(ацетат) + H2O | –180.54 | –128.87 | |
| ВЛ путь, ВЦ цикл | CH3COOH(ацетат) + CO2 + H2 = CH3(CO)COOH(пируват) + H2O | 45.46 | 71.91 |
| 2CO2 + 4H2 = CH3COOH(ацетат) + 2H2O | –169.50 | –115.3 | |
| ВЦ цикл | CH3(CO)COOH(пируват) + CO2 = CH2CO(COOH)2(оксалоацетат) | 13.11 | 35.03 |
| CH2CO(COOH)2(оксалоацетат) + H2 = CH2CH(OH)(COOH)2(малат) | –65.49 | –55.78 | |
| CH2CH(OH)(COOH)2(малат) = (CH)2(COOH)2(фумарат) + H2O | 5.68 | –5.26 | |
| (CH)2(COOH)2(фумарат) + H2 = (CH2)2(COOH)2(сукцинат) | –102.24 | –88.88 | |
| (CH2)2(COOH)2(сукцинат) + CO2 + H2 = (CH2)2CO(COOH)2(2-оксоглутарат) + H2O | 17.90 | 47.89 | |
| (CH2)2CO(COOH)2(2-оксоглутарат) + CO2 + H2 = (CH2)2C(OH)(COOH)3(цитрат) | –18.11 | 1.82 | |
| (CH2)2CO(COOH)2(2-оксоглутарат) + CO2 + H2 = (CH2)2C(OH)(COOH)3(изоцитрат) | –15.69 | – | |
| (CH2)2C(OH)(COOH)3(изо-цитрат) = C6H6O6(цис-аконитат) + H2O | 2.36 | – | |
| C6H6O6(цис-аконитат) + H2O = (CH2)2C(OH)(COOH)3(цитрат) | –4.78 | – | |
| (CH2)2C(OH)(COOH)3(цитрат) = CH2CO(COOH)2(оксалоацетат) + CH3COOH(ацетат) | –7.24 | –15.15 | |
| 3-ГП бицикл | CH3COOH(ацетат +CO2 = CH2(COOH)2(малонат) | 48.10 | 68.28 |
| CH2(COOH)2(малонат) + H2 = HCOCH2COOH(малонат семиальдегид) + H2O | –50.32 | –49.96 | |
| HCOCH2COOH(малонат семиальдегид) + H2 = (OH)CH2CH2COOH(3-гидроксипропионат) | –43.93 | –52.84 | |
| (OH)CH2CH2COOH(3-гидроксипропионат) + H2 = CH3CH2COOH(пропионат) + H2O | –89.92 | –61.88 | |
| CH3CH2COOH(пропионат) + CO2 = CHCH3(COOH)2(метилмалонат) | 47.7 | 69.07 | |
| CHCH3(COOH)2(метилмалонат) = (CH2)2(COOH)2(сукцинат) | –15.11 | –15.66 | |
| CH3CH2COOH(пропионат) + HCOCOOH(глиоксилат) = CHCH3CH(OH)(COOH)2 (метилмалат) | –74.74 | –52.35 | |
| CHCH3CH(OH)(COOH)2(метилмалат) = CCH3CH(COOH)2(мезаконат) + H2O | 5.64 | –5.61 | |
| CCH3CH(COOH)2(мезаконат) + H2O = (OH)CCH3CH2(COOH)2(цитрамалат) | 30.05 | 39.29 | |
| (OH)CCH3CH2(COOH)2(цитрамалат) = CH3(CO)COOH(пируват) + CH3COOH(ацетат) | 19.35 | 1.73 | |
| 2CO2 + 2H2 = OCHCOOH (глиоксилат) + H2O | 31.73 | 69.88 | |
| ВПФ цикл | CH3(CO)COOH (пируват) + H3PO4 = C3H5O6P(фосфоенолпируват) + H2O | 875.73 | 917.27 |
| CH2CO(COOH)2(оксалоацетат)+H3PO4 = C3H5O6P + H2O + CO2 | 865.62 | 882.24 |
Примечание. Жирным шрифтом показаны суммарные реакции циклов. Реакции фосфорилирования пирувата и оксалоацетата инициируют восстановительный пентозо-фосфатный (ВПФ) путь фиксации СО2. Использованы термодинамические константы из работ (Amend, Shock, 2001; Маракушев, Белоногова, 2012; Marakushev, Belonogova, 2013 (Suppl. Mat)).
Химические реакции (табл. 1) с отрицательной свободной энергией (экзергонические) термодинамически высвобождают энергию при их протекании. Очевидно, что обратимость реакций является ключевым фактором функционирования и эволюции этой сети. Например, свободная энергия ключевой реакции диспропорционирования цитрат → оксалоацетат + ацетат колеблется около нулевого значения как при физиологических температурах (–7.24 кДж), так и при 473 К (–15.15 кДж), (табл. 1), а недавние биохимические исследования показали полную обратимость цитратного цикла в Nitrispirae, что во многом определяется этой обратимой “лигазной” реакцией (Nunoura et al., 2018; Mall et al., 2018). Реакция сукцинат ↔ фумарат является редокс переключателем направления потока электронов между 3-ГП и ВЦ циклами, т.е. величину свободной энергии реакции сукцинат ↔ фумарат ($G_{{{\text{298}}}}^{0}$ = –102.24 кДж) (табл. 1) можно условно считать некоторым критерием и пределом обратимости реакций всех протометаболических циклов. Такой термодинамический контроль реализуется в многоступенчатости реакций с небольшим изменением свободной энергии Гиббса, что является важным фактором обратимости функционирования модулей суперцикла. Фосфоенолпируват уже не может стать интермедиатом этой метаболической сети, так как реакции фосфорилирования пирувата и оксалоацетата практически необратимы, (табл. 1), что свидетельствует в пользу гипотез первичного бесфосфорного метаболизма (Goldford et al., 2017).
На основе простого набора структурных ограничений, полученных из физических и химических соображений, был определен набор интермедиатов из 153 органических веществ (40 составов) системы С–Н–О для теоретических расчетов всех возможных комбинаций интермедиатов циклов фиксации СО2 (Morowitz et al., 2000). Компьютерное моделирование с использованием термодинамических и кинетических характеристик реакций карбоксилирования, гидратации, гидрогенизации и расщепления показывает, что “пространство” химических структур интермедиатов с оптимальными характеристиками для фиксации СО2 в несколько раз превышает набор интермедиатов Моровитца (Meringer, Cleaves, 2017). Всю совокупность этих веществ можно представить на фазовой диаграмме составов, (рис. 2). Равновесие С–Н2О разделяет диаграмму на окислительную (I) и восстановительную (II) фации. Все составы веществ Моровитца, Мерингера располагаются в окислительной фации I. Набор интермедиатов для общего метаболического ядра может быть значительно расширен вовлечением углеводородов в протометаболическую сеть (Zubarev et al., 2015). В этом случае “химическое пространство” интермедиатов существенно сдвигается в восстановительную фацию II, (рис 2). Важно, что в рамках этого пространства и располагаются все интермедиаты универсального ядра промежуточного метаболизма (Morowitz et al., 2000; Маракушев и Белоногова, 2009, 2010; Braakman, Smith, 2012, 2013; Goldford et al., 2017). На диаграмме составов С–Н–О (рис. 2) все они локализованы внутри треугольника с углеводородным основанием СН4–С2Н4.
Рис. 2.
Фазовое пространство интермедиатов автотрофного метаболизма на диаграмме составов системы С–Н–О. Представлены возможные интермедиаты хемоавтотрофных систем фиксации СО2 согласно Моровитцу, Мерингеру (1 – залитые кружки, оконтурено зеленым штрих-пунктиром) (Morowitz et al., 2000; Meringer, Cleaves, 2017) и Зубареву (2 – квадраты, оконтурено черным пунктиром) (Zubarev et al., 2015). 3 – Универсальные интермедиаты палеометаболизма (треугольники, оконтурено красным цветом) (Маракушев, Белоногова, 2009, 2010; Braakman, Smith 2012, 2013), 4 – включения углеводородов и простых органических веществ в Архейском кварце (звезды, оконтурено синим) (Schreiber et al., 2017).
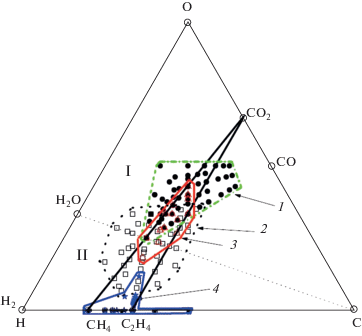
Углеводороды часто обнаруживают в газово-жидких включениях минералов глубинной генерации (Potter, Konnerup-Madsen, 2003), а недавним замечательным открытием является обнаружение включений абиогенных углеводородов и простых органических веществ в Архейском кварце из Австралийских конгломератов Джек Хиллс (Schreiber et al., 2017), которые в те времена могли являться источниками углерода возникающего метаболизма. На диаграмме составов (рис. 2) они большей частью расположены в системе СН4–СО2–С2Н4, охватывающие все интермедиаты универсального ядра метаболизма и, как отмечалось нами ранее (Маракушев, 2008), легкие углеводороды (от метана до этилена и его производных) могли являться химическим источником (и анаплеротическими составляющими) возникающих интермедиатов циклов фиксации СО2.
Таким образом, “химическое пространство” веществ системы С–Н–О является термодинамически контролируемой сетью реакций интермедиатов, создающей модулярные конструкции развивающиеся в определенных физико-химических условиях в конкретные хемоавтотрофные системы фиксации СО2. И все же, возникающий автотрофный палеометаболизм мог быть несколько иным, если основным источником углерода для автокаталитических химических сетей была не двуокись углерода, а эндогенный метан.
Автотрофный палеометаболизм фиксации метана. Недавние исследования изотопного фракционирования углерода в древних породах показали, что возраст первых возможных следов жизни существенно сдвинулся в сторону Катархея: 3.77 млрд лет (Ga) (Dodd et al., 2017), 3.83 Ga (McKeegan et al., 2007), 3.95 Ga (Tashiro et al., 2017), 4.10 Ga (Bell et al., 2015) и, очевидно, что окружающие условия в это время определяли пути эволюции возникающих метаболических сетей. Континентальная кора и верхняя мантия ранней Земли были значительно более восстановлены по сравнению с современными аналогами (Yang et al., 2014), а метан видимо был преобладающим газом в гидросфере и атмосфере (Pavlov et al., 2000; Tian et al., 2005; Zahnle et al., 2019). Газово-жидкие включения углеводородов и органических веществ в Архейском кварце (Touret, 2003; Schreiber et al., 2017) также указывают на достаточно восстановительную обстановку в этот период времени. Возможно, что высокое парциальное давление метана, существовавшее в гидротермальных системах древней Земли, приводило к формированию первичных метан ассимилирующих автотрофных протометаболических систем.
Модель первичного древнего анаэробного метанотрофного пути ацетогенеза, в котором источником углерода является метан вместо СО2, была предложена в работах (Nitschke, Russell, 2013; Russell, Nitschke, 2017), в которых обратный ВЛ путь (обозначенный на рис. 1 цифрой Ib) был предложен в качестве биомиметической основы автотрофного метаболизма. Окислителем метана в этом пути предполагается активированная окись азота (NO), образованная в процессе трансформации нитрат/нитрит, и авторы предполагают, что этот путь фиксации СН4 (“денитрифицирующий метанотрофный ацетогенез”) был первой энергетической системой метаболизма в гидротермальных выбросах ранней Земли.
Недавние исследования показали, что архея Methanosarcina acetivorans образует ацетат в обратном ВЛ пути когда окисление метана сопряжено восстановлением железа (III) (Soo et al., 2016; Timmers et al., 2017; Yan et al., 2018). Стехиометрия реакции обратного ВЛ пути в археях предполагает механизм, в котором четыре молекулы метана окисляются и две молекулы СО2 восстанавливаются с образованием трех молекул ацетата (Soo et al., 2016). Этот путь карбокси-метанотрофного ацетогенеза также можно рассматривать в качестве биомиметической модели первичной метаболической системы фиксации СН4. Он термодинамически очень выгоден с использованием NO в качестве окислителя: CH4 + 0.5СО2 + 2NO + Н2 = = 0.75CH3COOH + N2 + 1.5H2O, $\Delta G_{{{\text{298}}}}^{0}$ = –629.17; $\Delta G_{{{\text{473}}}}^{0}$ = –592.04 кДж/моль CH4 и достаточно благоприятен при сопряжении с восстановлением трехвалентного железа – составляющая минерала гематита: CH4 + 0.5СО2 + 6Fe2O3 (гематит) + Н2 = = 0.75CH3COOH + 4Fe3O4 (магнетит) + 1.5H2O, $\Delta G_{{{\text{298}}}}^{0}$ = –30.54; $\Delta G_{{{\text{473}}}}^{0}$ = –35.34 кДж/моль CH4.
Инициирующим шагом в анаэробном окислении как ароматических, так и алифатических углеводородов является связывание их с фумаратом (Haynes, Gonzalez, 2014), а реакция метана с фумаратом С4Н4О4 (фумарат) + СН4 = С5Н8О4 (2-метилсукцинат) удовлетворяет энергетическим требованиям для автотрофного роста (Thauer, Shima 2008; Beasley, Nunny, 2012; Averesch, Kracke, 2018). Это предполагает возможность ее участия в зарождающемся автотрофном метаболизме (Marakushev, Belonogova, 2019), именно внутри рассмотренного выше универсального “химического пространства” интермедиатов: карбокси- и α-кетокислот.
Рассмотрим конструкцию метаболической сети, объединяющую часть рассмотренного выше универсального ядра палеометаболизма (последовательность ВЦ цикла) (рис. 1), с предполагаемым метано-фумаратным (МФ) циклом (Marakushev, Belonogova, 2019), как модель метанотрофного метаболизма (рис. 3), зародившегося и функционировавшего в восстановительных гидротермальных системах раннего Архея при высоком парциальном давлении метана. Представлена комбинация части ВЦ цикла фиксации СО2 с метано-фумаратной ветвью фиксации СН4, как предполагаемая химическая основа первичного автотрофного палеометаболизма (ВЦ-МФ бицикл). В этом химическом симбиозе циклов точкой бифуркации является фумарат, который трансформируется в сукцинат (инициация ВЦ цикла) или 2-метилсукцинат (инициация МФ цикла).
Рис. 3.
Схема сопряжения метан-фумаратного (МФ) цикла (I, жирные стрелки) с ВЦ циклом фиксации СО2 (II) на основе общей последовательности реакций оксалоацетат → малат → фумарат. Углерод метана внедряется в фумарат, а углерод СО2 в пируват, сукцинат и 2-оксоглутарат с образованием С–С связи. Фумарат является точкой бифуркации в направлении гидрогенотрофного (образование сукцината) или метанотрофного (образование 2-метилсукцината) метаболизма.
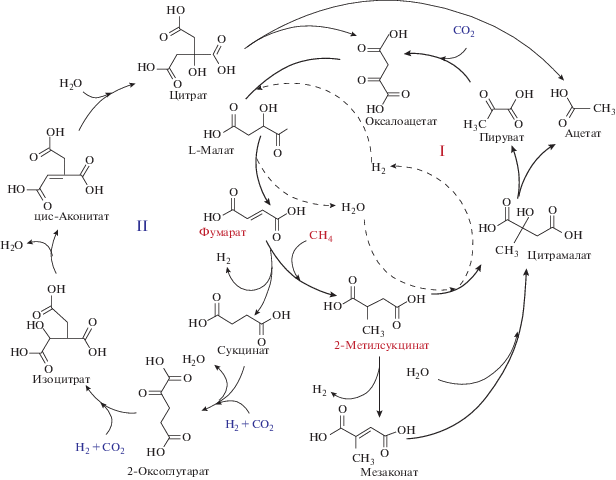
Ассимиляция метана осуществляется при присоединении метана к фумарату с образованием 2‑метилсукцината, анаэробное окисление которого приводит к образованию ацетата и пирувата. Образование пирувата (центральный “хаб” промежуточного метаболизма) открывает путь внедрения углерода метана в универсальное химическое пространство интермедиатов автотрофного метаболизма. Пируват ассимилирует СО2 с образованием оксалоацетата, который трансформируется в фумарат в реакциях компонентов восстановительного цитратного цикла. Фумарат, снова ассимилируя метан, начинает новый автокаталитический МФ цикл, в одном обороте которого из молекул метана и двуокиси углерода образуется молекула ацетата. Общая для ВЦ и МФ циклов последовательность реакций дикарбоновых кислот оксалоацетат → малат → фумарат → сукцинат недавно экспериментально продемонстрирована с протонированными интермедиатами при катализе комбинацией самородного железа с ионами Zn2+ и Cr3+ (Varma et al., 2018). Проблема протекания наиболее энергетически неблагоприятной реакции трансформации 2-метилсукцината в цитрамалат ($\Delta G_{{{\text{298}}}}^{0}$ = 96.57 кДж/моль, табл. 2) может быть решена использованием в реакции окислителей, таких как окислы азота и железа. Анаэробную фиксацию метана в МФ цикле можно представить в виде реакции C4H4O4 (фумарат) + + CH4 + [O] = C2H4O2 (ацетат) + C3H4O3 (пируват), где [O] – неорганический окислитель. Свободная энергия реакций с участием окисленных форм азота и железа приведена в табл. 2. Автокаталитическая природа МФ цикла связана с разветвлением цитрамалата на пируват и ацетат и может быть выражена в виде реакции: С4Н6О5 (малат) + + 1.5СН4 + 2.5CO2 = 2С4Н6О5 (два малата). Этот тип автотрофного метаболизма, как и в случае упомянутого выше обратного ВЛ пути, можно определить как карбокси-метанотрофный ацетогенез (табл. 2).
Зарождение химических систем палеометаболизма определялось физико-химическими условиями существования древней гидротермальной системы, модель которой представлена в виде фазовой диаграмме химический потенциал кислорода – температура (рис. 4). Диаграмма представляет собой двухкомпонентную систему (С и Н – экстенсивные параметры), т. к. кислород, представленный логарифмом активности О2 в растворе переходит в число интенсивных параметров наряду с температурой и давлением. Соответственно, при произвольном давлении нонвариантные равновесия на диаграмме (точки) состоят из четырех фаз, а трехфазные равновесия (линии) разделяют дивариантные поля устойчивости (фации) двухфазных равновесий.
Таблица 2.
Свободные энергии реакций МФ ветви (I) бицикла и суммарная реакция фиксации СН4 с участием окисленных форм азота и железа в качестве окислителей в гидротермальных условиях при температурах 298 и 473 К и PНАС
| Реакции МФ цикла | $\Delta G_{{{\text{298}}}}^{0}$, кДж | $\Delta G_{{{\text{473}}}}^{0}$, кДж |
|---|---|---|
| (CH)2(COOH)2(фумарат) + CH4 = (CH2)(CH3CH)(COOH)2 (метилсукцинат) | –44.95 | –29.97 |
| (CH2)(CH3CH)(COOH)2 (метилсукцинат) + H2O = (CH3CH)CH(OH)(COOH)2(цитрамалат) + H2 | 96.57 | 94.14 |
| (CH3C=СH)(COOH)2 (мезаконат) + H2 = (CH2)(CH3CH)(COOH)2 (метилсукцинат) | –66.53 | –54.85 |
| (CH3C=СH)(COOH)2 (мезаконат) + H2О = (CH3CH)CH(OH)(COOH)2 (цитрамалат | 30.05 | 39.29 |
| CH3CH)CH(OH)(COOH)2 (цитрамалат) = C2H4O2 (ацетат) + C3H4O3 (пируват) | 19.35 | 1.73 |
| Суммарная фиксация метана | ||
| C4H4O4 (фумарат) + CH4 + H2O = C2H4O2 (ацетат) + C3H4O3 (пируват) + H2 | 70.97 | 65.9 |
| C4H4O4 + CH4 + 0.5O2 = C2H4O2 + C3H4O3 | –192.22 | –182.53 |
| C4H4O4 + CH4 + 2HNO2 = C2H4O2 + C3H4O3 + H2O + 2NO | –115.77 | –143.28 |
| C4H4O4 + CH4 + 2NO = C2H4O2 + C3H4O3 + N2O | –274.7 | –250.83 |
| C4H4O4 + CH4 + NO = C2H4O2 + C3H4O3 + 0.5N2 | –276.93 | –264.48 |
| C4H4O4 + CH4 + Fe3O4 + 1.5SiO2 = C2H4O2 + C3H4O3 + 1.5Fe2SiO4 | 45.08 | 25.21 |
| C4H4O4 + CH4 + 3Fe2O3 = C2H4O2 + C3H4O3 + 2Fe3O4 | 22.38 | 13.87 |
| C4H4O4 + CH4 + 0.75FeS2 + 0.25Fe3O4 = C2H4O2 + C3H4O3 + 1.5FeS | 38.78 | 31.54 |
Рис. 4.
Диапазон изменения редокс состояния (активности О2) континентальной коры Архея 3.8 Ga назад (заштрихованная зеленым область) на диаграмме логарифм активности кислорода (lg ${{a}_{{{{{\text{О}}}_{{\text{2}}}}}}}$) – температура (Т, К) в гидротермальных условиях при РНАС. Фазовые пространства термодинамической устойчивости веществ и их парагенезисов (assemblages) рассчитывали согласно методике (Marakushev, Belonogova, 2009). Жирная линия – равновесие СО2 ↔ СН4, разделяющее области их термодинамической устойчивости (I и II). Фация сукцината оконтурена синими линиями равновесий, а фация ацетата – красными. Штриховые линии – равновесия минеральных буферов: гематит-магнетит, Fe2O3/Fe3O4 (НМ), пирит-пирротин-магнетит, FeS2 + Fe3O4/FeS (РРМ) и кварц-магнетит-фаялит, SiO2 + + Fe3O4/Fe2SiO4 (QMF). ∆QMF – диапазон изменения относительно равновесия QMF буфера в логарифмических единицах фугитивности О2. Обозначения: Acet – ацетат, Suc – сукцинат, Fum – фумарат. Свободные энергии водных веществ по данным (Amed, Shock, 2001).
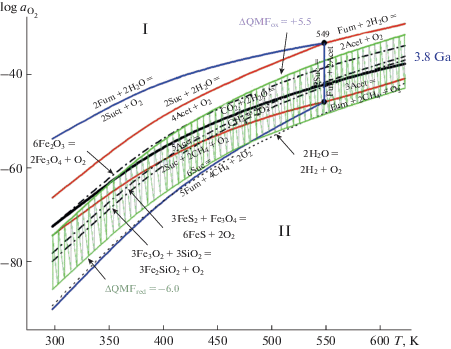
Диаграмма разделяется равновесием СН4 + + 2О2 = СО2 + 2Н2О (жирная линия) на два фазовых пространства, обозначенные римскими цифрами I и II, соответствующие окислительным и восстановительным условиям гидротермальной системы. Метастабильные равновесия формируют фазовые пространства устойчивости (фации) парагенезисов (ассоциаций) интермедиатов ВЦ-МФ бицикла – ацетата, сукцината и фумарата. Фации фумарата и сукцината расположены по обе стороны стабильного равновесия СН4/СО2, однако фация сукцината ограничена температурой 549 К. В гидротермальном растворе парагенезисы компонентов фумаратного цикла устойчивы, как в фации СО2, так и в фации СН4, т.е. них могут развиваться системы фиксации углерода, ассимилируемого в виде СО2 или СН4. Фация ацетата полностью охватывает равновесие СН4 + О2 = СО2 + Н2О, а вся система при изменении химического потенциала кислорода может развиваться в направлении образования низкотемпературного (Suc – H2O) и высокотемпературного (Fum – H2O) парагенезиса в фации СО2 (I) или образование низкотемпературного (Suc – CH4) и высокотемпературного (Fum – CH4) парагенезиса в фации СН4 (II). Таким образом, метановая фация (II) это широкая область термодинамической устойчивости систем ассимиляции СН4 органическими кислотами и кетокислотами в водной среде.
Минеральные буферы, определяющие окружающую редокс обстановку, до температуры 549 К располагаются в фации сукцината, однако равновесие гематит-магнетит (HM) находится в области термодинамической устойчивости СО2 (фация I), а пирит-пирротин-магнетит (PPM) и кварц-магнетит-фаялит (QMF) равновесия в фации II (устойчивость метана). Два последних определяют температурные редокс условия для фундаментального равновесия 2Suc + 2CH4 + O2 = 5Acet, как основы метанотрофного ацетогенеза. Фация магнетита (Fe3O4), входящая в состав минеральных редокс буферов, охватывает равновесие СН4/СО2 практически во всем диапазоне температур, рассматриваемой гидротермальной системы. Очевидно, что системы фиксации СО2 должны были развиваться выше равновесия СО2 ↔ СН4, тогда как системы фиксации СН4 – ниже него. Видимо одновременная фиксация СО2 и СН4 с образованием ацетата (карбокси-метанотрофия) (рис. 3) происходила в фации магнетита (Fe3O4) и оба эти субстрата могли быть источником углерода для развития палеометаболизма в области термодинамической устойчивости дикарбоновых кислот – универсальных интермедиатов промежуточного метаболизма.
На основе анализа микроэлементов магматических цирконов корового происхождения (в основном данные оксибарометра на основе церия), было показано, что континентальная кора Катархея была значительно более восстановленной по сравнению с современной и испытала прогрессивное окисление в раннем Архее ~ 3.6 млрд лет назад (Yang et al., 2014). В этот период возможного зарождения жизни редокс состояние земной коры (logfO2) периодически изменялось относительно равновесия фаялит-магнетит-кварцевого буфера (∆QMF). Например, в цирконах с возрастом 3.8 Ga ∆QMF составляла от –6.0 до +5.5 и этот редокс диапазон представлен на диаграмме (рис. 4). Это пространство полностью охватывает как равновесие СН4/СО2, так и магнетитовую фацию, однако в большей степени принадлежит к низкотемпературной восстановительной метановой фации (II), включающую все рассмотренные равновесия ассимиляции метана. Вплоть до 3.6 Ga и, может быть, даже до великого окислительного события (GOE) 2.2–2.4 Ga, окислительный потенциал редокс пар магнетита земной коры, по-видимому, определял химический потенциал кислорода в древних подводных минералогических системах. Таким образом, рассмотренные гидротермальные редокс и P-T-условия раннего Архея чрезвычайно благоприятны для развития метанотрофных и карбокси-метанотрофных систем палеометаболизма.
* * *
Совокупность универсальных интермедиатов автотрофного палеометаболизма образует фазовое пространство веществ системы С–Н–О, химическим фундаментом которого являются легкие углеводороды. Определенное “химическое пространство” веществ является термодинамически контролируемой сетью интермедиатов, комбинацией которых создавались различные системы автотрофного палеометаболизма. Современные автотрофные пути фиксации углерода, видимо, образовывались в результате сочетания отдельных модулей метаболических систем, созданных предковым метаболизмом, обратимость реакций которого, позволяла осуществлять различные стратегии реализации автотрофной ассимиляции углерода.
Автотрофный метаболизм предполагает ассимиляцию неорганического углерода исключительно в форме СО2, однако и метан является глубинным, неорганическим веществом и поэтому его фиксация это также проявление автотрофного метаболизма. Анаэробная фиксация метана универсальными компонентами протометаболических сетей в гидротермальных условиях термодинамически благоприятна. В условиях углеводородной дегазации ранней Земли фиксация углерода в форме углеводородов могла преобладать, но с переходом к режиму СО2 дегазации нашей планеты реликтовые формы метанотрофии неизбежно должны были или вымереть или эволюционировать в метаногенные формы или быть отброшенными в экстремальные экологические ниши. Даже древние микрофоссилии могут не иметь прямого отношения к LUCA и его потомкам, а являться останками других вымерших предшественников. Если предположить существование до LUCA более ранних предшественников (Cornish-Bowden, Cárdenas, 2017), то количество углерод-фиксирующих систем метаболизма в предполагаемых популяциях пре-LUCA организмов должно быть значительно больше, чем известно в настоящее время. Возможно также, что современные пути метанотрофии – это реликты палеометаболизма Архейского метанотрофного превосходства прокариот. Исследование “химического пространства” протометаболических сетей и экстраполяция результатов к условиям зарождающейся жизни является частью молекулярной палеонтологии, и многие еще не ясные ответы на фундаментальные вопросы происхождения автотрофного метаболизма могут быть скрыты в составе и архитектуре современных биохимических реакционных сетей.
Работа выполнена по теме государственного задания (AAAA-A19-119071190045-0).
Список литературы
Маракушев С.А. Трансформация углеводородов в компоненты архаической автотрофной системы фиксации СО2 // Докл. РАН. 2008. Т. 418. № 3. С. 412–418.
Маракушев С.А. Белоногова О.В. Физико-химические условия образования и самоорганизации компонентов архаического цикла фиксации СО2 в гидротермальных системах // Биофизика. 2009. Т. 54. № 4. С. 748–759.
Маракушев С.А., Белоногова О.В. Эволюция архаической хемоавтотрофной системы фиксации двуокиси углерода в гидротермальных системах // Докл. РАН. 2010. Т. 433. № 2. С. 262–268.
Маракушев С.А. Белоногова О.В. Термодинамические факторы естественного отбора в автокаталитических химических системах // Докл. РАН. 2012. Т. 444. № 1. С. 92–97.
Маракушев С.А., Белоногова О.В. Происхождение предкового метаболизма бактерий // Палеонтол. журн. 2013а. Т. 47. № 9. С. 109–119.
Маракушев C.А., Белоногова О.В. Зарождение примитивного хемоавтотрофного метаболизма в гидротермах и происхождение предковых таксонов прокариот // Проблемы зарождения и эволюции биосферы / Ред. Галимов Э.М. М.: УРСС. 2013б. С. 414–433.
Amend J.P., Shock E.L. Energetics of overall metabolic reactions of thermophilic and hyperthermophilic Archaea and Bacteria // FEMS Microbiol. Rev. 2001. V. 25. P. 175–243.
Averesch N.J.H., Kracke F. Metabolic network analysis of microbial methane utilization for biomass formation and upgrading to bio-fuels // Frontiers. Energy Res. 2018. V. 6. P. 1–16.
Beasley K.K., Nanny M.A. Potential energy surface for anaerobic oxidation of methane via fumarate addition // Environ. Sci. Technol. 2012. V. 46. P. 8244–8252.
Bell E.A., Boehnke P., Harrison T.M., Mao W.L. Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon // PNAS. 2015. V. 112. P. 14518–14521.
Braakman R., Smith E. The emergence and early evolution of biological carbon-fixation // PLoS Comput. Biol. 2012. V. 8. P. 1–16.
Braakman R., Smith E. The compositional and evolutionary logic of metabolism // Phys. Biol. 2013. V. 10. P. 1–63.
Catling D.C., Kasting J.F. Atmospheric evolution on inhabited and lifeless worlds. Cambridge: Cambridge Univ. Press, 2017. 556 p.
Cornish-Bowden A., Cárdenas M.L. “Life before LUCA” // J. Theor. Biol. 2017. V. 434. P. 68–74.
Dodd M.S., Papineau D., Grenne T., Slack J.F., Rittner M., Pirajno F., O’Neil J., Little C.T.S. Evidence for early life in Earth’s oldest hydrothermal vent precipitates // Nature. 2017. V. 543. P. 60–64.
Goldford J.E., Hartman H., Smith T.F., Segre D. Remnants of an ancient metabolism without phosphate // Cell. 2017. V. 168. P. 1–9.
Hordijk W., Steel M. Autocatalytic networks at the basis of life’s origin and organization // Life. 2018. V. 8. P. 62–73.
Haynes C.A., Gonzalez R. Rethinking biological activation of methane and conversion to liquid fuels // Nat. Chem. Biol. 2014. V. 10. P. 331–339.
Hügler M., Sievert S.M. Beyond the Calvin cycle: autotrophic carbon fixation in the ocean // Ann. Rev. Mar. Sci. 2011. V. 3. P. 261–289.
Mall A., Sobotta J., Huber C., Tschirner C., Kowarschik S., Bačnik K., Mergelsberg M., Boll M., Hügler M., Eisenreich W., Berg I.A. Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium // Science. 2018. V. 359. P. 563–567.
Marakushev S.A., Belonogova O.V. The parageneses thermodynamic analysis of chemoautotrophic CO2 fixation archaic cycle components, their stability and self-organization in hydrothermal systems // J. Theoret. Biol. 2009. V. 257. P. 588–597.
Marakushev S.A., Belonogova O.V. The divergence and natural selection of autocatalytic primordial metabolic systems // Orig. Life Evol. Biosph. 2013. V. 43 P. 263–281.
Marakushev S.A., Belonogova O.V. Ideas and perspectives: Development of nascent autotrophic carbon fixation systems in various redox conditions of the fluid degassing on early Earth // Biogeosciences. 2019. V. 16. P. 1817–1828.
Martin W., Russell M.J. On the origin of biochemistry at an alkaline hydrothermal vent // Phil. Trans. R. Soc. Lond. B: Biol. Sci. 2007. V. 362. P. 1887–1926.
Martin W.F., Weiss M.C., Neukirchen S., Nelson-Sathi S., Sousa F.L. Physiology, phylogeny, and LUCA // Microbial Cell. 2016. V. 3. P. 582–587.
McKeegan K.D., Kudryavtsev A.B., Schopf J.W. Raman and ion microscopic imagery of graphitic inclusions in apatite from the >3830 Ma Akilia supracrustals, West Greenland // Geology. 2007. V. 35. P. 383–397.
Meringer M., Cleaves J. Computational exploration of the chemical structure space of possible reverse tricarboxylic acid cycle constituents // Sci. Reports. 2017. V. 7. P. 1–12.
Morowitz H.J., Kostelnik J.D., Yang J., Cody G.D. The origin of intermediary metabolism // Proc. Natl. Acad. Sci. USA. 2000. V. 97. P. 7704–7708.
Muchowska K.B., Varma S.J., Chevallot-Beroux E., Lethuillier-Karl L., Li G., Moran J. Metals promote sequences of the reverse Krebs cycle // Nat. Ecol. Evol. 2017. V. 1. P. 1716–1721.
Muchowska K. B., Chevallot-Beroux E., Moran J. Recreating ancient metabolic pathways before enzymes // Bioorg. Med. Chem. 2019.V. 27. P. 2292–2297.
Nitschke W., Russell M.J. Beating the acetyl-CoA pathway to the origin of life // Phil. Trans. Royal Soc. London. B. 2013. V. 368. P. 20120258.
Nunoura, T., Chikaraishi, Y., Izaki, R., Suwa, T., Sato, T., Harada, T., Mori K., Kato Y., Miyazaki M., Shimamura S., Yanagawa K., Shuto A., Ohkouchi N., Fujita N., Takaki Y., Atomi H., Takai K. A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile // Science. 2018. V. 359. P. 559–563.
Nutman A.P., Bennett V.C., Friend C.R.L., Van Kranendonk M.J., Chivas A.R. Rapid emergence of life shown by discovery of 3.700-million-year-old microbial structures // Nature. 2016. V. 537. P. 535–539.
Pavlov A.A., Kasting J.F., Brown L.L., Rages K.A., Freedman R. Greenhouse warming by CH4 in the atmosphere of early Earth // J. Geophys. Res. 2000. V. 105. P. 11981–11990.
Potter J., Konnerup-Madsen J. A review of the occurrence and origin of abiogenic hydrocarbons in igneous rocks / Hydrocarbons in Crystalline Rocks / Eds Petford N., McCaffrey K.J.W. / Special Publications. 2003. V. 214. Geol. Soc. London. P. 151–173.
Ralser M. An appeal to magic? The discovery of a non-enzymatic metabolism and its role in the origins of life // Biochem. J. 2018. V. 475. P. 2577–2592.
Ruiz-Mirazo K., Briones C., de la Escosura A. Chemical roots of biological evolution: the origins of life as a process of development of autonomous functional systems // Open Biol. 2017. V. 7. 170050.
Russell M.J., Martin W. The rocky roots of the acetyl-CoA pathway // Trends Biochem. Sci. 2004. V. 29. P. 358–363.
Russell M.J., Nitschke W. Methane: fuel or exhaust at the emergence of life? // Astrobiol. 2017. V. 17. P. 1053–1066.
Schreiber U., Mayer C., Schmitz O.J., Rosendahl P., Bronja A., Greule M., Keppler F., Mulder I., SattlerT., Schöler H.F. Organic compounds in fluid inclusions of Archean quartz‒analogues of prebiotic chemistry on early earth // PLoS ONE. 2017. V. 12. P. e0177570.
Smith E., Morowitz H.G. Universality in intermediary metabolism // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 13168–13173.
Soo V.W.C., McAnulty M.J., Tripathi A., Zhu F., Zhang L., Hatzakis E., Smith P., Agrawal S., Nazem-Bokaee H., Gopalakrishnan S., Salis H.M., Ferry J.G., Maranas C.D., Patterson A.D., Wood T.K. Reversing methanogenesis to capture methane for liquid biofuel precursors // Microb. Cell Factories. 2016. V. 15. P. 11–25.
Tashiro T., Ishida A., Hori M. Early trace of life from 3.95 Ga sedimentary rocks in Labrador, Canada // Nature. 2017. V. 549. P. 516–518.
Thauer R.K., Shima S. Methane as fuel for anaerobic microorganisms // Ann. NY Acad. Sci. 2008. V. 1125. P. 158–170.
Tian F., Toon O.B., Pavlov A.A., De Sterck H. A hydrogen-rich early Earth atmosphere // Science. 2005. V. 308. P. 1014–1017.
Timmers P.H.A., Welte C.U., Koehorst J.J. Plugge C.M., Jetten M.S.M., Stams A.J.M. Reverse methanogenesis and respiration in methanotrophic Archaea // Archaea. 2017. V. 17. P. 1–22.
Touret J.L.R. Remnants of early Archaean hydrothermal methane and brines in pillow-breccia from the Isua-Greenstone Belt, West Greenland // Precambr. Res. 2003. V. 126. P. 219–233.
Varma S.J., Muchowska K., Chatelain P., Moran J. Native iron reduces CO2 to intermediates and end-products of the acetyl-CoA pathway // Nat. Ecol. Evol. 2018. V. 2. P. 1019–1024.
Wächtershäuser G. Evolution of the first metabolic cycles // Proc. Natl. Acad. Sci. USA. 1990. V. 87. P. 200–204.
Wächtershäuser G. Groundworks for an evolutionary biochemistry – the iron-sulfur world // Progr. Biophys. Mol. Biol. 1992. V. 58. P. 85–201.
Weiss M.C., Preiner M., Xavier J.C., Zimorski V., Martin W.F. The last universal common ancestor between ancient Earth chemistry and the onset of genetics // PLoS Genet. 2018. V. 14. № 8. P. e1007518.
Weiss M.C., Sousa F.L., Mrnjavac N., Neukirchen S., Roettger M., Nelson-Sathi S., Martin W.F. The physiology and habitat of the last universal common ancestor // Nature Microbiol. 2016. V. 1. P. 16116.
Yan Z., Joshi P., Gorski C.A., Ferry J.G. A biochemical framework for anaerobic oxidation of methane driven by Fe(III)-dependent respiration // Nature Commun. 2018. V. 9. № 1642. P. 1–9.
Yang X., Gaillard F., Scaillet B. A relatively reduced Hadean continental crust and implications for the early atmosphere and crustal rheology // Earth Planet. Sci. Letters. 2014. V. 393. P. 210–219.
Zahnle K.J., Gacesa M., Catling D.C. Strange messenger: A new history of hydrogen on Earth, as told by Xenon // Geochim. Cosmochim. Acta. 2019. V. 244. P. 56–85.
Zubarev D.Y., Rappoport D., Aspuru-Guzik A. Uncertainty of prebiotic scenarios: the case of the non-enzymatic reverse tricarboxylic acid cycle // Sci. Reports. 2015. V. 5(8009). P. 1–7.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


