Известия РАН. Серия биологическая, 2021, № 5, стр. 464-469
Цитологические основы регулятивного развития иглокожих и детерминированного у моллюсков
А. Л. Дроздов *
Национальный научный центр морской биологии имени А.В. Жирмунского ДВО РАН
690041 Владивосток, ул. Пальчевского, 17, Россия
* E-mail: anatoliyld@mail.ru
Поступила в редакцию 07.11.2020
После доработки 19.11.2020
Принята к публикации 26.01.2021
Аннотация
Первичноротые (Protostomia) и вторичноротые (Deuterostomia) целомические животные имеют детерминированное (мозаичное) и регуляторное развитие. Эмбриогенез первичноротых не имеет тенденции к регуляции, которая напротив хорошо развита у вторичноротых. В наших работах была исследована способность иглокожих регулировать развитие, в том числе компенсировать влияние гравитационных полей на эмбриогенез. После центрифугирования зигот морского ежа в некоторых случаях бластула разделяется пополам и развиваются идентичные близнецы. Частота встречаемости близнецов коррелирует с жесткостью кортекса, которая определяется организацией кортикального цитоскелета яиц и эмбрионов. У хитонов и двустворчатых моллюсков близнецы после центрифугирования зигот не образуются, но в некоторых случаях развиваются полиэмбриональные элементы. В отличие от морских ежей, кортикальный цитоскелет у моллюсков окончательно формируется в овогенезе и не перестраивается при оплодотворении. Обсуждается морфогенетическая роль кортекса яиц и эмбрионов в регулятивном развитии Deuterostomia и детерминированном (мозаичном) развитии Protostomia.
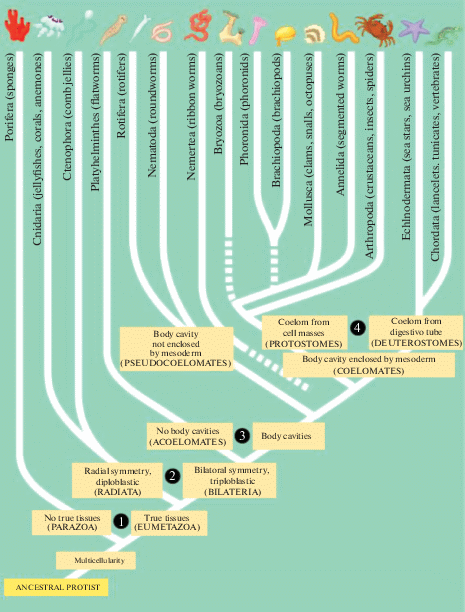
Целомические животные принадлежат к двум эволюционным линиям: Protostomia и Deuterostomia. По современным оценкам эти ветви были разделены ~700 млн лет назад (рис. 1). Представители первичноротых имеют детерминированное (мозаичное) развитие, а у вторичноротых – регулятивное. Кроме того, представители этих двух групп различаются пятью основными признаками: 1) базовым характером дробления зигот (спиральное у первичноротых и радиальное у вторичноротых); 2) способом формирования мезодермы (телобластичекое у первичноротых и энтероцельное у вторичноротых); 3) судьбой бластопора (остается первичным ртом у первичноротых и становится анусом у вторичноротых); 4) типом первичной личинки (трохофора у первичноротых и диплеврула у вторичноротых); 5) организацией нервной системы (брюшная нервная цепочка у первичноротых и дорзальная нервная трубка у вторичноротых). Кроме того, скелет вторичноротых мезодермального происхождения, а скелет первичноротых – эктодермального. Кожа вторичноротых является двухслойной: эктодермальный эпителий и мезодермальная соединительная ткань.
Рис. 1.
Филогенетическое дерево многоклеточных животных. (Интернет ресурс: https://www.mun.cа/biology/scarr/Phylogen of Animalia.html, посещение 16.11.2020).
Цитологические основы существенных различий в механизмах эмбриогенеза животных с регулятивным и детерминированным развитием далеки от понимания. В эмбриологии популярна гипотеза о позиционной информации – системе морфогенетических детерминантов – морфогенов, распределенных в цитоплазме яйца и бластомеров, которые определяют дифференциацию эмбрионов (Равен, 1964; Дэвидсон, 1972; Корочкин, 1977; Schroeder, 1980; Левин, Шварцман, 1980; Левин, 1982; Wessels, 1982; Исаева, 1984). Локализация морфогенов создается в ходе овогенеза, а полностью стабилизируется после оплодотворения уже в цитоплазме зиготы или при первых делениях дробления. У некоторых животных ей может предшествовать т.н. цитоплазматическая сегрегация – интенсивные перемещения как поверхностной (кортикальной), так и внутренней цитоплазматической овоплазмы (Kirschner, Gerhart, 1981; Sawada, 1983; Sawada, Osanai, 1984; Преснов, Исаева, 1985; Sardet et al., 1989; Shimizu, 1999). Существенную роль в локализации морфогенов и цитоплазматической сегрегации играет цитоскелет овоцитов, яиц и зигот. Это показано на модельных видах животных, принадлежащих к разным таксонам: морских звездах (Santella et al., 2014), лягушках (Geertje et al., 1983), рыбах (Becker, Hart, 1999), дрозофил (Bearer, 1992) и других (Speksnijder et. al., 1990; Singer, 1992; Shimizu, 1999). Биохимический состав морфогенетических детерминантов до конца не изучен. Вероятнее всего они представлены рибопротеиновыми (РНП) частицами (Исаева, 1984). Одним из подходов при изучении потенций эмбрионов к регулированию развития является исследование полиэмбрионии, т.е. формирование однояйцевых близнецов. У некоторых животных экспериментальным путем удавалось получать до четырех однояйцевых близнецов (Driesh, 1900; Loeb, 1909; Harvey, 1940). Эмбрионы морских ежей более полутора веков служат модельным объектом для изучения особенностей регулятивного развития животных. Ранее мы исследовали динамику развития близнецов при действии центрифугирования на оплодотворенные яйца морского ежа Strongylocentrotus nudus и ее связь с перестройками кортикального цитоскелета яиц (Дроздов, Святогор, 1987). Показано, что легче всего близнецы развиваются при центрифугировании зигот с 1-й по 6-ю мин развития (рис. 2).
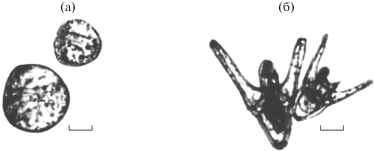
Рис. 2.
Однояйцевые близнецы морских ежей. (а) – стадия поздней бластулы; (б) – личинка на стадии плутеуса. Масштаб: 50 мкм (по Дроздов, Святогор, 1987).
Через 10 мин после оплодотворения число близнецов, развивающихся после центрифугирования, заметно снижается. Через полчаса и до появления первой борозды дробления их можно получить, добавляя в среду алкалоид цитохалазин В, который разрушает актиновые микрофиламенты цитоскелета.
Эмбриогенез первичноротых не имеет тенденции к регуляции, которая хорошо развита у вторичноротых. Двустворчатые моллюски и хитоны являются первичноротыми животными, для которых характерно спиральное детерминированное развитие, называемое иногда “мозаичным”. Зародыш рассматривается как мозаика зачатков, преформированных уже в неоплодотворенном яйце. Нами (Дроздов, Святогор, 1989) исследовано развитие эмбрионов двустворчатых моллюсков, имеющих гетеро-квадрантное и гомоквадрантное дробление, центрифугированных в течение 5 мин при 2000 g в период от оплодотворения до первого деления дробления. Эмбрионы с гетероквадрантным дроблением гигантской устрицы Crassostrea gigas развиваются с образованием полярной лопасти, а эмбрионы мактры китайской Mactra chinensis – без образования полярной лопасти. Также нами исследовано яйцо хитона Ischnochiton hakodadensis, имеющее гомоквадрантное дробление. Использование этих трех видов моллюсков позволило сравнить возможности формирования близнецов у моллюсков при разных типах дробления. У всех трех видов отмечены случаи полиэмбрионии, проявляющиеся в развитии близнецовых уродств (рис. 3). Частота их появления не зависит от времени центрифугирования зигот, но ее можно повысить при центрифугировании в присутствии цитохалазина В. Центрифугирование яиц моллюсков в присутствии цитохалазина В (ЦхВ) в отличие от центрифугирования в морской воде без него приводит к более резкой стратификации яйцеклетки, к некоторому увеличению частоты появления аберрантных эмбрионов и незначительному возрастанию доли близнецовых форм. Других внешне выраженных отличий зародышей, центрифугированных в ЦхВ, от зародышей, центрифугированных в морской воде без ЦхВ, отмечено не было.
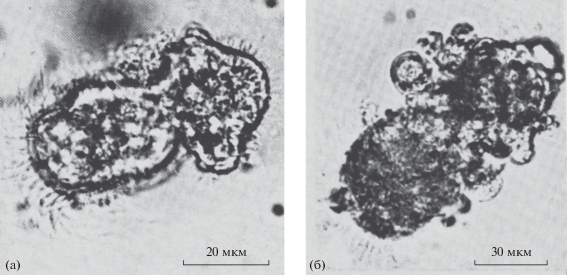
Рис. 3.
Элементы полиэмбрионии после центрифугирования зигот устрицы (а) и мактры (б). Масштаб: (а) – 20, (б) – 30 мкм (по Дроздов, Святогор, 1989).
Поскольку в работе многих авторов (обзор Исаева, 1984) показана существенная роль кортикального цитоскелета в распределении и механической фиксации морфогенетических детерминантов в яйцах и эмбрионах животных, мы исследовали цитоскелет кортекса неоплодотворенных и оплодотворенных яиц морских ежей и двустворчатых моллюсков. В кортексе неоплодотворенных яиц морского ежа Strongvlocentrotus intermedius нами (Дроздов и др., 1987) выявлена редкая сеть коротких микрофиламентов и фибрилл различного диаметра, связанных друг с другом, с поверхностью кортикальных гранул и со сгущениями электронно-плотного материала.
После оплодотворения в яйцах морского ежа происходит реорганизация кортекса: в кортикальном слое происходит формирование мощного цитоскелета, и кортекс становится плотным и стабильным. В нем выявляются одиночные и собранные в пучки актиновые микрофиламенты. Выделяющееся в перивителлиновое пространство содержимое кортикальных гранул разбухает, формируя оболочку оплодотворения. Она пронизана выростами цитоплазмы – микроворсинками, которые армированы пучками микрофиламентов (рис. 4). Нами показано (Дроздов, 1989), что у мактры в неоплодотворенных яйцах существует мощная сеть, состоящая из пучков актиноподобных филаментов, хорошо выявляющихся при электронно-микроскопическом исследовании “тритоновых теней” яиц (рис. 5). После оплодотворения принципиальных изменений цитоскелета не происходит.
Рис. 4.
Схема организации кортекса неоплодотворенного (а) и оплодотворенного (б) яиц морского ежа. гаг, гп – гликозаминогликаны и гликопротеины внеклеточного вещества яйцевых оболочек, жг – желточные гранулы, кг – кортикальные гранулы, мв – микроворсинки с пучком актиновых филаментов, мтх – митохондрии, пг – пигментные гранулы, пм – плазматическая мембрана, рнп – комплекс РНК с белком, цс – цитоскелетная сеть, связывающая мембранные органоиды и макромолекулярные комплексы кортикального слоя, эс – эндоплазматическая сеть с рибосомами (по Дроздов и др., 1987).
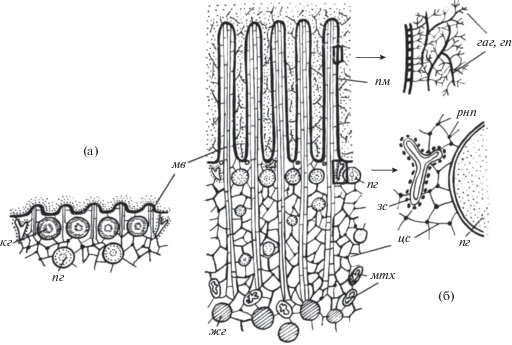
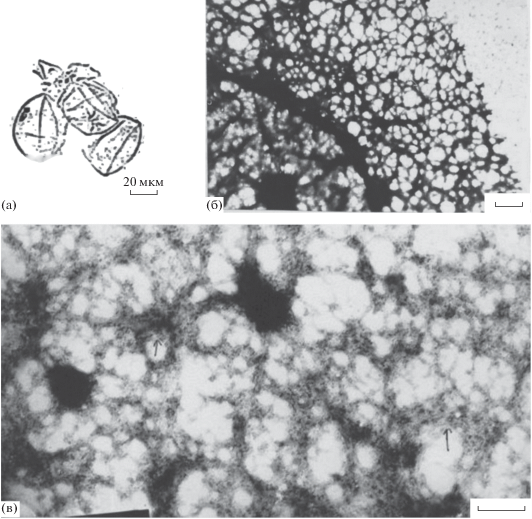
Рис. 5.
Кортексы неоплодотворенных яиц мактры китайской. (а) – тритоновые “тени” в световом микроскопе, (б), (в) – в просвечивающем электронном микроскопе. Масштаб: (а) – 20, (б) – 0.2, (в) – 0.1 мкм (по Дроздов, 1989).
Таким образом, распределение морфогенов различается у первичноротых и вторичноротых. Оно определяется организацией цитоскелета, который динамичен у эмбриона Deuterostomia и способен к перестройке, тогда как цитоскелет Protostomia является жестким и практически не изменяется во время оплодотворения и морфогенеза. Как следствие, морфогены занимают устойчивое положение в яйцеклетке, зиготе и эмбрионе, строго определяя течение эмбриогенеза.
Возможно, одним из следствий таких различий в организации цитоскелета первичноротых и вторичноротых является поведение их клеток в культуре. Клетки представителей типа хордовых сравнительно легко вводятся в культуру, которая широко применяется во многих биомедицинских и биотехнологических лабораториях по всему миру (Basic Cell Culture, 2002; Butler, 2003; Freshney, 2010; Animal Cell Culture, 2015 и др.). В то же время, несмотря на значительные за последние 50 лет усилия по введению в культуру клеток первичноротых животных, исследователи, как правило, ограничиваются наблюдениями за первичными культурами. Получать перевиваемые культуры практически не удается (Cai, Zhang, 2014; Potts et al., 2020). Можно полагать, что эти различия в поведении в культуре клеток первичноротых и вторичноротых связаны с регуляторными потенциями их цитоскелета. Расхождения в организации цитоскелета произошли ~ 700 млн лет тому назад, и они определяют детерминированные и регулятивные физико-химические особенности клеток и тканей этих двух главных ветвей царства многоклеточных животных.
Список литературы
Дроздов A.Л. Кортикальный цитоскелет неоплодотворенных и оплодотворенных яиц макгры китайской // Цитология. 1989. Т. 31. С. 652–656.
Дроздов A.Л., Исаева В.В., Подгорная О.И. Кортикальный цитоскелет неоплодотворенных и оплодотворенных яиц морского ежа // Цитология. 1987. Т. 29. С. 267–272.
Дроздов А.Л., Святогор Г.П. Морфогенетическая роль кортекса в развитии близнецов у морского ежа // Онтогенез. 1987. Т. 18. С. 540–546.
Дроздов А.Л., Святогор Г.П. Развитие центрифугированных яиц гигантской устрицы, мактры китайской и хитона // Онтогенез. 1989. Т. 20. С. 135–140.
Дэвидсон Э. Действие генов в раннем развитии. М.: Мир,1972. 342 с.
Исаева В.В. О морфогенетической роли кортикального цитоскелета и плазматической мембраны яйцеклетки // Цитология. 1984. Т. 26. С. 5–13.
Корочкин Л.И. Взаимодействие генов в развитии. М.: Наука, 1977. 280 с.
Левин В.Л. К вопросу о детерминантах, действующих на первых этапах соматогенеза у дрозофилы // Цитология. 1982. Т. 24. С. 604–609.
Левин В.Л., Шварцман П.Я. Новые данные о детерминации клеток в развитии дрозофилы (обзор литературы) // Цитология. 1980. Т. 22. С. 1259–1283.
Преснов Е.В., Исаева В.В. Перестройки топологии при морфогенезе. М.: Наука, 1985. 191 с.
Равен X. Оогенез: Накопление морфогенетической информации. М.: Мир, 1964. 304 с.
Animal Cell Culture. Cell Engeneering, 9. Ed. M. Al-Rubeai. Springer International Publishing Switzerland. 2015. 763 p.
https://doi.org/10.1007/978-3-319-10320-4_21
Basic Cell Culture, 2nd ed. Ed. J. M. Davis. Oxford University Press. 2002. 381 p.
Bearer E.L. Cytoskeleton in Development // Curr. Top. Dev. Biol. 1992. V. 26. P. 1–7.
Becker K.A., Hart N.H. Reorganization of filamentous actin and myosin-II in zebrafish eggs correlates temporally and spatially with cortical granule exocytosis // J. Cell Sci. 1999. V. 112. P. 97–110.
Butler M. Animal Cell Culture and Technology. London: Taylor & Francis Group, 2003–2004. 256 p.
https://doi.org/10.4324/9780203427835
Cai X., Zhang Y. Marine invertebrate cell culture: a decade of development. // J. Oceanography. 2014. V. 70. P. 405–414.
https://doi.org/10.1007/s10872-014-0242-8
Driesch H. Die isolirten Blastomeren des Echinidenkeimes // Arch. Entwicklungsmech. Organismen. 1900. Bd 10. S. 361–384.
Freshney R.I., Culture of Animal Cells. A manual of basic technique and spezialized applications. Wiley-Blackwell, 2010. 732 p.
https://doi.org/10.1002/9780470649367
Geertje A.U., Hara K., Koster C.H., Kirschner M.W. Evidence for a functional role of the cytoskeleton in determination of the dorsoventral axis in Xenopus laevis eggs // J. Embryol. Exp. Morph. 1983. V. 77. P. 15–37.
Harvey E.B. A new method of producting twins, triplets and quadruplest in Arbacia punctulata and their development // Biol. Bull. 1940. V. 78. P. 202–216.
Kirschner M.W., Gerhart J.C. Spatial and temporal changes in the amphibian egg // Bio Science. 1981. V. 31. P. 381–388.
Loeb J. Ober chemichen Bedingungen fur die Entstehumg einluger Zwiliinge beim Seeigel // Entwicklungsmech. Organismen. 1909. Bd 27. S. 119–140.
Potts R.W.A., Gutierrez A.P., Cortés-Araya Y., Houston R.D., Bean T.P. Developments in marine invertebrate primary culture reveal novel cell morphologies in the model bivalve Crassostrea gigas // PeerJ. 2020. V. 8. P. 9180. https://doi.org/10.7717/peerj.9180
Santella L., Limatola N., Chun J.T. Actin Cytoskeleton and Fertilization in Starfish Eggs // Sawada H., Inoue N., Iwano M. (eds.), Sexual Reproduction in Animals and Plants, Chapter 13. Springer Open. 2014. P. 141–156. https://doi.org/10.1007/978-4-431-54589-7_13
Sardet C., Speksnijder J., Inoue S., Jaffe L. Fertilization and ooplasmic movements in the ascidian egg // Development. 1989. V. 105. P. 237–249.
Sawada T. How ooplasm segregates bipolarly in ascidian eggs // Bull. Mar. Biol. Station, Asamushi, Tohoku Univ. 1983. V. 17. P. 123–140.
Sawada T., Osanai K. The cortical contraction related to the ooplasmic segregation in Ciona intestinalis eggs // W. Boux’s Arch. Devel. Biol. 1984. V. 190. P. 208–214.
Schroeder T.E. Expressions of the prefertilization polar axis in sea urchin eggs // Develop. Biol. 1980. V. 79. P. 428–443.
Shimizu T. Cytoskeletal mechanisms of ooplasmic segregation in annelid eggs // Int. J. Dev. Biol. 1999. V. 43. P. 11–18.
Singer R.H. The cytoskeleton and mRNA localization // Current Opinion in Cell Biology. 1992. V. 4. P. 15–19.
Speksnijder J.E., Christian Sardet Ch., Jaffe L.F. The Activation Wave of Calcium in the Ascidian Egg and Its Role in Ooplasmic Segregation // J. Cell Biol. 1990. V. 110. P. 1589–1598.
Wessells N.K. A catalogue of processes responsible for metazoan morphogenesis // Life Sci. Res. Reports. 1982. V. 22. P. 115–154.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


