Известия РАН. Серия биологическая, 2022, № 1, стр. 37-45
Регуляция активности глутаматдегидрогеназы в листьях кукурузы (Zea mays L.) при изменении светового режима
А. Т. Епринцев 1, *, Г. Б. Анохина 1, Д. Н. Федорин 1
1 ФГБОУВО “Воронежский государственный университет”
394018 Воронеж, Университетская площадь, д. 1, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 30.09.2019
После доработки 26.12.2019
Принята к публикации 26.12.2019
- EDN: WNUWNN
- DOI: 10.31857/S1026347021060068
Аннотация
Изучены молекулярные и биохимические механизмы регуляции активности глутаматдегидрогеназы (ГДГ) в листьях кукурузы при изменении светового режима. Установлено внутриклеточное распределение глутаматдегидрогеназной активности, показавшее, что исследуемый фермент локализован главным образом в митохондриях (86%). Выявлено, что величина активности ГДГ регулируется световым режимом. В темноте и при облучении дальним красным светом (ДКС) глутаматдегидрогеназная активность возрастает, что обусловлено активацией экспрессии генов, кодирующих α-субъединицу (gdh-2) и β-субъединицу (gdh-1). Уровень транскриптов генов gdh-1, gdh-2, кодирующих различные субъединицы этого фермента, увеличивался в темноте, но снижался на свету и при облучении красным светом. Показано, что трансдукция фитохромного сигнала осуществляется с участием вторичного мессенджера – катионов кальция.
Глутаматдегидрогеназа (ГДГ) – фермент, относящийся к классу оксидоредуктаз, который катализирует обратимую реакцию восстановительного аминирования 2-оксоглутарата до глутамата с использованием НАД+ и/или НАД(Ф) в качестве кофермента. Если классифицировать данный фермент по коферментной специфичности, существуют три основных типа ГДГ: НАД-зависимая (НАД-ГДГ, КФ 1.4.1.2), НАДФ-зависимая (НАДФ-ГДГ, КФ 1.4.1.4) и та, которая может использовать два кофермента сразу (НАД(Ф)-ГДГ, КФ 1.4.1.3) (Fontaine et al., 2013).
Большая часть ГДГ в растительной клетке имеет митохондриальную локализацию. Однако данный фермент также присутствует в цитоплазме и хлоропластах (Fontaine et al., 2006). Следует отметить, что глутаматдегидрогеназа в растениях может встречаться в корнях, семядолях, а также побегах. Наличие специфичных типов ГДГ (по используемому кофактору) в разных органах и тканях обусловлено такими факторами как клеточная дифференцировка и физиологическая функция, что связано с различиями в азотном обмене корней и листьев. Изоформы ГДГ могут быть вовлечены в анаболические процессы. Кроме того, могут обеспечивать катаболичесие процессы: удаление избыточного азота, также данный фермент обеспечивает преобладающий путь синтеза из глутамата 2-оскоглутарата, окисляемого в ЦТК (Engel, 2014).
Известно, что активность глутаматдегидрогеназы может регулироваться световым режимом (Miyashita, Good, 2008). Более того, имеются данные, что у Arabidopsis thaliana экспрессия генов ГДГ изменяется при смене условий темнота/свет (Гарник и др., 2013). Однако до сих пор в полной мере механизм, посредством которого осуществляется контроль работы данной ферментной системы недостаточно изучен. В связи с тем, что у растительных организмов имеются митохондриальный, хлоропластный, а также ядерный геномы, возникает необходимость в сложной системе передачи сигнала для осуществления процесса транскрипции. В настоящее время не изучено, каким образом осуществляется трансдукция сигнала: от органелл к ядру, обеспечивая процесс транскрипции (ретроградная регуляция), или же сигнал идет от ядра к органеллам (антероградная регуляция) (Petrillo et al., 2014).
Филогенетический анализ показал, что растительная ГДГ кодируется небольшим семейством генов, имеющим высокий процент гомологии. У кукурузы ГДГ в геноме представлена двумя генами, каждый из которых кодирует отдельные типы субъединиц ГДГ: α и β (Lehmann, Ratajczak, 2008). Sakakibara et al. изолировали полноразмерную копию кДНК gdh-1 (LOC542220), кодирующую β-субъединицу ГДГ кукурузы, которая локализована в хромосоме 1 (Sakakibara et al., 1995). Исследования структуры гена показали, что открытая рамка считывания кодирует 411 аминокислотный остаток (а. о.). Транскрипты данного гена обнаружены в корнях, его локализация связана с клетками оболочки проводящего пучка. Ген gdh-2 (LOC100193614), локализованый в хромосоме 10, кодирует α-субъединицу ГДГ кукурузы. Известно, что gdh-2 относится к генам с циркадной регуляцией. По предположению Гарника с соавт., в циркадной регуляции экспрессии гена gdh-2 ГДГ арабидопсиса участвуют различные сигнальные пути клетки, обеспечивающие координацию между отдельными компартментами (Гарник и др., 2013).
Все больше фактов указывает на важность Са2+ и кальмодулина в регуляции транскрипционных процессов в ответ на эндогенные и экзогенные раздражители. Существуют предположения, согласно которым изменение в уровне цитозольного кальция в ответ на раздражители может оказывать влияние на ядерную кальциевую сигнализацию путем простой диффузии Са2+ через ядерный поровый комплекс. Было показано, что ядра растительных клеток обладают собственным механизмом Са2+-сигнализации. При этом, в ядрах отмечается явное и независимое изменение в концентрации двухвалентных катионов кальция (по сравнению с цитоплазмой) в ответ на облучение синим светом, осмотические, механические и тепловые раздражители (Labuz et al., 2016).
Ранее в нашей лаборатории было установлено, что регуляция активности некоторых ключевых ферментов цикла Кребса, таких как цитратсинтаза, сукцинатдегидрогеназа, фумаратгидратаза и аконитатгидратаза в листьях растений в условиях стресса осуществляется на экспрессионном уровне с участием катионов кальция как вторичных мессенджеров (Попов и др., 2007; Епринцев и др., 2012; Eprintsev et al., 2013, 2016, 2018).
Цель данной работы – исследование особенностей регуляции функционирования глутаматдегидрогеназы (НАД(Ф)-ГДГ, КФ 1.4.1.3) в листьях кукурузы при изменении светового режима.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали 14-дневные листья растений кукурузы (Zea mays L.) сорта Воронежская 76, выращенных гидропонным способом при 10-часовом световом дне с интенсивностью света 25 Вт/м2 (“LabTech”, Корея). Температура выращивания растений составляла 25°С.
Растения экспонировали 12 ч на белом свету (вариант “свет”). Для создания разных световых режимов растения помещали в темноту на 24 ч (вариант “темнота”), после чего облучали красным (вариант “КС”), и/или дальним красным (вариант “ДКС” и “КС + ДКС”) светом в течение 15 мин, используя соответственно светодиоды 640–680 нм (КИПД40М40-К-П6, Россия) для облучения красным светом, 710–750 нм (3Л127А-5-5, Россия) для облучения дальним красным светом. Интенсивность света составляла 0.044 Вт/м2. Пробы для анализа отбирали через три часа с момента облучения (Eprintsev et al., 2013).
Применяли специфические ингибиторы: рутений красный (25 мМ) для блокировки транспорта кальция через ионные каналы, и этиленгуанинтетраацетат (ЭГТА) (5 мкМ) для хелатирования свободного кальция.
Для выделения митохондриальной фракции навеску листьев кукурузы 5 г растирали в фарфоровой ступке со средой выделения: 0.15 М Тris-HCl буфер (pH 7.4), 0.4 М сахароза, 2.5 мМ ЭДТА, 1 мМ хлорид калия, 4 мМ хлорид магния, 0.05% Тriton Х-100 в соотношении 1 : 10. Гомогенат фильтровали и центрифугировали 3 мин при 3000 g на центрифуге Еppendorf Centrifuge 5804R (“Еppendorf”, Германия). Супернатант центрифугировали 10 мин при 18000 g. Выделенную фракцию митохондрий разрушали осмотическим шоком в среде, содержащей 0.15 М Тris-HCl буфер, pH 7.4. Степень разрушения митохондрий была более 90%, что контролировали методом микроскопии на Olympus CX41RF (“Olympus”, Япония). Полученную фракцию митохондрий использовали для определения активности ГДГ. Все манипуляции проводили при температуре +4°С.
Активность ГДГ определяли спектрофотометрическим методом при 340 нм в среде, содержащей 13 мМ 2-оксоглутарата, 0.25 мМ НАДН, 1мМ CaCl2, 50 мМ (NH4)2SO4, 100 мМ Tris-HCl буфер рН 8.0 (Sarasketa et al., 2016).
Для выделения различных мембранных фракций из клеточного гомогената проводили центрифугирование в градиенте плотности сахарозы (Геннис, 1997). Градиент создавали путем последовательного наслоения растворов сахарозы в концентрациях: 2.5, 2.3, 1.8, 1.5, 1.3 М. Гомогенизировали исследуемый объект в среде выделения (1:5), которая содержала 0.1 М Tris-HCl буфер, рН 8.0; 0.4 М сахарозу; 2 мМ KCl; 1 мМ ЭДТА; 3 мМ ДТТ. Далее отфильтровывали супернатант и центрифугировали 3–4 мин при 1000 об/мин. Полученную надосадочную жидкость центрифугировали еще 3–4 мин с той же скоростью. Затем супернатант снова центрифугировали при 11 000 об/мин. Осадок растворяли в 10 мл среды выделения и наслаивали на вершину охлажденного до 0°С ступенчатого сахарозного градиента: 2.5 М (2 мл); 2.3 М (5 мл); 1.8 М (6 мл); 1.5 М (5 мл); 1.3 М (5 мл).
Разделение органелл достигалось путем центрифугирования на центрифуге Backman (США) при 100 000 g 90 мин при 0°С. Полученные фракции осторожно собирали и разбавляли буфером до концентрации сахарозы 0.4–0.5 М, а затем центрифугировали 30 мин при 11 000 об/мин для осаждения органелл. Полученные осадки разрушали осмотическим шоком (в 50 мМ Tris-HCl буфере, pH 7.5) и далее использовали для измерения активности ферментов.
Перекрестное загрязнение определяли по активности маркерных ферментов: цитоплазмы – алкогольдегидрогеназы (Pathuri et al., 2011) и митохондрий – сукцинатдегидрогеназы (Попов и др., 2007).
Общее количество белка определяли методом Лоури с соавт. (Lowry et al., 1951).
Суммарную РНК из растений выделяли фенол-хлороформным методом (Chomczynski, Sacchi, 1987). Обратную транскрипцию мРНК проводили с использованием обратной транскриптазы M-MuLV (“Евроген”, Россия). Подбор праймеров осуществляли на основе нуклеотидных последовательностей из GenBank, с помощью программы Primer-BLAST (табл. 1). Полимеразную цепную реакцию проводили на приборе LightCycler96 (“Roche”, Швеция) с красителем SybrGreen I (“Евроген”, Россия). Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α (Nicot et al., 2005). В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции. Относительный уровень экспрессии исследуемых генов определяли с применением 2–ΔΔCt-метода (Livak, Schmittgen, 2001).
Таблица 1.
Праймеры к генам глутаматдегидрогеназы для проведения ПЦР в реальном времени
| Ген | Праймер | Нуклеотидная последовательность | Температура отжига, °С |
|---|---|---|---|
| gdh-1 | Прямой | CTCCCTGTTGTATCCTCTTGGTC | 58 |
| Обратный | GCCATTGCCATTGCCATTGTT | ||
| gdh-2 | Прямой | TGATCCAGAGGCAGACGAGA | 60 |
| Обратный | GTAATGCGCGGTCAATGGTC |
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. Предварительную оценку характера распределения проводили по асимметрии и эксцессу (Excel, Microsoft Office), а также с помощью критерия Колмогорова-Смирнова. Полученные значения позволили оценить характер распределения как нормальный. Критерий Стьюдента использовали с применением поправки Бонферрони на множественные сравнения (Лакин, 1990). Дополнительно применяли однофакторный дисперсионный анализ ANOVA, который показал, что исследуемый в работе фактор действительно оказывал влияние (влияние фактора достоверно при p < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для определения субклеточной локализации ГДГ в листьях кукурузы было проведено центрифугирование в градиенте плотности сахарозы, которое позволило исследовать четыре фракции: цитоплазму, хлоропласты, митохондрии и пероксисомы. Результаты проведенного исследования представлены в табл. 2.
Таблица 2.
Субклеточная локализация глутаматдегидрогеназной активности в листьях кукурузы (n = 3; p ≤ 0.05)
| Фракция органоидов | Общая активность, Е/грамм сырой массы |
% Aктивности фермента от общего содержания |
|---|---|---|
| Пероксисомы | – | – |
| Цитоплазма | 15.5 | 9.53 |
| Хлоропласты | 6.38 | 3.92 |
| Митохондрии | 140.7 | 86.54 |
Из полученных данных следует, что ГДГ локализована в цитозоле (9.53%), хлоропластах (3.92%) и в большей степени в митохондриях (86.54%), что в целом согласуется с имеющимися литературными данными (Яковлева и др., 1964). В пероксисомальной фракции активности исследуемого фермента обнаружено не было. Как уже упоминалось, согласно данным, полученным Яковлевой с соавт., ГДГ в корнях кукурузы большей частью локализована в митохондриях.
Для определения чистоты полученных фракций был произведен анализ перекрестного загрязнения (табл. 3). Полученные результаты показывают, что степень перекрестного загрязнения для цитоплазматической фракции не превышает 4.5%, для хлоропластной и митохондриальной фракций – 10%, для пероксисомальной фракции – 1%.
Таблица 3.
Активность маркерных ферментов, используемых для определения чистоты фракций (n = 3; p ≤ 0.05)
| Фракция органоидов |
Активность СДГ |
Активность АДГ | Активность каталазы |
Содержание хлорофилла | ||||
|---|---|---|---|---|---|---|---|---|
| Е/мл | % | Е/мл | % | Е/мл | % | мг/мл | % | |
| Цитоплазма | 0.03 | 4.05 | 5.2 | 86.52 | н/о | н/о | 2.08 | 2.49 |
| Хлоропласты | 0.07 | 9.5 | 0.40 | 6.65 | 0.01 | 7.69 | 80.70 | 96.54 |
| Митохондрии | 0.64 | 86.5 | 0.35 | 5.82 | 0.01 | 7.69 | 0.81 | 1.51 |
| Пероксисомы | н/о | н/о | 0.06 | 1 | 0.11 | 84.6 | н/о | н/о |
В связи с тем, что в листьях кукурузы ГДГ в клетке имеет различную локализацию, нами была исследована общая (суммарная) активность данного фермента, являющаяся суммой активностей всех трех субклеточных фракций. Исследование фракции хлоропластов не проводилось, так как в них функционирует глутамин-синтетазный путь (Измайлов, 1986).
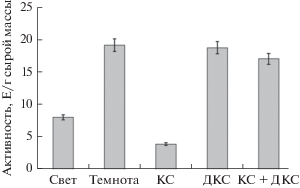
В результате проведенных исследований по влиянию различного светового режима на функционирование ГДГ было установлено, что в листьях кукурузы, находившихся на свету, общая активность ГДГ составила 8.11 Е/г сырой массы, в то время как в темноте наблюдалось ее увеличение в 2.4 раза выше (19.2 Е/г сырой массы) (рис. 1). После облучения растений красным светом с длиной волны 660 нм глутаматдегидрогеназная активность снижалась в несколько раз относительно этого показателя у растений, находящихся в темноте. Однако облучение листьев кукурузы ДКС и КС + ДКС не изменяло работу ферментативной системы – активность ГДГ была близка к значению в варианте “темнота”.
Рис. 1.
Активность глутаматдегидрогеназы из листьев кукурузы в условиях различного светового режима. Свет – растения, освещенные белым светом; темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм; СС – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин. Разными буквами отмечены данные, достоверно различающиеся при p < 0.05.
Для исследования влияния светового режима на активность митохондриальной формы ГДГ было проведено выделение митохондриальной фракции из зеленых листьев кукурузы методом дифференциального центрифугирования.
Расчет степени перекрестного загрязнения осуществлен на основе анализа активности маркерного фермента цитоплазмы – алкогольдегидрогеназы. Установлено, что данная величина в наших исследованиях для фракции митохондрий составляла 10%. Степень перекрестного загрязнения учитывали при анализе результатов по определению скорости функционирования ГДГ.
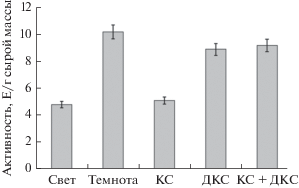
Анализ изменения активности митохондриальной ГДГ в листьях кукурузы в условиях разного освещения продемонстрировал низкие значения общей ферментативной активности в растениях вариантов “свет” и “КС” по сравнению с растениями, находившимися в темноте на протяжении всего времени эксперимента. Активность ГДГ в растениях, экспонировавшихся на свету, составила 4.8 Е/г сырой массы, что почти в два раза ниже, чем данный показатель у растений, находившихся в темноте. При облучении кукурузы красным светом скорость функционирования ГДГ была близкой к таковому показателю у растений варианта “свет”. Однако иная картина характерна для растений вариантов облучения “ДКС” и “КС + ДКС”. У этих опытных образцов активность составила 8.9 и 9.2 Е/г сырой массы соответственно. При этом исследуемая величина вариантов “ДКС” и “КС + ДКС” была в 1.9 раза выше этого показателя в варианте “свет” (рис. 2).
Рис. 2.
Активность глутаматдегидрогеназы в митохондриальной фракции из листьев кукурузы в условиях различного светового режима. Обозначения: см. рис. 1.
Полученные данные свидетельствуют о том, что действующим фактором в передаче сигнала выступает фитохромная система, осуществляющая рецепцию светового сигнала в области длин волн 660 и 730 нм. Угнетение функционирования ГДГ наблюдается в присутствии в клетке активной формы фитохрома, что связано с облучением кукурузы светом с длиной волны 660 нм. Следует отметить, что воздействие на растения дальнего красного света с длиной волны 730 нм приводит к активации глутаматдегидрогеназной активности.
Фитохромы имеют несколько вариантов контроля активности ферментов, как через непосредственное взаимодействие, так и через опосредованное влияние на геном – изменение экспрессии генетического аппарата клетки с участием различных мессенджеров (Феденко и др., 1995; Kreslavski et al., 2012; Eprintsev et al., 2016; Eprintsev et al., 2018).
В связи с этим нами был проведен анализ транскрипционной активности генов gdh-1 и gdh-2 ГДГ в условиях различного светового режима (рис. 3, 4). Установлено, что в растениях, экспонировавшихся на свету, содержание мРНК обоих генов ниже такового показателя в сравнении с растениями варианта “темнота”: концентрация транскриптов гена gdh-1 в растениях в темноте была выше таковых в 3.25 раза относительно варианта “свет”, в то время как значения относительного уровня транскриптов гена gdh-2 в темноте были выше, чем на свету в 1.38 раз. При облучении растений красным светом были получены аналогичные данные. Облучение растений красным светом индуцировало снижение концентрации мРНК гена gdh-1 в 1.77 раза и гена gdh-2 в 1.36 по сравнению с аналогичными показателями у растений, экспонируемых в темноте.
Рис. 3.
Относительный уровень экспрессии гена gdh-1 в листьях кукурузы при разных световых режимах. Обозначения: см. рис. 1.
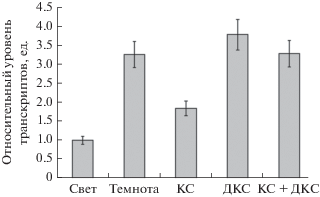
Рис. 4.
Относительный уровень экспрессии гена gdh-2 в листьях кукурузы при разных световых режимах. Обозначения: см. рис. 1.
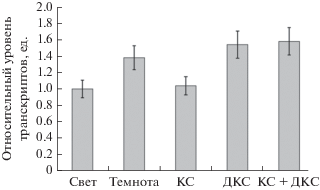
Следует отметить, что значения относительного уровня транскриптов гена gdh-1 в клетках растений после их облучения светом 730 нм и последовательным облучением 660 и 730 нм были в 3.8 и 3.3 раза больше, чем на свету соответственно. Величины транскриптов гена gdh-2 после облучения растений ДКС и последовательном облучении КС и ДКС оставались выше значений, отмеченных для варианта “свет”.
Результаты исследования данного этапа работы свидетельствуют о фитохром-зависимой регуляции экспрессии генов gdh-1 и gdh-2 глутаматдегидрогеназы, которая проявляется при освещении растений КС и ДКС, специфически акцептируемыми фитохромной системой. Активация фитохрома путем облучения растений красным светом индуцировала изменение содержания мРНК, проявляющееся в уменьшении величины анализируемого показателя. Как уже упоминалось, фитохромы имеют несколько вариантов контроля активности ферментов, и одним из них является изменение экспрессии генетического аппарата клетки с участием различных мессенджеров. Известно, что механизм регуляции экспрессии гена sdh 1-2 сукцинатдегидрогеназы при смене светового режима может осуществляться через изменение активности факторов транскрипции вторичными мессенджерами (Са2+, цГМФ) (Епринцев и др., 2016; Eprintsev et al., 2013).
Для определения влияния свободных катионов кальция на передачу светового сигнала применяли комплексон ЭГТА, который, являясь хелатирующим агентом, имеет высокое сродство к кальцию, и рутении красный, блокирующий кальциевые каналы ядерной мембраны.
На рис. 5 представлены результаты исследования ферментативной активности ГДГ в присутствии ЭГТА и рутения красного. Применение данных агентов приводило к связыванию кальция, что сопровождалось снятием ингибирующего эффекта действия красного света. Облучение красным светом не вызывало падения общей ферментативной активности, что полностью коррелировало с результатами, полученными в ходе исследования относительного уровня транскриптов генов gdh-1 и gdh-2. Применение комплексона ЭГТА обеспечивало ингибирующий эффект красного света на транскрипционную активность исследуемых генов (рис. 6, 7). Воздействие дальнего красного, а также сочетанного действия красного и дальнего красного света не вызывало изменения скорости транскрипции исследуемого гена в листьях исследуемых растений относительно темнового варианта. Кроме того, при использовании рутения красного установлено, что инкубация растений кукурузы в темноте приводила к увеличению содержания транскриптов генов ГДГ. В присутствии рутения не происходит изменение скорости функционирования митохондриальной ГДГ в листьях кукурузы при облучении растений красным, дальним красным светом и последовательным действием красным и дальним красным светом, относительно контроля – варианта “темнота”. Следовательно, ингибирование кальциевых каналов не приводит к изменению в работе исследуемого энзима.
Рис. 5.
Активность глутаматдегидрогеназы митохондриальной фракции в листьях кукурузы в условиях различного светового режима в присутствии комплексона ЭГТА (белые столбцы) и ингибитора кальциевых каналов рутения красного (серые столбцы). Обозначения: см. рис. 1.
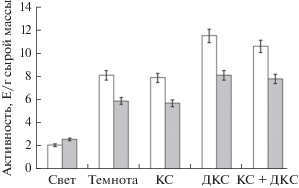
Рис. 6.
Уровень транскриптов гена gdh-1 в листьях кукурузы в присутствии комплексона ЭГТА (белые столбцы) и ингибитора кальциевых каналов рутения красного (серые столбцы). Обозначения: см. рис. 1.
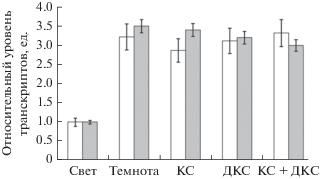
Рис. 7.
Уровень экспрессии гена gdh-2 в листьях кукурузы в присутствии комплексона ЭГТА (белые столбцы) и ингибитора кальциевых каналов рутения красного (серые столбцы). Обозначения: см. рис. 1.
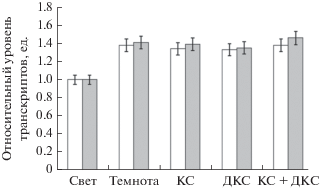
Таким образом, полученные результаты исследования транскрипционной активности генов gdh-1 и gdh-2 в листьях кукурузы в условиях различного светового режима в присутствии ЭГТА и рутения красного, позволили установить роль кальций-зависимой регуляции данных генов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ полученных данных свидетельствует о сложном влиянии светового режима на функционирование ГДГ в листьях кукурузы. Полное освещение и инсоляция красным светом вызывали резкое снижение глутаматдегидрогеназной активности. При облучении листьев дальним красным светом и в темноте происходило увеличение интенсивности работы данной ферментной системы. Ранее были получены данные для ферментов цикла Кребса, свидетельствующие о ингибировании работы аконитатгидратазы, цитратсинтазы и сукцинатдегидрогеназы в листьях растений. Следует отметить, что такой тормозящий эффект был характерен для митохондриальных изоформ этих энзимов. В данной работе было показано, что глутаматдегидрогеназная активность доминирует в митохондриальной фракции клеток листьев кукурузы, и ее общая активность в этом органоиде составляет 86.5%. Известно, что АТФ в высоких концентрациях является ингибитором работы ГДГ (в сторону образования 2-оксоглутарата) и дыхательного метаболизма митохондрии (Mastorodemos et al., 2005). Подобный эффект тормозящего действия света на активность ферментов связывается с трансформацией клеточного метаболизма, обусловленного индукцией фотосинтетического образования АТФ, т.е. на свету роль цикла Кребса в биоэнергетике клетки резко снижается (Eprintsev et al., 2016). Интересно отметить, что ГДГ активирует свою деятельность в темноте и при облучении дальним красным светом, что обусловлено интенсификацией функционирования цикла трикарбоновых кислот. В некоторых работах отмечается, что в листьях в темновых условиях ГДГ катализирует в большей степени реакцию аминирования (Turano et al., 1997; Fontaine et al., 2012, 2013). Важным вопросом интерпретации полученных данных является механизм трансдукции фитохромного сигнала в растительной клетке. Полученные результаты с использованием специфических ингибиторов катионов кальция ЭГТА и рутения красного подтвердили, что изменение в концентрации кальция служит переносчиком сигнала (Eprintsev et al., 2013).
Содержание Са2+ в ядрах листьев на свету значительно ниже, чем в темноте. В отсутствии света в клетках функционирует окислительный метаболизм, обеспечивающий энергией клетку. Это способствует активации митохондриального метаболизма, в том числе и цикла трикарбоновых кислот.
Увеличение транскрипционной активности гена gdh-1 в темноте значительно выше, чем гена gdh-2. Как известно, ген gdh-1 кодирует β-субъединицу ГДГ (Marchi et al., 2014). По имеющимся данным, преобладание в структуре фермента β‑субъединиц приводит к смещению равновесия в работе фермента в сторону реакции аминирования 2-оксоглутарата – образования 2ОГ. Вероятно, существенное увеличение транскрипционной активности гена gdh-1 в темноте связано с поставкой глутамата для синтеза аминокислот. Возрастание уровня транкриптов генов глутаматдегидрогеназы может свидетельствовать об увеличении доли этого фермента в анализируемых условиях, необходимой для поддержания нормального метаболизма митохондрий в темноте (при отсутствии фотосинтеза).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 20-04-00296).
Список литературы
Гарник Е.Ю., Бельков В.И., Тарасенко В.И., Потапова Т.В., Корзун М.А., Константинов Ю.М. Экспрессия гена глутаматдегидрогеназы gdh-2 арабидопсиса индуцируется под влиянием ингибитора синтеза тетрапирролов норфлуразона // Журн. стресс-физиологии и биохимии. 2013. № 4. С. 299–309.
Геннис Р. Биомембраны: Молекулярная структура и функции: Пер. с англ. М.: Мир, 1997. 624 с.
Епринцев А.Т., Селиванова Н.В., Федорин Д.Н., Башкин С.С., Селезнева Е.А., Дадакина И.В., Махмуд Али С. Роль катионов кальция в механизме фитохром-зависимой регуляции экспрессии гена sdh1-2 и активности сукцинатдегидрогеназы в листьях кукурузы // Биол. мембраны. 2012. Т. 29. № 3. С. 165–168.
Измайлов С.Ф. Азотный обмен в растениях. М.: Наука, 1986. 320 с.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. 351 с.
Попов В.Н., Федорин Д.Н., Епринцев А.Т. Световая регуляция экспрессии сукцинатдегидрогеназы в листьях Arabidopsis thaliana // Физиология растений. 2007. Т. 54. № 3. С. 40–415.
Феденко Е.П., Касумов К.К., Лапко В.Н. Система цАМФ как посредник фитохрома в действии света // Физиология и биохимия культурных растений. 1995. Т. 27. № 1–2. С. 3–11.
Яковлева В.И., Кретович В.Л., Гильманов М.К. О локализации глутаматдегидрогеназы в корнях кукурузы // Биохимия. 1964. Т. 29. № 3. С. 463–469.
Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156–159.
Engel P.C. Glutamate Dehydrogenases: the why and how of coenzyme specificity // Neurochem. Res. 2014. V. 39. P. 426–432.
Eprintsev A.T., Fedorin D.N., Sazonova O.V., Igamberdiev A.U. Light inhibition of fumarase in Arabidopsis leaves is phytochrome A-dependent and mediated by calcium // Plant Physiol Biochem. 2016. V. 102. P. 161–166.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Regulation of expression of the mitochondrial and peroxisomal forms of citrate synthase in maize during germination and in response to light // Plant Sci. 2018 V. 272. P. 157–163.
Eprintsev A.T., Fedorin D.N., Igamberdiev A.U. Ca2+ is involved in phytochrome A-dependent regulation of the succinate dehydrogenase gene sdh1-2 in Arabidopsis // J. Plant Physiol. 2013. V. 170. P. 1349–1352.
Fontaine J.X., Saladino F., Agrimonti C., Bedu M., Terce-Laforgue T., Tetu T., Hirel B., Restivo F.M., Dubois F. Control of the synthesis and subcellular targeting of the two GDH genes products in leaves and stems of Nicotiana plumbaginifolia and Arabidopsis thaliana // Plant Cell Physiol. 2006. V. 47. P. 410–418.
Fontaine J.X., Terce-Laforgue T., Bouton S., Pageau K., Lea P.J., Dubois F., Hirel B. Further insights into the isoenzyme composition and activity of glutamate dehydrogenase in Arabidopsis thaliana // Plant Signal. Behav. 2013. V. 8. P. 1–5.
Fontaine J.X., Tercé-Laforgue T., Armengaud P., Clément G., Renou J.-P., Pelletier S., Dubois F. Characterization of a NADH-dependent glutamate dehydrogenase mutant of Arabidopsis demonstrates the key role of this enzyme in root carbon and nitrogen metabolism // Plant Cell. 2012. V. 24. P. 4044–4065.
Kreslavski V.D., Fomina I.R., Los D.A., Carpentier R., Kuznetsov V.V., Allakhverdiev S.I. Red and near infra-red signaling: hypothesis and perspectives // J. Photochem. Photobiol. C: Photochem. Reviews. 2012. V. 13. P. 190–203.
Labuz J., Samardakiewicz S., Hermanowicz P., Wyroba E., Pilarska M., Gabrys H. Blue light-dependent changes in loosely bound calciumin Arabidopsis mesophyll cells: an X-ray microanalysis study // J. Exp. Bot. 2016. V. 67. P. 3953–3964.
Lehmann T., Ratajczak L. The pivotal role of glutamate dehydrogenase (GDH) in the mobilization of N and C from storage material to asparagine in germinating seeds of yellow lupine // J. Plant. Physiol. 2008. V. 165. P. 149–58.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method // Methods. 2001. V. 25. P. 402–408.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265–275.
Marchi L., Polverini E., Degola F., Baruffini E., Restivo F.M. lutamate dehydrogenase isoenzyme 3 (GDH3) of Arabidopsis thaliana is less thermostable than GDH1 and GDH2 isoenzymes // Plant Physiol Biochem. 2014. V. 83. P. 225–231.
Mastorodemos V., Zaganas I., Spanaki C., Bessa M., Plaitakis A. Molecular basis of human glutamate dehydrogenase regulation under changing energy demands // J. Neurosci. Res. 2005. V. 79. P. 65–73.
Miyashita Y., Good A. NAD(H)-dependent glutamate dehydrogenase is essential for the survival of Arabidopsis thaliana during dark-induced carbon starvation // J. Exp. Bot. 2008. V. 59. P. 667–680.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907–2914.
Pathuri I.P., Ines E. Reitberger, Ralph Hückelhoven, Reinhard K. Proels. Alcohol dehydrogenase 1 of barley modulates susceptibility to the parasitic fungus Blumeria graminis f. sp. hordei // J. Exp. Bot. 2011. V. 10. P. 3449–3457.
Petrillo E., Godoy Herz M.A., Barta A., Kalyna M., Kornblihtt A.R. Let there be light: regulation of gene expression in plants // RNA Biol. 2014. V. 11. P. 1215–1220.
Sakakibara H., Fujii K., Sugiyama T. Isolation and characterization of a cDNA that encodes maize glutamate dehydrogenase // Plant Cell Physiol. 1995. V. 36. P. 789–797.
Sarasketa A., Gonzalez-Moro M.B., Gonzalez-Murua C., Marino D. Nitrogen source and external medium pH interaction differentially affects root and shoot metabolism in Arabidopsis // Front. Plant Sci. 2016. V. 7. P. 1–12.
Turano F., Thakkar S., Fang T. Characterization and expression of NAD(H)-dependent glutamate dehydrogenase genes in Arabidopsis // Plant Physiology. 1997. V. 113. P. 1329–1341.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


