Известия РАН. Серия биологическая, 2022, № 1, стр. 102-107
Окислительные процессы и содержание иммунных комплексов в иммунокомпетентных органах гольцов бассейна Кроноцкого озера
И. И. Гордеев 1, 2, Д. В. Микряков 3, *, Н. И. Силкина 3, В. Р. Микряков 3, О. Ю. Бусарова 4
1 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 ФГБУН Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Борок, Ярославская область, Россия
4 Дальневосточный государственный технический
рыбохозяйственный университет (Владивосток)
Владивосток, Россия
* E-mail: daniil@ibiw.ru
Поступила в редакцию 28.10.2020
После доработки 27.01.2021
Принята к публикации 27.01.2021
- EDN: XZBPBB
- DOI: 10.31857/S1026347022010073
Аннотация
Исследован уровень содержания неспецифических иммунных комплексов, продуктов перекисного окисления липидов и антиокислительной активности в печени, почке и селезенке у носатого, белого, длинноголового, большеротого и малоротого гольцов из оз. Кроноцкое (п-ов Камчатка). Установлены межтканевые и межвидовые отличия исследуемых параметров. У разных гольцов значения показателей в каждом органе отличались, что предположительно связано с видовыми особенностями, образом жизни и структурно-функциональной организацией исследуемых тканей и органов. Полученные результаты могут быть использованы для мониторинга состояния здоровья популяции и сравнения с близкородственными видами.
Кроноцкое озеро расположено в юго-восточной части п-ова Камчатка на территории Кроноцкого государственного природного биосферного заповедника. Площадь водоема – 246 км2, максимальная (средняя) глубина – 136 (58) м, притоки представлены двумя крупными разветвленными реками и рядом ручьев короче 10 км (Аракельянц, Ткаченко, 2012). Из озера вытекает одноименная река длиной 40 км, впадающая в Тихий океан. В силу большого падения высоты по руслу р. Кроноцкое, экосистема озера оказалась изолирована от заходов проходных рыб. Сложившиеся условия и заповедный статус территории делают озеро Кроноцкое уникальным местом для изучения эволюции изолированных популяций.
В настоящее время в бассейне озера симпатрично обитают полиморфная жилая нерка–кокани Oncorhynchus nerka (Walbaum, 1792) и не менее шести репродуктивно изолированных форм (видов) гольцов (Маркевич, Есин, 2018; Esin et al., 2020), которые в процессе эволюции освоили разнообразные пищевые ниши и выработали различные адаптации, необходимые для эффективного потребления ресурсов. Длинноголовый, белый и носатые гольцы ведут мигрантный образ жизни: нерест происходит в притоках озера, а нагул – в самом озере. Длинноголовый голец Salvelinus kronocius (Viktorovsky, 1978) – хищник, населяет обширные открытые пространства озера; его основной объект питания – кокани. Белый голец Salvelinus albus (Glubokovsky, 1977) питается беспозвоночными в молодости, переходя на рыбную пищу по мере взросления. Носатый голец Salvelinus schmidti (Viktorovsky, 1978) населяет мелководные прибрежные участки, питается рачками-бокоплавами или личинками насекомых. Помимо форм с мигрантной жизненной стратегией в озере обитают две осёдлые формы: малоротые и глубоководные большеротые гольцы (Маркевич и др., 2017; Esin et al., 2020). Большеротые гольцы – специализированные бентофаги, а малоротые имеют широкую пищевую нишу. Все формы (виды) гольцов бассейна оз. Кроноцкое отличаются друг от друга морфологически, возрастной структурой, темпами роста, типом питания, а также степенью зараженности паразитами (Викторовский, 1978; Буторина и др., 2008; Павлов и др., 2013; Бусарова и др., 2016; Маркевич, Есин, 2018; Esin et al., 2020).
То, что в одном водоеме обитают несколько близкородственных форм (видов) (Senchukova et al., 2013), делает возможным проведение сравнительного анализа их иммунофизиологических показателей, различия в которых отражают как физиологическое состояние рыб, так и степень диссоциации этих форм (видов) в процессе симатрического видообразования. Ранее нами были установлены различия длинноголового, белого и носатых гольцов по содержанию иммунных комплексов, продуктов перекисного окисления липидов и антиокислительной активности в сыворотке крови и органах (Гордеев и др., 2017). На основе полученных данных было высказано предположение о зависимости физиологических показателей гольцов от образа жизни, типа питания и зараженности паразитами. В настоящей работе было продолжено исследование и проведен сравнительный анализ уровня окислительных процессов и иммунных комплексов в иммунокомпетентных органах у длинноголового, белого, носатого (морфотип N1g по Esin et al. (2020)), большеротого и малоротого гольцов, обитающих в оз. Кроноцкое.
МАТЕРИАЛЫ И МЕТОДЫ
Половозрелых рыб отлавливали с помощью жаберных сетей по всей акватории озера в июне – августе 2013 г. Исследовали 16 особей носатого (средняя масса 383 ± 39 г, средняя длина 300 ± 17 мм), 28 – белого (410 ± 84 г, 311 ± 25 мм), 5 – длинноголового (875 ± 139 г, 425 ± 54 мм), 15 – большеротого (139 ± 12 г, 254 ± 11 мм) и 9 – малоротого (57 ± 6 г, 182 ± 5 мм) гольцов. У отловленных рыб после вскрытия в стерильные пробирки отбирали образцы иммунокомпетентных органов (почка, селезенка и печень). Затем пробы замораживали в жидком азоте. В лабораторных условиях непосредственно перед анализом пробы размораживали при комнатной температуре. Для дальнейших исследований из тканей почки, селезенки и печени с помощью гомогенизатора готовили гомогенат с физиологическим раствором в соотношении 1 : 1.
В гомогенатах исследовали содержание неспецифических иммунных комплексов (ИК), продуктов перекисного окисления липидов (ПОЛ) и уровень антиокислительной защиты (АЗ). Выбор данных показателей обусловлен тем, что они отражают реакцию рыб на заражение паразитами, антропогенное загрязнение и изменение качества среды обитания (Микряков и др., 2001; Силкина, Микряков, 2005; Силкина и др., 2012).
Содержание ИК устанавливали спектрофотометрически при длине волны 450 нм методом селективной преципитации с 4%-ным полиэтиленгликолем мол. массой 6000 (Гриневич, Алферов, 1981).
Интенсивности ПОЛ определяли по накоплению малонового диальдегида (МДА) – одного из конечных продуктов перекисного окисления. Концентрацию МДА устанавливали по количеству продуктов ПОЛ, реагирующих с тиобарбитуровой кислотой и дающих с ней окрашенный комплекс. Интенсивность окрашивания оценивали спектрофотометрически по изменению максимума поглощения при 532 нм (Андреева и др., 1988). Содержание МДА вычисляли с учетом коэффициента молярной экстинкции: 1.56 × 105/(М см) и выражали в наномолях на 1 г ткани.
Об общей антиокислительной активности судили по кинетике окисления субстрата восстановленной формы 2,6-дихлорфенолиндофенола кислородом воздуха по общепринятой методике (Семенов, Ярош, 1985). Сущность метода заключается в том, что, чем выше скорость окисления субстрата в присутствии биологического материала, тем ниже содержание антиоксидантов в тканях. Константу ингибирования окисления субстрата (КОС), являющуюся показателем антиокислительной активности ткани, определяли относительно контроля по формуле: Ki = Kкон – Kоп/С, где Kкон и Kоп – константы скорости окисления субстрата соответственно в контроле и в опыте; С – концентрация биологического материала в кювете.
Статистическую обработку результатов исследования проводили по стандартным алгоритмам, реализованным в пакете программ Statistica v.6.0, с использованием t-теста. Различия считали значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительный анализ содержания ИК, МДА и КОС в печени, почке и селезенке гольцов, обитающих в оз. Кроноцкое, выявил межтканевые и межвидовые различия данных показателей.
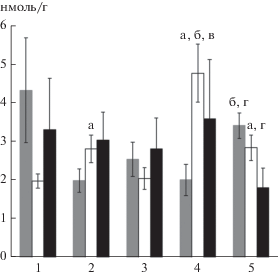
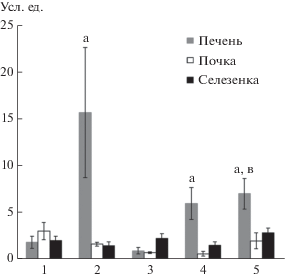
Анализ полученных данных показал различия содержание ИК в разных органах у исследуемых видов гольцов (рис. 1). Высокое содержание ИК обнаружено в печени носатого (15.65 ± 6.93 ус. ед.), большеротого (5.95 ± 1.71 ус. ед.) и малоротого гольца (6.98 ± 1.63 ус. ед.), а низкое – в почке большеротого (0.58 ± 0.24 ус. ед.), печени (0.9 ± ± 0.34 ус. ед.) и почке (0.7 ± 0.1 ус. ед.) длинноголового гольца. В органах белого гольца зафиксированы незначительные отличия уровня ИК. У 3-х видов гольцов наибольшее содержание ИК обнаружено в печени, у белого – в почке (3.0 ± 0.9 ус. ед.) и длинноголового – в селезенке (2.21 ± 0.52 ус. ед.). ИК – комплексы антиген-антитело и связанные с ними компоненты комплемента, образующиеся в результате взаимодействия с низкомолекулярными чужеродными соединениями (гаптенами, растворимыми антигенами и аутоантигенами). Они играют важную роль в процессах регуляции иммунных реакций, элиминации ксенобиотиков из организма и поддержании иммунологического и биохимического гомеостаза. Клетки крови с помощью компонентов комплемента связывают растворимые ИК и доставляют к макрофагам иммунокомпетентных органов, тем самым обеспечивая клиренс крови от ИК. Нарушение этого механизма наблюдается при инфекционных, инвазионных, токсических и аутоиммунных болезнях. Избыток ИК подавляет функциональное состояние иммунной системы и может приводить к развитию патологии (Ройт и др., 2000). Содержание ИК наиболее повышено у носатого гольца, особенно по сравнению с белым и длинноголовым, что соответствует данным предыдущего исследования (Гордеев и др., 2017). Однако на этот раз высокий показатель зафиксирован только в печени, тогда как ранее – во всех органах. У впервые исследованных форм (видов), большеротого и малоротого гольцов, уровень ИК, также выше, чем у белого и длинноголового.
Рис. 1.
Содержание ИК в печени, почке и селезенке гольцов Salvelinus sp. Кроноцкого озера. Примечание. Здесь и на рис. 2 и 3: 1 – белый, 2 – носатый, 3 – длинноголовый, 4 – большеротый, 5 – малоротый голец; а – значимые различия от белых гольцов; б – значимые различия от носатых гольцов; в – значимые различия от длинноголовых гольцов; г – значимые различия от большеротых гольцов при p ≤ 0.05.
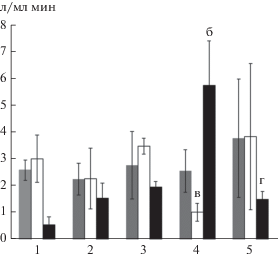
Одним из чувствительных индикаторов, отражающим влияние неблагоприятных стресс-факторов на метаболические процессы и состояние здоровья рыб, которое выражается в нарушении баланса окислительно-восстановительных процессов, является изменение соотношения уровня ПОЛ и активности АЗ тканей. МДА – один из конечных продуктов перекисного окисления липидов (ПОЛ). Образование МДА происходит в результате свободно-радикального окисления полиненасыщенных жирных кислот фосфолипидов клеточных мембран активными формами кислорода (АФК) – супероксидный и гидроксильный радикалы, синглетный кислород, пероксиды и многие другие соединения. Избыточное накопление АФК становиться причиной разрушения сульфгидрильных антиоксидантов, модификации липидного слоя клеточных мембран, что негативно влияет на жизнедеятельность клеток, темп роста, развития целостного организма (Журавлев, Пантюшенко, 1989; Владимиров и др., 1991; Барабой и др., 1992; Fiho, 1996; Кольтовер, 2000; Зенков и др., 2001; Меньшикова и др., 2008; Winston, 1991).
Максимальные значения МДА отмечены в почке (5.95 ± 1.71 нмоль/г) и селезенке большеротого (5.75 ± 1.65 нмоль/г) и печени (4.32 ± 1.35 нмоль/г) белого гольца (рис. 2). Минимальные значения зафиксированы в почке белого (1.98 ± 0.18 нмоль/г) и длинноголового (2.05 ± 0.28 нмоль/г), печени носатого (1.99 ± 0.33 нмоль/г) и большеротого (2.01 ± 0.4 нмоль/г) и селезенке малоротого (1.81 ± ± 0.51 нмоль/г) гольца. Сравнение содержания МДА у разных форм показало, что большие отклонения выявлены в почке и печени, а небольшие – в селезенке. Ранее значительное изменение показателя уровня ПОЛ у исследуемых форм (видов) было зафиксировано в почке, а в других тканях и органах – незначительное (Гордеев и др., 2017). На наш взгляд, полученные результаты указывают на наличие зависимости между окислительными процессами и особенностями структурно-функциональной организации исследуемых органов, а также содержанию гранулоцитов, наиболее интенсивно образующих АФК. Например, в почке, богатой гранулоцитами, процессы ПОЛ происходят более интенсивно, чем в печени и селезенке с низкой долей содержания этих клеток (Zapata et al., 1996; Van Muiswinkel, Van der Wal, 2006; Грушко и др., 2009).
Следует отметить, что в стационарных условиях во всех клетках живого организма в небольших количествах постоянно образуются АФК. Они участвуют в процессах клеточного метаболизма и их негативное влияние на клетки и ткани нейтрализуется системой АЗ (антиоксидантными ферментами: супероксиддисмутазой, каталазой, глутатионпероксидазой, глутатион-s-трансферазой) и низкомолекулярными антиоксидантными соединениями (б-токоферолом, восстановленным глутатионом, фенольной формой коэнзима Q10, в-каротином, аскорбиновой кислотой и др.). В отличии от МДА наибольшее колебание показателя КОС, фиксирующего уровень АЗ, отмечены в селезенке (рис. 3). В этом органе минимальные значения КОС характерны для белого гольца (0.57 ± 0.29 л/мл ⋅ мин), а максимальные – для большеротого (5.75 ± 1.65 л/мл ⋅ мин). Низкие значения КОС в исследуемых органах указывают на высокую активность АЗ.
Проведенное исследование показало высокий уровень межтканевых различий липидопереокислительных и антиокислительных процессов, происходящих в организме гольцов оз. Кроноцкое. Установленные различия показателей МДА и КОС, отражающие изменение окислительно-восстановительного баланса, видимо, обусловлены разным уровнем содержания антиоксидантных ферментов и низкомолекулярных соединений, обеспечивающих динамическое равновесие в прооксидант-антиоксидантной системе.
Нарушение баланса в системе “прооксидант–антиоксидант” в сторону активации перекисеобразовательных процессов установлено у зараженных паразитами рыб (Силкина, Микряков, 2005; Силкина и др., 2012). Интенсивность уровня заражения также зависит от функционального состояния иммунной системы (Микряков и др., 2011; Микряков, Микряков, 2015). У носатого гольца отмечены пиковые значения ИК в печени. Возможно, это связано с высокой инвазией нематоды Cystidicola farionis, паразитирующей в плавательном пузыре, индекс обилия которой составляет 169 экз/рыбу, а также гиперинвазией трематодами рода Crepidostomum (индекс обилия = 3461.3) (Бусарова и др., 2016). Патогенность C. farionis проявляется в изменении функций плавательного пузыря (Willers et al., 1991; Faisal et al., 2010), что может приводить к элиминации слабых рыб (Giaever et al., 1991). Показатели ИК, МДА и КОС у других форм гольцов не позволяют однозначно соотнести их с показателями зараженности паразитами.
Таким образом, полученные нами различия в уровнях исследуемых показателей в печени, почке и селезенке у носатого, белого, длинноголового, большеротого и малоротого гольцов из оз. Кроноцкое, по-видимому, связаны с видовыми и экологическими особенностями рыб, такими как образ жизни, тип питания, локальный уровень зараженности паразитами и т.д. Дальнейшие исследования c большей выборкой помогут понять уровень физиологических различий между формами, а также могут быть использованы для мониторинга состояния здоровья популяции и сравнения с близкородственными видами.
Благодарности. Авторы выражают благодарность Е.В. Есину (ИПЭЭ РАН, ФГБНУ “ВНИРО”) за помощь в подготовке рукописи и ценные замечания.
Финансирование. Работа выполнена в рамках государственного задания № 121050500046-8.
Список литературы
Андреева Л.И., Кожемякин Л.А., Кишкун А.А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой // Лаб. дело. 1988. № 11. С. 41–43.
Аракельянц А.Д., Ткаченко О.В. Гидрологические характеристики Кроноцкого озера в начале XXI века // Вестник МГУ. 2012. Сер. 5. География. № 6. С. 77–83.
Барабой В.А., Брехман И.И., Голотин В.Г., Кудряшов Ю.Б. Перекисное окисление и стресс. СПб.: Наука, 1992. 148 с.
Бусарова О.Ю., Кнудсен Р., Маркевич Г.Н. Паразитофауна гольцов (Salvelinus) озера Кроноцкое, Камчатка // Паразитология. 2016. Т. 50. № 6. С. 409–425.
Буторина Т.Е., Шедько М.Б., Горовая О.Ю. Особенности экологии гольцов рода Salvelinus (Salmonidae) бассейна озера Кроноцкое (Камчатка) по паразитологическим данным // Вопр. ихтиологии. 2008. Т. 48. № 5. С. 652–667.
Викторовский P.M. Механизмы видообразования у гольцов Кроноцкого озера. М., 1978. 106 с.
Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Сер. Биофизика. 1991. Т. 29. С. 1–249.
Гордеев И.И., Микряков Д.В., Силкина Н.И., Микряков В.Р., Бусарова О.Ю. Содержание иммунных комплексов и уровень окислительных процессов в крови и органах гольцов оз. Кроноцкое (п-ов Камчатка) // Arctic Envir. Res. 2017. Т. 17. № 3. С. 204–211.
Гриневич Ю.А., Алферов А.Н. Определение иммунных комплексов в крови онкологических больных // Лаб. дело. 1981. № 8. С. 493–496.
Грушко М.П., Ложниченко О.В., Федорова Н.Н. Гемопоэз у осетровых рыб. Астрахань, 2009. 190 с.
Журавлев А.И., Пантюшенко В.Т. Свободнорадикальная биология. М.: Моск. Вет. Акад, 1989. 60 с.
Зенков Н.К., Лапкин В.З., Меньщикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М.: МАИК “Наука/Интерпериодика”, 2001. 343 с.
Кольтовер В.К. Свободнорадикальная теория старения: исторический очерк // Успехи геронтол. 2000. № 4. С. 33–40.
Маркевич Г.Н., Есин Е.В. Речные дериваты эндемичных форм гольца Salvelinus malma (Salmonidae) оз. Кроноцкое (Россия, Камчатка) // Nature Cons. Res. Заповедная наука. 2018. Т. 3. № 3. С. 61–69.
Маркевич Г.Н., Есин Е.В., Салтыкова Е.А., Бусарова О.Ю., Анисимова Л.А., Кузищин К.В. Новые эндемичные формы глубоководных гольцов рода Salvelinus (Salmoniformes: Salmonidae) озера Кроноцкое (Камчатка) // Биология моря. 2017. Т. 43. № 3. С. 188–194.
Меньшикова Е.Б., Зенков Н.К., Лапкин В.З. и др. Окислительный стресс: патологические состояния и заболевания. Новосибирск: АРТА, 2008. 284 с.
Микряков В.Р., Балабанова Л.В., Заботкина Е.А., Лапирова Т.Б., Попов А.В., Силкина Н.И. Реакция иммунной системы рыб на загрязнение воды токсикантами и закисление среды. М., 2001. 126 с.
Микряков В.Р., Микряков Д.В. Иммунологическая индикация здоровья рыб // Вопросы ихтиологии. 2015. Т. 55. № 1. С. 119–123.
Микряков В.Р., Степанова М.А., Микряков Д.В. Зависимость интенсивности заражения синца Abramis ballerus дактилогиридами (Dactylogyrus chranilowi, Byohowscky, 1931) от уровня антимикробных свойств сыворотки крови хозяина // Паразитология. 2011. № 45(1). С. 50–53.
Павлов С.Д., Кузищин К.В., Груздева М.А. и др. Фенетическое разнообразие и пространственная структура гольцов (Salvelinus) озерно-речной системы Кроноцкая (Восточная Камчатка) // Вопр. ихтиологии. 2013. Т. 53. № 6. С. 645–670.
Ройт А., Бростофф Дж., Мейл Д. Иммунология. М., 2000. 592 с.
Семенов В.Л., Ярош А.М. Метод определения антиокислительной активности биологического материала // Укр. биохим. журн. 1985. Т. 57. № 3. С. 50–52.
Силкина Н.И., Микряков В.Р. Особенности показателей перекисного окисления липидов у Ligula intestinalis (Cestoda: Pseudophyllidea) и их хозяев – Abramis brama (L.) // Паразитология. 2005. Т. 39. Вып. 2. С. 117–123.
Силкина Н.И., Микряков В.Р., Микряков Д.В. Характер изменения некоторых иммунофизиологических показателей зараженных плероцеркоидами Ligula intestinalis лещей Abramis brama на разных стадиях развития паразита // Изв. РАН. Сер. биологическая. 2012. № 5. С. 567–571.
Esin E.V., Bocharova E.S., Borisova E.A., Markevich G.N. Interaction among morphological, trophic and genetic groups in the rapidly radiating Salvelinus fishes from Lake Kronotskoe // Evolutionary Ecology. 2020. https://doi.org/10.1007/s10682-020-10048-y
Faisal M., Fayed W., Brenden T., Noor A., Ebener M., Wright G., Jones M. Widespread infection of lake whitefish Coregonus clupeaformiswith the swimbladder nematode Cystidicola farionis in northern lakes Michigan and Huron // J. Great Lakes Res. 2010. V. 36. P. 121–134.
Fiho W.D. Fish antioxidant defences – A comparative approach // Braz. J. Med. and Biol. Res. 1996. V. 29. № 12. P. 1735–1742.
Giaever A., Klemetsen A., Halvorsen O. Infection of Cystidicola farionis fisher (Nematoda: Spiruroidea) in the swim bladder of Arctic charr, Salvelinus alpinus (L.), from Takvatn, north Norway // Nord. J. Freshwater Res. 1991. V. 66. P. 63–71.
Muiswinkel W.B. van, Vervoorn-Van Der Wal B. The Immune System of Fish // Fish Diseases and Disorders. Vol. 1. Protozoan and Metazoan Infections / Ed. by P.T.K. Woo. Canada: University of Guelph, 2006. P. 678–701.
Senchukova A.L., Mugue, N.S., Pavlov, S.D., Mel’nikova, M.N. On the origin of charrs of the genus Salvelinus of the Kronotskoe Lake and their relationships with other charr populations of the Kamchatka peninsula // J. ichthyology. 2013. V. 53(10). P. 840–848.
Winston G.W. Oxidants and antioxidants in aquatic animals // Compar. Biochem. Physiol. 1991. V. 100. № 1–2. P. 173–176.
Willers W.B., Dubielzig R.R., Miller L. Histopathology of the swimbladder of the cisco due to the presence of the nematode Cystidicola farionis fisher // J. Aqua. Anim. Health. 1991. V. 3. P. 130–133.
Zapata A.G., Chiba A., Varas A. Cells and Tissues of the Immune System of Fish // The Fish Immune System. Pathogen and Environment / Ed by G. Iwama, T. Nakanishi. London: Academic Press, 1996. P. 1–62.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая