Известия РАН. Серия биологическая, 2022, № 2, стр. 199-207
Анализ актинобиоты ризосферы табака с гетерологичным геном холиноксидазы из Arthrobacter globiformis
И. Г. Широких 1, 2, *, Я. И. Назарова 1, Г. Н. Ралдугина 3, А. А. Гулевич 4, Е. Н. Баранова 4
1 ФАНЦ Северо-Востока им. Н.В. Рудницкого
610007 Киров, ул. Ленина, 166а, Россия
2 Вятский государственный университет
610000 Киров, ул. Московская, 36, Россия
3 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
4 ВНИИ сельскохозяйственной биотехнологии
127550 Москва, ул. Тимирязевская, 42, Россия
* E-mail: irgenal@mail.ru
Поступила в редакцию 08.04.2020
После доработки 26.11.2020
Принята к публикации 27.11.2020
- EDN: PBHEGC
- DOI: 10.31857/S1026347022010139
Аннотация
Путем агробактериальной трансформации получены растения табака (Nicotiana tabacum) сорта Samsun с геном холиноксидазы (cod A), отвечающим за синтез глицинбетаина. Для оценки возможных воздействий трансформантов на почвенную микробную систему изучали их ризосферные комплексы, используя актиномицеты в качестве биоиндикационной группы микроорганизмов. Сравнивали численность, таксономический состав, функциональную структуру ризосферных комплексов исходного сорта и трансгенных линий СоdА7 и СоdА17, с различной экспрессией гена codA. Существенной разницы в таксономической структуре, встречаемости антагонистов фитопатогенных грибов и целлюлозолитиков в ризосфере исходных растений и растений-трансформантов не выявлено. Актиномицетные комплексы трансформантов характеризовались варьированием, сопоставимым по величине с варьированием, вызванным стрессовым воздействием почвенного фона.
Применение генно-инженерных технологий для повышения устойчивости сельскохозяйственных культур к абиотическим стрессам рассматривают в настоящее время как действенную стратегию решения проблем продовольственной безопасности (Brookes, Barfoot, 2017). Актуализация генно-инженерных технологий выдвигает задачу оценки их экологических последствий для окружающей среды, включая влияние на микробные сообщества почвы (Ladics et al., 2015). Кроме того, трансгенные растения широко используются в качестве экспериментальных моделей, позволяющих оценивать влияние отдельных генов, а также исследовать функции сетей взаимодействующих генов, контролирующих формирование морфологических, биохимических и физиологических признаков в процессе развития растения и при воздействии внешних факторов различной природы (Кочетов, Шумный, 2016).
Интродукция гетерологичного гена может повлечь изменения в характере микробно-растительных взаимодействий и вызвать перестройки в структуре комплексов ризосферной биоты. Большинство исследований, посвященных этому вопросу, выполнено на RR-растениях, несущих ген енолпирувилшикимат-3-фосфат-синтетазы (EPSP-синтетазы) из Agrobacterium sp. CP4, который придает устойчивость к гербициду раундап (Meriles et al., 2006; Zablotowicz, Reddy, 2007; Kremer, Means, 2009), и Bt-растениях, устойчивых к насекомым-вредителям благодаря гену дельта-эндотоксина Bacillus thuringiensis (Zhang et al., 2014; Singh, Dubey, 2016; Li et al., 2019). Авторы отмечают сильное варьирование наблюдаемых эффектов в зависимости от конкретного вида, техники трансформации, встраиваемой генетической конструкции, а также от экологических условий выращивания растений. Неизвестным остается, существуют ли специфические ответы со стороны микроорганизмов на различные категории, разработанных на сегодняшний день трансгенных растений, с учетом конкретной технологии и используемой генетической конструкции (Turrini et al., 2015).
Особое место среди существующего разнообразия подходов к управлению молекулярно-генетическими механизмами адаптации растений занимает генная инженерия осмолитов, ориентированная на создание устойчивых форм путем интродукции генов, связанных с ответами на осмотический стресс, который сопровождает многие виды негативных воздействий окружающей среды – высокую соленость, холод и засуху. К числу эффективных осмопротекторов относят глицинбетаин (ГБ), источником которого служит холин. Рядом авторов было показано, что бактериальный ген холиноксидазы codA может обеспечивать в ответ на стресс накопление ГБ в растениях, повышая тем самым их адаптивность к различным абиотическим стрессам (Prasad et al., 2000; Sakamoto, Murata, 2000; Agarwal, Jha, 2010; You et al., 2019). При трансформации геном codA древесных видов Eucalyptus globulus и E. camaldulensis группой японских исследователей отмечено отсутствие существенной разницы между трансформированными и нетрансформированными растениями по количеству колониеобразующих единиц (КОЕ) актиномицетов и других бактерий в прикорневой зоне почвы (Oguchi et al., 2014; Tran et al., 2018). Однако эти данные, как и значительная часть работ, выполненных с использованием генно-молекулярных методов, не позволяют судить о физиологических особенностях и экологических функциях почвенных микроорганизмов. В связи с этим сохранили свою значимость традиционные методы посева с последующим выделением микроорганизмов в чистые культуры, способные дать информацию об изменениях функциональной структуры модельных микробных комплексов. Кроме того, сам по себе вклад отдельного гена в перестройку ризосферного сообщества трансгенного растения должен быть сопоставлен с влиянием иных факторов, например, влиянием эдафических условий.
Цель работы − сравнительный анализ комплексов актиномицетов ризосферы Nicotiana tabacum сорт Samsun и трансгенных по гену холиноксидазы codA линий.
МАТЕРИАЛЫ И МЕТОДЫ
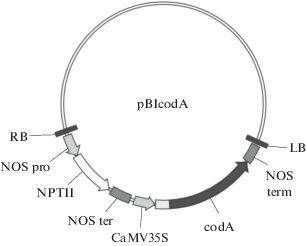
В работе использовали N. tabacum сорта Samsun (далее Самсун) и полученные на его основе с помощью агробактериальной трансформации линии CodA7 и CodA17. В качестве целевого был использован ген codA, под контролем CaMV 35S промотора. В качестве маркерного использовали ген NPTII неомицин-фосфотрансферазы, дающий возможность отбирать трансгенные проростки на среде с канамицином. Целевой ген codA был снабжен сигнальной последовательностью, отвечающей за доставку белкового продукта внутрь пластидного компартмента (рис. 1).
Рис. 1.
Схема экспрессионного вектора pBIcodA, содержащего маркерный ген NPTII и целевой ген холиноксидазы codА. NOSpro – промотор гена нопалинсинтазы; NPTII – маркерный ген неомицинфосфотрансферазы; NOSter – терминатор гена нопалинсинтазы; CaMV35S – промотор 35S из вируса мозаики цветной капусты; ss – сигнальная последовательность из гена рибулозобисфосфаткарбоксилазы/оксигеназы томата; codA – ген холиноксидазы из Arthrobacter globiformis.
Трансгенный статус – наличие гетерологичного гена в полученных трансформантах – подтверждали методом ПЦР с использованием праймеров, которые были оптимизированы для выявления внедренного гена codA: codF 5'-CGCCAACTTCTTCCAGATCAA-3' – прямой, и codR 5'-GGGTGTTCATGTCGAACG-3' – обратный. Длина амплифицированного фрагмента ДНК составила 507 п. о.
ДНК выделяли из растительной ткани с использованием набора реагентов “ДНК-Экстран” производства фирмы “Синтол” (Россия) согласно методике производителя. Реакцию ПЦР проводили в следующих условиях: 4 мин при 94°С; далее 35 циклов со следующими параметрами − 1 мин – 94°С, 30 с – 59°С, 30 с –55°С, 30 с –50°С; заключительные 10 мин – 72°С.
Экспрессию гена codА определяли с помощью обратной цепной реакции (ОТ-ПЦР). РНК выделяли стандартным методом с использованием набора “РНК-Экстран” фирмы “Синтол” согласно методике производителя. Концентрацию выделенной РНК определяли спектрофотометрически, кДНК получали по методике производителя (набор фирмы “Синтол”).
Клональное микроразмножение пробирочных растений исходного сорта и линий CodA7 и CodA17 проводили на среде МС без гормонов и витаминов (Murashige, Skoog, 1962). Растения, имеющие развитую корневую систему, высаживали в вегетационные сосуды и выращивали в условиях искусственного климата на двух почвенных фонах: 1) природная дерново-подзолистая почва с рНсол 3.6 и содержанием подвижного алюминия 12.8 мг/100 г почвы (стресс), 2) искусственный торфо-перегнойный почвогрунт с рНсол 6.0, без алюминия (контроль). Каждый вариант был представлен шестью клонами, которые выращивали в трех сосудах по два растения в каждом.
В возрасте 10 недель растения извлекали из сосудов, корневую систему освобождали от почвы отряхиванием, объединяли в усредненные образцы по вариантам. Из каждого усредненного образца брали по две навески (2.0 г) корней с почвой, оставшейся после отряхивания (считали это ризосферой), прогревали в течение 1 ч при 100°С для ограничения роста немицелиальных бактерий, гомогенизировали в ступке и готовили серию разведений для посева. Учитывали, выделяли и определяли структуру комплексов актиномицетов на казеин-глицериновом агаре (КГА) и агаре с пропионатом натрия. Колонии на чашках учитывали дифференцировано по морфологическим типам. Доминирующие колонии выделяли в чистую культуру, фиксируя их принадлежность к определенному образцу. Для каждого образца составляли выборки не менее 15 изолятов. Таксономическое положение изолятов определяли, используя фенотипические признаки (Определитель бактерий Берджи, 1997; Гаузе и др., 1983) и, выборочно, результаты анализа фрагмента гена 16S рРНК (“Синтол”, Москва). ДНК экстрагировали из чистых изолятов, ген 16S рРНК амплифицировали с помощью ПЦР с использованием универсальных бактериальных праймеров 16SF75 – AGTGGCGGACGGGTGAGTAA и 16SR1100 – TTACTAGCGATTCCGACTTCA. Условия для ПЦР использовали следующие: начальная денатурация при 95°С в течение 4 мин, 32 цикла 94°С в течение 20 с, 58°С в течение 30 с и 72°С в течение 45 с, после чего окончательное удлинение 5 мин при 68°С. Продукты ПЦР секвенировали на анализаторе ДНК ABI3130xl (Thermo Fisher Scientific, СШA). Первичный сравнительный анализ полученных нуклеотидных последовательностей с последовательностями из базы данных GenBank проводили с помощью программы NCBI BLAST (http://www.ncbi.nlm.nih.gov/blast). Парное выравнивание последовательностей осуществляли с помощью программы LALIGN (https://embnet.vital-it.ch/software/LALIGN_form.html).
Дополнительно изучали антифунгальные (Егоров, 2004) и целлюлозолитические (Teather, Wood, 1982) свойства выделенных культур. Характеризуя структуру ризосферных комплексов актиномицетов, использовали показатели долевого участия и частоты встречаемости таксона в комплексе, а также относительное обилие видов антагонистов и видов с различной целлюлозолитической активностью (%).
Статистическую обработку результатов проводили стандартными методами с использованием пакета программ EXCEL и STATGRAFICS.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе работы была проведена молекулярная проверка трансгенной природы независимо трансформированных линий табака CodA7 и CodA17. По результатам электрофореза продуктов амплификации наличие гетерологичной вставки codA обнаружено как у линии CodA7, так и у линии CodA17 (рис. 2).
Рис. 2.
Электрофореграммы продуктов ПЦР (верхняя) и ОТ-ПЦР (нижняя). Дорожки слева направо: М – маркер молекулярных весов; 1 – трансгенная линия CodA17; 2 – трансгенная линия CodA7; 3 – контрольное нетрансформированное растение; 4 – плазмидная ДНК.

В результате проведения ОТ-ПЦР было получено подтверждение экспрессии интродуцированного гена codА только у одной линии – CodA17. С учетом выявленных различий между линиями CodA7 и CodA17 по экспрессии гетерологичных вставок, обе линии были взяты для дальнейшего изучения актинобиоты в их ризосфере.
Выбор актиномицетов в качестве модельной биоиндикационной группы микроорганизмов определялся многообразием аспектов их взаимодействия с растением. Актиномицеты способны к биосинтезу широкого спектра физиологически активных соединений (антибиотики, фитогормоны, сидерофоры, витамины и т.д.) с фиторегуляторным и контролирующим развитие фитопатогенов действием (Viaene et al., 2016; Vurukonda et al., 2018). Благодаря продукции гидролитических ферментов (протеазы, целлюлазы, лигноцеллюлазы, ксиланазы и хитиназы), актиномицеты в почвах участвуют в утилизации разнообразных растительных полимеров и минерализации мономеров, создают для растений благоприятные условия существования (de Jesus Sousa, Olivares, 2016; Bhatti et al., 2017).
Сравнительный анализ численности и состава актиномицетных комплексов в ризосфере показал, что в обычных условиях (контроль) численность мицелиальных прокариот на корнях табака исходного сорта была в 2.8–3.6 раза выше, чем на корнях растений, подвергнутых трансформации (табл. 1). Кроме того, у исходного сорта доля актиномицетов в прокариотном комплексе ризосферы была в 3–6 раз значительнее, чем у линий CodA7 и CodA17. На фоне стресса, обусловленного токсичностью ионов алюминия в кислой почве, количество актиномицетов на корнях исходного сорта и линии CodA7 существенно снизилось, тогда как в ризосфере трансформанта CodA17, с экспрессией интродуцированного гена, напротив, увеличилось как абсолютное (в пять раз), так и относительное их содержание (в 20 раз). Количественная разница в отклике ризосферной актинобиоты на стресс у трансформантов может быть связана с различиями в экспрессии гена холиноксидазы и, соответственно, в накоплении растениями ГБ, а также с плейотропным действием гетерологичной вставки.
Таблица 1.
Численность и структура комплексов актиномицетов в ризосфере табака в зависимости от почвенного фона и генотипа
| Показатель | Почвенный фон | Генотип растения | ||
|---|---|---|---|---|
| Самсун | CodA7 | CodA17 | ||
| Общая численность актиномицетов, вырастающих на КГА, тыс. КОЕ/г | Контроль | 387 ± 10.1 | 140 ± 9.4 | 108 ± 6.84 |
| Стресс | 165 ± 8.6 | 102 ± 3.2 | 512 ± 1.7 | |
| Доля актиномицетов в прокариотном комплексе, % | Контроль | 1.54 | 0.46 | 0.23 |
| Стресс | 0.58 | 0.46 | 4.74 | |
| Долевое участие в комплексе представителей родов, % : | ||||
| Streptomyces | Контроль | 98.1 | 96.0 | 95.8 |
| Стресс | 98.3 | 95.7 | 96.7 | |
| Micromonospora | Контроль | 0.60 | 0.92 | 1.33 |
| Стресс | 0.46 | 0.80 | 0.06 | |
| олигоспоровые формы | Контроль | 0.82 | 1.58 | 2.00 |
| Стресс | 0.76 | 2.28 | 1.92 | |
| Streptosporangium | Контроль | 0 | 0.26 | 0.58 |
| Стресс | 0 | 0.58 | 0.47 | |
| Streptoverticillium | Контроль | 0.45 | 1.19 | 0.25 |
| Стресс | 0.46 | 0.68 | 0.82 | |
Сравнение исходного сорта и трансгенных линий по таксономической структуре ризосферного комплекса, выявляемого на среде с пропионатом натрия, показало, что на корнях табака с различной частотой встречались представители родов Streptomyces, Micromonospora, Streptosporangium, Streptoverticillium и олигоспоровые формы актиномицетов (рис. 3). В ризосфере всех трех генотипов по долевому участию доминировали представители рода Streptomyces (95.7–98.1%), как в контроле, так и в стрессовых условиях (табл. 1). В отличие от стрептомицетов, долевое участие видов рода Micromonospora изменялось в зависимости от генотипа растения, увеличиваясь от 0.46–0.60% в ризосфере исходного сорта до 0.80–0.92% на корнях трансформанта CodA7. Линия CodA17 отличалась наиболее значительным варьированием долевого вклада микромоноспор (0.06–1.33%). У всех исследуемых генотипов табака доля микромоноспор на фоне стресса снизилась по сравнению с обычными условиями. Большая, чем у стрептомицетов и представителей других родов, чувствительность Micromonospora sp. к кислотности почвы нами уже отмечалась ранее (Shirokikh et al., 2002, 2004).
Рис. 3.
Частота встречаемости (%) в ризосферных комплексах табака различных родов актиномицетов: Stm – Streptomyces, Mcm – Micromonospora, Stv – Streptoverticillium, Stsp – Streptosporangium; олг – олигоспоровые формы.
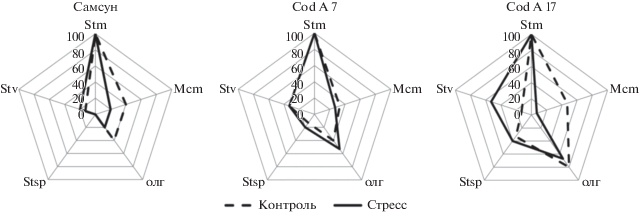
При выращивании табака в обычных условиях актинобиота в ризосфере исходного сорта и линий трансформантов различалась незначительно. На фоне стресса изменения в частоте встречаемости представителей отдельных таксонов зависели от генотипа растений. В минимальной степени стресс отразился на структуре актиномицетного комплекса линии CodA7, не экспрессирующей бактериальный ген холиноксидазы. В ризосфере исходного сорта и линии CodA17 реакция на стресс была более выраженной и заключалась в изменении относительного обилия, главным образом, микромоноспор и стрептовертициллов (табл. 1). Долевой вклад актиномицетов, объединенных в группу олигоспоровых, увеличивался в ризосфере трансформантов (1.58–2.28%) по сравнению с ризосферным комплексом исходного сорта (0.76–0.82%). Актиномицеты рода Streptosporangium, не обнаруженные в ризосфере исходного сорта, на корнях трансформантов были представлены в качестве минорного компонента, наряду с видами рода Streptoverticillium. Существенного влияния на варьирование их долевого вклада ни генотип растения, ни почвенный фон не оказали.
Далее ризосферные комплексы табака Самсун и его трансгенных линий CodA7 и CodA17 сравнивали по видовому составу рода Streptomyces. При микроскопии его представители имели типичные морфологические признаки: нефрагментированный субстратный и воздушный мицелий, длинные цепочки спор на воздушном и отсутствие спор на субстратном мицелии. Выборочный анализ фрагментов гена 16S рРНК у изолятов с данным морфотипом подтвердил, что выделенные культуры являются представителями рода Streptomyces, семейства Streptomycetaceae, порядка Streptomycetales, класса Actinobacteria. Однако для видовой идентификации культур одной последовательности по локусу гена 16S рРНК, оказалось недостаточно, поскольку все нуклеотидные фрагменты, выданные BLAST для исследуемых штаммов, более чем на 98% соответствовали введенным последовательностям. Очевидно, для идентификации штаммов Streptomyces на видовом уровне в большинстве случаев необходим мультилокусный анализ, ценность которого была продемонстрирована в нескольких недавно опубликованных работах (Labeda, 2016; Labeda et al., 2017). В связи с этим, помимо генетических данных, учитывали такие фенотипические признаки изолятов, как цвет воздушного и субстратного мицелия при посеве на среду КГА. Это позволило в стрептомицетных комплексах табака определить долевое участие представителей отдельных цветовых секций и серий (Гаузе и др., 1983).
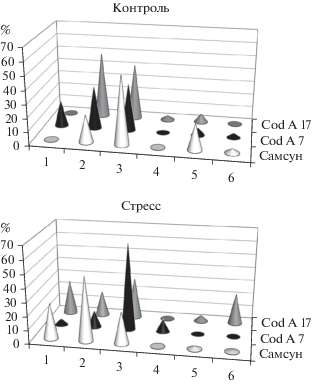
У исходного сорта комплекс стрептомицетов включал виды пяти секций и серий, как в обычных условиях, так и при стрессе (рис. 4). В контроле доминировали виды серии Cinereus Violaceus (50.9%), а при стрессе − Cinereus Achromogenes (47.5%). В ризосфере растений-трансформантов количество цветовых секций и серий, по сравнению с исходным сортом, практически не изменилось. Незначительные отличия касались в основном долевого участия в комплексе видов минорных секций и серий Imperfectus и Helvolo-Flavus Helvolus. Доминировали на обоих почвенных фонах в ризосфере линии CodA7 виды серии Cinereus Violaceus (37 и 67%), тогда как в ризосфере линии CodA17 – виды серии Cinereus Achromogenes (49%) в контроле и виды серии Cinereus Violaceus (30%) – при стрессе. Таким образом, разница между исходным сортом и линиями трансформантов по таксономическому составу актинобиоты не имела принципиального характера и, скорее всего, была обусловлена случайными факторами.
Рис. 4.
Долевое участие в ризосферных комплексах табака видов стрептомицетов из секций и серий: 1 – Cinereus Chromogenes, 2 – Cinereus Achromogenes, 3 – Cinereus Violaceus, 4 – Helvolo-Flavus Helvolus, 5 – Albus Albus, 6 – Imperfectus.
Табак Самсун и трансгенные линии CodA7 и CodA17 сравнивали также по функциональной структуре комплексов стрептомицетов в их ризосфере. При лабораторном тестировании на способность разлагать целлюлозу практически все изоляты, в той или иной степени, проявили способность к деструкции КМЦ в тесте с конго красным и, в соответствии с величиной зон деструкции КМЦ, были разделены на три группы: со слабой (тест-зона разложения КМЦ не более 30 мм), умеренной (тест-зона изменяется от 31 до 40 мм) и сильной (тест-зона более 40 мм) целлюлазной активностью. Соотношение долей изолятов, отнесенных к каждой из выделенных групп в ризосфере исходного сорта Самсун и линий трансформантов было различным, но средние значения зоны деструкции КМЦ изменялись в зависимости от генотипа растений и почвенного фона несущественно – в пределах от 34.1 ± 18.50 до 46.8 ± 12.33 мм (табл. 2). Результаты двухфакторного дисперсионного анализа показали, что варьирование данного показателя достоверно определялось взаимодействием факторов А × В (F = 3.87, p > 0.0271), но сами по себе ни почвенный фон (фактор А), ни генотип табака (фактор В) не оказали на него значимого влияния (табл. 3).
Таблица 2.
Показатели целлюлозолитической активности стрептомицетов из ризосферы табака исходного сорта и линий трансформантов
| Генотип | Фон почвы | Доля изолятов (%) с целлюлозолитической способностью | Средняя величина тест-зоны деструкции КМЦ, мм | ||
|---|---|---|---|---|---|
| слабой | умеренной | сильной | |||
| Самсун | Контроль | 10 | 20 | 70 | 46.8 ± 12.33 |
| Стресс | 20 | 50 | 30 | 38.1 ± 6.04 | |
| СodА7 | Контроль | 20 | 30 | 50 | 43.7 ± 9.75 |
| Стресс | 0 | 60 | 40 | 34.1 ± 18.50 | |
| СodА17 | Контроль | 0 | 80 | 20 | 39.7 ± 2.67 |
| Стресс | 0 | 50 | 50 | 42.7 ± 3.62 | |
Таблица 3.
Дисперсионный анализ влияния фона почвы, генотипа растения и их взаимодействия на встречаемость в ризосфере стрептомицетов с различными функциональными свойствами
| Источник варьирования | df | SS | F | Р |
|---|---|---|---|---|
| Антагонизм к F. сulmorum | ||||
| Фон почвы (фактор А) | 1 | 253.867 | 5.01 | 0.0295 |
| Генотип растения (фактор В) | 2 | 712.954 | 7.03 | 0.0020* |
| Взаимодействие факторов А×В | 2 | 200.597 | 1.98 | 0.1484 |
| Антагонизм к Alternaria sp. | ||||
| Фон почвы (фактор А) | 1 | 376.697 | 4.14 | 0.0496 |
| Генотип растения (фактор В) | 1 | 473.735 | 5.20 | 0.0288* |
| Взаимодействие факторов А×В | 1 | 1.79 | 116.52 | 0.5649 |
| Антагонизм к F. oxysporum | ||||
| Фон почвы (фактор А) | 1 | 1.6363 | 0.04 | 0.8506 |
| Генотип растения (фактор В) | 2 | 112.966 | 2.47 | 0.0940 |
| Взаимодействие факторов А×В | 2 | 51.0661 | 1.12 | 0.3346 |
| Антагонизм к F. avenaceum | ||||
| Фон почвы (фактор А) | 1 | 40.909 | 2.16 | 0.1472 |
| Генотип растения (фактор В) | 2 | 41.294 | 2.18 | 0.1226 |
| Взаимодействие факторов А×В | 2 | 1310.5 | 3.71 | 0.1226 |
| Целлюлозолитическая способность | ||||
| Фон почвы (фактор А) | 1 | 22.267 | 0.20 | 0.6550 |
| Генотип растения (фактор В) | 2 | 60.293 | 0.55 | 0.5821 |
| Взаимодействие факторов А×В | 2 | 426.307 | 3.87 | 0.0271* |
При тестировании антифунгальной активности ни один штамм среди выделенных из ризосферы исходного сорта, выращенного в обычных условиях, не ограничивал рост фитопатогенных тест-грибов Fusarium oxysporum, F. culmorum, F. proliferatum, F. avenaceum и Alternaria sp. В выборке культур, изолированных из ризосферы исходных растений, выращенных при стрессе, с равной частотой (22%), встречались антагонисты тест-культур Alternaria sp., F. oxysporum и F. culmorum (табл. 4). В комплексе стрептомицетов, изолированных из ризосферы линии CodA7, виды-антагонисты встречались как на обычном (20–30%), так и на стрессовом почвенном фоне (30–50%). Стрепомицетный комплекс линии СodА17 по встречаемости антифунгально активных штаммов (10–30% в зависимости от почвенного фона и тест-культуры гриба) занимал промежуточное положение между комплексами исходного сорта и линии CodA7. Результаты обработки полученных данных методом двухфакторного дисперсионного анализа показали, что на частоту встречаемости в ризосфере табака антагонистов гриба F. culmorum достоверное влияние оказали оба фактора – генотип растения (F = = 4.99, p > 0.0321) и фон почвы (F = 4.92, p > 0.0332), как и на встречаемость антагонистов гриба Alternaria sp. (F = 5.2, p > 0.0288) и (F = 4.14, p > 0.0496) соответственно (табл. 3). Но ни один из исследуемых факторов не оказал достоверного влияния на встречаемость в ризосфере стрептомицетов-антагонистов таких фитопатогенов, как F. oxysporum и F. avenaceum.
Таблица 4.
Структура комплекса стрептомицетов-антагонистов фитопатогенных грибов в ризосфере табака исходного сорта и линий трансформантов
| Генотип | Фон почвы | Встречаемость антагонистов к тест-культурам грибов, % | ||||
|---|---|---|---|---|---|---|
| F. proliferatum | F. oxysporum | F. culmorum | F. avenaceum | Alternaria sp. | ||
| Самсун | Контроль | 0 | 0 | 0 | 0 | 0 |
| Стресс | 0 | 22 | 22 | 0 | 22 | |
| СodА7 | Контроль | 0 | 30 | 20 | 0 | 30 |
| Стресс | 0 | 30 | 50 | 0 | 50 | |
| СodА17 | Контроль | 0 | 10 | 0 | 0 | 30 |
| Стресс | 0 | 0 | 0 | 20 | 20 | |
* * *
В результате интродукции гена холиноксидазы codA, участвующей в биосинтезе ГБ, независимо от функциональной активности гетерологичной вставки, значительных изменений в численности и разнообразии актинобиоты, соотношении представителей отдельных таксонов, ассоциированных с корнями растений-трансформантов, не выявлено. Отсутствие значимых различий, очевидно, объясняется локальным накоплением продукта гетерологичного гена (ГБ) в листьях и отсутствием его влияния на корневую экссудацию растений. При определении в ризосфере табака встречаемости представителей с антифунгальной активностью и целлюлозолитической способностью существенной разницы между трансформированными и исходными растениями также не установлено. Варьирование в соотношении изолятов стрептомицетов с различной функциональной активностью в ризосферных комплексах исходного сорта и генетически модифицированных линий по величине было сопоставимо с варьированием, обусловленным другими факторами, в частности – со стрессовым воздействием подвижного алюминия в кислой почве.
Финансирование. Работа выполнена в рамках государственных заданий (0767-2019-0090 и 0574-2019-0002) и частично поддержана грантом РФФИ (19-016-00207_а).
Список литературы
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. Роды Sreptomyces, Streptoverticillium, Chainia. М.: Наука, 1983. 248 с.
Егоров Н.С. Основы учения об антибиотиках. М.: Наука, 2004. 528 с.
Кочетов А.В., Шумный В.К. Трансгенные растения как генетические модели для изучения функций генов растений // Вавиловский журн. генетики и селекции. 2016. Т. 20. № 4. С. 476–481.
Определитель бактерий Берджи. В 2-х т. / Под ред. Хоулта Дж., Крига Н., Снита П., Стейли Дж., Уилльямса С. М.: Мир, 1997. Т. 2. 800 с.
Agarwal P.K., Jha B. Transcription factors in plants and ABA dependent and independent abiotic stress signaling // Biologia Plantarum. 2010. V. 54. P. 201–212.
Bhatti A.A., Haq S., Bhat R.A. Actinomycetes benefaction role in soil and plant health // Microbial Pathogen. 2017. V. 111. P. 458–467.
Brookes G., Barfoot P. GM crops: global socio-economic and environmental impacts 1996–2015 // UK: PG economics LTD, 2017. 201 p.
de Jesus Sousa J.A., Olivares F.L. Plant growth promotion by streptomycetes: ecophysiology, mechanisms and applications // Chem. Biol. Technol. Agriculture. 2016. V. 3. № 1. P. 24.
Kremer R.J., Means N.E. Glyphosate and glyphosate-resistant crop interactions with rhizosphere microorganisms // Eur. J. Agronomy. 2009. V. 31. № 3. P. 153–161.
Labeda D.P. Taxonomic evaluation of putative Streptomyces scabiei strains held in the ARS Culture Collection (NRRL) using multi-locus sequence analysis // Antonie van Leeuwenhoek. 2016. V. 109. № 3. P. 349–356.
Labeda D.P., Dunlap C.A., Rong X., Huang Y., Doroghazi J.R., Ju K.S., Metcalf W.W. Phylogenetic relationships in the family Streptomycetaceae using multi-locus sequence analysis // Antonie Van Leeuwenhoek. 2017. V. 110. № 4. P. 563–583.
Ladics G.S., Bartholomaeus A., Bregitzer P., Doerrer N.G., Gray A., Holzhauser T., Parrott W. Genetic basis and detection of unintended effects in genetically modified crop plants // Transgenic Res. 2015. V. 24. № 4. P. 587–603.
Li Z., Cui J., Mi Z., Tian D., Wang J., Ma Z., Niu S. Responses of soil enzymatic activities to transgenic Bacillus thuringiensis (Bt) crops-A global meta-analysis // Scie. Total Envir. 2019. V. 651. P. 1830–1838.
Meriles J.M., Vargas Gil, S., Haro R. J., March G.J., Guzman C.A. Glyphosate and previous crop residue effect on deleterious and beneficial soil-borne fungi from a peanut– corn–soybean rotations // J. Phytopath. 2006. V. 154. № 5. P. 309–316.
Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture // Physiol. Plant. 1962. V. 15. P. 473–497.
Oguchi T., Kashimura Y., Mimura M., Yu X., Matsunaga E., Nanto K., Shimada T., Kikuchi A., Watanabe K.N. A multi-year assessment of the environmental impact of transgenic Eucalyptus trees harboring a bacterial choline oxidase gene on biomass, precinct vegetation and the microbial community // Transgenic Res. 2014. V. 23. P. 767–777.
Prasad K.V.S.K., Sharmila P., Kumar P.A., Saradhi P.P. Transformation of Brassica juncea (L.) Czern with bacterial codA gene enhances its tolerance to salt stress // Mol. Breeding. 2000. V. 6. P. 489–499.
Sakamoto A., Murata N. Genetic engineering of glycinebetaine synthesis in plants: current status and implications for enhancement of stress tolerance // J. Experim. Botany. 2000. V. 51. № 342. P. 81–88.
Shirokikh I.G., Shirokikh A.A., Merzaeva O.V., Tumasova M.I. Actinomycetes in the Rhizosphere of red clover on a Soddy-Podzolic soil //Eur. Soil Science. 2004. V. 37. № 7. P. 762–768.
Shirokikh I.G., Zenova G.M., Zvyagintsev D.G. Actinomycetes in the rhizosphere of barley grown on acid soddy podzolic soil //Microbiology. 2002. V. 71. № 4. P. 455–459.
Singh A.K., Dubey S.K. Current trends in Bt crops and their fate on associated microbial community dynamics: a review // Protoplasma. 2016. V. 253. № 3. P. 663–681.
Teather R.M., Wood P.J. Use of congo-red polysaccharide interaction in enumeration and characterization of cellulozalytic bacteria the bovine rumen // Appl. Environ Microbiol. 1982. V. 43. P. 777–780.
Tran N.-H.T., Oguchi T., Matsunaga E., Kawaoka A., Watanabe K.N., Kikuchi A. Environmental risk assessment of impacts of transgenic Eucalyptus camaldulensis events highly expressing bacterial choline oxidase A gene // Plant Biotechnology. 2018. V. 35. P. 393–397.
Turrini A., Sbrana C., Giovannetti M. Belowground environmental effects of transgenic crops: a soil microbial perspective // Res. Microbiol. 2015. V. 166. № 3. P. 121–131.
Viaene T., Langendries S., Beirinckx S., Maes M., Goormachtig S. Streptomyces as a plant’s best friend? // FEMS Microbiol.Ecology. 2016. V. 92. № 8. P. 1–10. https://doi.org/10.1093/femsec/fiw119
Vurukonda S.S.K.P., Giovanardi D., Stefani E. Plant growth promoting and biocontrol activity of Streptomyces spp. as endophytes // Intern. J. Mol. Scie. 2018. V. 19. № 4. P. 952.
You L., Song Q., Wu Y., Li S., Jiang C., Chang L., Zhang J. Accumulation of glycine betaine in transplastomic potato plants expressing choline oxidase confers improved drought tolerance // Planta. 2019. V. 249. № 6. P. 1963–1975.
Zablotowicz R.M.; Reddy K.N. Nitrogenase activity, nitrogen content, and yield responses to glyphosate in glyphosate-resistant soybean // Crop. Protection. 2007. V. 26. P. 370–376.
Zhang Y.J., Xie M., Peng D.L. Effects of the transgenic CrylAc and CpTI insect-resistant cotton SGK321 on rhizosphere soil microorganism populations in northern China // Plant, Soil Environment. 2014. V. 60. № 6. P. 285–289.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


