Известия РАН. Серия биологическая, 2022, № 2, стр. 208-218
Межгодовая изменчивость энергетических резервов средней бурозубки (Sorex caecutiens) на северном побережье Охотского Моря
С. В. Киселев *
Институт биологических проблем Севера ДВО РАН
68500 Магадан, ул. Портовая, 18, Россия
* E-mail: kiselevmagadan@mail.ru
Поступила в редакцию 16.07.2020
После доработки 25.05.2021
Принята к публикации 25.05.2021
- EDN: CUFOVR
- DOI: 10.31857/S1026347022020123
Аннотация
Оценены зависимости между содержанием резервных энергетических веществ Sorex caecutiens, обилием кормовых объектов и численностью бурозубок в летние периоды 2012–2019 гг. Содержание гликогена в печени S. caecutiens значимой связи с численностью животных не проявило. Масса жировых резервов и относительная биомасса беспозвоночных (по данным учета почвенными ловушками) в августе находились в обратной зависимости от общей численности всех обитающих на территории видов бурозубок. Масса жировой ткани S. caecutiens при этом положительно коррелировала с биомассой личинок насекомых (прежде всего гусеницеобразных, составлявших основную массу личинок в сборах). Выявленные особенности свидетельствуют об обострении внутри- и межвидовой пищевой конкуренции в годы высокой численности бурозубок.
Численность бурозубок подвержена значительным сезонным колебаниям. Она минимальна весной и быстро нарастает летом в период репродукции. По достижению пика в июле–сентябре, иногда еще до окончания сезона размножения, численность начинает снижаться. Это снижение длится вплоть до следующего лета, но его темпы неодинаковы в разные сезоны года. Первое существенное сокращение обилия зверьков обычно приходится на осень (Калинин и др., 2008; Shchipanov et al., 2019). Для многих регионов характерны и значительные межгодовые изменения численности бурозубок. Нередко в формировании их популяционной динамики важную роль играют плотностно-зависимые факторы, когда интенсивность летнего роста и/или величина последующего падения численности зависят от плотности популяций (Kaikusalo, Hanski, 1985; Henttonen et al., 1989; Sheftel, 1989; Докучаев, 1990; Huitu et al., 2004; Калинин и др., 2008; Киселев, Ямборко, 2014; Киселев, 2019; Бобрецов и др., 2020). В годы повышенной численности зверьков ее сезонный пик и начало последующего снижения приходятся на более ранние сроки (Калинин и др., 2008). Высокая популяционная плотность явно оказывает негативное воздействие на бурозубок. Отмечалось, что переуплотнение их популяций приводит к увеличению флуктуирующей асимметрии скелетных характеристик особей, что, по мнению авторов работы, может быть следствием повышения уровня стресса у животных (Zakharov et al., 1991, 1997). Предполагалось также, что, по крайней мере, одним из компонентов плотностно-зависимой регуляции численности бурозубок может являться интенсивность эксплуатации кормовых ресурсов (Kaikusalo, Hanski, 1985; Henttonen et al., 1989; Моралева, 1987; Киселев и др., 2013; Киселев, Ямборко, 2014).
Кормовые условия могут оказывать влияние как на выживаемость, так и на интенсивность репродукции в популяциях животных. Это влияние может быть не только прямым, но и опосредованным – через изменение поведения особей, пространственной структуры популяций, восприимчивости к хищникам и болезнетворным организмам и пр. (Шилов, 1998). Увеличение смертности в ответ на ухудшение кормовых условий у бурозубок может происходить довольно быстро. Землеройки-бурозубки – мелкие насекомоядные млекопитающие, обладающие крайне высоким уровнем метаболизма. Высокая интенсивность обмена веществ, сравнительно небольшие жировые резервы и отсутствие такого энергосберегающего механизма, как торпор, вынуждают этих животных часто питаться (Genoud, 1988; Taylor, 1998). В сутки бурозубки потребляют количество корма, почти равное или даже превышающее собственную массу (в зависимости от вида), а время их жизни без доступа к пище составляет лишь несколько часов. Это ставит их в постоянную зависимость от доступности кормовых объектов.
Теоретически не только внутри-, но и межвидовая конкуренция за кормовые ресурсы может сказываться на благополучии популяций бурозубок. Они питаются разнообразными беспозвоночными, встречаемость которых в желудках, как правило, соответствует их доступности в природе. При этом одну и ту же территорию обычно населяют несколько видов бурозубок, пищевые рационы которых перекрываются практически полностью, и отличия в составе потребляемых ими жертв носят не качественный, а количественный характер (Pernetta, 1976; Королькова, 1977; Докучаев, 1981, 1990; Churchfield, 1982; Churchfield et al., 1991, 1999; Churchfield, Sheftel, 1994; Klenovšek et al., 2013; Докучаев и др., 2015; Ивантер и др., 2015). Частичному снижению межвидовой конкуренции в сообществах бурозубок способствуют различия в размерах тела сосуществующих видов (Kirkland, 1991; Fox, Kirkland, 1992). Размер тела влияет на способ добычи корма (надземный/подземный), а также на тип и размер потребляемых жертв – чем крупнее бурозубки, тем выше частота поедания более крупных беспозвоночных (Churchfield, Sheftel, 1994; Churchfield et al., 1999). Важную роль в питании крупных видов бурозубок играют дождевые черви (Lumbricidae).
Полевыми экспериментами было показано, что мелкие млекопитающие, в особенности бурозубки, могут оказывать существенное воздействие на определенные кормовые объекты. Ограждение экспериментальных площадок от доступа зверьков значительно повышало обилие некоторых беспозвоночных в сравнении с неогороженными контрольными участками (Королькова, 1975, 1977; Churchfield et al., 1991; Namba, Ohdachi, 2016). Доля изъятия беспозвоночных бурозубками, однако, варьирует в зависимости от плотности популяций последних, численности жертв, сезона года и некоторых других факторов. В Англии, например, критичного воздействия зверьков на беспозвоночных не отмечалось, обилие жертв в течение всего года сохранялось на довольно высоком уровне (Churchfield, 1982; Churchfield et al., 1991). Предполагалось, что землеройки никогда не испытывают недостаток корма (Pernetta, 1976; Churchfield, 1982). С продвижением на север, по мере снижения продуктивности местообитаний, освоение кормовых участков бурозубками возрастает (Королькова, 1975). В северной тайге значительная роль насекомоядных животных в снижении многих групп беспозвоночных отмечалась уже в летний период (Королькова, 1975, 1977). В Карелии расчётная доля изъятия кормовых ресурсов бурозубками на пике их численности превышала 50% (Ивантер, Макаров, 1994).
Несмотря на то, что в определенных случаях землеройки могут оказывать весьма существенное воздействие на кормовые объекты, неизвестно, как это сказывается на самих зверьках. Ранее в верховьях Колымы (континентальная часть Северо-Восточной Азии) отмечалась зависимость физиологического состояния Sorex caecutiens и Sorex isodon от уровня их численности (Киселев и др., 2013). Наибольшую связь с обилием бурозубок проявили запасы их резервных энергетических веществ, свидетельствуя об ухудшении питания животных в годы повышенной численности. Учеты беспозвоночных, однако, не осуществлялись, и точная причина наблюдаемого ухудшения питания осталась неясна. Помимо истощения кормовых ресурсов, как предполагалось, препятствовать нормальному питанию могли социальные взаимодействия (агрессивные контакты) между особями и конкуренция за пространство.
Целью данного исследования было: 1) на основе оценки физиологических показателей (относительная масса межлопаточной и паховой жировой ткани, содержание гликогена в печени) установить, проявляются ли признаки ухудшения питания S. caecutiens в годы высокой численности бурозубок на северном побережье Охотского моря; 2) если так, то попытаться выявить, является ли это следствием увеличения собственной плотности популяции или численности всех видов бурозубок в совокупности и 3) проверить, как соотносится межгодовая изменчивость физиологических показателей S. caecutiens с обилием кормовых объектов.S. caecutiens – самый массовый и широко распространенный вид среди землероек Северо-Восточной Азии, наибольшей численности достигает в лиственничниках (Докучаев, 1990). Помимо S. caecutiens на северном побережье Охотского моря обитают пять видов бурозубок: Sorex isodon, Sorex gracillimus, Sorex daphaenodon, Sorex camtschaticus, Sorex minutissimus. Первый из этих видов также многочисленный, остальные – второстепенные. Колебания численности по годам у всех видов в период исследований в разной степени совпадали (Киселев, 2019).
МАТЕРИАЛЫ И МЕТОДЫ
Район исследований и отлов бурозубок. Работа проведена на северном побережье Охотского моря в окрестностях г. Магадан (59°37′ с.ш., 150°56′ в.д.). Климат района исследований характеризуется избыточным увлажнением, холодным летом, снежной морозной зимой (Клюкин, 1970). Более подробная характеристика погодно-климатических условий была приведена ранее (Киселев, 2019). Исследование выполнено на материале, собранном в июле–августе 2012–2019 гг. в предпочитаемом S. caecutiens биотопе – лиственничнике. Подлесок в этом биотопе образован кедровым стлаником и березой Миддендорфа, напочвенный покров слагается мхами, кустарниками и кустарничками (голубика, багульник, брусника и др.), низкотравьем. Отлавливали зверьков с помощью конусов, наполовину заполненных водой. Учеты численности проводили на постоянной линии отлова (Киселев, 2019), тогда как для обеспечения большего количества материала по физиологическим показателям животных также были использованы дополнительные ловушки (конуса и стаканы объемом 0.5 л). Проверку ловушек осуществляли каждое утро, зверьков немедленно доставляли в лабораторию, просушивали на салфетках, взвешивали на весах с точностью до 0.01 г, после чего анализировали физиологические показатели добытых животных.
Оценка физиологических показателей. В анализах использовали неполовозрелых молодых особей (сеголеток) S. caecutiens. Животных с признаками линьки исключали из анализа, так как этот процесс оказывает влияние на физиологические показатели бурозубок (Докучаев, 1983, 1990). В связи с тем, что достоверные половые отличия по исследуемым параметрам у молодых неполовозрелых особей S. caecutiens отсутствуют (Киселев и др., 2013), данные по самцам и самкам анализировали в совокупности. Всего в анализ вошло 320 экз. сеголеток S. caecutiens.
Паховую (с одной стороны) и межлопаточную жировую ткань взвешивали на весах с точностью до 1 мг. Относительную массу тканей выражали в мг/г тела. Гликоген осаждали этанолом после обработки печени 30%-ным KOH и гидролизовали до глюкозы в 2N H2SO4 (Davidson, Berliner, 1974). Количество глюкозы в гидролизате выявляли ортотолуидиновым методом. Содержание гликогена в печени выражали в мг глюкозы на 1 г сырого веса органа.
Оценка относительной биомассы беспозвоночных. Отлов беспозвоночных осуществляли в июле–августе с помощью почвенных ловушек (ловушек Барбера), расположенных вблизи ловушек для мелких млекопитающих (в одном и том же месте во все годы). Десять пластиковых стаканов объемом 0.5 л и диаметром входного отверстия 90 мм устанавливали в линию (чуть ниже уровня поверхности почвы) на расстоянии 5 м друг от друга и наполовину заполняли водой. Сбор попавших в ловушки беспозвоночных проводили спустя 7 сут путем пропускания содержимого стаканчиков через сито. После этого ловушки вновь устанавливали на прежнее место до следующей проверки. Собранных беспозвоночных делили на группы, просушивали на салфетках до приблизительно естественного состояния и взвешивали. Относительную биомассу беспозвоночных выражали в г/100 ловушко-суток. За исключением личинок, беспозвоночных делили на группы в соответствии с их таксономической принадлежностью. В связи с чувствительностью используемого типа ловушек к подвижности объектов, личинок насекомых (с полным превращением) при взвешивании делили на группы в соответствии с внешним видом и способностью к передвижению. Были выделены червеобразные (без развитых конечностей; в основном двукрылые, в меньшем количестве перепончатокрылые и жесткокрылые), камподеовидные (в сборах представлены исключительно жесткокрылыми) и гусеницеобразные (гусеницы чешуекрылых и ложногусеницы пилильщиков) личинки. Мелкие и/или малочисленные беспозвоночные, характеризующиеся практически всегда низкой биомассой в сборах, были выделены в отдельную группу – прочие беспозвоночные.
Беспозвоночных, которых бурозубки в Северном Приохотье не используют или практически не используют в пищу (Докучаев, личное сообщение), исключали из анализа. Это имаго и личинки мертвоедов (Silphidae), клещи-краснотелки (Trombidiidae), муравьи (Formicidae) и имаго крупных жесткокрылых (Coleoptera). Последние (помимо мертвоедов), впрочем, в исследуемом биотопе были редки, лишь однажды была поймана жужелица рода Carabus с массой тела 0.6 г. Не вошли в анализ также данные по активно летающим беспозвоночным (имаго двукрылых, чешуекрылых, перепончатокрылых и др.).
Статистический анализ. Статистическая обработка данных выполнена в Statistica 10.0 (StatSoft, Inc.). Оценку достоверности различий по массе тела и жировой ткани между годами и месяцами осуществляли с помощью двухфакторного дисперсионного анализа после ln-трансформации данных. Так как распределение особей по содержанию гликогена в печени сильно отличалось от нормального, и преобразование данных не исправляло ситуацию, выявления межгодовых различий по этому параметру выполняли с помощью критерия Краскелла–Уоллиса. Различия по содержанию гликогена в печени между месяцами осуществляли с помощью критерия Манна–Уитни. Оценку связей между относительной численностью зверьков, их физиологическими параметрами и относительным обилием беспозвоночных проводили с использованием рангового коэффициента корреляции Спирмена (Rs).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Динамика численности и изменчивость физиологических показателей бурозубок. Относительная численность бурозубок в лиственничнике варьировала по годам в довольно широких пределах (рис. 1а). Колебания совокупной численности всех видов бурозубок в целом повторяли таковые S. caecutiens, собственно и составлявших основную массу землероек в рассматриваемом биотопе. Лишь в 2015 г., когда общая численность бурозубок достигла очередного пика, обилие S. caecutiens хоть и возросло по отношении к предшествующему году, все еще оставалось на относительно невысоком уровне. Наибольшую численность в лиственничнике в 2015 г. имели S. isodon, обычно занимавшие второе по обилию место среди землероек в этом биотопе (Киселев, 2019).
Рис. 1.
Динамика численности бурозубок и физиологические показатели S. caecutiens:(а) – относительная численность (сплошная линия – S. caecutiens, пунктирная линия – все виды бурозубок в совокупности); (б) – масса тела; (в) – относительная масса межлопаточной жировой ткани; (г) – относительная масса паховой жировой ткани; (д) – содержание гликогена в печени. Светлые круги и столбцы – июль, темные – август. Данные представлены как средние и ошибки средних.

Физиологические показатели S. caecutiens представлены на рис. 1 (б–д). Двухфакторный дисперсионный анализ показал, что год, месяц и их совместный эффект не вносили существенный вклад в изменчивость массы тела бурозубок. Остальные физиологические параметры достоверно изменялись по годам (межлопаточная жировая ткань: F7.304 = 4.7, p < 0.01; паховая жировая ткань: F7.303 = 6.0, p < 0.01; гликоген печени: H7.266 = 47.7, p < 0.01). Влияние месяца на физиологические показатели не было значительным, однако на относительную массу жировых тканей достоверное воздействие оказывал совместный эффект месяца и года (межлопаточная жировая ткань: F7.304 = 2.9; p < 0.01; паховая жировая ткань: F7.303 = 3.1; p < 0.01).
Как в июле, так и в августе ни один из физиологических показателей в межгодовом отношении не проявил достоверной связи с численностью S. caecutiens. Относительная масса межлопаточной и паховой жировой ткани отрицательно коррелировали с совокупной численностью бурозубок, но только в августе (Rs = –0.8, p < 0.05 и Rs = –0.9, p < 0.01 соответственно). Между индивидуальными значениями массы межлопаточной и паховой жировой ткани была установлена положительная связь (Rs = 0.8, p < 0.01 как в абсолютном, так и в относительном к массе тела выражении). Содержание гликогена в печени значимых связей с общей для всех видов бурозубок численностью не проявило.
Динамика обилия беспозвоночных. В анализ изменчивости относительной биомассы кормовых объектов бурозубок вошли 9 групп беспозвоночных: имаго жесткокрылых (Coleoptera), многоножки (Myriapoda), малощетинковые черви (Oligochaeta), пауки (Araneae), сенокосцы (Opiliones), три группы личинок и группа прочих беспозвоночных (рис. 2). Наибольшей относительной биомассой практически во все годы выделялись сенокосцы, лишь в 2016 г. при всплеске численности чешуекрылых наибольшей биомассой характеризовались гусеницеобразные личинки. Пауки в исследуемом биотопе в июле–августе были немногочисленны. Второе место после сенокосцев по биомассе среди беспозвоночных заняли гусеницеобразные личинки, биомасса червеобразных и камподеовидных личинок в сборах была относительно низкой. Обилие имаго жесткокрылых (за исключением не вошедших в анализ мертвоедов) в исследуемом биотопе также было сравнительно невысоким. Наибольшей численностью среди жесткокрылых характеризовались стафилиниды (Staphylinidae), но из-за мелких размеров тела их биомасса была небольшой. Третье место по биомассе после сенокосцев и гусеницеобразных личинок заняли многоножки (Myriapoda). В подавляющем большинстве случаев в сборах они были представлены отрядом Lithobiomorpha (класс Chilopoda), иногда встречались Geophilomorpha. Из малощетинковых червей в лиственничнике попадались лишь представители семейства Enchytraeidae. Прочие беспозвоночные в основном были представлены коллемболами (Collembola), червецами (Coccinea), тлями (Aphidinea), ледничниками (Boreidae), брюхоногими моллюсками (Gastropoda). Относительная биомасса этой группы обычно не достигала 0.05 г/100 ловушко-суток и лишь в 2019 г., когда произошла вспышка численности тли, существенно превысила это значение.
Рис. 2.
Динамика относительной биомассы различных групп беспозвоночных (светлые символы – июль, темные символы – август). При вспышках численности некоторых беспозвоночных (сенокосцы – 2018 г., гусеницеобразные личинки – 2016 г.) для наглядности использовался разрыв шкалы.
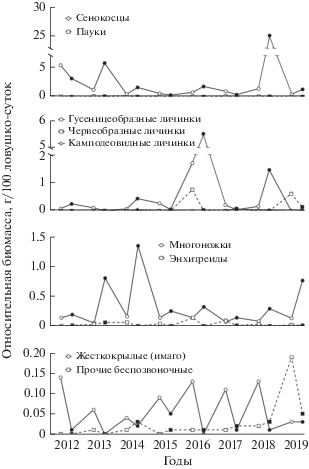
Динамика относительной биомассы отдельных групп беспозвоночных и всех беспозвоночных в целом представлена соответственно на рис. 2 и 3. В июле достоверных связей между совокупной биомассой кормовых объектов или биомассой отдельных групп беспозвоночных и численностью S. caecutiens или численностью всех видов бурозубок вместе выявлено не было. В августе совокупное обилие беспозвоночных проявило обратную зависимость от общей численности бурозубок (Rs = –0.8; p < 0.05), но не от численности S. caecutiens (Rs = –0.3; p > 0.05). Среди отдельных групп беспозвоночных достоверную отрицательную связь как с общей численностью бурозубок, так и с численностью S. caecutiens в августе проявила лишь биомасса гусеницеобразных личинок (Rs = –0.8; p < 0.05 в обоих случаях). Биомасса всех личинок в совокупности также находилась в обратной зависимости от общего обилия зверьков (Rs = –0.8; p < 0.05).
Рис. 3.
Динамика общей относительной биомассы беспозвоночных (светлые круги – июль, темные круги – август).

Физиологические показатели животных достоверной связи с биомассой беспозвоночных в июле не проявили. В августе была установлена высокая положительная связь относительной массы межлопаточной и паховой жировой ткани S. caecutiens с обилием гусеницеобразных личинок (соответственно Rs = 0.95; p < 0.01 и Rs = 0.75; p < 0.05), а также обилием всех личинок в целом (соответственно Rs = 0.95; p < 0.01 и Rs = 0.85; p < < 0.01). С биомассой других групп беспозвоночных и с общей биомассой кормовых ресурсов физиологические показатели достоверной связи в августе не проявили.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Динамика относительной биомассы беспозвоночных. Используемый тип учета беспозвоночных чувствителен не только к их обилию, но и к активности. При прочих равных условиях уловистость малоактивных форм (например, червеобразных личинок) будет ниже, по сравнению с активно перемещающимися по поверхности почвы беспозвоночными. Неактивные формы насекомых (куколки/коконы, яйца) в работе остались неучтенными. Не подходят используемые ловушки и для учета обитателей глубоких слоев почвы (например, дождевых червей и личинок некоторых двукрылых). Однако эти беспозвоночные, хоть и составляют существенную часть рациона крупных видов бурозубок, в питании мелких видов, включая S. caecutiens, не столь значимы. Последние добывают корм преимущественно в напочвенно-подстилочном ярусе (Churchfield, Sheftel, 1994; Churchfield et al., 1999; Ивантер и др., 2015), и обилие беспозвоночных в ловушках должно в значительной мере соответствовать их доступности для землероек. Так, например, в Англии состав и соотношение различных групп беспозвоночных в почвенных ловушках были подобны таковым в питании малых бурозубок (Sorex minutus) (Pernetta, 1976), но в гораздо меньшей степени соответствовали таковым в питании обыкновенной бурозубки (Sorex araneus) (Pernetta, 1976; Churchfield, 1982). Для второго вида, характеризующегося сравнительно крупными размерами тела, состав и соотношение потребляемых жертв в большей степени соответствовали таковым в почвенных пробах (Churchfield, 1982). Вообще, в районах мерзлотных почв крайнего Северо-Востока Азии поверхностно обитающие формы беспозвоночных по обилию значительно преобладают над собственно геобионтами, но и последние сосредоточены в верхнем горизонте почвы (Берман, Бухкало, 1985; Бухкало, 2009). В поясе редколесий верховьев Колымы, например, ниже 10 см ее слоя в почвенных пробах изредка встречались лишь отдельные особи энхитреид и личинки мух (Берман, Бухкало, 1985).
Результаты исследования свидетельствуют, что даже в летний период бурозубки могут оказывать высокое воздействие на кормовую базу, хотя степень этого воздействия неодинакова в различные месяцы, а также по отношению к различным группам беспозвоночных. Отсутствие достоверных связей между относительными показателями численности землероек и биомассы беспозвоночных в июле может быть связано с тем, что в это время обилие зверьков, как правило, еще невелико. Соответственно, и их воздействие на беспозвоночных может быть недостаточно высоким, чтобы отразиться на учетах. В августе относительная биомасса всех беспозвоночных в совокупности не проявила связи с численностью S. caecutiens, но находилась в обратной зависимости от общей для разных видов бурозубок численности. Среди отдельных групп беспозвоночных достоверную зависимость от обилия землероек проявила лишь биомасса гусеницеобразных личинок. Последние существенно преобладали среди личинок в сборах. Их биомасса на поверхности почвы, как правило, снижалась от июля к августу в годы высокой численности бурозубок, но в остальные годы возрастала (рис. 2). Довольно высокая встречаемость в питании бурозубок гусениц чешуекрылых характерна для многих регионов (Churchfield, Sheftel, 1994; Вольперт, Шадрина, 2002; Докучаев и др., 2015; Ивантер и др., 2015 и др.), это основной корм Sorex cinereus (вид, по размеру схожий с S. caecutiens) в сосновом лесу Восточной Канады (Bellocq et al., 1994; Bellocq, Smith, 2003). Ложногусеницы пилильщиков также охотно потребляются бурозубками (Королькова, 1977; Докучаев, 1981, 1990; Ивантер и др., 2015). Имеются данные, свидетельствующие, что бурозубки могут являться весьма эффективными хищниками чешуекрылых и пилильщиков в стадии кокона (Buckner, 1955, 1969; Holling, 1959; Королькова, 1977; Hanski, Parviainen, 1985). В полевых экспериментах в Западной Финляндии доля изъятия коконов сосновых пилильщиков мелкими млекопитающими (преимущественно средней бурозубкой и рыжей полевкой) положительно коррелировала с численностью последних в малопродуктивных типах леса. В высокопродуктивных типах леса подобная связь не проявлялась, несмотря на более высокую численность зверьков, вероятно, из-за большего обилия альтернативной пищи (Hanski, Parviainen, 1985).
Относительная биомасса других групп беспозвоночных по отдельности, включая составлявших их основную массу сенокосцев, не проявила достоверной связи с численностью бурозубок. Анализ воздействия бурозубок на численность сенокосцев ранее проводился в Карелии, где эти беспозвоночные также многочисленны и активно потребляются насекомоядными (Макаров, Ивантер, 2016). По данным авторов этого исследования, бурозубки начинают питаться сенокосцами после достижения последними определенного размера, различные виды землероек при этом включаются в потребление сенокосцев в разное время. В итоге наибольший пресс хищников на этих паукообразных приходится на период максимума численности жертв, и ущерб, нанесенный им землеройками невелик. Обилие сенокосцев в Карелии проявляло обратную зависимость от численности бурозубок лишь в сравнении между биотопами. В обследованном на побережье Охотского моря лиственничнике наблюдалась явная тенденция к отрицательной связи между численностью бурозубок и биомассой сенокосцев в августе. Исключение составил 2013 г., когда, несмотря на высокую численность зверьков, биомасса сенокосцев также была высока. Таким образом, в районе исследований бурозубки, по всей видимости, могут оказывать весомое влияние на динамику численности этих беспозвоночных.
Жировая ткань представителей рода Sorex весьма своеобразна. Как показано на примере S. araneus и S. minutus, почти все жировые отложения бурозубок обладают схожей гистологической структурой, характерной для бурого жира (Hyvärinen, 1994). Бурая жировая ткань в структурном, метаболическом и функциональном отношении отличается от белой, основная ее функция – продукция тепла. В то же время ряд косвенных фактов свидетельствует, что жировая ткань этих насекомоядных выполняет и функции белого жира (Hyvärinen, 1994; Киселев, 2017б). Предполагалось (Киселев, 2017б), что эта ткань у бурозубок, по крайней мере частично, может быть представлена так называемыми бежевыми, или брайт (от brown in white) адипоцитами. Для прояснения особенностей организации и функционирования жировой ткани бурозубок необходимы специальные исследования. В данном случае важно, что масса жировых резервов, по крайней мере, в теплое время года может быть хорошим показателем кормовых условий зверьков (Докучаев, 1990). Жировая ткань у бурозубок очень лабильна. Обильное питание содержащихся в неволе животных, приводит к быстрому депонированию больших количеств жировых отложений (Докучаев, 1990; Киселев, неопубликованные данные). Так, уже после 2-х суток передержки в неволе (при комнатной температуре) масса паховой и межлопаточной жировой ткани у сеголеток S. isodon (n = 94) в среднем превышала таковую у зверьков в естественной среде более чем в два раза, у S. caecutiens (n = 12) – более чем в три раза. Отсутствие доступа к пище, напротив, приводит к быстрой выработке жировых резервов. Восьмичасовое голодание в эксперименте значительно снижало массу жировой ткани S. isodon (Киселев, 2017б). В естественной среде скорость выработки жировых резервов при голодании у животных еще выше. Как было продемонстрировано на примере S. araneus, низкие температуры среды, высокая активность особей и некоторые другие факторы повышают интенсивность обмена веществ бурозубок, в естественных условиях она близка к предельно возможной для вида (Ochocińska, Taylor, 2005). У особей, погибших от голода в живоловках и конусах без воды, а также в давилках, в случае попадания хвостом или лапой, жировые отложения практически отсутствуют (Докучаев, 1990). Из-за низких температур среды и гораздо меньших исходных запасов резервных энергетических веществ длительность жизни бурозубок после начала голодания в этом случае существенно ниже, чем при содержании в неволе (Докучаев, 1990; Shchipanov et al., 2019). Высокий уровень жирового обмена бурозубок недавно был продемонстрирован экспериментально на основе анализа стабильных изотопов углерода в дыхании S. araneus (Keicher et al., 2017). Полное обновление всех жировых резервов S. araneus в этом исследовании происходило всего за 9–24 ч, а расчетное время их выработки в отсутствии доступа к пище составляло от 4.2 до 11 ч в разных возрастных группах. Очевидно также, что различные кормовые объекты должны оказывать неодинаковое влияние на интенсивность накопления жировых резервов этими насекомоядными. Масса жировой ткани, таким образом, может послужить хорошим индикатором условий питания бурозубок, хотя и некоторые другие факторы, приводящие к увеличению энергетических затрат, способны оказывать влияние на жировые запасы зверьков. Так, например, их уменьшение отмечалось во время линьки (Докучаев, 1990), при понижении окружающей температуры (Киселев, неопубликованные данные).
В июле достоверной связи массы жировой ткани с численностью бурозубок выявлено не было. В августе масса жировых резервов S. caecutiens не проявила значимой связи с собственной численностью, но достоверно (отрицательно) коррелировала с общей для разных видов бурозубок численностью, а также (положительно) с биомассой определенных кормовых объектов – личинок насекомых (прежде всего гусеницеобразных, составлявших основную массу личинок в сборах). Таким образом, можно заключить, что наблюдаемые отличия по упитанности S. caecutiens в годы с различными уровнями численности бурозубок, являются проявлением конкурентных отношений. Личинки насекомых, по всей видимости, характеризуются высокой питательной ценностью. Они являются важными предпочитаемыми кормовыми объектами бурозубок (Королькова, 1977; Churchfield, 1982; Churchfield, Sheftel, 1994; Вольперт, Шадрина, 2002; Докучаев и др., 2015; Ивантер и др., 2015). Обилие гусениц чешуекрылых и личинок пилильщиков, однако, также могло коррелировать с обилием их куколок/коконов, которые не могли быть учтены используемыми методами сбора беспозвоночных. Имеются и другие данные, свидетельствующие о влиянии доступности личинок насекомых на жировые запасы бурозубок. Н.Е. Докучаевым (1990) отмечалось быстрое снижение массы жировой ткани S. isodon в тополево-чозениевом лесу после вылета комаров-долгоножек (Tipulidae), обилие личинок и куколок которых до этого было высоким.
Тот факт, что зависимость упитанности S. caecutiens от численности бурозубок отмечалась как на побережье Охотского моря, так и в континентальной части Северо-Восточной Азии (верховья Колымы) (Киселев и др., 2013) свидетельствует, что эта особенность является общей для большей части региона. Во всяком случае, в предпочитаемых S. caecutiens биотопах – лиственничниках в годы высокой численности землеройки оказывают весомое воздействие на кормовые объекты (по крайней мере, привилегированные). В обоих районах отлов бурозубок осуществлялся с помощью конусов. Известно, что в эти ловушки в основном попадаются нерезидентные особи (Щипанов и др., 2003). В связи с этим ранее предполагалось, что наблюдаемые признаки ухудшения питания бурозубок в годы их высокой численности могли быть следствием трудностей в поиске свободной территории молодыми расселяющимися зверьками (Киселев и др., 2013). Отсутствие индивидуального участка могло препятствовать стабильной добыче корма. Связь обилия бурозубок и беспозвоночных, выявленная на побережье Охотского моря, однако, предполагает, что ухудшению питания в годы высокой численности животных подвергаются не только нерезиденты. Зависимость упитанности бурозубок от уровня их численности отмечалась и другими авторами, использовавшими для отлова животных иной тип ловушек. В Западной Финляндии (Norrdahl, Korpimӓki, 2002) и в европейской части России (Толкачев, 2007) индекс упитанности (отношение массы к длине тела) обыкновенных бурозубок, пойманных при помощи давилок, находился в обратной зависимости от плотности их популяций. Это, с одной стороны, подтверждает, что ухудшение питания зверьков в годы их высокого обилия характерно и для оседлых особей, с другой – свидетельствует, что эта зависимость не уникальна для Северо-Восточной Азии. Высокому воздействию животных на кормовую базу во многом может способствовать отсутствие специфического поведения, направленного на защиту участков обитания. Землеройки рода Sorex, по-видимому, не охраняют свою территорию в летний период (Олейниченко, 2007, 2012; Shchipanov et al., 2019; Щипанов, 2021). Влиять на энергетические резервы бурозубок и интенсивность эксплуатации ими кормовых ресурсов, возможно, способны также социальные взаимодействия особей, частота которых увеличивается с повышением численности зверьков. Социальные контакты между кон- и гетероспецификами, значительную долю которых составляют агрессивные взаимодействия (Калинин и др., 1998; Калинин, Щипанов, 2003; Олейниченко, 2007), вероятно, являются энергетически затратными для бурозубок (Ochocińska, Taylor, 2005; Олейниченко, 2007; Щипанов, 2021). Для поддержания жизнедеятельности в условиях повышенных энергозатрат необходимо больше пищевых ресурсов, в связи с чем нагрузка на кормовую базу при высоком обилии животных может возрастать дополнительно.
Содержание гликогена в печени у млекопитающих – очень вариабельный, зависящий от многих факторов параметр. Экспериментально было выявлено, что гликоген печени у бурозубок довольно быстро вырабатывается во время плавания в холодной воде (неопубликованные данные). Животные, погибшие в конусах, таким образом, имеют лишь остаточные количества гликогена. Все же эти значения, вероятно, коррелируют с таковыми у зверьков до попадания в ловушки. По крайней мере, половозрастные различия по содержанию гликогена в печени у отловленных конусами бурозубок соответствовали таковым у живых зверьков, содержавшихся в неволе.
В верховьях Колымы на фоне уменьшения массы жировых резервов бурозубок с увеличением их численности уровень гликогена в печени зверьков, напротив, повышался (Киселев и др., 2013). Предполагалось, что данная особенность была следствием нерегулярного питания (увеличения промежутков времени между приемами пищи) животных в годы их высокого обилия. Содержание гликогена в печени у млекопитающих довольно быстро истощается при голодании, однако при длительном доступе к высококалорийной пище после голодания уровень этого углевода сильно возрастает и может кратно превышать таковой в норме (Mosin, 1982; Nur et al., 1995). Аналогичная особенность была отмечена и у бурозубок (Киселев, 2017б). На побережье Охотского моря, однако, связи содержания гликогена в печени с численностью S. caecutiens выявлено не было. Причина отличий между районами в динамике содержания гликогена печени животных точно не ясна, возможно, это связано с различиями в обилии и составе кормовых объектов бурозубок. В обследованной части верховьев Колымы, по визуальной оценке, биомасса и разнообразие беспозвоночных выше, чем на побережье. Содержание гликогена в печени и масса жировых резервов у бурозубок на Колыме также в целом были больше (Киселев, 2017а). Как отмечалось выше, накопить чрезмерное количество гликогена печени способны лишь особи, получившие после голодания длительный доступ к калорийной пище. Этого может не происходить, если в годы высокой численности зверьки испытывают трудности с поиском питательного корма постоянно.
Результаты данного и более ранних исследований свидетельствуют, что на Северо-Востоке Азии упитанность S. caecutiens снижается в годы высокой численности бурозубок. Масса жировых резервов средней бурозубки в конце летнего периода проявила положительную связь с обилием определенных беспозвоночных. Относительная биомасса кормовых объектов, в свою очередь, находилась в обратной зависимости от численности бурозубок. Таким образом, ухудшение физиологического состояния зверьков в годы их высокой численности, по всей видимости, является следствием обострения конкуренции за пищевые ресурсы. Не исключено, однако, что и некоторые другие плотностно-зависимые факторы, в частности социальные взаимодействия и конкуренция за пространство, также могут оказывать определенное влияние на энергетические резервы животных. Масса жировой ткани S. caecutiens и обилие напочвенных беспозвоночных в этом исследовании проявили связь не столько с численностью данного вида, сколько с численностью всех видов бурозубок в совокупности, что может свидетельствовать не только о внутри-, но и межвидовых конкурентных отношениях.
Выявленные особенности предполагают, что пищевая конкуренция является важным компонентом плотностно-зависимой регуляции численности бурозубок. Наибольшую зависимость от обилия зверьков среди беспозвоночных проявили личинки насекомых, по-видимому, обладающие высокой питательной ценностью. Недостаток питательного корма в условиях повышенных энергетических затрат на социальные взаимодействия может способствовать высокой смертности животных.
Благодарности. Автор выражает искреннюю признательность Н.Е. Докучаеву (ИБПС ДВО РАН) за помощь в определении таксономической принадлежности беспозвоночных, за сведения по пищевым предпочтениям бурозубок и комментарии к работе.
Финансирование. Исследование выполнено при частичной финансовой поддержке РФФИ (гранты 15-04-02668 и 18-04-00579).
Список литературы
Берман Д.И., Бухкало С.П. Население почвообитающих беспозвоночных животных пояса редколесий бассейна Верхней Колымы // Пояс редколесий верховий Колымы (район строительства Колымской ГЭС). Владивосток: ДВНЦ АН СССР, 1985. С. 64–90.
Бобрецов А.В., Лукьянова Л.Е., Петров А.Н., Быховец Н.М. Периодические изменения численности средней бурозубки (Sorex caecutiens, Eulipotyphla) в предгорной тайге Северного Урала и факторы ее популяционной динамики // Экология. 2020. № 3. С. 224–229.
Бухкало С.П. Функциональная и пространственная структура населения почвенных беспозвоночных в лиственничных сообществах северо-востока Азии // Изв. РАН. Сер. биол. 2009. № 4. С. 445–452.
Вольперт Я.Л., Шадрина Е.Г. Мелкие млекопитающие северо-востока Сибири. Новосибирск: Наука, 2002. 246 с.
Докучаев Н.Е. Питание землероек-бурозубок (Soricidae) и оценка их роли в горно-таежных экосистемах Северо-Восточной Сибири // Экология млекопитающих Северо-Восточной Сибири. М.: Наука, 1981. С. 3–22.
Докучаев Н.Е. Сезонные изменения веса тела у средней и крупнозубой бурозубок в Северо-Восточной Сибири // Бюл. МОИП. Отд. Биол. 1983. Т. 88. Вып. 2. С. 36–42.
Докучаев Н.Е. Экология бурозубок Северо-Восточной Азии. М.: Наука, 1990. 160 с.
Докучаев Н.Е., Емельянова Л.Г., Орехов П.Т. Бурозубки бассейна р. Надым (север Западной Сибири) // Сиб. экол. журн. 2015. № 1. С. 63–69.
Ивантер Э.В., Макаров А.М. Пространственная организация популяций землероек-бурозубок (Sorex, Insectivora) и ее связь с кормностью биотопов // Зоол. журн. 1994. Т. 73. № 9. С. 124–138.
Ивантер Э.В., Коросов А.В., Макаров А.М. К изучению трофических связей мелких насекомоядных млекопитающих // Зоол. журн. 2015. Т. 94. № 6. С. 711–722.
Калинин А.А., Демидова Т.Б., Олейниченко В.Ю., Щипанов Н.А. Сезонная динамика численности землероек-бурозубок (Insectivora, Soricidae) // Зоол. журн. 2008. Т. 87. № 2. С. 218–225.
Калинин А.А., Щипанов Н.А. Плотностно-зависимое поведение землероек-бурозубок (Sorex araneus, S. caecutiens и S. minutus) в естественных и экспериментальных условиях // Изв. РАН. Сер. биол. 2003. № 6. С. 689–697.
Калинин А.А., Щипанов Н.А., Демидова Т.Б. Поведение четырех видов землероек-бурозубок Sorex isodon, S. araneus, S. caecutiens и S. minutus (Insectivora, Soricidae) при межвидовых контактах // Зоол. журн. 1998. Т. 77. № 7. С. 838–849.
Киселев С.В. Физиологические показатели бурозубок Охотско-Колымского края // Чтения памяти академика К.В. Симакова. Матер. докл. Всерос. научн. конф. (Магадан, 22–24 ноября 2017 г.). Магадан: ИП Жарикова Т. В., 2017а. С. 143–146.
Киселев С.В. Физиологический ответ равнозубой бурозубки (Sorex isodon) на голодание и возобновление питания // Ж. эвол. биохим. и физиол. 2017б. Т. 53. № 4. С. 288–294.
Киселев С.В. Динамика численности и структура сообщества бурозубок в окрестностях г. Магадан (северное побережье Охотского моря) // Сиб. экол. журн. 2019. № 5. С. 564–574.
Киселев С.В., Лазуткин А.Н., Ямборко А.В. Некоторые физиолого-биохимические показатели сеголеток средней (Sorex caecutiens Laxmann) и равнозубой (Sorex isodon Turov) бурозубок при разной плотности популяции // Изв. РАН. Сер. биол. 2013. № 4. С. 485–494.
Киселев С.В., Ямборко А.В. Динамика численности средней (Sorex caecutiens) и равнозубой (Sorex isodon) бурозубок в бассейне Верхней Колымы // Зоол. журн. 2014. Т. 93, № 9. С. 1106–1116.
Клюкин Н.К. Климат // Север Дальнего Востока. М.: Наука, 1970. С. 101–132.
Королькова Г.Е. Влияние землероек-бурозубок на беспозвоночных животных лесной подстилки и почвы // Роль животных в функционировании экосистем (Матер. совещания). М.: Наука, 1975. С. 140–143.
Королькова Г.Е. Мелкие млекопитающие северотаежных биогеоценозов // Основные типы биогеоценозов северной тайги. М.: Наука, 1977. С. 260–269.
Макаров А.М., Ивантер Э.В. Размерные особенности жертв и их роль в питании землероек-бурозубок (Sorex L.) // Экология. 2016. № 3. С. 236–240.
Моралева Н.В. К проблеме межвидовых отношений близких видов землероек-бурозубок (Insectivora, Sorex) // Фауна и экология птиц и млекопитающих Средней Сибири. М.: Наука, 1987. С. 213–228.
Олейниченко В.Ю. Поведение сеголеток обыкновенной (Sorex araneus), средней (Sorex caecutiens) и малой (Sorex minutus) бурозубок на освоенной и чужой территориях // Зоол. журн. 2007. Т. 86. № 10. С. 1259–1271.
Олейниченко В.Ю. Поведенческие взаимоотношения взрослых самок обыкновенной бурозубки (Sorex araneus) с конспецификами на освоенной территории // Изв. РАН. 2012. № 4. С. 420–429.
Толкачев О.В. Воздействие урбанизации на население бурозубок лесных экосистем: Автореф. дис. канд. биол. наук. Екатеринбург, 2007. 25 с.
Шилов И.А. Экология. М.: Высш. шк., 1998. 512 с.
Щипанов Н.А. Случайные процессы и использование территории обыкновенной бурозубкой (Sorex araneus L.) // Экология. 2021. № 2. С. 153–160.
Щипанов Н.А., Купцов А.В., Калинин А.А., Олейниченко В.Ю. Конуса и живоловки ловят разных землероек-бурозубок (Insectivora, Soricidae) // Зоол. журн. 2003. Т. 82. № 10. С. 1258–1265.
Bellocq M.I., Bendell J.F., Innes D.G.L. Diet of Sorex cinereus, the masked shrew, in relation to the abundance of Lepidoptera larvae in northern Ontario // Am. Midl. Nat. 1994. Vol. 132. № 1. P. 68–73.
Bellocq M.I., Smith S.M. Population dynamics and foraging of Sorex cinereus (masked shrew) in the boreal forest of eastern Canada // Ann. Zool. Fennici. 2003. V. 40. № 1. P. 27–34.
Buckner C.H. Small mammals as predators of sawflies // Canad. Entomol. 1955. V. 87. № 3. P. 121–123.
Buckner C.H. The common shrew (Sorex araneus) as a predator of the winter moth (Operophtera brumata) near Oxford, England // Canad. Entomol. 1969. V. 101. № 4. P. 370–375.
Churchfield S. Food availability and diet of the common shrew, Sorex araneus, in Britain // J. Anim. Ecol. 1982. V. 51. № 1. P. 15–28.
Churchfield S., Hollier J., Brown V.K. The effects of small mammal predators on grassland invertebrates, investigated by field exclosure experiment // Oikos. 1991. V. 60. № 3. P. 283–290.
Churchfield S., Nesterenko V.A., Shvarts E.A. Food niche overlap and ecological separation amongst six species of coexisting forest shrews (Insectivora: Soricidae) in the Russian Far East // J. Zool. Lond. 1999. V. 248. № 3. P. 349–359.
Churchfield S., Sheftel B.I. Food niche overlap and ecological separation in a multi-species community of shrews in the Siberian taiga // J. Zool. Lond. 1994. V. 234. № 1. P. 105–124.
Davidson M.B., Berliner J.A. Acute effects of insulin on carbohydrat metabolism in rat liver slices: independence from glucagon // Amer. J. Physiol. 1974. V. 227. № 1. P. 79–87.
Fox B.J., Kirkland G.L., Jr. An assembly rule for functional groups applied to North American soricid communities // J. Mammal. 1992. V. 73. № 3. P. 491–503.
Genoud M. Energetic strategies of shrews: ecological constrains and evolutionary implications // Mammal Rev. 1988. V. 18. № 4. P. 173–193.
Hanski I., Parviainen P. Cocoon predation by small mammals, and pine sawfly population dynamics // Oikos. 1985. V. 45. № 1. P. 125–136.
Henttonen H., Haukisalmi V., Kaikusalo A., Korpimäki E., Norrdahl K., Skaren U.A.P. Long-term population dynamics of the common shrew Sorex araneus in Finland // Ann. Zool. Fenn. 1989. № 26. P. 349–355.
Holling C.S. The components of predation as revealed by a study of small mammal predation of the European pine sawfly // Canad. Entomol. 1959. V. 91. № 5. P. 293–320.
Huitu O., Norrdahl K., Korpimäki E. Competition, predation and interspecific synchrony in cyclic small mammal communities // Ecography. 2004. V. 27. № 2. P. 197–206.
Hyvärinen H. Brown fat and the wintering of shrews / Advances in the biology of shrews / Eds Merritt J.F., Kirkland G.L. Jr., Rose R.K.: Carnegie Mus. Nat. Hist. Spec. publ. 1994. V. 18. P. 259–266.
Kaikusalo A., Hanski I. Population dynamics of Sorex araneus and S. caecutiens in Finnish Lapland // Acta Zool. Fennica. 1985. № 173. P. 283–285.
Keicher L., O’Mara M.T., Voigt C.C., Dechmann D.K.N. Stable carbon isotopes in breath reveal fast metabolic incorporation rates and seasonally variable but rapid fat turnover in the common shrew (Sorex araneus) // J. Exp. Biol. 2017. V. 220 (Pt 15). P. 2834–2841.
Kirkland G.L., Jr. Competition and coexistence in shrews (lnsectivora: Soricidae) / The biology of the Soricidae / Eds Findley J.S., Yates T.L. Albuquerque: Spec. Publ. Museum Southwestern Biol. Univ. New Mexico. 1991. P. 15–22.
Klenovšek T., Novak T., Čas M., Trilar T., Janžekovič F. Feeding ecology of three sympatric Sorex shrew species in montane forests of Slovenia // Folia Zool. 2013. V. 62. № 3. P. 193–199.
Mosin A.F. Some physiological and biochemical features of starvation and refeeding in small wild rodents // Comp. Biochem. Physiol. A. 1982. V. 71. № 3. P. 461–464.
Namba T., Ohdachi S.D. Top-down cascade effects of the long-clawed shrew (Sorex unguiculatus) on the soil invertebrate community in a cool-temperate forest // Mammal Study. 2016. V. 41. № 3. P. 119–130.
Norrdahl K., Korpimӓki E. Changes in individual quality during a 3-year population cycle of voles // Oecologia. 2002. V. 130. № 2. P. 239–249.
Nur T., Sela I., Webster N.J., Madar Z. Starvation and refeeding regulate glycogen synthase gene expression in rat liver at the posttranscriptional level // J. Nutr. 1995. V. 125. № 10. P. 2457–2462.
Ochocińska D., Taylor J.R.E. Living at the physiological limits: field and maximum metabolic rates of the common shrew (Sorex araneus) // Physiol. Biochem. Zool. 2005. V. 78. № 5. P. 808–818.
Pernetta J.C. Diets of the shrews Sorex araneus L. and Sorex minutus L. in Wytham grassland // J. Anim. Ecol. 1976. V. 45. № 3. P. 899–912.
Shchipanov N.A., Zima J., Churchfield S. Introducing the Common Shrew / Shrews, Chromosomes and Speciation (Cambridge Studies in Morphology and Molecules: New Paradigms in Evolutionary Bio) / Eds Searle J., Polly P., & Zima J. Cambridge: Cambridge University Press, 2019. P. 19–67.
Sheftel B.I. Long-term and seasonal dynamics of shrews in Central Siberia // Ann. Zool. Fennici. 1989. V. 26. № 4. P. 357–369.
Taylor J.R.E. Evolution of energetic strategies in shrews // Evolution of shrews. Białowieża: Mammal Res. Inst. PAS, 1998. P. 309–346.
Zakharov V.M., Demin D.V., Baranov A.S., Borisov V.I., Valetsky A.V., Sheftel B.I. Development stability and population dynamics of shrews Sorex in central Siberia // Acta Theriol. 1997. V. 42. Suppl. 4. P. 41–48.
Zakharov V.M., Pankakoski E., Sheftel B.I., Peltonen A., Hanski I. Developmental stability and population dynamics in the common shrew, Sorex araneus // Amer. Nat. 1991. V. 138. № 4. P. 797–810.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


