Известия РАН. Серия биологическая, 2022, № 2, стр. 219-224
Влияние ионов Zn2+ на активность кислых нуклеаз пресноводных моллюсков
Т. С. Дроганова 1, *, Л. В. Поликарпова 1, Е. А. Тишина 1, М. Анка 1, Д. Б. Петренко 1, Н. В. Васильев 1
1 ГОУ ВО МО Московский государственный областной университет
141014 Московская обл., Мытищи, ул. Веры Волошиной, 24, Россия
* E-mail: ecolab@mgou.ru
Поступила в редакцию 24.06.2021
После доработки 28.09.2021
Принята к публикации 28.09.2021
- EDN: LWJJIR
- DOI: 10.31857/S1026347022020056
Аннотация
Исследовано действие повышенных концентраций ионов Zn2+ на активность комплекса кислых дезоксирибонуклеаз (ДНКаз) и рибонуклеаз (РНКаз) гепатопанкреаса моллюска живородка речная (Viviparus viviparus L.). Выявлено увеличение активности кислых ДНКаз при воздействии Zn2+. Прослеживается антисимбатная зависимость изменения активности кислых ДНКаз от концентрации цинка в гепатопанкреасе моллюсков. Характер активности РНКаз под действием ионов Zn2+ является менее показательным. Характер изменения активности кислых ДНКаз у подопытных животных показывает, что данный биохимический показатель может быть использован в качестве маркера токсического воздействия на живые организмы в эколого-биохимическом мониторинге загрязнений пресных вод.
Цинк входит в кофакторы более, чем 300 ферментов, функционирующих в клетках живых организмов и относящихся к шести основным классам (Sigel, 1983; Andreini, Bertini, 2012), является микроэлементом и выполняет каталитическую (например, карбоангидраза, карбоксипептидаза, щелочная фосфатаза), сокаталитическую (например, фосфолипаза С, нуклеаза Р1, лейкиламинопептидаза) или структурную функции (например, аспартаткарбамоилтрансфераза) (McCall et al., 2000; Stefanidou et al., 2006; Crichton, 2012; Le Pabic, 2014; Шейбак, 2016). Он является мембранным стабилизатором (Oje et al., 2010). Цинк не токсичен при низких концентрациях, но, как и большинство микроэлементов, в высоких концентрациях влияет на деление, рост и развитие клеток микроорганизмов, растений и животных, а также на половое созревание.
Антропогенными источниками поступления цинка в природные воды являются городской сток, автотранспорт, промышленные стоки металлургических и нефтеперерабатывающих предприятий (ATSDR, 2005). Проблема превышения концентраций цинка в природных водах поднимается достаточно регулярно (Oje et al., 2010; Wojtkowska et al., 2016), однако у биологов и особенно медиков в большей степени вызывают озабоченность возможные нарушения здоровья населения. Практически малоизученными остаются вопросы, связанные с биохимическим воздействием цинка на гидробионтов. В данной связи выявление биохимического воздействия этого распространенного экополлютанта на гидробионтов представлялось целесообразным.
В большинстве исследований, проведенных на рыбах и описывающих механизмы воздействия цинка, показано, что основная причина интоксикации цинком связана с нарушением гомеостаза кальция. Описано, что ионы Zn2+ способны действовать по принципу подмены метаболита и имитировать ионы Ca2+, проникать в клетку через кальциевые каналы жаберных клеток, что приводит к гипокальциемии путем конкурентного торможения (Hughes; Barritt, 1989; Ballatori, 2002; Hogstrand, 2012). При острых поражениях это приводит к значительным функциональным и структурным деградациям жабр, например, гиперсекреции, гипертрофии, гиперплазии, которые заканчиваются асфиксией (Le Pabic, 2014).
Биологические эффекты цинка зависят от формы поступления цинка в водоемы. В воде ионы металла могут находиться в виде гидратированных ионов Zn2+ или комплексов с различными органическими или неорганическими лигандами, поскольку цинк является сильным комплексообразователем (Hogstrand, 2012). Из всех форм цинка, обнаруженных в водной среде, гидратированные ионы Zn2+ определены как наиболее биодоступные и токсичные (Roesijadi, Robinson, 1994; ANZECC, 2000; Hogstrand, 2012; Wojtkowska et al., 2016).
В ряду тяжелых металлов, например, в сравнении с медью или кадмием, цинк не является самым токсичным для пресноводных мидий, но он накапливается в поверхностных водах до более высоких концентраций, при воздействии которых вызывает острые нарушения биохимических реакций или даже гибель водных организмов (Grabarkiewicz, Davis, 2008).
В настоящей работе изучение биохимического воздействия цинка проводили на моллюске живородка речная Viviparus viviparus L., который распространен в Европейской части России и использование которого как индикаторного вида к токсическому воздействию обосновано в ряде работ (Gomot de Vaufleury, 2000; Цветков, Коничев, 2006; Nica et al., 2012; Дроганова и др., 2017; Уваева, Шимкович, 2017). Целью исследования было выявление изменений активности под влиянием ионов Zn2+ комплекса кислых дезоксирибонуклеаз (ДНКаз) и рибонуклеаз (РНКаз) живородки речной Viviparus viviparus L., которые чувствительны к концентрационным изменениям веществ и активно реагируют на изменения состава природных вод. Нуклеазы не участвуют в метаболизме токсикантов в клетках, однако, являясь ферментами деполимеризации нуклеиновых кислот, играют существенную роль в обмене веществ в целом, что дает возможность охарактеризовать общее состояние гомеостаза организма и осуществлять оценку состояния водного объекта. Предполагалось, что изучение ДНКаз моллюска позволило бы осуществлять раннюю диагностику токсических воздействий на гидробионтов еще до появления у них физиологических, поведенческих и морфологических проявлений в ответ на такое воздействие.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор животных осуществляли в Пестовском водохранилище (село Тишково Пушкинского района Московской области, 56°05′11.1′′ N, 37°44′21.9′′ E). Акклимацию их проводили в лабораторном аквариуме объемом 150 л с водными растениями из места сбора в условиях, близких к естественным, с постоянной аэрацией и освещением в течение двух недель. После этого проводили токсикологический эксперимент. Собранных моллюсков делили на контрольную и опытную группы. Опытных животных подвергали воздействию Zn2+ в концентрации, соответствующей 2 ПДК (для Zn2+ ПДКхоз-быт = 5 мг/л) (СанПиН 1.2.3685-21).
Экспозиция опыта составляла 0, 2, 4, 6, 12, 24, 48, 72 и 96 ч. Контролем служили животные, отобранные непосредственно перед началом эксперимента (при экспозиции 0 ч), а также моллюски, содержащиеся в воде без внесения токсиканта при прочих равных условиях в течение тех же временных интервалов. При проведении эксперимента использовали 110 особей моллюсков (по 55 в контрольной и опытной группах). По истечении установленного времени экспозиции отбирали из обеих групп по 5–6 животных, путем вивисекции извлекали пищеварительную железу (гепатопанкреас), из которой получали экстракт водорастворимых белков растиранием при охлаждении с битым кварцевым стеклом. В качестве экстрагирующей жидкости использовали 0.5%-ный раствор Тriton Х-100 (10-кратный объем по отношению к навеске ткани). Белковые экстракты очищали центрифугированием в рефрижераторной центрифуге “Eppendorf 5417 R” при 6700 g и 4°С в течение 30 мин, затем отделяли супернатант (Fafanđel et al., 2008; Дроганова и др., 2017; Kovačić et al., 2017).
Концентрацию белка в полученных экстрактах определяли по методу Лоури (Lowry et al., 1951).
Активность ДНКазы оценивали c помощью флуориметрического метода, используя в качестве субстрата синтетический одноцепочечный олигодезоксирибонуклеотидный фрагмент Rsol-P (TTCGCCTACGAATTTCAAGCC), меченный парой флуорофоров: сигнальным красителем 6-FAM (6-карбоксифлуоресцеин, λмакс.поглощения = 490 нм, λмакс. флуоресценции = 520 нм) на 5'-конце и тушителем флуоресценции BHQ-1 (Black Hole Quencher, λмакс. поглощения = 535 нм, диапазон гашения 480–580 нм) на 3'-конце (аналогично зондам TaqMan-типа) (Цветков и др., 2012).
Для определения активности ДНКазы в пробирке смешивали 1 мл ацетатного буфера (рН 4.6) и 50 мкл белкового экстракта (разбавленного в 20 раз). В контрольную пробирку вместо белка вносили 1.5 мл 50 мМ ацетатного буфера. В каждую пробирку вносили по 5 мкл субстрата Rsol-P (“BioBeagle”). Смесь растворов инкубировали при комнатной температуре в течение 90 мин, после чего измеряли интенсивность флуоресценции на спектрофлуориметре “Флуорат-Панорама 02” при длинах волн 492 нм (поглощение света) и 520 нм (флуоресценция) для каждой точки экспозиции.
За единицу активности ДНКазы принимали такое количество фермента, которое катализировало превращение 1 моль субстрата за 1 мин.
Активность РНКазы определяли модифицированным методом Анфинсена по изменению оптического поглощения раствора, в котором находятся кислоторастворимые продукты гидролиза высокомолекулярной РНК.
Смесь для определения активности РНКазы содержала 50 мкл 0.2%-ного раствора РНК из пекарских дрожжей (“Sigma”, США), 400 мкл 50 мМ ацетатного буфера (pH 4.4) и 50 мкл белкового экстракта. Пробы инкубировали в течение 1 ч при 37°С, затем охлаждали 10 мин при 4°С, после чего негидролизованную РНК осаждали прибавлением 1 мл 0.15 М раствора MgCl2 (“Panreac”, США) в 75%-ном этаноле. Пробы выдерживали 1 ч на холоде для формирования осадка, после чего центрифугировали при 8000 g на рефрижераторной центрифуге “Hettich Universal 320 R” и 4°С в течение 20 мин. Декантировали супернатанты и измеряли их оптическую плотность против контроля, в который экстракт белков вносили после прибавления раствор–осадителя, при 260 нм на спектрофотометре “Thermo genesis 6” (Anfinsen et al., 1957).
За единицу активности РНКазы принимали такое количество фермента, которое вызывает увеличение поглощения раствора на единицу оптической плотности при 260 нм за 1 мин.
Удельную активность ферментов рассчитывали в единицах на 1 мг белка (Е/мг белка).
Содержание цинка в экстрактах, полученных из гепатопанкреаса моллюсков, определяли атомно-абсорбционным методом на спектрометре “Квант-2А” (ООО “КОРТЭК”, Россия) в пламени ацетилен-воздух по линии 213.8 нм с источником резонансного излучения (лампа с полым катодом) и дейтериевым корректором фонового поглощения.
Статистическую обработку результатов проводили по t-критерию Стьюдента с помощью MS Excel.
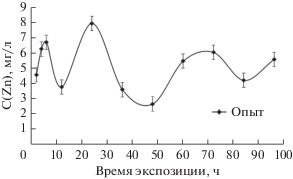
Результаты измерения ферментативной активности приведены на рис. 1 и 2, содержание цинка на рис. 3.
Рис. 1.
Изменение удельной активности ДНКазы в норме и при остром воздействии ионов Zn2+ в концентрации 10 мг/л. Результаты представлены в виде среднее значение ± среднеквадратичная ошибка (для рис. 1–3). Различия между значениями удельной активности фермента статистически значимы при р ≤ 0.01 в экспозиции 2, 4, 6, 12, 24, 48 и 96 ч.

РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во время проведения эксперимента не наблюдали гибель животных и/или приспособительного поведения (снижения или увеличения подвижности, выделения слизи, закрывания устья раковины крышечкой). Активность фермента не остается постоянной на протяжении эксперимента как у контрольной, так и у опытной групп исследованных животных вследствие естественных метаболических процессов в организме моллюсков и имеет фазовый характер, что является отражением процессов индукции и репрессии ферментов (рис. 1). Воздействие Zn2+ приводит к существенному ускорению биохимического ответа – увеличению активности ДНКазы по сравнению с контрольной группой животных. На протяжении эксперимента выявлено чередование фаз снижения и повышения активности. При этом в первые сутки эксперимента можно наблюдать резкое возрастание активности под воздействием токсиканта (от 0 до 6 ч), а затем снижение (от 6 до 24 ч). Далее, к 48 ч экспозиции вновь следует резкое увеличение активности фермента (до максимального значения). Минимальное значение активности ДНКазы отмечено при 72 ч экспозиции, в этот период она почти совпадает со значениями контрольных животных. В контрольной группе животных, содержавшихся в течение экспозиции без воздействия токсикантов, отмечались менее значимые колебательные изменения активности фермента в те же временные промежутки.
Fafanđel et al. (2008) также отмечают фазовый характер изменения активности кислой ДНКазы в гемоцитах и тканях пищеварительной железы моллюсков Mytilus galloprovincialis при воздействии бензина и ПАВ в концентрации 5 мг/л и при действии 250 мг/л сульфата меди.
Неоднозначные результаты получены для другого исследованного фермента – РНКазы. В целом, активность РНКазы несущественно изменяется при действии Zn2+. От 0 до 2 ч экспозиции величины активности в опытной и контрольной группах совпадают, затем активность фермента незначительно повышается в опытной группе моллюсков (от 2 до 12 ч). От 12 до 24 ч наблюдается прирост активности РНКазы в опытной группе животных, но, стоит отметить, что значения активности остаются ниже контрольных в интервале от 12 до 48 ч. Далее значения активности РНКазы в контрольной и опытной группах совпадают. К окончанию эксперимента активность фермента в опытной группе снижается. Минимального значения активность РНКазы достигает при 48 ч экспозиции. Чередование фаз снижения и повышения активности становится более выраженным в интервале от 12 до 96 ч (рис. 2).
Концентрация цинка определялась в экстрактах гепатопанкреаса испытуемых животных, выделенных в тех же временных интервалах (рис. 3). Оказалось, что количество цинка в гепатопанкреасе меньше, чем созданное в эксперименте в воде и также изменяется волнообразно. При этом вероятно, что ДНКаза участвует в адаптивном процессе при воздействии цинка, поскольку замечено, что ее активность обратно пропорциально зависит от концентрации цинка в тканях Еуд.(ДНКазы) ↔ С(Zn). Хотя статистически такая корреляция между полученными зависимостями прослеживается слабо, что характерно для биологических процессов.
В литературе описано, что ферменты гидробионтов, в том числе кислые ДНКазы, чувствительны к токсическому воздействию. Так, увеличение активности кислых ДНКаз в ответ на снижение качества воды отмечено в тканях мидий Crenomytilus grayanus (Мензорова, Рассказов, 2007) и Mytilus galloprovincialis (Kovačić et al., 2017). Ibrahim, Mahmoud (2005) в работе по изучению влияния тяжелых металлов на развитие патологических процессов в печени рыб Tilapia zillii, Clarias gariepinus и Mugil cephalus показали, что под действием ионов тяжелых металлов (Fe2+, Mn2+, Zn2+, Cu2+, Pb2+ и Cd2+) повышается активность таких ферментов как аспартатаминотрансфераза и аланинаминотрансфераза. На основани полученных нами данных, катионы цинка вызывают увеличение активности кислой ДНКазы живородки речной, и при этом возможно, что прирост активности является результатом опосредованного процесса.
Таким образом, уровень активности ДНКазы является информативным показателем физиологического состояния гидробионтов и может рассматриваться в качестве биохимического критерия для характеристики токсических свойств водной среды. Сравнительный анализ активности ДНКазы может быть использован в мониторинговых программах для биохимической индикации загрязнения водоемов, тогда как слабо выраженная динамика активности РНКазы, делает затруднительным ее использование для биохимической индикации загрязнения водоемов.
Результаты, полученные при изучении изменения активности нуклеаз под воздействием ионов Zn2+, не противоречат известным исследованиям активности ферментов у гидробионтов под влиянием токсикантов различной химической природы (Etxeberria et al., 1994; Au, 2004; Дроганова и др., 2017, 2019).
Список литературы
Дроганова Т.С., Коничев А.С., Петренко Д.Б., Поликарпова Л.В., Цветков И.Л. Влияние фторида натрия и фторуксусной кислоты на активность кислой ДНКазы, кислой фосфатазы и спектр растворимых белков гепатопанкреаса живородки речной // Вест. Моск. Государ. Област. Универ. Сер.: Естественные науки. 2017. № 4. С. 36–45. https://doi.org/10.18384/2310-7189-2017-4-36-45
Дроганова Т.С., Поликарпова Л.В., Коничев А.С. Белковые спектры печени живородки речной в норме и при интоксикации ионами свинца(II) // Теор. и прикл. экология. 2019. № 3. С. 109–113. https://doi.org/10.25750/1995-4301-2019-3-109-113
Мензорова Н.И., Рассказов В.А. Использование различных тест-систем и биохимической индикации для мониторинга экологического состояния бухты Троицы (Японское море) // Биология моря. 2007. Т. 33. № 2. С. 144–149.
СанПиН 1.2.3685-21 “Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания”.
Уваева Е.И., Шимкович Е.Д. Биоиндикационное значение популяционных характеристик живородок (Mollusca, Gastropoda, Viviparidae) в водоемах Центрального Полесья // Ученые записки Казанского университета. Сер. Естественные науки. 2017. Т. 159. № 3. С. 521–530.
Цветков И.Л., Коничев А.С. Экологическая биохимия гидробионтов. М.: Изд-во МГОУ, 2006. 104 с.
Цветков И.Л., Поликарпова Л.В., Коничев А.С. Новый метод количественного определения активности дезоксирибонуклеазы с использованием флуоресцентно меченых олигонуклеотидов в качестве субстрата // Вест. МГОУ. Сер.Естест. науки. 2012. № 3. С. 46–51.
Шейбак В.М. Биологическое значение и регуляция гомеостаза цинка у млекопитающих // Проблемы здоровья и экологии. 2016. № 4(50). С. 11–16.
Andreini C.A., Bertini I. Bioinformatics view of zinc enzymes // J. Inorg. Biochem. 2012. V. 111. P. 150–156. https:doi.org/https://doi.org/10.1016/j.jinorgbio.2011.11.020
Anfinsen C.B., Redfield R.R., Choate W.I., Page J., Carrol W.R. Studies of cross structure, cross-linkage and terminal sequences in ribonuclease // J. Biol. Chem. 1957. V. 207. P. 201–210.
ATSDR (Agency for Toxic Substances and Disease Registry). 2005. Toxicological profile: Zinc (online).
Au D.W.T. The application of histo-cytopathological biomarkers in marine pollution monitoring: a review // Marine Poll. Bull. 2004. V. 48. P. 817–834. https://doi.org/10.1016/j.marpolbul.2004.02.032
Australian and New Zealand Environment and Conservation Council. 2000. National water quality management strategy: An introduction to the Australian and New Zealand guidelines for fresh and marine water quality. ANZECC, Canberra.
Ballatori N. Transport of toxic metals by molecular mimicry // Environ. Health Persp. 2002. V.110. P. 689–694. https://doi.org/10.1289/ehp.02110s5689
Crichton R. Zinc – Lewis Acid and Gene Regulator. Biological Inorganic Chemistry (Second Edition). 2012. P. 229–246.
Etxeberria M., Sastre I., Cajaraville M.P., Marigómez I. Digestive lysosome enlargement induced by experimental exposure to metals (Cu, Cd, and Zn) in mussels collected from a zinc-polluted site // Arch. Environ. Contam. Toxicology. 1994. V. 27. P. 338–345. https://doi.org/10.1007/bf00213169
Fafanđel M., Bihari N., Perić L., Cenov A. Effect of marine pollutants on the acid DNase activity in the hemocytes and digestive gland of the mussel Mytilus galloprovincialis // Aquatic Toxicology. 2008. V. 86(4). P. 508–513. https://doi.org/10.1016/j.aquatox.2007.12.011
Gomot de Vaufleury A. Standardized growth toxicity testing (Cu, Zn, Pb, and Pentachlorophenol) with Helix aspersa // Ecot. Environ. Saf. 2000. V. 46. P. 41–50. https://doi.org/10.1006/eesa.1999.1872
Grabarkiewicz J., Davis W. An Introduction to Freshwater Mussels as Biological Indicators: Including Accounts of Interior Basin, Cumberlandian, and Atlantic Slope Species. United States Environmental Protection Agency. 2008 122 p. https://doi.org/10.13140/2.1.3580.2405
Hogstrand C. Zinc. Homeostasis and Toxicology of Essential Metals. 2012. 31A (11). P. 135–200.
Hughes B.P., Barritt, G.J. Inhibition of the liver cell receptor-activated Ca2+ inflow system by metal ion inhibitors of voltage-operated Ca2+ channels but not by other inhibitors of Ca2+ inflow // Biochim. Biophys.Acta. 1989. V. 101. P. 197–205. https://doi.org/10.1016/0167-4889(89)90135-3
Ibrahim S.A., Mahmoud S.A. Effect of heavy metals accumulation on enzyme activity and histology in liver of some Nile fish in Egypt // Egyptian J. Aquat. Biol. Fisheries. 2005. V. 9. P. 203–219. https://doi.org/10.21608/ejabf.2005.1824
Kovačić I., Fafanđel M., Perić L., Batel I. Effect of environmental pollutant mixtures on acid DNase activity in mussel Mytilus galloprovincialis: ex situ and in situ study // Bulletin Environ. Contam. Toxicology. 2017. 99. P. 433–437. https://doi.org/10.1007/s00128-017-2162-y
Le Pabic C. Effets du zinc sur la physiologie du stade juvénile de la seiche commune Sepia officinalis et étude du système immunitaire pour le développement d’outils in vitro // Ecotoxicologie. 2014. 237 p.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent // J. Biol. Chem. 1951. V. 193. № 1. P. 265–275. https://doi.org/10.1016/S0021-9258(19)52451-6
McCall K.A., Huang C., Fierke C.A. (2000). Function and mechanism of zinc metalloenzymes // J. nutrition, 130 5S Suppl, 1437–1446. https://doi.org/10.1093/jn/130.5.1437S
Nica D.V., Bura M., Gergen I., Harmanescu M., Bordean D.M. Bioaccumulative and conchological assessment of heavy metal transfer in a soil-plant-snail food chain // Chem. Cent. J. 2012. V. 6. P. 55–70. https://doi.org/10.1186/1752-153X-6-55
Oje O.A., Uzoegwu P.N., Onwurah I.N., Nwodo U.U. Environmental pollution levels of lead and zinc in Ishiagu and Uburu communities of Ebonyi State, Nigeria // Bull. Environ. Contamin. Toxicol. 2010. V. 85. P. 313–317. https://doi.org/10.1007/s00128-010-0082-1
Roesijadi G., Robinson W.E. Metal regulation in aquatic animals: mechanisms of uptake, accumulation, and release. In: Malins DC and Ostrander GK (eds.) // Aquatic toxicology: molecular, biochemical, and cellular perspectives. Lewis Publishers: Boca Raton. 1994. P. 387–420.
Sigel H. Metal ions in biological systems. 2020. V. 15. 520 p.
Stefanidou M., Maravelias C., Dona A., Spiliopoulou C.M. Zinc: a multipurpose trace element // Arch. Toxicology. 2006. V. 80. № 1. P. 1–9. https://doi.org/10.1007/s00204-005-0009-5
Wojtkowska M., Bogacki J., Witeska A. Assessment of the hazard posed by metal forms in water and sediments // Sci. Total Environ. 2016.V. 551–552. P. 387–392. https://doi.org/10.1016/j.scitotenv.2016.01.073
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая