Известия РАН. Серия биологическая, 2022, № 2, стр. 127-140
Филогеографическая структура домовой мыши Mus musculus на территории Восточной Европы и Азии по данным анализа контрольного региона (D-loop) мтДНК
А. Н. Мальцев 1, *, Е. В. Котенкова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский проспект, 33, Россия
* E-mail: mus-musculus@yandex.ru
Поступила в редакцию 01.10.2020
После доработки 20.07.2021
Принята к публикации 20.07.2021
- EDN: SFEFJL
- DOI: 10.31857/S1026347022020135
Аннотация
Исследовано 153 особи Mus musculus, у которых обнаружен 120 гаплотипов контрольного региона (D-петли) мтДНК. Выявлено 7 филогрупп. В Европе идентифицировано 4 группы, в Азии – 2, в Закавказье – 1. Территория Европы и Азии заселялась разными филогенетическими линиями. Выделенная нами “Сибирская” линия M. musculus расселялась на восток Азии вдоль крупных транспортных магистралей. Расселение М. musculus в Восточную Европу могло происходить из Закавказья как возможного центра происхождения M. musculus,. Не выявлено дифференциации подвидов М. musculus (M. m. wagneri, M. m. musculus, M. m. gansuensis). Популяции Восточной Европы неоднократно перемешивались в связи с расселением домовых мышей с помощью человека, тогда как Сибирь и Японию заселила лишь одна линия M. musculus. По нашим данным, филогенетическая линия домовых мышей из Закавказья оказалась монофилетичной, в отличие от некоторых других выделенных линий.
Анализ митохондриальной ДНК (мтДНК) разных групп животных широко применяется для изучения расселения представителей разных таксонов, их филогенетических взаимоотношений и эволюционной судьбы популяций (Avise, 2000). В надвидовой комплекс домовых мышей Mus musculus sensu lato входят две дивергентные группы: синантропных (M. musculus, Mus domesticus, Mus castaneus) и экзоантропных (Mus spicilegus, Mus macedonicus, Mus spretus, Mus cypriacus) (Boursot et al., 1993; Sage et al., 1993; Guènet, Bonhomme, 2003; Cucchi et al., 2006, 2020) видов. Синантропные таксоны парапатричны и скрещиваются в местах контакта ареалов, в то время как экзоантропные виды аллопатричны и симпатричны с синантропными (Sage et al., 1993). Систематика домовых мышей, в том числе и подвидовое деление, неоднократно обсуждались нами и другими исследователями (Sage et al., 1993; Bonhomme et al., 1994; Межжерин, 1994; Котенкова, 2000; Tucker et al., 2005; Спиридонова и др., 2008; Maltsev et al., 2015; Богданов и др., 2020). Это дает нам основание принять точку зрения о видовом таксономическом статусе M. musculus (L. 1758) и подвидовом M. m. musculus, M. m. wagneri, M. m. gansuensis. При построении филогенетических деревьев и сетей на основании анализа контрольного региона мтДНК и гена цитохрома b с помощью разных программ синантропные таксоны с высокой поддержкой выделяются в отдельные кластеры, каждый из которых может включать несколько отдельных линий (Yonekawa et al., 2003; Tucker et al., 2005; Susuki et al., 2013). Географическое распределение гаплотипов каждого из таксонов в целом соответствует полученным другими методами данным об их распространении (Suzuki et al., 2013).
Переход к синантропному образу жизни позволил трем видам домовых мышей заселить большие пространства. По мнению ряда авторов (Auffray et al., 1990; Tchernov, 1993; Cucchi et al., 2005; Kotenkova, Maltsev, 2012), неолитическая революция – т.е. переход человека к земледелию является ключевым фактором в эволюции этих видов. Тем не менее, к настоящему времени многие аспекты взаимосвязи развития сельского хозяйства, транспортных путей в истории человека с динамикой формирования синантропии и демографией M. musculus в историческом аспекте остаются недостаточно изученными (Cucchi, Vigne, 2006; Cucchi et al., 2012). С применением разных методов молекулярно-генетического анализа достаточно детально исследованы филогеография и филогенетические взаимоотношения M. domesticus (Gündüz et al., 2005; Rajabi-Maham et al., 2008; Bonhomme et al., 2010; Jones et al., 2011, 2013), а в географическом аспекте распределение по территории разных таксонов надвидового комплекса Mus musculus s.l. в Западной Европе (Searle et al., 2009; Bonhomme et al., 2010; Jones et al., 2010), некоторых регионах Центральной, Передней, Южной и отдельных областях Северной Азии (Yonekawa et al., 2003; Cпиридонова и др., 2008, 2011; Gündüz et al., 2001, 2005; Rajabi-Maham, 2012; Suzuki et al., 2013). Что касается M. musculus, то Сузуки и др. (Suzuki et al., 2013), показали наличие двух филетических групп (Mus-1, Mus-2) в Европе и Азии (на основании анализа цитохрома b и контрольного региона мтДНК), причем в первую из них входят три подгруппы. Наблюдается существенная степень привязанности этих подгрупп к определенным регионам, но отдельные гаплотипы могут встречаться на весьма значительном удалении (несколько сотен и даже тысяч км) друг от друга. В России и на территориях сопредельных стран, входящих ранее в СССР, проанализированы лишь, как правило, малочисленные выборки из крупных населенных пунктов. Найдены гаплотипы двух филетических групп M. musculus (Mus-1 с тремя подгруппами, Mus-2), а в Москве и Томске гаплотипы M. domesticus (Suzuki et al., 2013). Ранее у синантропных таксонов: M. musculus, M. domesticus и M. сastaneus обнаружены “видоспецифические” гаплотипы мтДНК (Yonekawa et al., 1981). В относительно небольшом числе исследованных выборок домовых мышей из России и сопредельных стран представлены преимущественно гаплотипы мтДНК M. musculus. И лишь на севере Дальнего Востока обнаружено присутствие мтДНК M. castaneus. Митохондриальный гаплотип M. domesticus на Дальнем Востоке встречается только в Приморском крае (Yonekawa et. al., 2003). Высказано предположение, что миграционный путь M. musculus в Китай проходил через Казахстан и мыши заселяли территории через северо-западную границу (Jing et al., 2014). Согласно полученным нами (Мальцев, 2011; Мальцев, Баженов, 2013; Maltsev et al., 2015) и другими исследователями (Yonekawa et al., 2003) результатам, при сравнительном анализе контрольного региона мтДНК, дифференциация между ранее выделенными подвидами M. m. musculus и M. m. wagneri отсутствовала. При изучении мтДНК не найдено существенных различий между популяциями M. musculus из Восточной Европы и Средней Азии (Prager et al., 1996, 1998; Geraldes et al., 2008). В данной работе мы сконцентрируемся преимущественно на филогеографической структуре, а не подвидовом делении этого вида, охватив весь ареал на евразийском континенте.
Информация о путях и сроках расселения домовых мышей по России и прилежащим территориям основана преимущественно на анализе путей и сроков их заселения людьми (Кучерук, 1994; Хляп, Варшавский, 2010). Как показали исследования с помощью молекулярно-генетических методов, в которых сопоставляли пути расселения M. domesticus и миграции человека, такой подход вполне оправдан (Jones et al., 2013). Ранее В.В. Кучерук (1994) собрал обширный материал и обобщил имеющиеся до 1990 г. сведения о распространении и расселении синантропных домовых мышей на территории бывшего СССР. Сопоставление пунктов регистрации домовых мышей было взаимосвязано со следующими особенностями жизни и деятельности человека: мыши не были найдены в местах, где плотность населения меньше одного человека на 1 км2 (в тундровой, таежной и пустынной зонах); густота пунктов обнаружения мышей в значительной степени совпадала с пахотными угодьями; в высокогорных населенных пунктах обнаружены лишь временные псевдопопуляции. Основным средством расселения домовых мышей служил водный транспорт, а соответственно путями расселения – судоходные реки. И это не удивительно, поскольку железные дороги (первая в 1837 г.) и автомобильные магистрали появились значительно позже и далеко не везде. Возможность использования для анализа расселения домовых мышей молекулярно-генетические подходы позволяет идентифицировать филетические линии и пути их распространения, попытаться разграничить направления расселения мышей до и после перехода к синантропному образу жизни и выявить пути расселения с человеком. Все это мы осветили в той или иной степени в данной работе.
Задачи работы – изучение филогеографической структуры и анализ вариабельности контрольного региона мтДНК у представителей М. musculus на территории всего ареала вида от западной границы в Германии до островов Японии.
МАТЕРИАЛЫ И МЕТОДЫ
Для генетического анализа использовали особи M. musculus из 79 локалитетов Европы и Азии. Всего исследовано 153 последовательности контрольного региона D-петли мтДНК. Из них 72 нуклеотидные последовательности – оригинальный материал, полученный от мышей, отловленных живоловками в 9 регионах России, Молдовы, Армении и Казахстана. Остальные (81) взяты из базы данных Genbank/NCBI (рис. 1).
Рис. 1.
Карта распределения гаплотипов домовых мышей M. musculus в Евразии. Условные обозначения: ▲ – Европа 1; ⚪ – Европа 2; 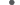 – Европа 3; ◼ – Европа 4; Х – Закавказье; ◇ – Азия 1; ◆ – Азия 2; ★ – одиночные гаплотипы M. m. musculus; @ – гаплотипы M. m. wagneri;
– Европа 3; ◼ – Европа 4; Х – Закавказье; ◇ – Азия 1; ◆ – Азия 2; ★ – одиночные гаплотипы M. m. musculus; @ – гаплотипы M. m. wagneri;  – M. m. Gansuensis.
Места отлова домовых мышей: номер на карте/ локалитет/№ гаплотипа/линия/координаты-с.ш.-в.д./№
в Генбанке, автор (условные обозначения авторов: Prager et al., 1996 – (1); Suzuki et al., 2013 – (2); Geraldes et al., 2008 – (3); Orth et al., 2002 – (4); Ihle et al., 2006 – (5); Maltsev et al., 2015 – (6); если номер автора отсутствует – наши данные); A1, A2, E1, E2, E3, E4,
W-1, W-2, Z1, G1 – филогенетические линии домовых мышей M. musculus из регионов Евразии по нашим материалам; ОГ – одиночные гаплотипы; Mus-1, Mus-2,
Mus-1а, Mus-1b, Mus-1с – линии домовых мышей M. musculus по данным Suzuki et al., 2013). 1/ г. Санкт-Петербург/4/ОГ/59°52′ с.ш. 30°17′ в.д./KR866314; 21/Ахеринг
(Германия)/ 57/E4/ 48°20′, 11°42′/ U47499, (1); 22/ Рудльфинг (Германия)/58/E4/48°24′,
11°49′/ U47504, (1); 26/Лхотка (Чехия)/61/ОГ/ Mus-1b/ 50°1′, 14°26′/AB649687, (2);
55/Пивус Нурски (Польша)/95/E4/52°39′, 22°16′ EU938968, (3); 56/Беляны (пригород Варшавы,
Польша)/96/E2/52°20′, 22°14′/EU938970, (3); 57/Оминне (Польша)/97/E2/51°37′, 22°46′/EU938974,
(3); 58/Помыков (Польша)/98/E2/51°38′, 22°44′/EU938978, (3); 59/Большая Вулька (Польша)/99/E2/52°53′,
22°23′/EU938988, (3); 60/Ольшовец (Польша)/100/ОГ/ 51°00′, 22°35′/EU938987, (3); 61/Майдан
Сенявский (Польша)/101/E2/50°17′, 22°43′/EU938993, (3); 62/Красне (Польша)/102/E2/50°15′,
22°43′/EU938995, (3); 63/Добча (Польша)/103/E2/50°13′, 22°44′/EU938997, (3); 64/Фалиевка
(округ Санок, Польша)/ 104/E2/49°38′, 22°10′/EU938998, (3); 65/Рачкова (Польша)/105/E2/49°38′,
22°11′/EU939003, (3); 66/Хайдунанас (Венгрия)/ 106/ОГ/47°50′, 21°25′/EU939003, (3);
67/Сепеш Дебрецен (Венгрия)/107/E1/47°28′, 21°35′/EU939006, (3); 68/Сзомолйом (округ
Хайди-бухар, Венгрия)/108/E1/47°26′, 21°23′/EU939015, (3); 69/Мезосас (Венгрия)/109/E1/47°6′,
21°34′/EU939018, (3);70/Габортелеп (Венгрия)/110/E1/46°31′, 20°55′/EU939019, (3);
71/Брезница (Словакия)/113/E2/49°09′, 21°39′/EU938929, (3); 72/Буковце (Словакия)/112/E1/49°15′,
21°42′/EU938927, (3); 73/ Хмелов (Словакия)/111, 117/E1/49°4′, 21°26′/EU938926, EU938944,
(3); 74/Словенска Кайна (Словакия)/115/E1/48°57′, 21°41′/EU938939, EU938933, (3) 75/Голциковце
(Словакия)/ 114/E1/49°1′, 21°43′/EU938934, (3); 76/Седлиска (Словакия)/116/E1/48°54′,
21°43′/EU938943, (3); 77/ Нижний Грабовец (Словакия)/ 118/E1/48°48′, 21°46′/EU938945,
(3); 78/Раковец над Ондавой (Словакия)/119/E1/48°46′, 21°46′/EU938950, (3); 79/Пьески
(Словакия)/120/E1/48°40′, 21°47′/EU938953, (3); 4/Крикова (Молдова)/6-10/E2-E3/47°8′,
28°51′/KR866316, KR866317, KR866318, KR866319, KR866320, (6); 25/Кишинёв (Молдова)/60/E3/47°0′,
28°53′/U47533, (1); 33/Унгены (Молдова)/68/A1/Mus-1а/47°13′, 27°48′/AB820928, (2);
27/Донецк (Украина)/62/ОГ/Mus-1a/48°0′, 37°48′/AB649690, (2); 20/Аскания-Нова (Херсонская
область, Украина) 55/E1 46°27′ 33°52′/U47519, (1); 19/Джанкой (Крым)/56/ОГ/45°42′,
34°23′/U47528, (1); 2/г. Москва/1/Z1, 2/ОГ, 3/E3/55°44′, 37°45′/KR866311/ KR866312,
KR866313; 3/ c. Тормосин, Цимлянские пески (Волгоградская область)/13/E1; 12,15/E3,
14,17,18/E4; 11,16/W-2/Mus1/1b/48°10′, 42°41′/KR866321, KR866322, KR866323, KR866324,
KR866325, KR86632; 18/Батуми (Грузия)/54/E3/41°38′, 41°37′/U47532, (1); 6/г. Ереван
(Армения)/23-29/Z1/40°10′/44°31′/KR866331, KR866332, KR866333, KR866334, KR866335,
KR866336, KR866337; 23/Лагодехи (Грузия)/59/Z1 (из сети)/ 41°49′, 46°16′/AF506180,
(4); 24/Шираки (Грузия)/ 59/Z1 (из сети)/ 41°22′, 46°22′/AF506182, (4); 32/Сулак,
Дагестан/67/E1/43°16′, 47°30′/U47520, (1); 13/Сальск, Нижний Дон/46/E1/46°28′, 41°32′/EU939058,
(3); 14/г. Цимлянск/47/E3/47°38′, 42°6′/EU939059, (3); 7/Окрестности г. Астрахани/20/E1;
19,21/W-1; 22/W-2; 87/E4/Mus-1/1b/46°20′, 48°0′/KR866327, KR866328, KR866329, KR866330;
15/Пески “Шекили” (Астраханская область)/ 48/ОГ/48° 7′, 46°45′/EU939061, EU939062,
(3); 16/Харабали (Астраханская область)/ 49/ОГ/47°24′, 47°15′/EU939060, (3); 10/ Сара-Камыш
(Туркмения)/41/W1; 42/Е1; 43/ОГ/42°2′, 57°57′/U47522, U47526, (1); 11//Теджен, Туркмения/44/E1/37°23′,
60°30′/U47518, (1); 46/Актобе (Казахстан)/ 84/A2 (из сети)/Mus-2/50°17′, 57°10′/AB649693,
(2); 17/Алма-Ата (Казахстан)/50-52/ Каz1; 53/W-2/43°16′, 76°54′/EU939043, EU939044,
EU939045, EU939046, (5); 36/Бухара (Узбекистан)/71/A1/Mus-1/39°46′, 64°27′/AB820931,
(2); 44/Ташкент (Узбекистан)/82/А2 (из сети)/Mus-2/41°16′, 69°13′/ AB649689, (2);
8/г. Павлодар (Казахстан)/5/ОГ/52°18′, 77°1′/KR866315; 5/ г. Ишим (Тюменская область)/
30-35/A2/Mus-2/56°7′, 69°30′/KR866338, KR866339, KR866340, KR866341, KR866342; 12/Горно-Алтайск/
45,85/A2/Mus-2/51°56′, 85°58′/U47527, (1); AB64969, (2); 47/г. Иркутск (Иркутская
обл.)/ 86/A2/Mus-2/ 52°16′, 104°18′/AB649695, (2); 9/с. Нижний Цасучей (Забайкальский
край)/40/E3; 36-39/G1 (из сети)/50°30′, 115°7′/KR866342, KR866343, KR866344, KR866345;
28/Аксу (Китай)/78/ОГ; 63/A1/Mus-1b/ 41°10, 80°15′/AB649751, AB649752, (2); 29/Тумэнь
(Китай)/64/A1/Mus-1с/42°58′, 129°50′/AB649729, (2);31, Лхаса, Тибет (Китай)/66/A2/Mus-2/29°38′,
91°8′/AB649722, (2); 34/ Хулин (Китай)/ 69/A1; 80/E1; 77/ОГ/Mus-1b/ 45°45′, 132°56′/AB820939,
AB820940, AB820941, (2); 37/ Турфан (Китай)/72/ОГ/Mus-1b/ 42°57′, 89°11′/AB820938,
(2); 39/Хух-Хото (Китай)/. 74/ОГ/Mus-1b/40°50′, 111°44′/AB649737, (2); 40/ Тунляо
(Китай)/75/ОГ/Mus-1b/43°39′, 122°14′/ AB820935, (2); 41/Манаси (Китай)/76/ОГ/Mus-2/
44°18′, 86°12′/ AB820934, (2); 48/ Чжэнчжоу (Китай)/ 88/A1/Mus-1/34°44′, 113°37′/
AB649739, (2); 49/ Лайян (Китай)/ 89/A2/Mus-2/ 36°58′, 120°42′/ AB649753, (2); 50/Цицикар
(Китай)/ 90/A1/Mus-1с/47°21′, 123°55′/ AB649727, (2); 43/ Краскино (Приморский край)/
81/ОГ/ Mus-1/ 42°42′, 130°46′/AB649708, (2); 30/ Комсомольск-на-Амуре/65/A2/ Mus-2/50°34′,
136°59′/ AB649699, (2); 45/ Хасан (Приморский край)/ 83/ОГ/ 42°25′, 130°38′/AB649711,
(2); 38/Хвачхон (Южная Корея)/ 73/A1/ Mus-1с/ 38° 6′, 127°42′/ AB820926, (2); 42/
Бусан (Южная Корея)/ 79/A1/Mus-1с/ 35°10′, 129°4′/ AB820933, (2); 52/Ганхвадо (Южная
Корея) 92/A1/ Mus-1с/ 37°44′, 126°28′/ AB820925, (2); 53/Фукуока (Япония)/ 93/A1/Mus-1с/
33°35′, 130°24′/AB820932, (2); 54/Окинава (Япония)/94/A1/Mus1-с/26°20′, 127°48'/ AB819905,
(2); 35/ Тоттори (Япония)/ 70/A1/ Mus-1с/35°29′, 134°14′/AB820923, (2); 51/Сетана
(Хоккайдо Япония)/91/A1/Mus-1с/42°25′, 139°52′, AB820927, (2).
– M. m. Gansuensis.
Места отлова домовых мышей: номер на карте/ локалитет/№ гаплотипа/линия/координаты-с.ш.-в.д./№
в Генбанке, автор (условные обозначения авторов: Prager et al., 1996 – (1); Suzuki et al., 2013 – (2); Geraldes et al., 2008 – (3); Orth et al., 2002 – (4); Ihle et al., 2006 – (5); Maltsev et al., 2015 – (6); если номер автора отсутствует – наши данные); A1, A2, E1, E2, E3, E4,
W-1, W-2, Z1, G1 – филогенетические линии домовых мышей M. musculus из регионов Евразии по нашим материалам; ОГ – одиночные гаплотипы; Mus-1, Mus-2,
Mus-1а, Mus-1b, Mus-1с – линии домовых мышей M. musculus по данным Suzuki et al., 2013). 1/ г. Санкт-Петербург/4/ОГ/59°52′ с.ш. 30°17′ в.д./KR866314; 21/Ахеринг
(Германия)/ 57/E4/ 48°20′, 11°42′/ U47499, (1); 22/ Рудльфинг (Германия)/58/E4/48°24′,
11°49′/ U47504, (1); 26/Лхотка (Чехия)/61/ОГ/ Mus-1b/ 50°1′, 14°26′/AB649687, (2);
55/Пивус Нурски (Польша)/95/E4/52°39′, 22°16′ EU938968, (3); 56/Беляны (пригород Варшавы,
Польша)/96/E2/52°20′, 22°14′/EU938970, (3); 57/Оминне (Польша)/97/E2/51°37′, 22°46′/EU938974,
(3); 58/Помыков (Польша)/98/E2/51°38′, 22°44′/EU938978, (3); 59/Большая Вулька (Польша)/99/E2/52°53′,
22°23′/EU938988, (3); 60/Ольшовец (Польша)/100/ОГ/ 51°00′, 22°35′/EU938987, (3); 61/Майдан
Сенявский (Польша)/101/E2/50°17′, 22°43′/EU938993, (3); 62/Красне (Польша)/102/E2/50°15′,
22°43′/EU938995, (3); 63/Добча (Польша)/103/E2/50°13′, 22°44′/EU938997, (3); 64/Фалиевка
(округ Санок, Польша)/ 104/E2/49°38′, 22°10′/EU938998, (3); 65/Рачкова (Польша)/105/E2/49°38′,
22°11′/EU939003, (3); 66/Хайдунанас (Венгрия)/ 106/ОГ/47°50′, 21°25′/EU939003, (3);
67/Сепеш Дебрецен (Венгрия)/107/E1/47°28′, 21°35′/EU939006, (3); 68/Сзомолйом (округ
Хайди-бухар, Венгрия)/108/E1/47°26′, 21°23′/EU939015, (3); 69/Мезосас (Венгрия)/109/E1/47°6′,
21°34′/EU939018, (3);70/Габортелеп (Венгрия)/110/E1/46°31′, 20°55′/EU939019, (3);
71/Брезница (Словакия)/113/E2/49°09′, 21°39′/EU938929, (3); 72/Буковце (Словакия)/112/E1/49°15′,
21°42′/EU938927, (3); 73/ Хмелов (Словакия)/111, 117/E1/49°4′, 21°26′/EU938926, EU938944,
(3); 74/Словенска Кайна (Словакия)/115/E1/48°57′, 21°41′/EU938939, EU938933, (3) 75/Голциковце
(Словакия)/ 114/E1/49°1′, 21°43′/EU938934, (3); 76/Седлиска (Словакия)/116/E1/48°54′,
21°43′/EU938943, (3); 77/ Нижний Грабовец (Словакия)/ 118/E1/48°48′, 21°46′/EU938945,
(3); 78/Раковец над Ондавой (Словакия)/119/E1/48°46′, 21°46′/EU938950, (3); 79/Пьески
(Словакия)/120/E1/48°40′, 21°47′/EU938953, (3); 4/Крикова (Молдова)/6-10/E2-E3/47°8′,
28°51′/KR866316, KR866317, KR866318, KR866319, KR866320, (6); 25/Кишинёв (Молдова)/60/E3/47°0′,
28°53′/U47533, (1); 33/Унгены (Молдова)/68/A1/Mus-1а/47°13′, 27°48′/AB820928, (2);
27/Донецк (Украина)/62/ОГ/Mus-1a/48°0′, 37°48′/AB649690, (2); 20/Аскания-Нова (Херсонская
область, Украина) 55/E1 46°27′ 33°52′/U47519, (1); 19/Джанкой (Крым)/56/ОГ/45°42′,
34°23′/U47528, (1); 2/г. Москва/1/Z1, 2/ОГ, 3/E3/55°44′, 37°45′/KR866311/ KR866312,
KR866313; 3/ c. Тормосин, Цимлянские пески (Волгоградская область)/13/E1; 12,15/E3,
14,17,18/E4; 11,16/W-2/Mus1/1b/48°10′, 42°41′/KR866321, KR866322, KR866323, KR866324,
KR866325, KR86632; 18/Батуми (Грузия)/54/E3/41°38′, 41°37′/U47532, (1); 6/г. Ереван
(Армения)/23-29/Z1/40°10′/44°31′/KR866331, KR866332, KR866333, KR866334, KR866335,
KR866336, KR866337; 23/Лагодехи (Грузия)/59/Z1 (из сети)/ 41°49′, 46°16′/AF506180,
(4); 24/Шираки (Грузия)/ 59/Z1 (из сети)/ 41°22′, 46°22′/AF506182, (4); 32/Сулак,
Дагестан/67/E1/43°16′, 47°30′/U47520, (1); 13/Сальск, Нижний Дон/46/E1/46°28′, 41°32′/EU939058,
(3); 14/г. Цимлянск/47/E3/47°38′, 42°6′/EU939059, (3); 7/Окрестности г. Астрахани/20/E1;
19,21/W-1; 22/W-2; 87/E4/Mus-1/1b/46°20′, 48°0′/KR866327, KR866328, KR866329, KR866330;
15/Пески “Шекили” (Астраханская область)/ 48/ОГ/48° 7′, 46°45′/EU939061, EU939062,
(3); 16/Харабали (Астраханская область)/ 49/ОГ/47°24′, 47°15′/EU939060, (3); 10/ Сара-Камыш
(Туркмения)/41/W1; 42/Е1; 43/ОГ/42°2′, 57°57′/U47522, U47526, (1); 11//Теджен, Туркмения/44/E1/37°23′,
60°30′/U47518, (1); 46/Актобе (Казахстан)/ 84/A2 (из сети)/Mus-2/50°17′, 57°10′/AB649693,
(2); 17/Алма-Ата (Казахстан)/50-52/ Каz1; 53/W-2/43°16′, 76°54′/EU939043, EU939044,
EU939045, EU939046, (5); 36/Бухара (Узбекистан)/71/A1/Mus-1/39°46′, 64°27′/AB820931,
(2); 44/Ташкент (Узбекистан)/82/А2 (из сети)/Mus-2/41°16′, 69°13′/ AB649689, (2);
8/г. Павлодар (Казахстан)/5/ОГ/52°18′, 77°1′/KR866315; 5/ г. Ишим (Тюменская область)/
30-35/A2/Mus-2/56°7′, 69°30′/KR866338, KR866339, KR866340, KR866341, KR866342; 12/Горно-Алтайск/
45,85/A2/Mus-2/51°56′, 85°58′/U47527, (1); AB64969, (2); 47/г. Иркутск (Иркутская
обл.)/ 86/A2/Mus-2/ 52°16′, 104°18′/AB649695, (2); 9/с. Нижний Цасучей (Забайкальский
край)/40/E3; 36-39/G1 (из сети)/50°30′, 115°7′/KR866342, KR866343, KR866344, KR866345;
28/Аксу (Китай)/78/ОГ; 63/A1/Mus-1b/ 41°10, 80°15′/AB649751, AB649752, (2); 29/Тумэнь
(Китай)/64/A1/Mus-1с/42°58′, 129°50′/AB649729, (2);31, Лхаса, Тибет (Китай)/66/A2/Mus-2/29°38′,
91°8′/AB649722, (2); 34/ Хулин (Китай)/ 69/A1; 80/E1; 77/ОГ/Mus-1b/ 45°45′, 132°56′/AB820939,
AB820940, AB820941, (2); 37/ Турфан (Китай)/72/ОГ/Mus-1b/ 42°57′, 89°11′/AB820938,
(2); 39/Хух-Хото (Китай)/. 74/ОГ/Mus-1b/40°50′, 111°44′/AB649737, (2); 40/ Тунляо
(Китай)/75/ОГ/Mus-1b/43°39′, 122°14′/ AB820935, (2); 41/Манаси (Китай)/76/ОГ/Mus-2/
44°18′, 86°12′/ AB820934, (2); 48/ Чжэнчжоу (Китай)/ 88/A1/Mus-1/34°44′, 113°37′/
AB649739, (2); 49/ Лайян (Китай)/ 89/A2/Mus-2/ 36°58′, 120°42′/ AB649753, (2); 50/Цицикар
(Китай)/ 90/A1/Mus-1с/47°21′, 123°55′/ AB649727, (2); 43/ Краскино (Приморский край)/
81/ОГ/ Mus-1/ 42°42′, 130°46′/AB649708, (2); 30/ Комсомольск-на-Амуре/65/A2/ Mus-2/50°34′,
136°59′/ AB649699, (2); 45/ Хасан (Приморский край)/ 83/ОГ/ 42°25′, 130°38′/AB649711,
(2); 38/Хвачхон (Южная Корея)/ 73/A1/ Mus-1с/ 38° 6′, 127°42′/ AB820926, (2); 42/
Бусан (Южная Корея)/ 79/A1/Mus-1с/ 35°10′, 129°4′/ AB820933, (2); 52/Ганхвадо (Южная
Корея) 92/A1/ Mus-1с/ 37°44′, 126°28′/ AB820925, (2); 53/Фукуока (Япония)/ 93/A1/Mus-1с/
33°35′, 130°24′/AB820932, (2); 54/Окинава (Япония)/94/A1/Mus1-с/26°20′, 127°48'/ AB819905,
(2); 35/ Тоттори (Япония)/ 70/A1/ Mus-1с/35°29′, 134°14′/AB820923, (2); 51/Сетана
(Хоккайдо Япония)/91/A1/Mus-1с/42°25′, 139°52′, AB820927, (2).

Выделение тотальной ДНК осуществляли с помощью стандартного солевого и фенол хлороформного методов из фиксированных 96%-ным спиртом тканей (хвост, сердце, печень, мышцы). ПЦР проводили в термоциклере Genamp 9700 (“AppliedBiosystems”, США) с использованием праймеров Mtloop3F (5'CACCACCAGCACCCAAAGCT3') и Mtloop2R (5'AGCATTTTCAGTGCTTTGCT3'). Амплификацию проводили в 20 мкл реакционной смеси, содержащей 1 мкл тотальной ДНК в концентрации 100 нг на мл, по 1 мкл 10 мМ раствора каждого праймера, 0.2 мкл 100 мМ раствора MgCl2, 2 мкл 10 × Taq буфера (“СибЭнзим”, Россия), 2 мкл 8 мМ смеси dNTPs, 0.2 ед. Taq полимеразы (“СибЭнзим”) и деионизированную воду. Режим ПЦР включал начальные 5 мин денатурации (94°С), 35 циклов амплификации (94°C – 15 с, 55°C – 30 с, 72°C – 1 мин) и финальную достройку цепей (72°C – 7 мин). Продукты амплификации очищали на колонках Gene JET PCR Purification Kit (“Thermo scientific”). Секвенирование проводили на секвенаторе Applied Biosystems 3130 Genetic Analyzer с использованием набора BigDye (R) Terminator v3.1 Cycle Sequencing Kit (согласно инструкциям производителя). Выравнивание последовательностей осуществляли с помощью программы Bioedit v.7.0.5.3 (Hall, 1999) с ручной доводкой. Для множественного выравнивания последовательностей была использована программа CLASTAL W (Thompson et al., 1994), интегрированная в пакет Bioedit. Длина исследуемой последовательности D-петли после проведения множественного выравнивания у всех домовых мышей составила 993 п.н., включая делеции и вставки.
Для реконструкции филогенетических отношений между гаплотипами мтДНК построено древо с помощью Байесовского анализа в программе MrBayes версии 3.1.2 (Ronquist, Huelsenbeck, 2003) с использованием модели GTR (“General Time”) и процедуры “gamma distributed rates across sites”. Для выбора подходящей модели нуклеотидных замен последовательности тестировали в программе JModeltest, v.0.1.1 (Posada, Crandall, 1998) с использованием 6 цепей (пять “горячих” и одна “холодная”), 500 тыс. генераций и 20% от генерированных филогенетических древ. Параметры модели нуклеотидных замещений и длин ветвей были использованы для построения консенсусного филогенетического древа и оценок апостериорной вероятности его ветвлений. Среди 153 полученных индивидуальных последовательностей обнаружено 120 гаплотипов. Из них ранее 39 гаплотипов были депонированы в базу данных GenBank/NCBI под соответствующими номерами KR866314- KR86634347 (Maltsev et al., 2015). Филогенетическая сеть использована для построения “splitnetwork”, изображающую в недихотомической форме родство гаплотипов с некорректирующей р-дистанцией NeighborNet в программе Splits Tree4 (Huson, Bryant, 2006). Степень дивергенции мтДНК оценивали с помощью p-дистанции, которая соответствует среднему расстоянию от предкового гаплотипа по всем производным гаплотипам в программе MEGA X, используя алгоритм К2P. Количество полиморфных сайтов (S), нуклеотидное (π) и гаплотипическое разнообразие (h) рассчитывали в программе DNAsp, v.5.10 (Rozas et al., 2003). Для анализа распределения попарных различий между последовательностями мтДНК применен метод MMD (mismatch distribution analysis) с использованием программ DNAsp, v.5.10 (Rozas et al., 2003) и Arlequin 3.5.1.2. (Excoffier et al., 2005).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Филогенетический анализ. Топология филогенетического дерева (рис. 2), построенного с помощью Байесового анализа, была аналогична филогенетической сети NeighbourNet (рис. 3), но состав особей M. musculus в ряде филогрупп имел небольшие отличия. В Европе идентифицировано 4 группы, в Азии – 2 и в Закавказье – 1. В филогруппу Азия 1 вошли особи из Японии (4 гаплотипа), Кореи (2) и севера-востока Китая (5), Молдовы (Унгены – 1) и Узбекистана (Бухара – 1). Филогруппу Азия 2 составили гаплотипы домовых мышей из России (а именно из Сибири и с Дальнего Востока: Тюменской области – 6 гаплотипов, Алтая – 1, Иркутской области – 1, Хабаровского края – 1), Казахстана (1), Узбекистана (1) и Китая (2). Гаплотипы из Казахстана и Узбекистана добавлены по данным филогенетической сети (рис. 3). Основу клады Азия 2 составили гаплотипы мышей из Западной Сибири. Наиболее неоднородными по составу оказались европейские филогруппы (рис. 2, 3). В филогруппу Европа 1 вошли следующие гаплотипы: из Словакии (9), Венгрии (4), России (Ростовской области – 1, Крыма – 1, Астрахани – 1, Волгоградской области – 1), Дагестана (Сулак – 1), Туркменистана (Сарыкамыш – 1), Китая (Хулин – 1). Основу клады Европа 1 составили гаплотипы из Словакии. Выборка из Словакии образовала отдельный подкластер внутри кластера Европа 1. В состав другой европейской линии Европа 2 входили преимущественно гаплотипы мышей из Польши (9). Кроме того туда вошли гаплотипы из Молдовы (Кишинёв – 2) и Словакии (Брезника – 1). Генетическая дифференциация остальных филогрупп из Европы (Европа 3, 4) была значительно выше, чем упомянутых ранее (Европа 1, 2). В состав филогруппы Европа 3 вошли гаплотипы из Молдовы (Кишинёв – 4), России (Москвы – 1, Волгоградской области – 2, Восточной Сибири, Забайкальский край, Нижний Часучей – 1), Грузии (Батуми – 1). Филогруппа Европа 4 разделилась на 2 подгруппы. В первую попали гаплотипы из Астрахани (1) и Волгоградской области (3). Во вторую – гаплотипы из Баварии (2) и Польши (1). Самую высокую степень дифференциации имела “закавказская” филогруппа (вероятностная поддержка 0.96), которая образовала монофилетическую кладу. P-дистанция от других гаплотипов M. musculus филогрупы Закавказье составляла от 1.5 до 1.1%, что значительно выше, чем дистанции между другими сравниваемыми группами (табл. 1). В кластер Закавказье вошли гаплотипы из Армении (Ереван) – 7 и г. Москвы – 1. На филогенетической сети к ним добавилось 2 гаплотипа из Грузии. Часть особей M. m. wagneri образовала две небольшие гаплогруппы (W1 и W2) (рис. 3). В гаплогруппу W1 вошли особи из России (Астрахань – 2 гаплотипа) и один гаплотип из Туркмении (Саракамыш). Группу W2 cоставили гаплотипы из России (Астрахань – 1, Тормосин – 2) и Казахстана (Алма-Аты – 1). Подвид M. m. gansuensis не выделялся ни на филогенетической сети, ни на дереве как отдельная филогруппа. На сети отмечена одна индивидуальная короткая ветвь (G1) с двумя гаплотипами из России (Забайкальский край) и одним гаплотипом из Китая (рис. 3).
Рис. 2.
Байесовское консенсусное дерево для 120 гаплотипов мтДНК (D-петля) Mus musculus. Последовательности Mus domesticus взяты из Генбанка в качестве внешней группы.

Рис. 3.
Филогенетическая сеть NeighbourNet для 120 гаплотипов контрольного региона (D-петли) мтДНК M. musculus. Отмечены экзоантропные подвиды M. m. wagneri (W 1-W2), M. m. gansuensis (G 1) и выборка M. m. wagneri из Казахстана (Kaz 1).

Таблица 1.
Генетические дистанции гаплогрупп M. musculus
| Закавказье | Закавказье | Европа-3 | Европа-2 | Европа-1 | Европа-4 | Азия-2 |
| Европа-3 | 0.01520 | |||||
| Европа-2 | 0.01100 | 0.00919 | ||||
| Европа-1 | 0.01394 | 0.01001 | 0.00816 | |||
| Европа-4 | 0.01405 | 0.00700 | 0.00815 | 0.00919 | ||
| Азия-2 | 0.01410 | 0.01107 | 0.01085 | 0.01168 | 0.01003 | |
| Азия-1 | 0.01307 | 0.00815 | 0.00766 | 0.00842 | 0.00642 | 0.00861 |
К одиночным гаплотипам, не вошедшим в филогруппы на филогенетическом дереве и сети, относятся следующие: из Европы (4), Китая (6), Казахстана (3), Туркмении (1), Узбекистана (1), Забайкальского края (4). Всего отмечено 19 одиночных гаплотипов, но часть из них входили в микро- или макро-гаплогруппы на филогенетической сети.
Филогенетическое дерево и сеть незначительно отличались по составу одиночных и вошедших в филогруппы гаплотипов (рис. 2, рис. 3). Так, гаплотипы мышей из Центральной Азии (Ташкента (Узбекистан) и Актобе (Казахстан)), на сети вошли в филогруппу Азия 2, а гаплотипы мышей из Грузии (Лагодехи, Шираки) – в филогруппу Закавказье, в то время как на дереве они располагались в основании в микрогруппе с гаплотипом из Крыма (Джанкой). Гаплотипы из Казахстана (Алма-Аты) образовали небольшую ветку на сети (Каz1) как и гаплотипы подвида M. m. gansuensis (рис. 3). Остальные одиночные гаплотипы составляли общий филогенетический пул вида M. musculus.
Анализ генетической изменчивости и попарных различий последовательностей контрольного региона мтДНК популяций домовых мышей. Проанализировано 4 выборки из 4 регионов: Закавказья, Восточной Европы, Западной Сибири, Азии (Япония, Корея). Каждая из этих выборок образовала компактную однородную филогруппу на филогенетическом древе с высокой вероятностной поддержкой (рис. 2). Как уже отмечалось выше, большая часть гаплотипов мышей из Польши вошла в состав линии Европа 2. График попарных различий последовательностей контрольного региона мтДНК показывает два пика в распределении (рис. 4а). Получены следующие данные по генетической изменчивости (табл. 2) домовых мышей из Польши: генная изменчивость (Hd) составила 0.709, нуклеотидная (Pi) – 0.00282. У домовых мышей из Закавказья (Армения, Грузия) выявлено пять пиков в распределении частот попарных различий (рис. 4б). Кроме того, в этом регионе генная изменчивость (Hd = 0.821) и количество мутаций (26) были выше, чем в выборках домовых мышей из других регионов (табл. 2). В выборке из Азии (Япония\Корея) график попарных различий последовательностей показывает один пик в распределении (рис. 4в). Эти мыши характеризовались самым низкими значениями количества мутаций (Eta = 2) и нуклеотидной изменчивости (Pi = 0.00067) по сравнению с другими выборками. У домовых мышей из Западной Сибири (Тюменская область, Республика Алтай) выявлены один пик в распределении частот попарных различий (рис. 4г) и относительно низкая нуклеотидная изменчивость (Pi = 0.00094) (табл. 3 ).
Рис. 4.
График частот попарных различий между последовательностями мтДНК (D-петли) для выборок домовых мышей M. m. musculus. (а) – Польша; (б) – Закавказье; (в) – Западная Сибирь; (г) – Азия (Япония, Корея)).

Таблица 2.
Генетическая изменчивость мтДНК(d-loop) M. musculus по разным регионам
| Азия (Япония\Корея) | Закавказье | Польша | Западная Сибирь | |
|---|---|---|---|---|
| Число последовательностей мтДНК (N) | 7 | 15 | 11 | 12 |
| Генная изменчивость (Hd) | 0.524 | 0.821 | 0.709 | 0.667 |
| Нуклеотидная изменчивость (Pi) | 0.00067 | 0.00585 | 0.00282 | 0.00094 |
| Количество мутаций (Eta) | 2 | 26 | 9 | 8 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На байесовском дереве все гаплотипы отделяются от внешней группы (M. domesticus) с высокой поддержкой (0.95), что свидетельствует о наличии у них мтДНК M. musculus (в том числе у филогруппы Закавказье) и о генетическом единстве разных форм M. musculus. Как уже отмечалось в результатах, семь филогрупп дерева относятся к трем регионам: Европе (4 группы), Азии (2) и Закавказью (1). Начнем анализ полученных данных с Закавказья, поскольку этот регион рассматривается в эволюционном аспекте как возможный центр дифференциации M. musculus.
Гаплогруппа Закавказье включает все исследованные гаплотипы из Армении (г. Ереван), один гаплотип из г. Москвы, а на филогенетической сети еще и два гаплотипа из Грузии (рис. 2, 3). По-видимому, совместная кластеризация выборок из популяций г. Москвы и Закавказья не случайна. Несмотря на несомненное гибридное происхождение домовых мышей из Армении (Милишников и др., 1990, 2004; Mezhzherin et al., 1998), которые несут гены как минимум двух таксонов (M. musculus и M. domesticus), домовые мыши из Еревана обладают мтДНК M. musculus. В более ранних исследованиях на основании анализа полиморфизма контрольного региона мтДНК домовых мышей (Prager et al., 1996, 1998; Orth et al., 2002) выявлено присутствие в популяциях Грузии мт-гаплотипов как domesticus, так и musculus-типов. По другим данным (Boissinot, Boursot, 1997), гаплотипы из Грузии и Армении близки или идентичны таковым M. musculus из Центральной России (Москва) и Прибалтики (Латвия, г. Рига), что согласуется с нашими данными. Принимая во внимание наследование мтДНК по материнской линии (Avise et al., 1987), мы выдвинули гипотезы, объясняющие данный феномен (Maltsev et al., 2016). Первая из них касается истории расселения домовых мышей по территории Евразии в соответствии с гипотетической моделью, предложенной французскими исследователями (Boursot et al., 1996; Guénet, Bonhomme, 2003), вторая учитывает данные отечественных авторов по анализу зоны гибридизации Закавказья (Милишников, 2004; Милишников и др., 2004). Согласно гипотезе французских исследователей, родиной группы синантропных таксонов домовых мышей является Северная Индия (Boursot et al., 1996; Dinn et al., 1996). Возможный сценарий расселения предковой формы M. musculus может быть таким: ее представители перемещались из Северной Индии вдоль побережья Каспийского моря в Закавказье и далее в Восточную Европу. Согласно эволюционной модели Дуваукс и др. (Duvaux et al., 2011), периоды полной изоляции M. musculus, M. domesticus и M. castaneus в рефугиумах в периоды оледенения и контакт их ареалов в межледниковые периоды чередовались в ходе эволюции и дивергенции этих таксонов. Предположения о происхождении M. musculus в Закавказье как рефугиуме или на территории, расположенной недалеко к востоку от Каспийского моря, высказывали Бурсо и др. (Boursot et al., 1993) и Праджер и др. (Prager et al., 1993, 1996), в дальнейшем мыши расселялись в западном направлении в Центральную Европу и в восточном в Китай и Японию. Заселение Закавказья уже дивергировавшими от M. domesticus и M. castaneus представителями предковой формы M. musculus возможно происходило с юга-востока Прикаспийской низменности (Boursot et al., 1996; Guénet, Bonhomme, 2003). Здесь расселяющаяся линия M. musculus разделилась. Одна группа мышей двинулась на северо-запад Восточной Европы, другая, обогнув Каспийское море, достигла Кавказа и проникла на территорию Закавказья вдоль побережья. Этот сценарий может объяснять филогенетическое родство домовых мышей из Закавказья и Центра Европейской части России, и, таким образом, полученные нами и другими исследователями данные – попадание гаплотипов выборки мышей из Закавказья, Москвы и Риги в одну филогруппу.
Возможно и другое объяснение полученных результатов. В закавказских популяциях были обнаружены предковые аллели, характерные для домовых мышей, расселяющихся из предполагаемого центра происхождения синантропных таксонов надвида Mus musculus s. l. (Милишников, 2004; Милишников и др., 2004). Высказано предположение, что в Закавказье могла заселиться недифференцированная форма домовых мышей (Милишников и др., 2004), и лишь позже туда проникли дивергировавшие M. musculus и M. domesticus, которые скрещивались как друг с другом, так и с предковой формой, образовав сложную по генетической структуре обширную зону гибридизации. Авторы считают наиболее вероятным сценарий, согласно которому разновременные события гибридизации “наложились” на генофонд древнего автохтонного населения домовых мышей этого региона (Милишников и др., 2004). Таким образом, домовые мыши Закавказья и Москвы могли сохранить предковые аллели и мтДНК M. musculus, что и привело к их выделению в единую филогруппу. Заселение домовыми мышами территории Закавказья шло не только с севера, но и с юга. С Ближнего Востока двигалась линия M. domesticus, причем она разделилась: одна группа распространялась по Средиземноморью, другая проникла в Закавказье. Ряд палеонтологических находок показывает, что M. domesticus колонизировала данный регион ~5–6 тыс. лет назад в период неолита (Cucchi et al., 2013). Заселение Закавказья разными формами мышей с юга и севера оказало существенное влияние на формирование генетической структуры обширной зоны гибридизации в Закавказье (Милишников, 2004; Милишников и др., 2004).
Учитывая, что Закавказье представляет собой огромную по площади территорию, заселенную мышами, сохранившими реликтовый генофонд, можно предположить, что представители другой выделенной нами филетической линии – Европа 1, основу которой составили гаплотипы из Словакии и Венгрии – могли расселяться с этой территории в направлении Кавказа и Восточной Европы (рис. 5). Об этом свидетельствует наличие двух гаплотипов этой линии: один на Кавказе (пос. Сулак, Дагестан, локалитет 32) и в Прикаспии (окрестности г. Астрахани, локалитет 7) (рис. 1). Если соединить точки поимок представителей этой линии (рис. 1), то возможно проследить путь их расселения с Кавказа и Прикаспия в направлении Восточной Европы (рис. 5). В целом, в сценарий расселения M. musculus из Закавказья укладывается и состав филогруппы Европа 3, куда вошли гаплотипы мышей из Грузии (г. Батуми), России (Волгоградская область), Молдовы (гг. Крикова и Кишинева). Однако попадание гаплотипа из Москвы в группу Закавказье и наличие единственного гаплотипа из Батуми в составе филогруппы Европа 3 можно объяснить и поздним завозом мышей из Закавказья в эти места людьми. Мы не нашли подтверждений заселения Азии ни представителями филогруппы Закавказье, ни Европа 1 и Европа 3. Безусловно, для подтверждения той или иной гипотезы необходимы дальнейшие исследования и большие по объему выборки из разных локалитетов этого региона.
Рис. 5.
Карта путей расселения домовых мышей M. m. musculus. → Черной стрелкой обозначено направление путей расселения. 1 – Линия Азия 2 (Сибирский тракт). Вдоль Сибирского тракта и шелкового пути (точки – Ишим, Ирскутк, Лайян, Комсомольск-на-Амуре, Горно-Алтайск). 2 – Линия Европа 1. (точки – Саракамыш, Астрахань, Сулак, Тормосин, Сальск, Аскания Нова, Словакия, Венгрия). 3 – Линия Закавказье. (точки – Ереван, Лагодехи, Шираки, Москва).

Согласно нашим данным, филогруппа Закавказье является достаточно обособленной, выделяется с высокой поддержкой, обладает высоким генетическим разнообразием (табл. 2) и количеством мутаций. Ранее нами в выборке из Закавказья было обнаружено 11 замен, 9 из них оказались трансверсиями (Maltsev et al., 2016).
Результаты, полученные по частоте попарных различий между последовательностями мтДНК домовых мышей Закавказья (Армения, Грузия) подтверждают ранее высказанное предположение о постоянном перемешивании разных популяций и притоке мигрантов, поскольку нами выявлено многопиковое и широко купольное распределении (рис. 4б). Высокие значения гаплотипического и нуклеотидного разнообразия в сравнении с остальными анализируемыми выборками M. musculus также отмечены в популяциях домовых мышей из Закавказья (табл. 2). Высокие значения этих показателей, с одной стороны, могут означать, что популяции стабильны и в течение длительного времени поддерживают высокую численность, с другой – что в их состав входят особи из нескольких ранее изолированных популяций (Avise, 2000). С нашей точки зрения, в данном случае больше подходит второе объяснение, ввиду гибридного происхождения домовых мышей из Закавказья.
Анализ филогруппы Европа 2 мало что дает для понимания расселения домовых мышей из древних центров их происхождения и дифференциации, поскольку в ее состав вошли гаплотипы из Польши, Словении и Молдовы (г. Кишинев). Однако это указывает на заселение Польши отдельной филетической линией. Достаточно трудно привязать к этому анализу и филогруппу Европа 4. В настоящее время представляется затруднительным решить вопрос о времени заселения домовыми мышами той или иной территории, поскольку после перехода к синантропному образу жизни M. musculus расселялась с помощью человека. Для домовых мышей из Польши характерна высокая генная изменчивость и среднее значение нуклеотидной изменчивости (табл. 2). Структура гистограммы попарных различий выборки домовых мышей из Польши свидетельствует о резких колебаниях эффективной численности с последующим экспансивном ростом (рис. 4а).
Статья международной группы авторов (Geraldes et al., 2008), где использованы те же, что и нами, гаплотипы из Европы и некоторых других точек ареала M. musculus, посвящена проблеме дифференциации (а не путям расселения) трех таксонов домовых мышей M. domesticus, M. musculus и M. castaneus. Поэтому сравнивать построенные ими и нами деревья довольно затруднительно. Единственное, что можно отметить, это выделение образцов из Казахстана в отдельный кластер, в который вошли особи из г. Алма-Ата и ее пригородов. Алма-Ата находится в пределах ареала подвида M. m. wagneri. Поэтому можно предположить, что эта филогруппа образована представителями именно этого подвида. Несколько образцов (№№ 50–53) в нашей работе были взяты также из Алма-Ата и один из гаплотипов вошел в состав небольшой группы W-2 с другими особями wagneri из Волгоградской области (рис. 3). Другие последовательности из Казахстана (№ 50–52) объединились в небольшую группу Kaz-1 на филогенетической сети (рис. 3). Ранее на основании анализа контрольного региона мтДНК (Maltsev et al., 2016) мы обнаружили гаплогруппу, образованную представителями M. m. wagneri из Казахстана, отличающуюся высокой генетической изменчивостью (оз. Зайсан). Таким образом, особи подвида wagneri с юга Казахстана филогенетически связаны с европейскими гаплотипами wagneri и наши данные не противоречат гипотезе о наличии цента расселения подвида M. m. wagneri в Средней Азии (Suzuki et al., 2015)
Рассмотрим расселение филогрупп Азии. Поскольку для анализа нами использованы данные из Генбанка, то сопоставим соответствие выделенных нами филогрупп с теми, которые были обнаружены другими исследователями (рис. 1). Из азиатского региона в них вошли преимущественно гаплотипы, проанализированные в работе Сузуки и др. (Suzuki et al., 2013). Согласно данным этих авторов, M. musculus разделяется на две группы: Mus-1 и Mus-2. В свою очередь, Mus-1 включает три филетические линии, представители каждой из которых обитают в определенных областях. Для азиатского региона это филетические линии Mus-1b и Mus-1c. Представители линии Mus-1b распространены по всей территории Китая, но обнаружены также в Закавказье, Иране, Восточной Европе и в России, в локалитете, расположенном относительно недалеко от границы с Китаем. Распространение линии Mus-1c ограничено небольшой областью на северо-востоке Китая, Кореей и Японией, за исключением единственного гаплотипа, принадлежащего мыши из Краскино (Россия, побережье на границе с Кореей). Два гаплотипа из Китая, доступные в Генбанке (на дереве №№ 63, 69, рис. 2) по данным Сузуки и др. (Suzuki et al., 2013), относятся к филогруппе Mus-1b. Они попали в филогруппу Азия 1. Помимо этих гаплотипов в филогруппу Азия 1 вошли следующие: из Китая – № 88 (Mus-1), а также №№ 64, 90; из Кореи – №№ 73, 79, 92; из Японии – №№ 70, 91, 93, 94. Все эти гаплотипы по данным Сузуки и др. (Suzuki et al., 2013) принадлежат к филогруппе Mus-1с. В филогруппу Азия 1 вошли также гаплотипы: из г. Бухары (№ 71, по Сузуки и др. (Suzuki et al., 2013) – Mus-1, без указания конкретной филетической линии), а также из Молдовы № 68, по Сузуки и др. (Suzuki et al., 2013) – Mus-1a. Попадание гаплотипа из Молдовы (Унгены) в филогруппу Азия 1, а также выявленный японскими исследователями гаплотип, относящийся к филетической линии Mus-1b (по нашим данным, это уникальный гаплотип), в Лотке (Чехия) можно объяснить скорее завозом домовых мышей с транспортом, а не их самостоятельным расселением до или вскоре после перехода к синантропному образу жизни. Таким образом, прослеживается соответствие филетических линий Mus-1b и Mus-1c и выделенной нами линией Азия 1. Данные о генетической изменчивости и частоте попарных различий указывают на то, что население домовых мышей Японских островов сформировалось относительно недавно (табл. 2, рис. 4в). Один пик в распределении может свидетельствует об однократном заселении островов мышами с материка, а низкая нуклеотидная изменчивость – о возможной депрессии численности, или же относительно недавнем формировании группировки (Rogers, Harpending, 1992). Это не противоречит данным японских исследователей.
В филогруппу Азия 2 вошли в основном гаплотипы из Сибири (рис. 1). Из них гаплотипы мышей из г. Комсомольск-на-Амуре (№ 65), Казахстана, Актобе (№ 84), Узбекистана, г. Ташкента (№ 82), г. Горно-Алтайска (№ 85) и г. Иркутска (№ 86). Кроме них, туда вошли гаплотипы мышей из Китая: Лхаса, Тибета (№ 66) и Лайана (№ 89). Все они по Сузуки и др. (2013) попадают в филогруппу Mus-2. По данным этих авторов, к той же филогруппе относятся гаплотипы новосибирских мышей и ряда локалитетов Китая (не включены в наш анализ). В филогруппу Азия 2 кластеризовались гаплотипы мышей, отловленных нами в г. Ишиме. Японские исследователи характеризуют гаплотипы группы Mus-2 как широко распределенные по большой территории, многие из которых отличаются от ближайших последовательностей двумя или более нуклеотидными заменами. И лишь 2 гаплотипа этой группы найдены в нескольких местах. При этом одинаковые гаплотипы обнаружены на далеких расстояниях друг от друга, что по мнению авторов (Suzuki et al., 2013), свидетельствует о недавнем расселение этой линии на большие расстояния. Отметим, что в силу сурового климата и относительно поздним срокам колонизации Западной и Восточной частей Сибири с холодным климатом (в пределах территории России) людьми, домовые мыши могли заселять этот регион только с помощью человека лишь в XVII–XIX столетиях (Хляп, Варшавский, 2010). В областях с низкими зимними температурами и снежным покровом домовые мыши могут выживать только в постройках человека (Кучерук, 1994). Путь расселения мышей, принадлежащих к филогруппе Азия 2, мог пролегать по Сибирскому тракту, существовавшему с 1730 г. по конец XIX в. и уходил в Китай по новому шелковому пути (рис. 5). Он также назывался Московско-сибирский тракт, шел из Москвы и поворот в Китай был у г. Кяхта (Забайкальский край) (Бойко, 2012; Катионов, 2006). Со времен Екатерины II по нему шли обозы и грузы из Москвы в Сибирь и Китай. В более позднее время (XIX в.) была проложена Транссибирская железнодорожная магистраль, за основу которой был взят более ранний Сибирский тракт. Мы предполагаем, что домовые мыши могли перемещаться по Сибирскому тракту и железнодорожным магистралям с запада на восток из Европейской части России в Сибирь и на Дальний Восток. Об этом свидетельствует несколько точек их отлова, которые расположены вдоль железнодорожной дороги (гг. Ишим, Иркутск, Комсомольск-на-Амуре) (рис. 5). Сибирский тракт XIX в. отличается от того, который существовал в XIX в. он был изменен и пролегал уже не через г. Тобольск, а шел южнее и одной из первых точек этого тракта был г. Ишим. Особи из г. Ишима присутствуют в филогруппе Азия 2 и от этого пункта мы провели линию расселения вдоль железнодорожной магистрали и Сибирского тракта (рис. 5). В филогруппу Азия 2 вошли гаплотипы мышей из точек, расположенных вдоль нового Сибирского тракта (гг. Ишим, Иркутск) и ряда крупных транспортных узлов Транссибирской (гг. Ишим, Иркутск) и Байкало-Амурской (гг. Иркутск, Комсомольск-на-Амуре) магистралей. Гаплотип домовых мышей китайского г. Лаяйн возможно попал в состав Сибирской филогруппы в связи с расселением мышей по новому шелковому пути через г. Кяхта, по которому грузы везли в Китай (рис. 5).
График частот попарных различий между гаплотипами для линии M. musculus из Западной Сибири отражает классическое представление об эффективной численности популяций (рис. 4г). График имеет однокупольное распределение, что может говорить об экспансивном росте численности с одним пиком. Однако низкое нуклеотидное разнообразие свидетельствует о возможной депрессии численности, или об относительно недавнем формировании группировки. Вероятно, основателями населения могли быть домовые мыши из Европейской части России, учитывая их расселение вместе с человеком, в том числе по крупным транспортным магистралям, таким как Транссибирская и Байкало-Амурская. Дальнейшие исследования позволят уточнить количество городов в Сибири, связанных с линиями Азия 1, Азия 2 и их расселением.
Наши данные достаточно хорошо согласуются с результатами японских исследователей и подтверждают заселение Азии и Европы разными филетическими линиями. Сузуки и др. (Suzuki et al., 2013) отмечают высокое гаплотипическое разнообразие европейских филогрупп и связывают это с относительно незначительной его дифференциацией при расселении. В пользу этого говорят и полученные нами данные, в том числе и достаточно большое число уникальных гаплотипов, разбросанных по всему ареалу вида. Что касается таксономического аспекта, то, как уже отмечалось в результатах, представители M. m. wagneri сформировали две небольшие группы, однако часть гаплотипов этого подвида вошла в другие филогруппы, а многие выделились как уникальные.
На основании проведенных исследований можно выделить Сибирскую линию домовых мышей M. musculus и современный путь их расселения (XVIII–XIX вв.) на восток Азии вдоль крупных транспортных магистралей. Состав гаплотипов и их распределение по территории линии Европа 1 может быть связано с расселением домовых мышей из Закавказья, как древнего центра дифференциации. Филогенетический анализ по данным контрольного региона мтДНК не показал значительную дифференциацию подвидов М. musculus (M. m. wagneri, M. m. musculus, M. m. gansuensis). Филогеографические линии домовых мышей M. musculus в Евразии отличались высокой неоднородностью на западе ареала (Восточная Европа) и компактностью на востоке (Сибирь, Китай, Япония, Корея). Популяции Восточной Европы неоднократно перемешивались в связи с расселением домовых мышей с помощью человека, тогда как Сибирь и Японию в современное время заселила лишь одна линия M. musculus. Филогенетическая линия домовых мышей из Закавказья оказалась, по нашим данным, монофилетичной в отличие от ряда других выделенных нами линий.
Финансирование. Исследование выполнено при финансовой поддержке гранта РНФ (19-74-00148).
Благодарности. Авторы выражают благодарность А.В. Сурову, Ю.А. Баженову, Н.И. Абрамсон, М.В. Холодовой и Н.Н. Бурняшеву за помощь в сборе материала и консультации при использовании соответствующих целям методов работы.
Список литературы
Бойко В.П. Роль Московско-Сибирского тракта в хозяйственном и культурном развитии Сибири XIX в. // Вестн. Том. Гос. Ун-та. История. 2012. Т. 18. № 2. 48 с.
Богданов А.С., Мальцев А.Н., Котенкова Е.В., Маликов В.Г., Лисовский А.А., Стахеев В.В., Darvish J., Castiglia R. Изменчивость фрагментов экзона 11 ядерного гена Brca1 и митохондриального гена Cox1 у домовых мышей Mus musculus // Мол. биология. 2020. Т. 54. № 2. С. 212–223.
Катионов О.Н. Московско-Сибирский тракт как основная сухопутная транспортная коммуникация Сибири (30-е гг. ХVIII–90-е гг. XIX вв.): Автореф. дис. докт. ист. наук. Омск: Новосибирский гос. пед. ун-т, 2006. 34 с.
Котенкова Е.В. Синантропные и дикоживущие мыши надвидового комплекса Mus musculus s. 1: систематика, распространение, образ жизни, механизмы изоляции и эволюция: Автореф. дис. докт. биол. наук. М.: Институт проблем экологии и эволюции им. А.Н. Северцова РАН, 2000. 55 с.
Кучерук В.В. Ареал домовых мышей надвидового комплекса Mus musculus s. lato // Домовая мышь. Происхождение, распространение, систематика, поведение / Ред. Е.В. Котенковой, Н.Ш. Булатовой. М.: Наука, 1994. С. 56–61.
Мальцев А.Н. Микроэволюция и внутривидовая структура домовой мыши Mus musculus: Автореф. дис. канд. биол. наук. М.: Институт проблем экологии и эволюции им. А.Н. Северцова РАН, 2011. 26 с.
Мальцев А.Н., Баженов Ю.А. Филогеография домовой мыши Mus musculus на территории России и ближнего зарубежья и роль инвазий // Живые и биокосные системы. 2013. № 5. http://doi.org/jbks.ru/archive/issue-5/article-11
Межжерин С.В. Таксономия и современные взгляды на систему домовых мышей Палеарктики // Домовая мышь. Происхождение, распространение, систематика, поведение / Ред. Е.В. Котенкова, Н.Ш. Булатова, ред. М.: Наука, 1994. С. 15–27.
Милишников А.Н., Лавренченко Л.А., Рафиев А.Н., Орлов В.Н. Высокий уровень интрогрессии генов Mus domesticus в популяции мыши Mus musculus s. str. Закавказья // Докл. АН СССР. 1990. Т. 311. № 3. С. 764–768.
Милишников А.Н. Разграничение древнего и эволюционно-нового полиморфизма в популяциях надвидового комплекса домовых мышей Mus musculus sensu lato // Докл. РАН. 2004. Т. 397. С. 281–285.
Милишников А.Н., Лавренченко Л.А., Лебедев В.С. Происхождение домовых мышей Закавказья (надвидовой комплекс Mus musculus). Новый взгляд на пути их расселения и эволюцию // Генетика. 2004. Т. 40. 1234–1250.
Спиридонова Л.Н., Коробицина К.В., Якименко Л.В., Богданов А.С. Генетическая дифференциация подвидов домовой мыши Mus musculus и их таксономические взаимоотношения: данные RAPD-PCR анализа // Генетика. 2008. Т. 44. С. 841–849.
Спиридонова Л.Н., Киселёв К.В., Коробицина К.В. Несогласованность распространения маркеров разных систем наследования (я-, мтДНК и хромосомы) в надвидовом комплексе Mus musculus как следствие обширной гибридизации в Приморье // Генетика. 2011. Т. 47. С. 115–125.
Хляп Л.А., Варшавский А.А. Синантропные и агрофильные грызуны как чужеродные млекопитающие // Рос. журн. биол. инвазий. 2010. № 3. С. 73–91.
Auffray J.-C., Marshall J.T., Thaler L., Bonhomme F. Focus on the nomenclature of European species of Mus // Mouse Genome. 1990. V. 88. P. 7–8.
Avise J.C. Phylogeography: the history and formation of species. Cambridge: Harvard University Press, 2000. 484 p.
Avise J.C., Arnold J., Ball R. Intraspecific phylogeography: the mitochondrial DNA bridge between population genetics and systematics // Ann. Rev. Ecol. Syst. 1987. V. 18. P. 489–522.
Boissinot S., Boursot P. Discordant phylogeographic patterns between the Y chromosome and mitochondrial DNA in the house mouse: selection on the Y chromosome? // Genetics. 1997. V. 146. P. 1019–1034.
Bonhomme F., Anand R., Darviche D., Din W., Boursot P., Kazuo M., Toshihiko S., Hiromichi Y. et al. The House Mouse as a Ring Species? // Genetics In Wild Mice. Ist Application to Biomedical Research / Eds Kazuo M., Toshihiko S., Hiromichi Y. Basel, Karger: Japan Sci. Soc. Press Tokyo, 1994. P. 13–23.
Bonhomme F., Orth A., Cucchi T., Rajabi-Maham H., Catalan J., Boursot P., Auffray J.-C., Britton-Davidian J. Genetic differentiation of the house mouse around the Mediterranean basin: Matrilineal footprints of early and late colonization // Proc. Roy Soc. B: Biol. Sci. 2010. V. 278. P. 1034–1043.
Boursot P., Auffray J.-C., Britton-Davidian J., Bonhomme F. The evolution of house mice // Annu Rev. Ecol. Evol. Syst. 1993. V. 24. P. 119–152.
Boursot P., Din W., Anand R., Darviche D., Dod B., Deimling von F., Talwar G.P., Bonhomme F. Origin and radiation of the house mouse: Mitochondrial DNA phylogeny // J. Evol. Biol. 1996. V. 9. P. 391–415.
Cucchi T., Vigne J.D., Auffray J.-C. First occurrence of the house mouse (Mus musculus domesticus Schwarz and Schwarz, 1943) in the Western Mediterranean: A zooarchaeological revision of subfossil occurrences // Biol. J. Linn. Soc. 2005. V. 84. P. 429–445.
Cucchi T., Vigne J.D. Origin and diffusion of the house mouse in the Mediterranean // Human Evolution. 2006. V. 21. P. 95–106.
Cucchi T., Auffray J.C., Vigne J.D. History of house mouse synanthropy and dispersal in the Near East and Europe: a zooarchaeological insight // Evolution of the House Mouse / Eds Macholan M., Baird S.J.E., Munclinger P., Piàlek J. Cambridge: Cambridge University Press, 2012. P. 65–93.
Cucchi T., Kovács E.Z., Berthon R., Orth A., Bonhomme F., Evin A., Siahsarvie R., Darvish J., Bakhshaliyev V., Marro A. On the trail of Neolithic mice and men towards Transcaucasia: zooarchaeological clues from Nakhchivan (Azerbaijan) // Biol. J. Linn. Soc. 2013. V. 108. P. 917–928.
Cucchi T., Papayianni K., Cersoy S., Aznar-Cormano L., Zazzo A., Debruyne R., Berthon R. et al. Tracking the near eastern origins and European dispersal of the western house mouse // Scientific Reports Nature. 2020. V. 10. scientificreportswww.nature.com/scientificreports
Din W., Anand R., Boursot P., Darviche D., Dod B., Jouvin-Marche E., Orth F., Talwar G.P., Cazenave P.-A., Bonhomme F. Origin and radiation of the house mouse: clues from nuclear genes // J. Evol. Biol. 1996. V. 9. P. 519–539.
Duvaux L., Belkhir K., Boulesteix M., Boursot P. Isolation and gene flow: inferring the speciation history of European house mice // Mol. Ecol. 2011. V. 20. P. 5248–5264.
Excoffier L., Guillaume Laval G., Schneider S. Arlequin (version 3.0): An integrated software package for population genetics data analysis // Evol. Bioinform Online. 2005. V. 1. P. 47–50.
Geraldes A., Basset P., Gibson B., Smith K.L., Harr B., Yu H.-T., Bulatova N., Ziv Y., Nachman M.W. Inferring the history of speciation in house mice from autosomal, X-linked, Y-linked and mitochondrial genes // Mol. Ecol. 2008. V. 17. P. 5349–5363.
Guènet J.-L., Bonhomme F. Wild mice: an ever-increasing contribution to a popular mammalian model // Trends in Genetics. 2003. V. 19. P. 24–31.
Gündüz I., Auffray J.-C., Britton-Davidian J., Catalan J., Ganem G., Ramalhinho M.G., Mathias M.L., Searle J.B. Molecular studies on the colonization of the Madeiran archipelago by house mice // Mol. Ecol. 2001. V. 10. P. 2023–2029.
Gündüz I., Rambau R.V., Tez C., Searle J.B. Mitochondrial DNA variation in the western house mouse (Mus musculus domesticus) close to its site of origin: studies in Turkey // Biol. J. Linn. Soc. 2005. V. 84. P. 473–485.
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Research. 1999. V. 41. P. 95–98.
Huson D.H., Bryant D. Application of phylogenetic networks in evolutionary studies // Mol. Biol. Evol. 2006. V. 23. P. 254–267.
Ihle S., Ravaoarimanana I., Thomas M., Tautz D. An analysis of signatures of selective sweeps in natural populations of the house mouse // Mol. Biol. Evol. 2006. V. 23. P. 790–797.
Jing M., Yu H.-T., Bi X., Lai Y.-C., Jiang W., Huang L. Phylogeography of Chinese house mice (Mus musculus musculus/castaneus): distribution, routes of colonization and geographic regions of hybridization // Mol. Ecol. 2014. V. 23. P. 4387–4405.
Jones E.P., Kooij J., Solheim R., Searle J.B. Colonization and interactions of two subspecies of house mouse (Mus musculus) in Norway // Mol. Ecol. 2010. V. 19. P. 5252–5264.
Jones E.P., Jensen J.-K., Magnussen E., Gregersen N., Heidi S., Hansen H. S., Searle J. B. A molecular characterization of the charismatic Faroe house mouse // Biol. J. Linn. Soc. 2011. V. 102. P. 471–482.
Jones E.P., Eager H.M., Gabriel S.I., Jóhannesdóttir F., Searle J.B. Genetic differentiation of the house mouse around the Mediterranean basin: Matrilineal footprints of early and late colonization // Rev. Trends Genet. 2013. V. 29. P. 298–308.
Kotenkova E.V., Maltsev A.N. The role of invasions in evolution of commensal taxa of Mus musculus sensu lato species group // Russ. J. Biol. Invasions. 2012. V. 3. P. 230–234.
Maltsev A.N., Stakheev V.V., Bogdanov A.S. Fomina E.S., Kotenkova E.V. Phylogenetic relationships of intraspecific forms of the house mouse Mus musculus: Analysis of variability of the control region (D-loop) of mitochondrial DNA // Doklady Biol. Sci. 2015. V. 465. P. 380–383.
Maltsev A.N., Stakheev V.V., Kotenkova E.V. Role of invasions in formation of phylogeographic structure of house mouse (Mus musculus) in some areas of Russia and the near abroad // Russ. J. Biol. Invasions. 2016. V. 7. P. 255–267.
Mezhzherin S.V., Kotenkova E.V., Mikhailenko A.G. The house mice, Mus musculus s. l., hybrid zone of Transcaucasus // Zeit. Zaugetierk. 1998. V. 63. P. 154–168.
Orth A.L., Auffray J.-C., Bonhomme F. Two deeply divergent mitochondrial clades in the wild mouse Mus macedonicus reveal multiple glacial refuges south of Caucasus // Heredity. 2002. V. 89. P. 353–357.
Posada D., Crandall K.A. ModelTest: testing the model of DNA substitution // Bioinformatics. 1998. V. 14. P. 817–818.
Prager E.M., Sage R.D., Gyllensten U., Thomas W.K., Hübner R., Jones C.S., Noble L., Searle J.B., Wilson A.C. Mitochondrial DNA sequence diversity and the colonization of Scandinavia by house mice from East Holstein // Biol. J. Linn. Soc. 1993. V. 50. P. 85–122.
Prager E.M., Tichy H., Sage R.D. Mitochondrial DNA sequence variation in the eastern house mouse, Mus musculus: Comparison with other house mice and report of a 75-bp tandem repeat // Genetics. 1996. V. 143. P. 427–446.
Prager E.M., Orrego C., Sage R.D. Genetic variation and phylogeography of central Asian and other house mice, including a major new mitochondrial lineage in Yemen // Genetics. 1998. V. 150. P. 835–861.
Rajabi-Maham H., Orth A., Bonhomme F. Phylogeography and postglacial expansion of Mus musculus domesticus inferred from mitochondrial DNA coalescent, from Iran to Europe // Mol. Ecol. 2008. V. 17. P. 627–641.
Rajabi-Maham H., Orth A., Siahsarvie R., Boursot P., Darvish J., Bonhomme F. The south-eastern house mouse Mus musculus castaneus (Rodentia: Muridae) is a polytypic subspecies // Biol. J. Linn. Soc. 2012. V. 107. P. 295–306.
Rogers, A.R., Harpending H. Population growth makes waves in the distribution of pairwise genetic differences // Biol. Evol. 1992. V. P. 552–569.
Ronquist F., Huelsenbeck J.P. Mrbayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. P. 1572–1574.
Rozas J., Sanchez-DeI, Barrio J.C., Messeguer X., Rozas R. Dnasp, DNA polymorphism analyses by the coalescent and other methods // Bioinformatics. 2003. V. 19. P. 2496–2497.
Sage R.D., Atchley W.R., Capanna E. House mice as models in systematic biology // Syst. Biology. 1993. V. 42. P. 523–561.
Searle J., Jones C., Gündüz I., Scascitelli M., Jones E., Herman J., Rambau V., Noble L., Berry J., Giménez M., Jóhannesdóttir F. Of mice and (Viking?) men: phylogeography of British and Irish house mice // Proc. Roy Soc. B: Biol. Sci. 2009. V. 276. P. 201–207.
Suzuki H., Nunome M., Kinoshita G., Aplin K.P., Vogel P., Kryukov A.P., Jin M.-L., Han S.-H., Maryanto I., Tsuchiya K., Ikeda H., Shiroishi T., Yonekawa H., Moriwaki K. Evolutionary and dispersal history of Eurasian house mice Mus musculus clarified by more extensive geographic sampling of mitochondrial DNA // Heredity. 2013. V. 111. P. 375–390.
Suzuki H., Yakimenko L.V., Usuda D., Frisman L.V. Tracing the eastward dispersal of the house mouse, Mus musculus // Genes and Environment. 2015. V. 37. P. 1–9.
Tchernov E. From sedentism to domestication: a preliminary review for Southern Levant // Skeletons in Her Cupboard: Festschrift for Juliet Clutton-Brock / Eds. Clason A.T., Payne S., Uerpmann H. P. Oxford: Oxbow Books, 1993. P. 189–233.
Thompson J.D., Higgins D.G., Gibson T.J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice //. J. Syst. Evol. Res. 1994. V. 22. P. 4673–4680.
Tucker P., Sandstedt S., Lundrigan B. Phylogenetic relationships in the subgenus Mus (genus Mus, family Muridae, subfamily Murinae): examining gene trees and species trees // Biol. J. Linn. Soc. 2005. V. 84. P. 653–662.
Yonekawa H., Moriwaki K., Gotoh O., Hayashi J.I., Watanabe J., Miyashita N., Petras M.L., Tagashira Y. Evolutionary relationships among five subspecies of Mus musculus based on restriction enzyme cleavage patterns of mitochondrial DNA // Genetics. 1981. V. 98. P. 801–816.
Yonekawa H., Tsuda K. Tsuchiya K., Yakimenko L.V., Korobitsyna, Chelomina G. N., Spiridonova L.N., Frisman L.V., Kryukov A.P., Moriwaki K. Genetic diversity, geographic distribution and evolutionary relationships of Mus musculus subspecies based on polymorphisms of mitochondrial DNA // Probl. of Evolution. V. 5 / Eds. Kryukov A.P., Yakimenko L.V. Vladivostok: Dalnauka, 2003. V. 5. P. 62–89.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


