Известия РАН. Серия биологическая, 2022, № 2, стр. 141-150
Влияние дефицита цинка на экспрессию генов и активность антиоксидантных ферментов у растений ячменя при оптимальной и низкой температуре
Н. М. Казнина 1, *, Ю. В. Батова 1, Н. С. Репкина 1, А. Ф. Титов 1
1 Институт биологии – обособленное подразделение ФГБУН ФИЦ “Карельский научный центр
Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: kaznina@krc.karelia.ru
Поступила в редакцию 20.05.2020
После доработки 22.06.2020
Принята к публикации 22.06.2020
- EDN: RLWLDT
- DOI: 10.31857/S1026347022010085
Аннотация
В условиях контролируемой среды изучали динамику активности двух ключевых антиоксидантных ферментов – супероксиддисмутазы (СОД) и пероксидазы (ПО) и экспрессию кодирующих их генов (HvSOD1 и HvPRX07) при температуре 22 и 4°С у растений ячменя, растущих при оптимальном (2 мкМ) содержании цинка в корнеобитаемой среде и его дефиците (0 мкМ). Установлено, что при 22°С дефицит цинка не приводит к усилению интенсивности перекисного окисления липидов (ПОЛ) в корнях и листьях ячменя, что соотносится с увеличением количества транскриптов изученных генов и повышением активности СОД и ПО. В условиях гипторемии дефицит металла вызывал усиление окислительных процессов в корнях проростков, что связано с отсутствием увеличения активности антиоксидантных ферментов, несмотря на повышение экспрессии генов. При этом в листьях усиления окислительных процессов не происходит. Защита клеток листа от окислительного стресса в условиях совместного действия дефицита цинка и низкой температуры может быть связана с усилением активности других (неферментных) компонентов антиоксидантной системы.
К настоящему времени накоплен большой объем экспериментальных данных, характеризующих реакцию растений на различные виды стрессовых воздействий. Как установлено, одной из главных причин отрицательного влияния любого стрессора на растения является развитие в его клетках и тканях окислительного стресса, возникающего в результате резкого увеличения количества активных форм кислорода (АФК). Небольшое количество АФК, образующееся в норме в хлоропластах, митохондриях и пероксисомах обычно быстро устраняется благодаря работе антиоксидантной системы. В условиях стресса баланс между образованием и нейтрализацией АФК нарушается, приводя к их накоплению в клетках. И хотя многие АФК выполняют роль сигнальных молекул, активизирующих защитные системы организма, их чрезмерное накопление представляет серьезную опасность, вызывая окисление липидов, протеинов и нуклеиновых кислот и, как следствие, серьезные нарушения клеточного метаболизма (Apel, Hirt, 2004; Gill, Tuteja, 2010).
Цинк является одним из наиболее важных для растений микроэлементов, поскольку выполняет большое число разнообразных функций в растительной клетке (Broadley, 2007; Sinclair, Krämer, 2012). Вследствие этого, его недостаток в окружающей среде и растениях ведет к серьезным нарушениям в протекании основных физиологических процессов и снижению продуктивности (Казнина, Титов, 2019). Как показывают исследования, во многом это обусловлено развитием в клетках окислительного стресса, который может быть вызван целым рядом причин. В частности, дефицит цинка способствует усилению образования свободных радикалов в реакциях, протекающих с участием ионов железа, так как эти металлы конкурируют за места связывания в молекулах белков и фосфолипидов (Cakmak, 2000; Zago, Oteiza, 2001). Кроме того, цинк необходим для нормального функционирования ряда ферментов, участвующих в антиоксидантной защите, и при дефиците металла их активность заметно снижается. Например, он входит в состав Cu/Zn супероксиддисмутазы (Cu/Zn СОД), которая является ключевым антиоксидантным ферментом, обеспечивающим нейтрализацию супероксид радикала (Broadley, 2007), а также маннозы-6-фосфат-изомеразы, участвующей в метаболизме аскорбата – важнейшего низкомолекулярного антиоксиданта клеток (Höller et al., 2014). Помимо этого, недостаток металла усиливает НАДФН-оксидазную генерацию супероксида, что было обнаружено, например, у бобов (Pinton et al., 1994). Наконец, нельзя не отметить участие цинка в регуляции экспрессии генов, в том числе участвующих в антиоксидантном ответе, который осуществляется у растений с участием транскрипционных факторов, имеющих домен “цинковые пальцы” (Alloway, 2008)
Учитывая важную роль цинка в поддержании окислительно-восстановительного баланса клетки, высказано предположение, что его дефицит может отрицательно сказываться на способности растений противостоять другим стресс-факторам, таким, как например, засуха, низкая температура, загрязнение поллютантами, вследствие усиления окислительных процессов в клетках (Cakmak, 2000). Однако такого рода экспериментальных данных крайне мало. Учитывая это, нами проведено сравнительное изучение влияния дефицита цинка на динамику активности двух ключевых антиоксидантных ферментов – супероксиддисмутазы (СОД) и пероксидазы (ПО), и экспрессию кодирующих их генов у растений ячменя, находящихся в оптимальных температурных условиях и подвергнутых действию низкой положительной температуры.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на растениях ярового ячменя (Hordeum vulgare L.) сорта Нур, которые выращивали в климатической камере при температуре воздуха 22°С, его относительной влажности 60%, ФАР 100 мкмоль/м2·с и 14-часовом фотопериоде. При этом одну часть растений выращивали на питательном растворе Хогланда–Арнона (1/2 концентрации) в который добавляли сульфат цинка в оптимальной концентрации (2 мкМ) (вариант Zn 2 мкМ + 22°С), а другую на таком же растворе, но без добавления соли цинка (вариант Zn 0 мкМ + + 22°С). Спустя 7 сут часть проростков обоих вариантов переносили в камеру с температурой 4°С (варианты Zn 2 мкМ + 4°С и Zn 0 мкМ + 4°С), другие растения оставляли в прежних условиях. Температура 4°С, выбранная на основе предварительных опытов, находится в пределах субповреждающих значений для данного сорта ячменя. Анализ растений проводили до начала низкотемпературного воздействия (исходный уровень) и спустя 1, 3 и 7 сут действия низкой температуры.
Интенсивность перекисного окисления липидов (ПОЛ) в корнях и листьях растений оценивали по содержанию малонового диальдегида (МДА), которое определяли с использованием реакционной среды, содержащей 0.25%-ный раствор тиобарбитуровой кислоты в 10%-ной трихлоруксусной кислоте (Heath, Packer, 1968). Растительный материал гомогенизировали в реакционной среде. Гомогенат выдерживали на водяной бане при 95°С в течение 30 мин, быстро охлаждали и центрифугировали 10 мин при 10 000 g. Оптическую плотность супернатанта измеряли с использованием спектрофотометра СФ-2000 (“Спектр”, Россия) при 532 и 600 нм. Для расчета содержания МДА (мкмоль/г сырой массы) использовали коэффициент экстинкции, равный 155 мМ–1 см–1.
Накопление транскриптов генов анализировали методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ). Листья и корни растирали в жидком азоте. Тотальную РНК выделяли с помощью набора ExtractRNA (“Синтол”). Количество и качество тотальной РНК проверяли спектрофотометрически на приборе SmartSpec Plus (“Bio Rad”, США) по соотношению длин волн 260/280 и с помощью электрофореза в 1%-ном агарозном геле. Для удаления остатков ДНК препарат РНК обрабатывали ДНКазой (“Синтол”). кДНК синтезировали, используя набор для обратной транскрипции с М-MLV обратной транскриптазой и случайными (random) гексапраймерами (“Евроген”, Россия) (табл. 1). В качестве референсного гена использовали актин. Количество и качество синтезированой кДНК проверяли спектрофотометрически на приборе SmartSpec Plus (“Bio Rad”). Амплификацию образцов проводили в приборе iCycler с оптической приставкой iQ5 (“Bio Rad”), используя наборы для амплификации с интеркалирующим красителем SYBR Green (“Евроген”). Специфичность продуктов амплификации проверяли плавлением ПЦР фрагментов. Эффективность ПЦР, оцениваемая по стандартной кривой, достигала 98%. Уровень транскриптов генов вычисляли по формуле 2–ΔΔСт и выражали в относительных единицах (Livak et al., 2001).
Таблица 1.
Праймеры для проведения ПЦР в режиме реального времени
| Ген | Праймер | Последовательность праймера 5' → 3' |
Номер доступа в базе данных NCBI |
|---|---|---|---|
| HvActin | Прямой | ATGTTTTTTTCCAGACG | HVU21907 |
| Обратный | ATCCAAGCCAACCCAAGT | ||
| HvSOD1 | Прямой | CCTGCCCTTTCCACTCG | HM537232 |
| Обратный | TGTCGTAGGACCGTCATCG | ||
| HvPRX07 | Прямой | TCCACCCTCATCTCCTCCTT | AJ003141 |
| Обратный | ACGGCTTGAACGGTCCTC |
Для определения активности СОД (КФ 1.15.1.1.) и ПО (КФ 1.11.1.7.) листья гомогенизировали в 0.1 М фосфатном буфере (pH 7.8). Гомогенат центрифугировали при 15 000 g в течение 20 мин при 4°С. Супернатант использовали для определения содержания белка и активности ферментов спектрофотометрическим методом, как описано нами ранее (Казнина и др., 2016). Об активности СОД судили по способности ингибировать фотохимическое восстановление нитросинего тетразолия. Активность ПО определяли, используя в качестве субстрата гваякол. Активность ферментов рассчитывали на мг белка. Общее содержание белка определяли по методу Бредфорда (Bradford, 1971), используя в качестве стандарта бычий сывороточный альбумин.
Биологическая повторность при изучении биохимических показателей была 2–3 кратная. Каждая из них содержала растительный материал, собранный с 3–4 растений. Аналитическая повторность 3–4 кратная. Весь опыт повторяли дважды. На рисунках и в таблицах представлены средние значения и их стандартные ошибки. Анализ данных проводили с использованием пакета анализа данных Microsoft Exel. О достоверности различий судили по критерию Стьюдента при р < 0.05.
Исследования выполнены на научном оборудовании Центра коллективного пользования ФИЦ “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование показало, что у растений ячменя, растущих в оптимальных температурных условиях, дефицит цинка не вызывает увеличения интенсивности ПОЛ в корнях и листьях, наоборот, содержание МДА в варианте Zn 0 мкМ + 22°C на протяжении всего опыта было ниже, чем в варианте Zn 2 мкМ + 22°C (табл. 2). В условиях гипотермии как при оптимальной концентрации цинка (вариант Zn 2 мкМ + 4°C), так и при его дефиците (вариант Zn 0 мкМ + 4°C) в листьях содержание МДА также практически не менялось, тогда как в корнях спустя 3-е и 7-о сут наблюдалось заметное его увеличение (по сравнению с исходным уровнем).
Таблица 2.
Влияние дефицита цинка на содержание малонового диальдегида (мкмоль/г сырой массы) в корнях и листьях ячменя при оптимальной (22°С) и низкой (4°С) температуре
| Вариант | Исходный уровень | Экспозиция, сут | ||
|---|---|---|---|---|
| 1 | 3 | 7 | ||
| Корень | ||||
| 2 мкМ Zn + 22°C | 2.53 ± 0.11cd | 2.32 ± 0.02d | 2.04 ± 0.04ef | 2.25 ± 0.01d |
| 0 мкМ Zn + 22°C | 2.51 ± 0.04c | 1.93 ± 0.06ef | 2.29 ± 0.16de | 1.90 ± 0.02f |
| 2 мкМ Zn + 4°C | 2.53 ± 0.11cd | 2.19 ± 0.08de | 2.97 ± 0.04b | 3.64 ± 0.18a |
| 0 мкМ Zn + 4°C | 2.51 ± 0.04c | 2.32 ± 0.02d | 2.63 ± 0.05c | 3.68 ± 0.07a |
| Лист | ||||
| 2 мкМ Zn + 22°C | 2.17 ± 0.10bc | 2.16 ± 0.02b | 2.24 ± 0.04b | 2.61 ± 0.07a |
| 0 мкМ Zn + 22°C | 1.83 ± 0.07c | 1.95 ± 0.10bc | 1.90 ± 0.06bc | 2.30 ± 0.06b |
| 2 мкМ Zn + 4°C | 2.17 ± 0.10bc | 2.49 ± 0.18ab | 2.72 ± 0.10a | 2.74 ± 0.12a |
| 0 мкМ Zn + 4°C | 1.83 ± 0.07c | 2.31 ± 0.16ab | 2.21 ± 0.18bc | 2.43 ± 0.12ab |
Примечание. Здесь и в табл. 3 и 4 различные буквы обозначают достоверные различия при р < 0.05.
Нами также обнаружено, что при температуре 22°С, независимо от содержания цинка в корнеобитаемой среде, количество транскриптов гена HvSOD1 в корнях и листьях ячменя увеличивалось, достигая максимальных значений к концу опыта (рис. 1а, 1б). Однако при дефиците металла (вариант Zn 0 мкМ + 22°C) количество мРНК этого гена было заметно ниже, чем при его оптимальном содержании (вариант Zn 2 мкМ + 22°C). В оптимальных условиях минерального питания в органах ячменя возрастало (по отношению к исходному уровню) и количество мРНК гена HvPRX07 (рис. 2). При дефиците микроэлемента в корнях уровень транскриптов этого гена резко увеличивался через 1 сут после начала измерений, однако к концу опыта снижался до исходных значений. В листьях же он уменьшался и до завершения опыта оставался довольно низким, причем существенно ниже, чем при оптимальном содержании микроэлемента.
Рис. 1.
Влияние дефицита цинка на количество транскриптов гена HvSOD1 в корнях (а) и листьях (б) ячменя при оптимальной (22°С) и низкой (4°С) температуре. 1 – исходный уровень, 2, 3, 4 – через 1, 3 и 7 сут соответственно.

Рис. 2.
Влияние дефицита цинка на количество транскриптов гена HvPRX07 в корнях (а) и листьях (б) ячменя при оптимальной (22°С) и низкой (4°С) температуре. 1 – исходный уровень, 2, 3, 4 – через 1, 3 и 7 сут соответственно.
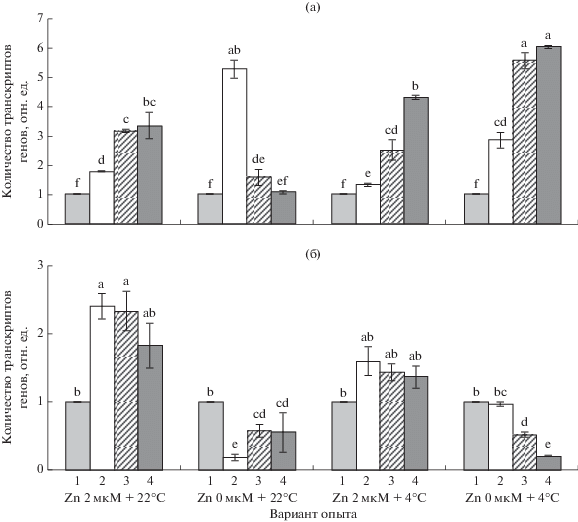
При действии на растения низкой температуры в корнях независимо от уровня цинка в корнеобитаемой среде уже спустя 1 сут наблюдалось увеличение (по отношению к исходному уровню) количества транскриптов изученных нами генов (рис. 1, 2). И в дальнейшем оно продолжало увеличиваться, достигая максимума для HvSOD1 через 3 сут, для HvPRX07 – через 7 сут. Тем не менее, в целом, в условиях гипотермии число матриц гена HvSOD1 в корнях к завершению опыта было гораздо ниже, чем в вариантах опыта с температурой 22°С, тогда как гена HvPRX07 – существенно выше.
В отличие от корней, в листьях при воздействии на растения 4°С характер изменений экспрессии указанных генов зависел от содержания цинка в среде. В частности, в оптимальных условиях минерального питания экспрессия гена HvSOD1 возрастала при увеличении экспозиции и к концу опыта превышала его почти в 7 раз (рис. 1), при этом количество транскриптов гена HvPRX07 достоверно не изменялось (рис. 2). При дефиците цинка после некоторого увеличения количества мРНК гена HvSOD1 через 1 сут низкотемпературного воздействия, уже спустя 3 сут содержание транскриптов обоих генов заметно уменьшалось по сравнению с исходным уровнем и к завершению опыта оказалось существенно ниже, чем при оптимальном содержании микроэлемента.
В результате исследования было также выявлено, что в условиях действия оптимальной температуры дефицит цинка приводит к снижению активности антиоксидантных ферментов. В частности, спустя 7 сут роста растений в условиях недостатка этого микроэлемента (исходный уровень) активность СОД (табл. 3) и ПО (табл. 4) как в корнях, так и в листьях ячменя была ниже, чем при оптимальном содержании металла. В дальнейшем, несмотря на то, что активность обоих ферментов увеличивалась, к завершению опыта она оказалась значимо ниже, чем при оптимальном содержании металла (табл. 3, 4). При воздействии на растения низкой температуры как в условиях дефицита цинка, так и при его оптимальном содержании в корнях увеличения активности СОД и ПО не происходило. Активность обоих ферментов в течение всего опыта оставалась на уровне близком к исходному или даже существенно уменьшалась. При этом в листьях активность СОД и ПО в обоих вариантах опыта (Zn 2 мкМ + 4°C и Zn 0 мкМ + 4°C) после некоторого снижения через 1 сут действия низкой температуры, на 3-и сутки восстанавливалась до исходных значений, а уже через 7 сут заметно их превосходила. В целом, в листьях в условиях дефицита цинка и гипотермии увеличение активности СОД было менее выраженным, чем при его оптимальном содержании в среде, тогда как активность ПО, наоборот, возрастала сильнее при недостатке микроэлемента.
Таблица 3.
Влияние дефицита цинка на общую активность супероксиддисмутазы (усл. ед. активности/ мг белка) в корнях и листьях ячменя при оптимальной (22°С) и низкой (4°С) температуре
| Вариант | Исходный уровень | Экспозиция, сут | ||
|---|---|---|---|---|
| 1 | 3 | 7 | ||
| Корень | ||||
| 2 мкМ Zn +22°C | 18.97 ± 1.14с | 14.11 ± 2.40сd | 14.45 ± 1.42cd | 48.45 ± 1.09a |
| 0 мкМ Zn +22°C | 11.60 ± 0.15d | 10.09 ± .48d | 17.33 ± 2.02cd | 30.02 ± 0.75b |
| 2 мкМ Zn + 4°C | 18.97 ± 1.14c | 20.99 ± 1.80c | 10.30 ± 1.39d | 12.87 ± 0.84d |
| 0 мкМ Zn + 4°C | 11.60 ± 0.15d | 13.13 ± 0.59d | 10.97 ± 0.76d | 10.91 ± 1.05d |
| Лист | ||||
| 2 мкМ Zn +22°C | 2.95 ± 0.38cd | 2.70 ± 0.37cd | 2.81 ± 0.17cd | 5.93 ± 0.26a |
| 0 мкМ Zn +22°C | 2.00 ± 0.37d | 2.61 ± 0.29cd | 2.78 ± 0.38cd | 5.19 ± 0.46ab |
| 2 мкМ Zn + 4°C | 2.95 ± 0.38cd | 1.65 ± 0.31d | 2.47 ± 0.55cd | 4.81 ± 0.23b |
| 0 мкМ Zn + 4°C | 2.00 ± 0.37d | 1.23 ± 0.52d | 2.06 ± 0.53cd | 3.53 ± 0.24c |
Таблица 4.
Влияние дефицита цинка на активность гваяколзависимой пероксидазы (усл. ед. активности/мг белка) в корнях и листьях ячменя при оптимальной (22°С) и низкой (4°С) температуре
| Вариант | Исходный уровень | Экспозиция, сут | ||
|---|---|---|---|---|
| 1 | 3 | 7 | ||
| Корень | ||||
| 2 мкМ Zn + 22°C | 19.31 ± 1.03bc | 17.10 ± 0.53cd | 15.17 ± 0.58de | 23.10 ± 0.45ab |
| 0 мкМ Zn + 22°C | 12.64 ± 0.55ef | 15.07 ± 1.01de | 24.87 ± 0.76a | 20.87 ± 0.69b |
| 2 мкМ Zn + 4°C | 19.31 ± 1.03bc | 19.54 ± 0.16b | 13.67 ± 0.06e | 9.52 ± 0.28g |
| 0 мкМ Zn + 4°C | 12.64 ± 0.55ef | 17.52 ± 0.43c | 15.96 ± 0.46cd | 10.80 ± 0.23f |
| Лист | ||||
| 2 мкМ Zn + 22°C | 0.46 ± 0.02e | 0.63 ± 0.02c | 0.66 ± 0.03c | 1.96 ± 0.04a |
| 0 мкМ Zn + 22°C | 0.34 ± 0.03f | 0.45 ± 0.02e | 0.52 ± 0.01de | 1.29 ± 0.01b |
| 2 мкМ Zn + 4°C | 0.46 ± 0.02e | 0.32 ± 0.02f | 0.37 ± 0.06ef | 0.59 ± 0.02cd |
| 0 мкМ Zn + 4°C | 0.34 ± 0.03f | 0.41 ± 0.01e | 0.53 ± 0.04cd | 0.65 ± 0.02c |
ОБСУЖДЕНИЕ
Недостаток цинка, который зафиксирован в отношении 30–50% почв мира (Hacisalihoglu, Kochian, 2003), оказывает отрицательное воздействие на многие физиологические процессы у растений и приводит к значительному снижению их продуктивности (Sinclair, Krämer, 2012; Казнина, Титов, 2019). Одной из главных причин этого является развитие в клетках окислительного стресса, вызванного накоплением избыточного количества свободных радикалов кислорода (Cakmak, 2000; Hacisalihoglu, Kochian, 2003; Höller et al., 2014; Tewari et al., 2019). При этом показано, что нарушение окислительно-восстановительного баланса клеток при дефиците цинка во многом связано с уменьшением активности СОД (Cakmak, 2000; Broadley, 2007). Как известно, цинк входит в состав активного центра Cu/ZnСОД – одной из изоформ фермента, функционирующей в большинстве компартментов клетки и катализирующей реакцию дисмутации супероксид радикала с образованием перекиси водорода и кислорода. Снижение активности Cu/ZnСОД при недостатке цинка было обнаружено у ржи, пшеницы (Cakmak et al., 1997; Hacisalihoglu et al., 2003), кукурузы (Wang, Jin, 2007) и сорго (Li et al., 2013) и сопровождалось усилением ПОЛ, что говорит о развитии в клетках окислительного стресса. Кроме того, показано, что уменьшение активности СОД, вызванное недостатком этого микроэлемента, может негативно влиять и на активность других антиоксидантных ферментов, например, каталазы, которая чувствительна к избытку супероксида. Вместе с тем, в литературе имеются данные и о повышении в условиях дефицита цинка активности некоторых ферментных компонентов антиоксидантной системы, что обнаружено у сортов (генотипов) ржи, пшеницы (Cakmak et al., 1997), гороха (Pandey et al., 2012), риса (Rose et al., 2012) и кукурузы (Tewari et al., 2019). Как правило, это соответствует более высокой устойчивости растений к данному виду стрессового воздействия.
Одним из путей регуляции активности антиоксидантных ферментов в стрессовых условиях является изменение экспрессии кодирующих их генов (Gill, Tuteja, 2010). Известно, например, что регуляция количества транскриптов генов, кодирующих Cu/ZnСОД, может осуществляться как на транскрипционном, так и на постранскрипционном уровнях с участием микроРНК, в частности miR398 и miR528 (Li et al., 2013). Однако сведений об изменении содержания транскриптов генов, участвующих в антиоксидантном ответе в условиях стресса, вызванного дефицитом цинка, относительно немного, и все они получены при выращивании растений в оптимальных температурных условиях.
В наших опытах в условиях дефицита цинка была изучена реакция антиоксидантной системы ячменя не только при оптимальной, но и при низкой температуре. При этом были проведены наблюдения за изменением активности СОД и ПО, как ключевых антиоксидантных ферментов, а также за изменением количества транскриптов двух генов: HvSOD1 и HvPRX07.
Нами впервые изучена реакция антиоксидантной системы ячменя на дефицит цинка не только при оптимальной, но и при низкой температуре. При этом прослежена динамика активности двух ключевых антиоксидантных ферментов – СОД и ПО, а также количества транскриптов двух генов: SOD1, кодирующего у ячменя одну из изоформ Cu/ZnСОД, участвующую в ответе на абиотический и биотический стрессы (Abu-Romman, Shatnawi, 2011), и гена PRX07, изменение экспрессии которого у ячменя ранее было выявлено только в ответ на биотический стресс и поранение (Kristensen et al., 1999). Результаты наших исследований показали, что в условиях дефицита цинка при 22°С в органах ячменя не происходит интенсификации ПОЛ, что говорит о сохранении про-антиоксиданого равновесия в клетках. При этом и в корнях, и в листьях растений зафиксировано постепенное увеличение количества транскриптов гена HvSOD1 и повышение общей активности СОД. Причем в листьях к концу воздействия активность фермента почти достигала уровня, характерного для растений, находившихся в оптимальных условиях минерального питания. Аналогичный эффект ранее был выявлен у растений сорго (Li et al., 2013), что, по мнению авторов, способствовало поддержанию у них нормального уровня ПОЛ. Однако в этих же опытах в корнях растений дефицит цинка вызывал усиление ПОЛ, которое наблюдалось на фоне снижения экспрессии гена CSD1, кодирующего цитоплазматическую изоформу Cu/Zn СОД, и уменьшения активности соответствующего фермента. В наших опытах у ячменя активность СОД в корнях при дефиците цинка также была заметно ниже, чем при его оптимальной концентрации во внешней среде. Однако, очевидно, благодаря усилению экспрессии гена HvSOD1 она достигала уровня, достаточного для сохранения интенсивности ПОЛ на низком уровне.
Как известно, для сохранения баланса АФК в клетках важное значение имеет согласованность в изменении активности СОД и ферментов, участвующих в детоксикации перекиси водорода. В наших опытах в оптимальных условиях минерального питания экспрессия гена HvPRX07 и активность ПО в корнях и листьях ячменя увеличивались в процессе роста растений, тогда как в условиях дефицита металла динамика содержания транскриптов этого гена в подземных и в надземных органах носила разнонаправленный характер, а именно – транзиторное увеличение в корнях и значительное снижение в листьях. Активность же ПО в органах растений росла, достигая максимальных значений к концу опыта. Полученные нами результаты в целом согласуются с данными литературы. Так, Zeng et al. (Zeng et al., 2019) на растениях сои показали, что в условиях дефицита цинка уровень экспрессии генов ряда изоформ ПО в органах может меняться как в сторону усиления, так и ослабления. Авторы считают, что разнонаправленные изменения экспрессии генов PRX связаны с тем, что роль разных изоформ этого фермента, изменяется в процессе адаптации растений к дефициту цинка. Возрастание же пероксидазной активности при дефиците цинка ранее наблюдали в корнях и листьях у растений капусты (Hajiboland, Amirazad, 2010) и чая (Mukhopadhyay et al., 2013). Показано также, что у более устойчивых к дефициту микроэлемента сортов кукурузы (Tewari et al., 2019), гороха (Pandey et al., 2012), риса (Rose et al., 2012) активность ПО, а также других ферментов, участвующих в нейтрализации перекиси, поддерживалась на более высоком уровне, чем у неустойчивых. Повышение активности ПО на фоне уменьшения экспрессии PRX генов может объясняться увеличением содержания в клетках перекиси водорода – субстрата ПО – вследствие активизации СОД. Помимо этого, учитывая, что ПО кодируются большим количеством генов (Wang et al., 2015), снижение активности одного из них может компенсироваться усилением экспрессии других.
Низкая температура также вызывает в клетках окислительный стресс, и холодоустойчивость растений во многом зависит от активности антиоксидантных ферментов в условиях гипотермии (Радюк и др., 2009; Колупаев и др., 2015; Синькевич и др., 2016 и др.). Отметим, что такого рода данные получены в основном при изучении клеток листьев растений. Сведений о том, что в это время происходит в клетках корня, крайне мало. Хотя некоторые авторы и указывают на существование заметных различий в ответе на охлаждение со стороны антиоксидантной системы подземных и надземных органов (Полесская и др., 2004).
Наши исследования показали, что в условиях гипотермии в корнях растений ячменя, независимо от содержания цинка в корнеобитаемой среде, экспрессия генов HvSOD1 и HvPRX07 усиливается с увеличением экспозиции, причем в большей степени гена HvPRX07. Повышения же активности СОД и ПО при этом не происходит, а интенсивность ПОЛ возрастает, свидетельствуя о развитии окислительного стресса. Поскольку накопление продуктов ПОЛ наблюдалось как при дефиците цинка, так и при его оптимальной концентрации, причем практически в равной мере, можно заключить, что усиление окислительных процессов явилось следствием воздействия именно низкой температуры, и могло быть связано с высокой чувствительностью к ней изоформ этих ферментов, функционирующих в клетках корня.
В листьях, в отличие от корней, увеличения интенсивности ПОЛ при действии температуры 4°С в обоих вариантах опыта (при оптимальном и низком содержании цинка) не происходило, но в экспрессии генов и активности ферментов были выявлены заметные различия, обусловленные содержанием микроэлемента в корнеобитаемой среде. В частности, в оптимальных условиях уже спустя сутки низкотемпературного воздействия количество транскриптов генов HvSOD1 и HvPRX07 увеличивалось и сохранялось на высоком уровне в течение всего периода действия низкой температуры. В условиях дефицита цинка уровень мРНК этих генов, наоборот, значительно снижался с увеличением экспозиции, что наиболее отчетливо наблюдалось спустя 7 сут. При этом активность СОД и ПО при дефиците цинка в среде хотя и несколько увеличивалась, но оставалась существенно ниже, чем при оптимальном содержании металла. Можно предположить, что обнаруженное нами в варианте Zn 0 мкМ + 4°C уменьшение количества транскриптов гена HvSOD1 и относительно низкая активность СОД в листьях, является адаптивной реакцией, необходимой для поддержания активности фотосинтетического аппарата, и, по крайней мере отчасти, обусловлена внутриклеточным “перераспределением” ионов цинка с целью поддержания активности другого цинксодержащего фермента – карбоангидразы, который участвует в фиксации СО2 и влияет на работу РУБИСКО (Руденко и др., 2015). Это предположение согласуется с данными, показывающими, что при восстановлении снабжения этим микроэлементом растений, длительное время находившихся в условиях его дефицита, в первую очередь восстанавливается активность именно карбоангидразы, что, по мнению авторов, говорит о наличии некоего “приоритета” этого фермента над СОД в использовании цинка (Li et al., 2013). Отсутствие же признаков развития окислительного стресса в листьях ячменя при гипотермии и дефиците металла, может объясняться усилением участия в защите клеток других антиоксидантов, способных нейтрализовать супероксид радикалы, например, аскорбиновой кислоты (Радюк и др., 2009), а также повышением содержания протекторных соединений, таких как сахара и пролин (Колупаев и др., 2015).
Таким образом, на основании полученных данных и анализа литературы можно заключить, что дефицит цинка в оптимальных температурных условиях не приводит к усилению окислительного стресса в клетках корня и листа растений ячменя, что соотносится с увеличением количества транскриптов гена HvSOD1 и HvPRX07 и повышением активности ферментов СОД и ПО. В условиях гипотермии дефицит цинка также вызывает усиление экспрессии генов HvSOD1 и HvPRX07 в корнях проростков, однако активность ферментов при этом не увеличивается, что приводит к усилению интенсивности ПОЛ и развитию окислительного стресса. При этом в листьях усиления окислительных процессов не происходит, несмотря на то, что количество мРНК обоих генов уменьшается с увеличением времени низкотемпературного воздействия, а активность ферментов, хотя и повышается, но в гораздо меньшей степени, чем при оптимальном содержании цинка в среде. Предполагается, что защита клеток листа от окислительного стресса в условиях совместного действия дефицита цинка и низкой температуры связана с усилением активности других (неферментных) компонентов антиоксидантной системы.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (тема 0218-2019-0074).
Список литературы
Казнина Н.М., Титов А.Ф. Влияние дефицита цинка на физиологические процессы и продуктивность культурных злаков // Успехи современной биологии. 2019. Т. 139. С. 280–291.
Колупаев Ю.Е., Рябчун Н.И., Вайнер А.А., Ястреб Т.О., Обозный А.И. Активность антиоксидантных ферментов и содержание осмолитов в проростках озимых злаков при закаливании и криострессе // Физиология растений. 2015. Т. 62. С. 533–541.
Полесская О.Г. Каширина Е.И., Алехина Н.Д. Изменение активности антиоксидантных ферментов в листьях и корнях пшеницы в зависимости от формы и дозы азота в среде // Физиология растений. 2004. Т. 51. С. 686–691.
Радюк М.С., Доманская И.Н., Щербаков Р.А., Шалыго Н.В. Влияние низкой положительной температуры на содержание низкомолекулярных антиоксидантов и активность антиоксидантных ферментов в зеленых листьях ячменя // Физиология растений. 2009. Т. 56. С. 193–199.
Руденко Н.Н., Игнатова Л.К., Федорчук Т.П., Иванов Б.Н. Карбоангидразы фотосинтезирующих клеток высших растений // Биохимия. 2015. Т. 80. С. 798–813.
Синькевич М.С., Селиванов А.А., Антипина О.В., Кропочева Е.В., Алиева Г.П., Суворова Т.А., Астахова Н.В., Мошков И.Е. Активность антиоксидантных ферментов у растений Arabidopsis thaliana при закаливании к гипотермии // Физиология растений. 2016. Т. 63. С. 777–782.
Abu-Romman S., Shatnawi M. Isolation and expression analysis of chloroplastic copper/zinc superoxide dismutase gene in barley // S. Afr. J. Bot. 2011. V. 77. P. 328–334.
Alloway B.J. Zinc in soil and crop nutrition. 2-d ed. Brussels, Paris: IZA and IFA, 2008.136 p.
Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress and signal transduction // Annu. Rev. Plant Biol. 2004. V. 55. P. 373–399.
Bradford M.M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding / M.M. Bradford // Anal. Biochem. 1976. V. 72. P. 248–254.
Broadley M.R. Zinc in plants // New Phytol. 2007. V. 173. P. 677–702.
Cakmak I. Possible roles of zinc in protecting plant cells from damage by reactive oxygen species // New Phytol. 2000. V. 146. P. 185–205.
Cakmak I., Öztürk L., Eker S., Torun B., Kalfa H.I., Yilmaz A. Concentration of zinc and activity of copper/zinc-superoxide dismutase in leaves of rye and wheat cultivars differing in sensitivity to zinc deficiency // J. Plant Physiol. 1997. V. 151. P. 91–95.
Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants // Plant Physiol. Biochem. 2010. V. 4. P. 909–930.
Hacisalihoglu G., Hart J.J., Wang Y-H., Cakmak I., Kochian L.V. Zinc efficiency is correlated with enhanced expression and activity of zinc-requiring enzymes in wheat // Plant Physiol. 2003. V. 131. P. 595–602.
Hacisalihoglu G., Kochian L. How do some plants tolerate low level of soil zinc? Mechanisms of zinc efficiency in crop plants // New Phytol. 2003. V. 159. P. 341–350.
Hajiboland R., Amirazad F. Growth, Photosynthesis and antioxidant defense system in Zn-deficient red cabbage plants // Plant, Soil Environ. 2010. V. 56. P. 209–217.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189–198.
Höller S., Hajirezaei M.-R., von Wirén N., Frei M. Ascorbate metabolism in rice genotypes differing in zinc efficiency // Planta. 2014. V. 239. P. 367–379.
Kristensen B.K., Bloch H., Rasmussen S.K. Barley coleoptile peroxidases. Purification, molecular cloning and induction by pathogens // Plant Physiol. 1999. V. 120. P. 501–512.
Li Y., Zhang Y., Shi D., Kiu X., Qin J., Ge Q., Xu L., Pan X., Li W., Zhu Y., Xu J. Spatial-temporal analysis of zinc homeostasis reveals the response mechanisms to acute zinc deficiency in Sorhum bicolor // New Phytol. 2013. V. 200. P. 1102–1115.
Livak K.J., Thomas D., Schmittgen T.D. // Methods 2001. V. 25. P. 402–408.
Mukhopadhyay M., Das A., Subba P., Bantawa P., Sarkar B., Ghosh P., Mondal T.K. Structural, physiological, and biochemical profiling of tea plants under zinc stress // Biol. Plant. 2013. V. 57. P. 474–480.
Pandey N., Gupta B., Pathak G.C. Antioxidant response of pea genotypes to zinc deficiency // Физиология растений. 2012. Т. 59. С. 225–231.
Pinton R., Cakmak I., Marschner H. Zinc deficiency enhanced NAD(P)H-dependent superoxider redical production in plasma membrane vesicles isolated from roots of bean plants // J. Exp. Bot. 1994. V. 45. P. 45–50.
Rose M.T., Rose T.J., Pariasca-Tanaka J., Yoshihashi T., Neuweger H., Goesmann A., Frei M., Wissuva M. Root metabolic response of rice (Oriza sativa L.) genotypes with contrasting tolerance to zinc deficiency and bicarbonate excess // Planta. 2012. V. 236. P. 959–973.
Sinclair S.A., Krämer U. The zinc homeostasis network of land plants // Biochim. Biophys. Acta. 2012. V. 1823. P. 1553–1567.
Tewari R.K., Kumar P., Sharma P.N. An effective antioxidant defense provides protection against zinc deficiency-induced oxidative stress in Zn-efficient maize plants // J. Plant Nutr. Soil Sci. 2019. V. 182. P. 701–707.
Wang H., Jin J. Effects of zinc deficiency and drought on plant growth and metabolism of reactive oxygen species in maize (Zea mays L.) // Agric. Sci. China. 2007. V. 6. P. 988–995.
Wang Y., Wang Q., Zhao Y., Han G., Zhu S. Systematic analysis of maize class III peroxidase gene family reveals a conserved subfamily in abiotic stress response // Gene. 2015. V. 566. P. 95–108.
Zago M.P., Oteiza P.I. The antioxidant properties of zinc: interactions with iron and antioxidants // Free Radical Biol. Med. 2001. V. 31. P. 266–274.
Zeng H., Zhang X., Ding M., Zhang X., Zhu Y. Transcriptome profiles of soybean leaves and roots in response to zinc deficiency // Physiol. plant. 2019. V. 167. P. 330–351.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


