Известия РАН. Серия биологическая, 2022, № 3, стр. 258-271
Филогеография малой Crocidura suaveolens и сибирской Crocidura sibirica белозубок: в поисках географической Родины
В. А. Грицышин 1, *, И. В. Артюшин 1, В. О. Бурская 2, Б. И. Шефтель 3, В. С. Лебедев 4, А. А. Банникова 1, **
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
2 Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Большой Каретный пер., д. 19 стр. 1, Россия
3 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский пр-т, 33, Россия
4 Зоологический музей МГУ им. М.В. Ломоносова
125009 Москва, ул. Большая Никитская, 2, Россия
* E-mail: vladimir.sokol.gritsyshin@gmail.com
** E-mail: hylomys@mail.ru
Поступила в редакцию 29.11.2020
После доработки 23.06.2021
Принята к публикации 23.06.2021
- EDN: FZFKVK
- DOI: 10.31857/S1026347022020093
Аннотация
Изучен полиморфизм гена cytb двух форм видового комплекса “малая белозубка”: Crocidura suaveolens (s. stricto) и C. sibirica. Гаплотипы сибирской белозубки крайне близки к таковым малой и не образуют самостоятельной гаплогруппы. Генетическое разнообразие популяций азиатской части ареала выше, чем в Восточной Европе. Для совокупных выборок из Азии и Европы выявлен достоверный рост эффективной численности. Анализ времен экспансии показал, что азиатская территория была заселена раньше (до последнего ледникового максимума), чем восточно-европейская (в конце позднего плейстоцена–начале голоцена). Результаты реконструкции предкового ареала согласуются с гипотезой происхождения малой белозубки в Средней Азии и более поздним проникновение в Центральную Азию, а затем в Восточную Европу.
Малая белозубка в широком понимании (Crocidura suaveolens sensu lato) – это крупный видовой комплекс, состав которого еще обсуждается. На огромном ареале, простирающемся через всю Евразию от Пиренейского п-ва до о. Цусима через несколько природных зон, все формы “малой белозубки”, кроме С. sibirica, имеют идентичный кариотип (Графодатский и др., 1988) и многие авторы полагают, что в пределах этой территории все популяции с 2n = 40 должны быть объединены в одном виде C. suaveolens (Catzeflis et al., 1985; Vogel et al., 1986; Hutterer, 1993). Но имеются также свидетельства морфологического (Зайцев, 1991; Темботова, 1999; Банникова и др., 2001; Jiang, Hoffmann, 2001) и высокого молекулярного (Vogel et al., 2003; Ohdachi et al., 2004; Bannikova et al., 2006; Dubey et al., 2006, 2007a, 2007b) разнообразия этой группы. В настоящее время в составе видовой группы “малая белозубка” по морфологическим данным и митохондриальной ДНК (мтДНК) различают не менее семи форм, однако точка зрения на их видовой статус варьируют у разных авторов. Обычно распознают собственно малую белозубку C. suaveolens (Pallas, 1811), сибирскую C. sibirica (Dukelsky, 1930), кавказскую длиннохвостую C. gueldenstaedtii (Pallas 1811), каспийскую C. caspica (Thomas, 1907), манчжурскую С. shantungensis (Miller 1901) и белозубку Зарудного C. zarudnyi (Ognev, 1928) (Зайцев, 1991; Зайцев и др., 2014; Bannikova et al., 2006; Burgin et al., 2018). Но некоторые авторы придают видовой статус также и C. mimula (Miller 1901) из Западной Европы (Bannikova et al., 2006) или C. aleksandrisi (Vesmanis, 1977) из Киренаики средиземноморского побережья Северной Африки (Burgin et al., 2018). По митохондриальным данным в составе видовой группы “малая белозубка” обозначаются и другие формы: образцы с Пиренейского п-ва, юга и запада Франции и юга Италии образуют кладу, включающую в себя подвиды cantabra и iculisma; самостоятельные филогруппы формируют белозубки Кипра (cypria), образцы с островов Лесбос и Вукарикисилка и Западной Турции, белозубки Центрального и юго-восточного Ирана и Ливии (Dubey et al., 2007a). Таксономический статус этих форм остается не ясным.
Малая белозубка в узком понимании (Crocidura suaveolens s.str.) (типовая территория Крым, Херсонес) имеет самый обширный ареал из всех палеарктических видов и отличается разнообразием занимаемых ландшафтов, обитая, главным образом, в интрозональных биотопах пустынной, степной и лесной зон, а также в антропогенных местообитаниях. В пустынях Средней и Центральной Азии населяет сайры и оазисы, в лесной зоне европейской части ареала особенно тяготеет к синантропии, встречаясь в разнообразных жилых постройках (Зайцев и др., 2014).
Малая белозубка демонстрирует широкую амплитуду изменчивости окраски и размеров, что объясняет выделение разными авторами нескольких форм: C. lignicolor (Miller 1900) из Синьцзян, C. ilensis (Miller 1901) из восточного Казахстана, C. lar (Allen 1928) из Монголии, и C. mordeni (Goodwin 1934) из центрального Казахстана. В ряде работ к форме suaveolens s.str. ошибочно отнесли название C. gmelini (Hoffmann, 1996; Jiang, Hoffmann, 2001).
Филогеографическая структура и демографическая история C. suaveolens s.str. плохо изучены из-за ограниченности анализируемых ранее выборок. Огромный ареал малой белозубки требует репрезентативной выборки, покрывающей всю географическую изменчивость вида. Здесь надо заметить, что генетически собственно малая белозубка четко отличается от остальных форм видового комплекса, кроме сибирской белозубки. При этом сибирская белозубка наиболее определенно из всех форм диагностируется по морфологии (Зайцев, 1991) и кариотипу (Графодатский и др., 1988), но не отличается от C. suaveolens s.str. по гаплотипам мтДНК (Bannikova et al., 2006). В отсутствие возможности простой генетической диагностики C. sibirica большую проблему составляет существование разных взглядов на ее ареал (Зайцев, 1991; Зайцев и др., 2014). В том числе, по мнению И.И. Стогова, в правобережной части Восточно-Казахстанской области встречается только сибирская белозубка, а в дельте Черного Иртыша, оба вида обитают совместно (Бекенов и др., 1985). Однако на основе морфологического определения мы не обнаружили образцов C. sibirica в нашей выборке из этого последнего локалитета (Зайсанская котловина). Стоит также отметить, что белозубки из Средней и Центральной Азии в некоторых работах были ошибочно отнесены к C. sibirica вместо C. suaveolens, без данных из terra typica последней и без учета морфологии (Jiang, Hoffmann, 2001; Ohdachi et al., 2004; Dubey et al., 2006, 2007a). В связи с проблемой генетической диагностики по мтДНК, в анализируемую выборку включены также материалы по образцам, географическое происхождение и морфологическая характеристика которых соответствуют форме C. sibirica.
В настоящей работе впервые исследована филогеографическая структура малой и сибирской белозубок на обширной географической выборке. Цель работы состояла в изучении внутривидовой генетической изменчивости, выявлении потенциальных филогеографических разрывов и установления центра генетического разнообразия и направления расселения.
МАТЕРИАЛЫ И МЕТОДЫ
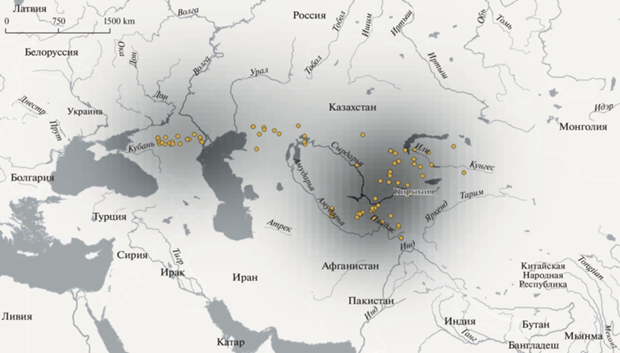
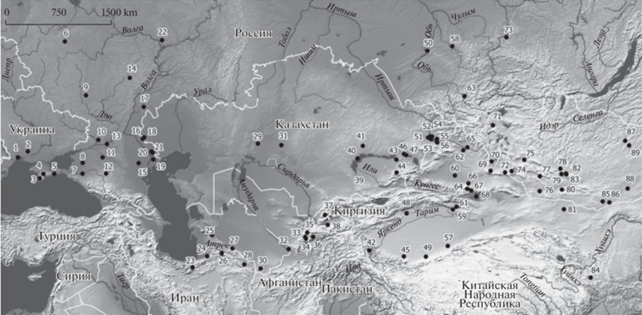
Объем материала. В анализируемую выборку вошли последовательности митохондриального гена цитохрома b (cytb) 160 особей малой белозубки и 14 особей сибирской белозубки, из которых 109 образцов C. suaveolens и 3 образца C. sibirica представляют собой новый материал, впервые представленный в данной работе. Остальные последовательности (76 сиквенсов), включая внешнюю группу, взяты из базы ГенБанка (AB077076, AB077078, AB077080, AB077083–AB077089, AB077278, AB077279, AY843462–AY843486, AY994368, AY994370, AY994377, AY994386, AY994387, AY994389, DQ630062, DQ630063, EU742583, EU742593, EU742609–EU742614, HM586991–HM586996, KX354172–KX354175, KX354177, KX354178, KX354180, KX354181, MN690930–MN690935, MN690937–MN690939), 28 из них получены нами в рамках предшествующих работ (Bannikova et al., 2006, 2011; Банникова и др., 2009; Sheftel et al., 2018), 48 – другими авторами (Vogel et al., 2003; Ohdachi et al., 2004; Dubey et al., 2006, 2007a; Chen et al., 2020). Общая выборка включает образцы из 90 локалитетов и охватывает основную часть ареала изучаемых видов (рис. 1).
Рис. 1.
Характеристика образцов, использованных в работе: локалитет/размер выборки/гаплотипы по рис. 3/номера доступа для последовательностей из ГенБанка (последовательности, полученные авторами ранее, отмечены звездочкой). 1 – Украина, Одесса/2/h1/HM586992*, HM586991; 2 – Украина, Николаев/3/h14; 3 – Крым, Севастополь/h4/AY843475; 4 – Крым/8/h8, h10, h15; 5 – Крым, Феодосия/1/h10/AY994377; 6 –Московская обл./2/h2; 7 – Краснодарский край/1/h7/AY843476; 8 – Ростовская обл., Азов/1/h7; 9 –Воронежская обл./2/h2/EU742609*, EU742610*; 10 – Ростовская обл./1/h14; 11 –Ростовская обл., Сальск/1/h10; 12 – Ставрополь/1/h5/AY843467; 13 – Ростовская обл., Цимлянск/2/h13; 14 –Пензенская обл./1/h1; 15 –Калмыкия/7/h10, h9, h13, h14; 16 –Астраханская обл., пески Шкили/2/h17, h12; 17 –Саратовская обл., с. Дьяковка/2/h16; 18 –оз. Баскунчак/1/h17/AY994386*; 19 – Астраханская обл./1/h74/AY843477; 20 – Астраханская обл./8/h11, h12, h7, h6, h10, h26, h3; 21 –Астраханская обл., Досанг/2/h10/EU742613*; 22 – респ. Татарстан, Казань/1/h14/AY843483; 23 – Иран, Мазандаран/1/h24/DQ630063; 24 – Иран, Голестан/1/h44; 25 – Туркменистан/h39/AY843466; 26 – Иран, сев. Хорасан, п. Даркаш/1/h43; 27 – Туркмениcтан, Фирюза/1/h40/AY843481; 28 – Иран, Мешхед/1/h41/DQ630062; 29 – Казахстан, Кызылординская обл./1/h18; 30 – Туркменистан, Бадхыз/1/AY843479; 31 – Казахстан, Карагандинская обл./1/h19; 32 – Туркменистан, Керки/1/h37/AY843480; 33 – Таджикистан, р. Сарытаг/h34, h36; 34 – Узбекистан, Гиссарский хр./2/h31/EU742612*; 35 – Таджикистан, Пенджикент/1/h31/AY843478; 36 – Таджикистан, оз. Искандеркуль /1/h35/AY843482; 37 – Узбекистан, Чаткальский хр./2/h29, h30/EU742611*; 38 – Таджикистан, Похтапор/1/ h33; 39 – Казахстан, Чу-Илийские горы/2/h21, h20; 40 – Казахстан, сев.-зап. Балхаш/3/h23, h22; 41 – Казахстан, сев. Балхаш/1/h28; 42 – Китай, Синцзянь, Ташкурган (Кашгария)/h45, h46/MN690939; 43 – Казахстан, Алма-Атинская обл./1/h24; 44 – Казахстан, Аксуйский р-н/1/h23; 45 – Китай, Синцзянь, Хотан (Кашгария)/1/h52/AY84347; 46 – Казахстан, Алма-Атинская обл./2/h25, h27; 47 – Казахстан, Алма-Атинская обл./1/h12; 48 – Китай, Синцзянь, Аксу (Кашгария)/1/h51/AY843463; 49 – Китай, Синцзянь, Миньфен (Кашгария)/1/h47; 50 – Новосибирск/6/h69, h68, h66, h67/AY843484–AY843486; AB077279, AB077089; 51 – Казахстан, Зайсан, Тассай/3/h17, h69; 52 – Казахстан, Зайсан, Тассай/3/h17, h59; 53 – Казахстан, Зайсан, бугор Айгыркум/3/h17; 54 – Казахстан, Зайсан, Аксуат, /2/h19; 55 – Казахстан, Зайсан, Шакельмес/1/h63; 56 – Казахстан, Зайсан, Тугыл/2/h60; 57 – Китай, Синцзянь, Черчен/3/h48, h50, h49/AY843470, AB077083, AB077084; 58 –Кемерово/1/h64/ AY994389*; 59 – Китай, Синцзянь, Корла (Джунгария)/1/h55/AB077085; 60 – Китай, Синцзянь, Мосован (Джунгария)/2/h58/h62/AB077086, AB077086; 61 – Китай, Синцзянь, Баграш (Джунгария)/1/h56/AY843469; 62 – Китай, Синцзянь, Фухай (Джунгария) /1/h59/AY843464; 63 – респ. Алтай, Телецкое оз./5/h65, h72, h73/EU742583, HM586994, HM586996, HM586995; 64 – Китай, Синцзянь, Дабаньчэн (Джунгария)/1/h63/AY843462; 65 – Китай, Синцзянь, уезд Алтай (Джунгария)/7/h21, h53, h60, h63, h59/MN690935, MN690931, MN690932, AY843462, MN690930, MN690933, MN690934; 66 – Китай, Синцзянь, Фукан (Джунгария)/1/h57/ AY843473; 67 – Китай, Синцзянь, Богдо-Ола (Джунгария)/1/h61/AY843472; 68 – Китай, Синцзянь, Турфан (Джунгария)/1/h54/AY843465; 69 – Монголия, Байтаг-Богд-Уул/1/h10; 70 – Монголия, р. Булган-гол/2/h69, h10; 71 – Монголия, оз. Шаазгай-нуур/1/h71; Монголия, Такин-Шара-нуруу/1/h63; 73 –Красноярский край/2/h69; 74 – Монголия, окр. Гун-Тамга-булаг/7/h70, h71, h63, h69; 75 – Монголия, Говь-Алтай аймак, Шарга/1/h76/AB077088; 76 – Монголия, Барун-Шаргын-Гол/4/h69, h79; 77 – Монголия, Их-Дзармаг/1/h10; 78 – Монголия, Баянхонгор а-л., р. Цаган-Гол, Ба-Цаган/2/h69; 79 – Монголия, Баянхонгор а-к, ю.скл. Баги-Богд-уул/1; 80 – Монголия, оазис Дзулганай/1/ h79; 81 – Китай, Алашань, Эдзин/1/h70/AY843474; Монголия, оз. Орог-нуур/1/h10; 83 – Монголия, Их-Богд-Уул/1/h69/AY994387*; 84 – Китай, Гансу, Лианхуашань/1/KX354181*; 85 – Монголия, Гоби, Гашуун-булаг/10/h10, h69, h70, h77, h79; 86 – Монголия, Таван-Алдын Худун/1/h69; 87 – Монголия, Баян-Овоо, Хар-Ямат/1/h70; 88 – Монголия, окр. Хатан-булаг/1/h70; 89 – Монголия, В. Хантэй, Баян Уул/1/h75.
Выделение, амплификация и секвенирование. Выделение ДНК осуществляли стандартным фенол-хлороформным методом (Sambrook et al., 1989). Для амплификации использовали наружные праймеры из предшествующих публикаций (Bannikova et al., 2006, 2011), для секвенирования − внутренние праймеры L15136 (Bannikova et al., 2006) и Cro_H481su (5'-ACAGAGAATCCTCCTCAGATTCACTCTAC-3'), специально разработанные для группы “suaveolens”. Секвенирование осуществляли на коммерческой основе с помощью набора реактивов ABIPRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе Applied Biosystems 3730 DNA Analyzer в ЗАО “Евроген”. Номера последовательностей, депонированных в ГенБанк: MW297680–MW297791.
Филогенетический и филогеографический анализ. Филогенетический анализ проводили с помощью методов максимального правдоподобия (ML) в программе IQ-TREE (Nguyen et al., 2015; Hoang et al., 2017), ближайшего соседа (NJ) и максимальной экономии (MP) в программе MEGA 10 (Kumar et al., 2018), а также Байесовым методом (BI) в BEAST v. 1.10.4 (Drummond, Rambaut, 2007). В последнем случае длина цепи составила 3 × 108 поколений; для построения ультраметрического дерева использовали разделение на две партиции по положениям в кодоне 1 + 2 и 3 и модели молекулярной эволюции для партиций HKY и GTR + G4 соответственно. В ML, NJ и MP анализах проверку надежности топологии осуществляли бутстрэп-тестом с 1000 репликаций.
При построении деревьев в качестве внешней группы были взяты последовательности C. shantungensis (AB077076, AB077078, AB077080, AB077278, EU742593), C. caspica (AY994368, AY994370) и Crocidura aff. suaveolens (KX354172–KX354175, KX354177, KX354178, KX354180) из ГенБанка. Помимо внешней группы итоговое выравнивание включило 174 последовательности в анализах ML, MP и NJ, и 146 последовательностей в анализе BI.
Медианную сеть гаплотипов строили в программе NETWORK 5.0 (Bandelt et al., 1999) и редактировали средствами стандартного пакета Paint в Microsoft Windows 10. Генетические дистанции между выборками (p- и K2P дистанции) рассчитывали в программе MEGA 10. Анализ p-дистанций между крупными географическими выборками был проведен с целью определения их генетической близости и определения числа групп в последующих анализах генетического разнообразия и демографических показателей.
Показатели генетического разнообразия (нуклеотидное и гаплотипическое разнообразие), параметры распределения попарных дистанций (mismatch distribution), время экспансии (τ), значения Fst между выборками, тесты на нейтральность (Tajima, 1989) и (Fu, 1996) рассчитывали в программе Arlequin 3.5.2.2 (Excoffier et al., 2005) для выборок с n ≥ 10. Для описания общего характера демографической истории использовали метод Bayesian Skyline Plot (BSP) (Drummond et al., 2005), позволяющий оценить изменение эффективной численности во времени. Демографический анализ производили в BEAST v. 1.10.4. Использовали модель строгих часов и модель Bayesian Skyline с 10 группами для формы дерева. Возможность применения более простой демографической модели – модели экспоненциального роста исключили, используя метод Marginal Likelihood Estimator.
Оценка скорости эволюции cytb. Оценка возраста недавних событий дивергенции (<1–2 млн лет) содержит серьезную проблему, которая заключается в потенциальной возможности искажения времен дивергенции вследствие изменения видимой скорости замен с течением времени (rate decay) (Ho et al., 2005). Вследствие этого филогенетические скорости, полученные для оценки межвидовых событий дивергенции, могут быть неприменимы к датированию внутривидовых (популяционных) событий.
Для определения времени экспансии использовали скорость дивергенции по всем позициям cytb равную 16% за млн лет, которая была получена следующим образом. Во-первых, было принято допущение, что изменение скорости замен со временем по трансверсиям 3-его положения кодона (tv3) cytb незначительно и tv3 происходят со скоростью близкой к филогенетической. Эта скорость (substitution rate) была получена для Crocidura ранее (Лавренченко и др., 2009) и составляет 1.87% за млн лет. Во-вторых, исходя из соотношения разных типов замен в cytb в каждом из видов группы C. suaveolens s.lato, было оценено, что скорость tv3 составляет 23.4% от скорости всех замен по всем позициям. Из этого следует, что скорость (substitution rate) всех замен в cytb видов группы C. suaveolens s.lato, пригодная для оценки недавних времен (<100 тыс. лет назад), равна 8%, скорость дивергенции гаплотипов (divergence rate), следовательно, – 16%.
Реконструкция центра происхождения. Для реконструкции возможного центра происхождения предкового митотипа был использован принцип максимальной экономии (парсимонии), как было предложено в аналогичной работе по обыкновенной бурозубке (Raspopova et al., 2020). Цель анализа – используя связь между географическим распространением митотипов и их филогенетическими отношениями, определить такое географическое положение предкового митотипа, при котором сценарий распространения митохондриальных линий по ареалу будет максимально экономным. Для решения задачи использовался парсимониальный алгоритм, адаптированный для координатных данных (landmark data) и реализованный в программе TNT версии v. 1.5 Sept. 2020 (Catalano et al. 2010; Goloboff, Catalano 2016). Поскольку географические координаты не могут использоваться напрямую для описания положения точек в двумерном пространстве, их предварительно преобразовывали в условные декартовы координаты, используя линейное многомерное шкалирование матрицы дистанций между точками сбора проб с помощью cmdscale в R. Допустимое распространение предковых митотипов было ограничено набором точек сбора материала и узлами координатной сетки 12 × 12, покрывающей современный ареал. Кроме того, необходимо было учесть неопределенность филогенетических отношений между гаплотипическими линиями. Для этого анализ повторяли 100 раз используя выборку деревьев, полученную в результате анализа в BEAST (BSP), затем анализировали распределение в пространстве реконструированных для предкового узла локалитетов.
Для перевода полученных декартовых координат в широту/долготу использовали оригинальный скрипт, доступный от одного из авторов (И. Артюшин). Плотность распределения реконструировали с помощью ядерной оценки плотности (kde – kernel density estimation), используя распределение фон Мизеса–Фишера с параметром kappa = 200 в качестве ядра. Расчеты проводили в среде R v3.6.1 с использованием функций nls{stats}, distGeo{geosphere} и пакета raster для визуализации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Филогенетический и филогеографический анализ. Ни один из проведенных филогенетических анализов (BI, ML, MP, NJ) не позволил получить разрешенного дерева гаплотипов, однако несколько потенциальных группировок можно вычленить. На рис. 2 приведено Байесово дерево, реконструированное в программе Beast, которое является также хронограммой основных эволюционных событий в изучаемой группе. Медианная сеть (рис. 3) включает 79 гаплотипов, из них 71 найдено у малой белозубки, 7 – у сибирской белозубки и один гаплотип для них общий. Сеть имеет звездообразную структуру, в которой, тем не менее, можно обнаружить те же, что на дереве, группировки гаплотипов.
Рис. 2.
Филогенетическое дерево Crocidura suaveolens s.str. и C. sibirica по результатам Байесова анализа 1140 п.н. 146 последовательностей и хронограмма основных событий дивергенции. Слева от узлов дерева указаны значимые апостериорные вероятности (>0.7) в BI и бутстрэп-поддержки (>50%) в ML анализах. Справа от узлов приведены времена важных событий дивергенции. Внешняя группа не показана.
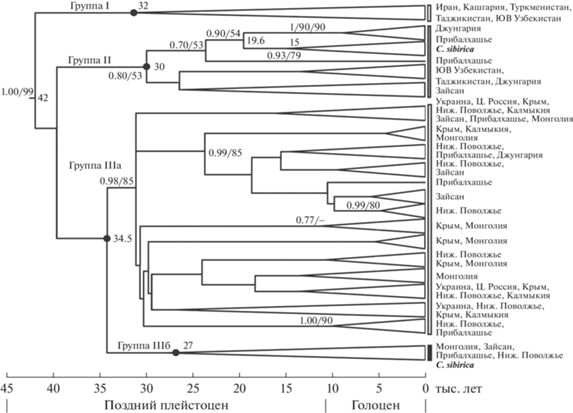
Рис. 3.
Медианная сеть гаплотипов cytb малой белозубки, включающая 160 последовательностей длиной 998 п.н. Размеры кружков соответствуют числу особей с данным гаплотипом, число замен между гаплотипами обозначено поперечными штрихами на соединяющих гаплотипы линиях, группы гаплотипов пронумерованы римскими цифрами.

Группировка I наиболее гетерогенна, в ней отсутствует центральный, наиболее распространенный гаплотип, а гаплотипы отличаются между собой большим числом замен. Эту группу составляют гаплотипы из Средней Азии, Ирана, Кашгарии. В группу II входит основная часть гаплотипов из Сибири, гаплотипы из Прибалхашья, Зайсанской котловины, Джунгарии, а также три единичных гаплотипа из Средней Азии. Гаплотипы сибирской белозубки своеобразны и формируют единую гаплогруппу внутри группы II. Группа Ш включает два широкоареальных гаплотипа (h10, h69) и гаплотипы, производные от них, и может быть подразделена на две подгруппы: IIIа и IIIб. Подгруппа IIIа образована преимущественно гаплотипами восточной Европы и включает также часть гаплотипов Монголии, Джунгарии, Зайсанской котловины и Прибалхашья. Подгруппа IIIб содержит большую часть гаплотипов Монголии и Джунгарии, зайсанские и прибалхашские гаплотипы, один гаплотип из Астрахани, а также часть сибирских гаплотипов, причем образцы C. sibirica из Красноярска и один образец из Новосибирска несут гаплотип h69, широко распространенный среди образцов из других локалитетов, в том числе, Гоби.
В целом, образцы из Средней Азии наиболее разобщены между собой и удалены от образцов других географических регионов. Гаплотипы, общие с самой северной и самой южной частью ареала обнаруживаются только в Прибалхашье и Зайсанской котловине. В выборке из Восточной Европы общие с азиатскими гаплотипы (в первую очередь из Прибалхашья) обнаруживаются к востоку от левобережья Волги и отсутствуют на правобережье и далее в западной части ареала.
Как видно из приведенных данных, гаплотипы из ареала C. sibirica очень близки к таковым C. suaveolens s.str., не образуют единой монофилетической группы, и малая белозубка оказывается по мтДНК парафилетической относительно сибирской. На этом основании мы далее анализируем и обсуждаем выборку образцов двух видов (C. suaveolens/C. sibirica) как единое целое.
Времена основных событий дивергенции. На рис. 2 показаны времена основных событий дивергенции в группе C. suaveolens/C. sibirica. С учетом принятой скорости дивергенции ~16% за млн лет, последний общий предок всех линий C. suaveolens s.str./C. sibirica существовал 42 тыс. лет назад. Линия C. sibirica, которая обнаруживается внутри группировки II, обособилась 19.6 тыс. лет назад, а ее радиация произошла 15 тыс. лет назад.
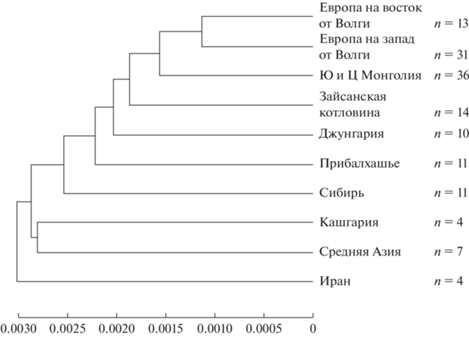
Генетическое разнообразие географических популяций. Исходя из географических и генетических дистанций (p-дистанции 0.22–0.72%) между образцами из локальных популяций были скомпанованы 10 основных выборок (n ≥ 4) (рис. 4), 7 из которых (n ≥ 10) включены в анализ генетического разнообразия и демографии: C. suaveolens – (1) Европа 1: к западу от правобережья Волги, (2) Европа 2: от левобережья Волги до Урала, (3) Прибалхашье, (4) Зайсанская котловина, (5) Южная и Центральная Монголия (Гоби), (6) Джунгария, (7) C. sibirica – Алтай, Красноярск, Кемерово, Новосибирск (Сибирь). Для анализа суммарной выборки по Азии использовали все имеющиеся данные (n = 97). Моделирование изменения эффективной численности во времени было произведено только для выборок размером более 25 экз.
Рис. 4.
UPGMA-дендрограмма средних попарных p-дистанций между основными выборками. По шкале отложены p‑дистанции, количество образцов в выборках указано рядом с соответствующей ветвью дендрограммы.
В табл. 1 и 2 приведены показатели молекулярного разнообразия и демографические параметры для выборок размером не менее 10 экз. Статистические показатели разнообразия cytb в географических выборках из общей восточно-европейской и нескольких азиатских популяций выявили низкое гаплотипическое и нуклеотидное разнообразие популяции Восточной Европы по сравнению с отдельными азиатскими популяциями и азиатской выборкой в целом (табл. 1). Среди крупных выборок наибольшее гаплотипическое разнообразие отличает популяцию Зайсанской котловины, наибольшее нуклеотидное разнообразие обнаружено в Прибалхашье. Высокие показатели h и π в Сибири объясняются существованием в составе C. sibirica двух симпатричных гаплогрупп (p-дистанция 0.76%); внутри этих группировок разнообразие низкое. Несмотря на маленький размер выборок из Средней Азии (n = 7) и Кашгарии (n = 4), отметим, что гаплотипное и нуклеотидное разнообразие в них очень высокое (π = 0.0046 ± 0.0029 в Средней Азии и π = 0.0050 ± 0.0036 в Кашгарии) при h = 1 в обоих случаях.
Таблица 1.
Показатели разнообразия cytb в географических популяциях белозубок и результаты тестов на нейтральность: размер выборки (n), гаплотипическое разнообразие (h), нуклеотидное разнообразие (π), Tajima’s D, Fu’s Fs и p-values. Достоверные показатели нейтральности выделены полужирным шрифтом
| Выборки | N | H | π | Tajima’s D | Tajima’s D p-value | Fu’s Fs | Fu’s Fs p-value |
|---|---|---|---|---|---|---|---|
| Сибирь | 11 | 0.9455 ± 0.0535 | 0.0045 ± 0.0026 | 0.6434 | 0.7730 | –0.3012 | 0.4130 |
| Джунгария | 10 | 0.9333 ± 0.0773 | 0.0041 ± 0.0025 | –0.2817 | 0.4190 | –2.1931 | 0.0840 |
| Ю. и Ц. Монголия (Гоби) | 35 | 0.9647 ± 0.0201 | 0.0026 ± 0.0015 | –1.2325 | 0.1120 | –1.9485 | 0.1660 |
| Зайсан | 14 | 0.9890 ± 0.0314 | 0.0038 ± 0.0022 | 0.1945 | 0.6280 | 1.0705 | 0.7300 |
| Балхаш | 11 | 0.9455 ± 0.0659 | 0.0052 ± 0.0030 | –1.2674 | 0.1090 | –2.2619 | 0.1040 |
| В. Казахстан (Балхаш + Зайсан) | 25 | 0.9867 ± 0.0167 | 0.0045 ± 0.0025 | –1.3985 | 0.0720 | –4.3467 | 0.0390 |
| вся Азия | 97 | 0.9888 ± 0.0052 | 0.0043 ± 0.0024 | –2.1728 | 0.0010 | –25.500 | 0.0000 |
| Европа 1: от Волги до Урала | 15 | 0.9524 ± 0.0344 | 0.0024 ± 0.0015 | –1.06072 | 0.1440 | –3.242 | 0.0300 |
| Европа 2: к западу от Волги | 31 | 0.9075 ± 0.0419 | 0.0017 ± 0.0011 | –1.4555 | 0.0610 | –5.4720 | 0.0030 |
| вся Европа | 46 | 0.9362 ± 0.0271 | 0.0020 ± 0.0012 | –1.9196 | 0.0070 | –12.233 | 0.0000 |
Таблица 2.
Оценка демографических параметров малой белозубки на основе модели внезапной экспансии: tau и относительное tau – время в заменах на ген и на сайт соответственно; SSD – сумма квадратов отклонений (sum of squared deviations) от модели, Rg – индекс неравномерности (raggedness index) распределения попарных рзличий в выборке
| Выборки | n | tau and 90% CI |
Relative tau (substitutions per site) | SSD | SSD p-value | Rg | Rg p-value |
|---|---|---|---|---|---|---|---|
| Сибирь | 11 | 10.736 (4.645−99.736) | 0.009 (0.004−0.088) | 0.0285 | 0.5940 | 0.0499 | 0.8060 |
| Джунгария | 10 | 4.141 (2.469−10.053) | 0.004 (0.002−0.0090) | 0.2390 | 0.1370 | 0.1630 | 0.2390 |
| Ю. и Ц. Монголия (Гоби) | 35 | 3.473 (1.889−5.563) | 0.003 (0.002−0.005) | 0.0016 | 0.8520 | 0.0147 | 0.9250 |
| Зайсан | 14 | 6.022 (2.986−9.793) | 0.005 (0.003−0.009) | 0.0062 | 0.9150 | 0.0167 | 0.9720 |
| Балхаш | 11 | 4.000 (2.910−11.811) | 0.004 (0.003−0.010) | 0.0171 | 0.2700 | 0.0433 | 0.5180 |
| В Казахстан (Балхаш + Зайсан) | 25 | 6.107 (3.332−8.994) | 0.005 (0.003−0.008) | 0.0021 | 0.9200 | 0.0095 | 0.9660 |
| Вся Азия | 97 | 3.758 (2.521−10.352) | 0.003 (0.002−0.009) | 0.0013 | 0.7330 | 0.0060 | 0.9230 |
| Европа 1: от Волги до Урала | 15 | 2.041 (1.764−5.494) | 0.002 (0.002−0.005) | 0.0052 | 0.6740 | 0.0373 | 0.7540 |
| Европа 2: к западу от Волги | 31 | 2.027 (1.041−3.137) | 0.002 (0.001−0.003) | 0.0031 | 0.5360 | 0.0453 | 0.5730 |
| Вся Европа | 46 | 1.937 (1.320−3.586) | 0.002 (0.001−0.003) | 0.0009 | 0.4470 | 0.0364 | 0.2760 |
Демографический анализ.Тесты на нейтральность Таджимы и Фу имеют достоверно отрицательное значение только в случае европейской популяции, что указывает на ее недавнюю экспансию. В случае совокупной выборки по всей Азии также отмечается достоверный рост, однако для отдельных географических популяций рост не достоверен (табл. 1). Показатели Rg и SSD не противоречат модели внезапной экспансии ни для одной из выборок (табл. 2).
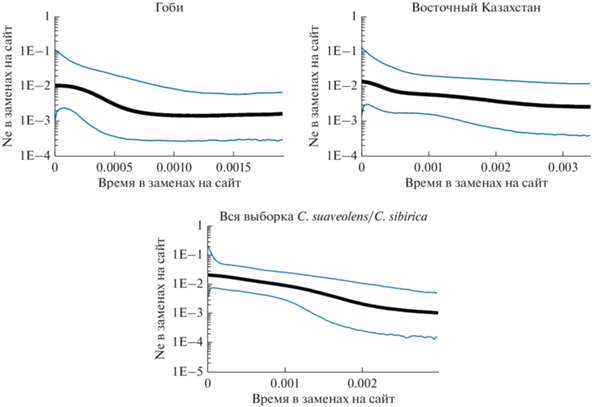
Моделирование изменения эффективной численности во времени (BSP) для группы C. suaveolens s.str./C. sibirica в целом показало на слабый рост, точное время которого по полученной картине установить сложно (рис. 5). Результаты анализа BSP для выборок Гоби и Восточного Казахстана указывают на относительно недавний рост для популяции Гоби и заметно более плавный и существенно более ранний рост в Восточном Казахстане. Получить результаты анализа BSP для выборки из Европы не удалось из-за слишком низкой нуклеотидной и гаплотипической изменчивости. Однако двукратное отличие tau (время в нуклеотидных заменах, табл. 2) в выборках из Центральной Азии и Казахстана по сравнению с Восточной Европой косвенным образом указывает на их больший возраст. Если пересчитать показатель tau в абсолютное время при скорости дивергенции cytb 16% за млн. лет для двух выборок с достоверным ростом (вся Азия и вся Европа, табл. 2), можно получить примерное время расселения. На азиатской территории экспансия была более ранней, ~24 тыс. лет назад, восточно-европейская часть ареала была заселена не более 12 тыс. лет назад, что соответствует концу позднего плейстоцена, началу голоцена.
Рис. 5.
Реконструкция общего характера демографической истории методом BSP для популяций малой белозубки из Гоби Монголии (слева), Восточного Казахстана (справа) и общей выборке по С. suaveolens.
В анализе Mismatch distribution распределение попарных дистанций в суммарной выборке из Восточной Европы и в крупных популяциях из Центральной Азии довольно сходно (рис. 6). Вместе с тем, форма распределения безусловно унимодальна в первом случае (т.е. в Европе не отклоняeтся от ожидаемого, исходя из модели внезапной экспансии), в то время как в крупных азиатских выборках (южная/центральная Монголия, Восточный Казахстан, Азия в целом) наблюдаемое распределение визуально начинает отклоняться от ожидаемого. Наименее гладкую форму распределения имеют выборки из Прибалхашья и Зайсана, хотя их индексы Rg этого не показывают. Деление европейской выборки на подвыборки с левого и правого берега Волги с целью сравнительного анализа сопоставимых по размеру и компактности популяций из Восточной Европы и Центральной Азии не изменило результата.
Рис. 6.
Графики распределения попарных генетических дистанций Mismatch distribution в основных выборках малой белозубки. Сплошная линия – фактическое распределение, короткий штрих – распределение согласно модели внезапной экспансии. По оси абсцисс указана дистанция в числе замен, по оси ординат – частота данной дистанции.
Анцестральный ареал. Реконструкция центра происхождения (рис. 7) показала, что, последний общий предок современных митохондриальных линий малой белозубки мог быть распространен в Средней Азии (кроме юго-запада), а также на территории Казахстана и далее на запад до северного Прикаспия. Наиболее высокая плотность распределения возможных точек происхождения обнаруживается в области от Семиречья до западного Гиссаро-Алая. Область возможного распространения предкового митотипа не включает Монголию, северный Китай, Алтай, Иран, Туркменистан и Причерноморье.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хронограмма и структура группировки I на филогенетической сети (возможно, первое ветвление дерева; отсутствие центрального гаплотипа, общего для большинства образцов, значительное число замен между гаплотипами,) позволяют предположить, что эта группировка, содержащая преимущественно среднеазиатские, иранские и кашгарские гаплотипы, древнее, чем группировки II и Ш, т.е. расселение белозубок на южной части ареала представляет собой более раннее событие по сравнению с колонизацией запада и северо-востока современного ареала. Заселение европейской части ареала произошло в наиболее недавнее время. Об этом говорят самое низкое гаплотипическое и нуклеотидное разнообразие выборки из Восточной Европы, образцы из которой встречаются в единственной группе III, имеющей простую звездообразную структуру с центральным, наиболее распространенным гаплотипом. Наоборот, гаплотипы из восточного Казахстана встречаются во всех группировках гаплотипов и нуклеотидное разнообразие восточно-казахстанских популяций – одно из самых высоких, что указывает на ее потенциальную древность. Результаты поиска предковых локалитетов вида также согласуются с гипотезой средне-азиатского и/или казахстанского происхождения малой белозубки, указывают на недавнее происхождение центрально-азиатских (Монголия, Китай) популяций и еще более позднее заселение европейской части ареала в результате быстрой экспансии с территории Казахстана.
Итак, наши данные показывают, что малая белозубка очень быстро и относительно недавно колонизировала свой ареал. Видимо, вследствие этого на огромной и экологически разнообразной территории филогеографические разрывы не успели сформироваться, а разнообразие вариантов окраски и размеров отражает только морфологическую адаптацию к аридным или гумидным ландшафтам и не имеет под собой исходной генетической основы.
По характеру ареала и ландшафтно-биотопической приуроченности малая белозубка сходна с некоторыми другими палеарктическими видами мелких млекопитающих. Серый хомячок, Cricetulus migratorius (Pallas 1773), населяет степи, лесостепи, пустыни и полупустыни от Греции до юго-восточной Монголии включительно и от Центральной России до Белуджистана (Лебедев, 2012). Его ареал, таким образом, практически полностью включает в себя ареал малой белозубки, хотя он не заходит так далеко на север и не встречается в лесной зоне. Серый хомячок экологически пластичен и, подобно малой белозубке, в аридной зоне заселяет оазисы. У этого вида обнаружено три аллопатрических митохондриальных линии (Lebedev et al., 2018) при филогеографическом разрыве по Волге между двумя широко ареальными формами (2.5% различий). Малая белозубка в отличие от хомячка, вероятно, лишь недавно освоила территории к западу от Волги. К востоку от Волги и до Монголии обитает восточная линия серого хомячка, филогеографическая структура которой напоминает таковую у малой белозубки своим звездообразным характером и низким нуклеотидным разнообразием. Как и малая белозубка, серый хомячок относительно поздно заселил Центральную Азию (Монголия) из Средней Азии и/или Казахстана, время его экспансии на восточной части ареала практически совпадает с таковым у малой белозубки и оценивается в 25 тыс. лет назад (Lebedev et al., 2018).
Общие черты в характере современного ареала и направления расселения можно обнаружить у Crocidura suaveolens s.lato с видовым комплексом домовой мыши (Mus musculus s.lato). В частности, ареал формы “musculus” практически совпадает с ареалом C. suaveolens s. str., кроме самой южной (Иран) и западной (центральная Европа) частей, и есть некоторое сходство в филогеографической структуре (Bonhomme, Searle, 2012). Так же как и в случае малой белозубки, Средняя Азия домовой мышью была заселена раньше, чем Китай, Монголия и Европа: известные из литературы датировки указывают на экспансию, близкую к плейстоцен-голоценовой границе (Suzuki et al., 2013; Hardouin et al., 2015; Li et al., 2020).
Ситуация с сибирской белозубкой пока остаётся не ясной. C. sibirica включает две митохондриальные линии, которые, не привязаны к определенным географическим локалитетам, не составляют монофилетической группы, т.е. (как и в прежних исследованиях) не являются видоспецифичными. Одна из этих линий (из общей группировки II) распространена преимущественно в западной части ареала (Новосибирск, Кемерово), вторая (линия из общей группировки IIIб) – преимущественно в юго-восточной части (Красноярск, Телецкое оз.).
Западная сибирская линия, по сравнению с юго-восточной, содержит больше гаплотипов, причем среди них нет общих с таковыми из ареала малой белозубки. Обособление этой линии произошло ~ 20 тыс. лет назад. Если принять эту датировку за время разделения гаплотипов собственно C. sibirica и C. suaveolens s.str., то вряд ли можно допустить видовой статус сибирской формы в связи с очень недавним временем ее обособления. Отсутствие географической структуры митохондриальной изменчивости также говорит о недавнем формировании современного ареала. В таком случае, сибирская белозубка является лишь морфотипом малой белозубки, изолированной, например, на Алтае в каком-то граничащем с лесом степном рефугиуме во время последнего ледникового максимума. Фиксация в такой популяции морфологических отличий, в том числе связанных с адаптаций к обитанию в лесной среде, может не сопровождаться общей дивергенцией и репродуктивной изоляцией от сестринской формы. Существование второй (более молодой и похожей на гаплотипы из Монголии) линии может объясняться гибридизацией с малой белозубкой во время вторичного контакта. Исходя из широкого ареала C. suaveolens s.str. и небольшого ареала C. sibirica, находящегося к тому же на самой северной оконечности ареала малой белозубки, логично предположить, что интрогрессия мтДНК происходила в направлении от малой белозубки к сибирской.
Другая гипотеза состоит в том, что C. sibirica – это настоящий вид, “родной” мтДНК которого в настоящее время мы не находим, поскольку она была полностью замещена мтДНК малой белозубки вследствие гибридизации в период активной колонизации современного ареала. Существование двух митохондриальных линий в этом случае может объясняться двумя событиями гибридизации с исходной формой (малая белозубка) в течение разновременных вторичных контактов. Природа противоречий генетической и морфологической изменчивости сибирской белозубки ожидает решения с помощью большого числа ядерных локусов.
Финансирование. Работа выполнена при финансовой поддержке гранта РФФИ (20-04-00081а).
Благодарности. Авторы благодарят Ю.Н. Литвинова, Ф.М. Голенищева, В.Г. Маликова, М.В. Касаткина, Ю.М. Ковальскую, А.В. Сурова и других коллег, принявших участие в сборе материала для генетического анализа.
Список литературы
Банникова А.А., Олейниченко В.Ю., Ломов А.А., Долгов В.А. О таксономическом взаимоотношении малой и длиннохвостой белозубок, Crocidura suaveolens и C. guldenstaedtii (Insectivora, Soricidae) // Зоологический журн. 2001. Т. 80. № 6. С. 721–730.
Банникова А.А., Шефтель Б.И., Лебедев В.С., Александров Д.Ю., Мюлленберг М. Crocidura shantungensis – новый вид в фауне Монголии и Бурятии // Докл. Акад. Наук. 2009. Т. 424. № 6. С. 836–839.
Бекенов А., Бутовский П.М., Касабеков Б.В., Ланкин П.М., Стрелков П. П., Стогов И.И., Федосенко А.К., Шаймарданов Р.Т., Шубин И.Г. Млекопитающие Казахстана. т. 4. Насекомоядные и рукокрылые / Под ред. Гвоздева Е.Б. и Страутмана Е.И. Казахская ССР, Алма-Ата: Наука, 1985. 280 с.
Графодатский А.С. Раджабли С.И., Шаршов А.В., Зайцев М.В. Кариотипы пяти видов землероек-белозубок фауны СССР // Цитология. 1988. Т. 30. № 10. С. 1247–1250.
Зайцев М.В. Видовой состав и вопросы систематики землероек-белозубок (Mammalia, Insectivora) фауны СССР // Труды Зоологического института Академии наук СССР. 1991. Т. 243. С. 3–46.
Зайцев М.В., Войта Л.Л., Шефтель Б.И. Млекопитающие фауны России и сопредельных территорий. Насекомоядные. // Определители по фауне России. Вып. 178. СПб.: Зоологический институт РАН. 2014. 377 с.
Лавренченко Л.А., Банникова А.А., Лебедев В.С. Эндемичные землеройки-белозубки (Crocidura) Эфиопии: недавняя адаптивная радиация древней группы // Доклады Академии наук. 2009. Т. 424. № 5. С. 705–708.
Лебедев В.С. Семейство Cricetidae // Млекопитающие России: систематико-географический справочник. Cборник Трудов Зоологического Музея МГУ. Ред. Павлинов И.Я., Лисовский А.А. 2012. Т. 52. С. 211–220.
Темботова Ф.А. Закономерности изменчивости и эволюции насекомоядных млекопитающих Кавказа. Дис. … док. био. наук. Нальчик: КБНЦ РАН, 1999. 315 с.
Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48.
Bannikova A.A., Lebedev V.S., Kramerov D.A., Zaitsev M.V. Phylogeny and systematics of the Crocidura suaveolens species group: corroboration and controversy between nuclear and mitochondrial DNA markers // Mammalia. 2006. V. 70. № 1–2. P. 106–119.
Bannikova A.A., Abramov A.V., Borisenko, A.V., Lebedev V.S., Rozhnov V.V. Mitochondrial diversity of the white-toothed shrews (Mammalia, Eulipotyphla, Crocidura) in Vietnam // Zootaxa. 2011. T. 2812. № 1. C. 1–20.
Bonhomme F., Searle J.B. House mouse phylogeography // Evolution of the house mouse (Cambridge series in morphology and molecules) / Eds. Machola’n M., Baird S.J.E., Munclinger P., Pia’lek J. UK, Cambridge: Cambridge University Press. 2012. P. 278–296.
Burgin C., He K., Haslauer R., Sheftel B.I., Jenkins P.D., Ruedi M., Hintsche S., Motokawa M., Hinckley A., Hutterer R. Species accounts of Soricidae // Handbook of the mammals of the world. Vol. 8. Insectivores, sloths and colugos / Eds. Wilson, D.E., Mittermeier R.A. Spain, Barcelona: Lynx Edicions. 2018. P. 332–551.
Catalano S.A., Goloboff P.A., Giannini N.P. Phylogenetic morphometrics (I): the use of landmark data in a phylogenetic framework // Cladistics. 2010. V. 26. P. 539–549.
Catzeflis F., Maddalena T., Hellwing S., Vogel P. Unexpected findings on the taxonomic status of East Mediterranean Crocidura russula auct. (Mammalia, Insectivora) // Zeitschrift für Säugetierkunde. 1985. V. 50. № 4. P. 185–201.
Chen S., Qing J., Liu Z., Liu Y., Tang M., Murphy R.W., Pu Y., Wang X., Tang K., Guo K., Jiang X. Multilocus phylogeny and cryptic diversity of white-toothed shrews (Mammalia, Eulipotyphla, Crocidura) in China // BMC evolutionary biology. 2020. V. 20. № 1. P. 1–4.
Drummond A.J., Rambaut A. BEAST: Bayesian evolutionary analysis by sampling trees // BMC Evol. Biol. 2007. V. 7. P. 214.
Drummond A.J., Rambaut A., Shapiro B., Pybus O.G. Bayesian coalescent inference of past population dynamics from molecular sequences // Molecular Biology and Evolution. 2005. V. 5. P. 1185–1192.
Dubey S., Cosson J.-F., Magnanou E., Vohralik V., Benda P., Frynta D., Hutterer R., Vogel V., Vogel P. Mediterranean populations of the lesser white-toothed shrew (Crocidura suaveolens group): an unexpected puzzle of Pleistocene survivors and prehistoric introductions // Mol. Ecology. 2007a. V. 16. № 16. P. 3438–3452.
Dubey S., Nová P., Vogel P., Vohralík V. Cytogenetic and molecular relationships between Zarudny’s rock shrew (Crocidura zarudnyi; Mammalia: Soricomorpha) and Eurasian taxa // J. Mammalogy. 2007b. V. 88. № 3. P. 706–711.
Dubey S., Zaitsev M., Cosson J.-F., Abdukadier A., Vogel P. Pliocene and Pleistocene diversification and multiple refugia in a Eurasian shrew (Crocidura suaveolens group) // Mol. Phylogen. Evolution. 2006. V. 38. № 3. P. 635–647.
Excoffier L., Laval G., Schneider S. Arlequin (version 3.0): an integrated software package for population genetics data analysis // Evolutionary bioinformatics. 2005. V. 1. P. 47–50.
Fu Y. New statistical tests of neutrality for DNA samples from a population // Genetics. 1996. V. 143. № 1. P. 557–570.
Goloboff P.A, Catalano S.A. TNT version 1.5, including a full implementation of phylogenetic morphometrics // Cladistics. 2016. V. 32. № 3. P. 221–238.
Hardouin E.A., Orth A., Teschke M., Darvish J., Tautz D., Bonhomme F. Eurasian house mouse (Mus musculus L.) differentiation at microsatellite loci identifies the Iranian plateau as a phylogeographic hotspot // BMC Evolutionary Biology. 2015. V. 15. № 26.
Ho S.Y.W., Phillips M.J., Cooper A., Drummond A.J. Time dependency of molecular rate estimates and systematic overestimation of recent divergence times // Mol. Biol. Evol. 2005. V. 22. P. 1561–1568.
Hoang D.T., Chernomor O., von Haeseler A., Minh B.Q., Vinh L.S. UFBoot2: Improving the ultrafast bootstrap approximation // Mol. Biol. Evol. 2017. V. 35. № 2. P. 518–522.
Hoffmann R.S. Noteworthy shrews and voles from the Xizang-Qinghai Plateau // Contribution in Mammalogy: A Memorial Volume Honoring Dr. J. Knox Jones, Jr. 1996. P. 155–168.
Hutterer R. Order Insectivora // Mammal species of the world: A taxonomic and geographic reference / Eds. Wilson D.E., Reeder D.M. Washington, DC: Smithsonian Institution Press. 1993. P. 69–130.
Jiang X., Hoffmann R.S. A revision of the white-toothed shrews (Crocidura) of southern China // J. Mammalogy. 2001. V. 82. № 4. P. 1059–1079.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: molecular evolutionary genetics analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. № 6. P. 1547–1549.
Li Y., Fujiwara K., Osada N., Kawai Y., Takada T., Kryukov A.P., Abe K., Yonekawa H., Shiroishi T., Moriwa K., Saitou N. House mouse Mus musculus dispersal in East Eurasia inferred from 98 newly determined complete mitochondrial genome sequences // Heredity. 2020. P. 1–16.
Lebedev V., Poplavskaya N., Bannikova A., Ryurikov G., Surov A. Genetic differentiation in Cricetulus migratorius Pallas, 1773 (Rodentia, Cricetidae) // Mammalian Biology. 2018. V. 92. № 1. P. 115–119.
Nguyen L.T., Schmidt H.A., von Haeseler A., Minh B.Q. IQ-TREE: A fast and effective stochastic algorithm for estimating maximum likelihood phylogenies // Mol. Biol. Evol. 2015. V. 32. № 1. P. 268–274.
Ohdachi S.D., Iwasa M.A., Nesterenko V.A., Abe H., Masuda R., Haberl W. Molecular phylogenetics of Crocidura shrews (Insectivora) in east and central Asia // J. Mammalogy. 2004. V. 85. № 3. P. 396–403.
Raspopova A.A., Bannikova A.A., Sheftel B.I., Kryštufek B., Kouptsov A.V., Illarionova N.A., Pavlova S.V., Lebedev V.S. A never-ending story of the common shrew: searching for the origin // Mammal Research. 2020. V. 65. P. 729–742.
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. N.Y.: Cold Spring Harbor Laboratory Press. 1989. 1546 p.
Sheftel B.I., Bannikova A.A., Fang Y., Demidova T.B., Alexandrov D.Y., Lebedev V.S., Sun Y.H. Notes on the fauna, systematics, and ecology of small mammals in Southern Gansu, China // Biology Bulletin. 2018. V. 45. № 8. P. 898–912.
Suzuki H., Nunome M., Kinoshita G., Aplin K.P., Vogel P., Kryukov A.P., Jin M.-L., Han S.-H., Maryanto I., Tsuchiya K., Ikeda H., Shiroishi T., Yonekawa H., Moriwaki K. Evolutionary and dispersal history of Eurasian house mice Mus musculus clarified by more extensive geographic sampling of mitochondrial DNA // Heredity. 2013. V. 111. P. 375–390.
Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism // Genetics. 1989. V. 123. № 3. P. 585–595.
Vogel P., Cosson J.F., Jurado L.F.L. Taxonomic status and origin of the shrews (Soricidae) from the Canary Islands inferred from a mtDNA comparison with the European Crocidura species // Mol. Phylogenetics Evol. 2003. V. 27. № 2. P. 271–282.
Vogel P., Maddalena T., Catzeflis F. A contribution to the taxonomy and ecology of shrews (Crocidura zimmermanni and C. suaveolens) from Crete and Turkey // Acta Theriologica. 1986. V. 31. № 39. P. 537–545.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая