Известия РАН. Серия биологическая, 2022, № 3, стр. 312-321
Структура сообществ паразитов окуня (Perca fluviatilis L.) В начальный период формирования Богучанского водохранилища
Ю. К. Чугунова 2, *, Е. П. Иешко 1, **
1 Красноярский филиал ФГБНУ “ВНИИ рыбного хозяйства и океанографии”
660097 Красноярск, ул. Парижской Коммуны, 33, Россия
2 Институт биологии Карельского научного центра РАН
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: jhermann@mail.ru
** E-mail: ieshkoep@gmail.com
Поступила в редакцию 03.09.2020
После доработки 11.11.2020
Принята к публикации 11.11.2020
- EDN: USJYPZ
- DOI: 10.31857/S1026347022030064
Аннотация
Впервые исследованы эколого-популяционные изменения видового богатства и разнообразия паразитических сообществ окуня Perca fluviatilis (L. 1758) в процессе трансформации биоты Богучанского водохранилища. Исходный состав паразитов (2012 г.) отличался высоким разнообразием, преобладали метацеркарии трематод. В 2014 г. происходит резкое обеднение видового состава паразитов, указывая на практическое отсутствие роли бентоса в этологии окуня. После заполнения водоема (2016–2019 гг.) видовой состав паразитов окуня заметно меняется: нарастает разнообразие и встречаемость паразитических инфузорий. Гельминты, имеющие планктонный путь развития (Proteocephalus percae, Camallanus lacustris, Triaenophorus nodulosus), становятся доминирующими, определяя лимнофильный тип паразитофауны.
Богучанское водохранилище – третье по площади водохранилище России, образовано в нижнем течении р. Ангары. Заполнение водоема проходило в 2012–2015 гг., площадь водного зеркала при нормальном подпорном уровне (НПУ) водохранилища 208.0 м составляет 2326 км2, полный объем – 58.2 км3, максимальная глубина – 75 м, средняя – 25 м (Корпачев и др., 2013; Корпачев, Пережилин, 2018; Барабанова, 2019). Трансформация р. Ангары при создании водохранилища формирует новый комплекс факторов, напрямую и опосредованно влияющих на состояние водной биоты.
В фитопланктоне р. Ангары (в районе формирования Богучанского водохранилища) до зарегулирования было зарегистрировано 236 таксонов планктонных водорослей. Средняя численность и биомасса в вегетационный период составляла 0.41–0.80 млн кл./л и 0.14–0.30 г/м3 соответственно (Шевелева, Воробьева, 2009). В период заполнения водохранилища в составе фитопланктона происходит резкое снижение видового разнообразия (в 2014 г. – 10, в 2015 – 23 вида), но регистрируется вспышка количественных показателей цианобактерий (Глущенко, 2019). В 2016–2017 гг. количественные показатели фитопланктона существенно возросли. Максимальная численность (6.4–9.0 млн кл./л) отмечена весной, биомасса – летом (4.8–6.4 г/м3) (Usoltseva, Titova, 2017).
Видовой состав зоопланктона р. Ангары до зарегулирования был представлен 60 видами (Шевелева, Воробьева, 2009) и не претерпел существенных изменений в первые годы заполнения водохранилища. Зоопланктон верхнего участка Богучанского водохранилища сходен по разнообразию фауны коловраток, ракообразных и комплекса доминантов с выше расположенным Усть-Илимским водохранилищем. По мере заполнения водохранилища гидрологический и температурный режимы способствовали развитию лимнофауны верхнего участка. Так на третьем году заполнения (2015 г.) численность и биомасса зоопланктона (на участке, расположенном в 100 км ниже плотины Усть-Илимской ГЭС), уже достигали 57.6 тыс. экз./м3 и 1050 мг/м3, что значительно выше по сравнению с данными 2014 г. (13 тыс. экз./м3 и 165 мг/м3 соответственно). В 2016 г. продолжается увеличение продукции зоопланктона, биомасса которого на данном участке исследования составляла 2 г/м3 (Шевелева и др. 2016).
Состав зообентоса в р. Ангаре на месте будущего водохранилища был разнообразен. В 2002–2003 гг. обнаружено 144 разновидности организмов различных таксонов. Численность и биомасса бентоса составляли 5.3 тыс. экз./м2 и 17.0 г/м2 соответственно. Доминировали байкальские гаммариды (53.0% численности, 65.0% биомассы), субдоминанты по численности – олигохеты и хирономиды (19.0 и 17.0%), по биомассе – моллюски и олигохеты (12.0 и 9.0%) соответственно (Бажина, Клеуш, 2014).
Во время наполнения водохранилища (2014 г.) донная фауна Богучанского водохранилища оказалась резко обедненной по видовому составу и включала виды из пяти таксономических групп, где преобладали хирономиды (11 видов). На 5-й год существования водохранилища (2018 г.) количество видов хирономид возрастает до 17. Чаще всего встречались Polypedilum gr. nubeculosum и Cryptochironomus gr. defectus, в целом фауна хирономид находится на стадии формирования (Машонская, 2019).
Ихтиофауна р. Ангары в зоне формирования Богучанского водохранилища насчитывала 31 вид рыб и рыбообразных из 11 семейств. Осетр (Acipenser baeri Brandt), стерлядь(Acipenser ruthenus Brandt), ленок (Brachymystax lenok Pallas) встречались в Ангаре единично, таймень (Huсho taimen Pallas) и сиг (Coregonus lavaretus pidschian Gmelin) были малочисленны. Наиболее распространенным являлся хариус (Thymallus arcticus Pallas). Лещ (Abramis brama L.) и верховка (Leucaspius delineates Heckel) мигрировали в систему Ангары из русла Енисея, а также через систему расположенных выше ангарских водохранилищ (Понкратов, 2014).
В современном составе рыбного населения регистрируются: щука (Esox lucius L.), окунь, ерш (Gymnocephalus cernuus L.), плотва (Rutilus rutilus L.), лещ, елец обыкновенный (Leuciscus leuciscus L.), язь (Leuciscus idus L,), налим (Lota lota L.), гольян обыкновенный (Phoxinus phoxinus L). Доминантами являются окунь и плотва, составляющие (по данным промысловой статистики в 2019 г.) 50 и 30% уловов соответственно. Как и вышерасположенные ангарские водохранилища (Олифер, 1977, Тугарина, 1977), Богучанское водохранилище в последующие годы станет водоемом окунёво-плотвичного типа.
В работе используются два ключевых понятия: “инфрасообщество” – все виды паразитов, обнаруженные у отдельной особи хозяина и “компонентное сообщество” – виды паразитов данной популяции хозяина (Holmes, Price, 1986). Изменения гидрологических и гидробиологических параметров на ранних этапах образования водохранилища рассмотрены на примере изменения видового состава и структуры паразитофауны окуня. Для оценки богатства фауны паразитов применен широко используемый в классической экологии метод, который учитывает зависимость видового богатства от площади обследованной территории или числа проб (Джиллер, 1988). В последние годы появились немногочисленные примеры изучения зависимости видового богатства паразитов от числа исследованных хозяев (Иешко, Коросов, 2012; Salgado-Maldonado et al., 2016; Pelegrini et al., 2018; Иешко и др., 2019; Llopis-Belenguer et al., 2020).
Первыми в отечественной паразитологии данный подход реализовали Г.К. Петрушевский и М.Г. Петрушевская (1960), показавшие, что богатство паразитофауны имеет закономерную связь с числом исследованных рыб. В современной литературе широко обсуждается вопрос о механизмах формирования и природе паразитарных сообществ. Считается (Llopis-Belenguer et al., 2020), что понимание действующих процессов может варьировать в зависимости от уровня пространственной организации и рассматриваемой грани разнообразия: таксономического, функционального и филогенетического.
Данная работа направлена на исследование концепции экологического соответствия в паразитологии. Трансформация речной биоты в условиях становления водохранилища – это процесс, в ходе которого представители рыбного населения сохраняются в тех случаях, когда способны приспособиться к новым условиям обитания. Используя эту модель, мы демонстрируем изменения видового разнообразия паразитов в процессе адаптации окуня к новым условиям обитания и использованию пищевых ресурсов, в ходе чего происходит утрата специфичных видов и становление новой структуры паразитофауны.
Трансформация в кратчайший период речной экосистемы в озерную дает возможность оценить динамику и перестройку паразитарных сообществ в ответ на изменения биоты. В этой связи можно предположить, что компонентные сообщества паразитов окуня, обитающих в изменяющихся условиях водохранилища, будут различаться богатством инфрасообществ и скоростью накопления видового богатства компонентных сообществ паразитов по сравнению с исходным речным периодом.
В данной статье показаны изменения видового разнообразия и встречаемости паразитов, обусловленные утратой типичных мест обитания окуня при переходе водоема от речного статуса к озерному. Показаны паразитологические последствия обеднения бентосного и литорального комплекса в экологии и питании окуня, которые сопровождаются утратой специфичных видов гельминтов в связи с разрывом жизненного цикла. Рассмотрены особенности видового богатства компонентных сообществ, кривых накопления видового состава паразитов окуня в условиях трансформации условий обитания.
МАТЕРИАЛЫ И МЕТОДЫ
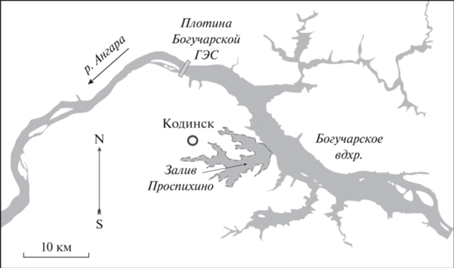
Материал был собран летом (июнь–июль) 2012–2016 гг. и 2019 г. в зал. Проспихина (низовье Богучанского водохранилища) (рис. 1 ). Исследования проводили на живом (Быховская-Павловская, 1985) и фиксированном 10%-ном р-ром формалина (Доровских, Степанов, 2009) материале. Методом полного паразитологического вскрытия исследовано 139 экз. окуня.
Для количественной характеристики зараженности использовали следующие показатели: экстенсивность инвазии (ЭИ,%), индекс обилия (ИО, экз./рыбу). Численность инфузорий определяли по числу клеток (среднее значение в выборке в 25 полях зрения при увеличении микроскопа 10 × 15). В случае, когда среднее число клеток было <10 экз., указывали знак “+” (единично); от 10 до 50 экз. –“++” (мало); >50 экз. –“+++” (много).
Для описания связи количества обнаруженных видов паразитов с увеличением объема выборки хозяина использовали уравнение степенной регрессии s = anb. Параметры уравнений регрессии имеют биологическую интерпретацию: коэффициент b характеризует скорость нарастания видового богатства компонентных сообществ паразитов (s) при росте числа исследованных особей хозяина (n), коэффициент a равен ожидаемому числу видов паразитов на первой особи, взятой из данной модельной выборки (Иешко и др., 2019).
Обработка и анализ данных выполнен с использованием программ Past (Hammer et al., 2001) и R (https://www.r-project.org). Написанный на языке R cкрипт для конкретной выборки методом рандомизации (Мастицкий, Шитиков, 2014) строит 100 серий кривых накопления видового богатства паразитов и для каждого ряда рассчитывает коэффициенты а и b регрессионного уравнения. Были рассчитаны группы коэффициентов по всем данным для каждого года отдельно. Ряды этих коэффициентов использовали для расчета средних, их распределений с оценкой значимости различий по DN-критерию Колмогорова–Смирнова.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Видовой состав паразитов окуня в разные годы. У окуня Богучанского водохранилища за весь период исследований обнаружен 31 вид паразитов, относящихся к 7 типам: Choanzoa (кл. Ichthyosporea), Cnidaria (кл. Myxozoa), Ciliophora (кл. Oligohymenophorea), Platyhelminthes (кл. Monogenea, Cestoda, Trematoda), Nematoda (кл. Chromadorea), Arthropoda (кл. Hexanauplia), Mollusca (кл. Bivalvia).
Наиболее разнообразная паразитофауна, сохранившая типичный облик речных условий, найдена у окуня в начальный период заполнения водохранилища. В 2012 г. было обнаружено 17 видов паразитов, среди которых доля видов со сложным циклом развития несколько выше(52.9%), чем с простым (47.1%).Основу видового состава паразитов окуня формировали гельминты: моногенеи (2), трематоды (5), цестоды (1), нематоды (1). Ядро компонентного сообщества паразитов образуют метацеркарии трематод: Ichthyocotylurus variegates (Creplin, 1825) и Diplostomum volvens Nordmann, 1832, доминирующие по встречаемости и средней численности (табл. 1). К массовым видам можно отнести: Apiosoma сampanulatum (Timofeev, 1962), Camallanus lacustris, Zoega, 1776, Diplostomum spathaceum Rudolphi, 1819). Единично встречалисьTrichodina urinaria Dogiel, 1940, Ancyrocephalus percae Ergens, 1966, Achtheres percarum (Nordmann, 1832).
Таблица 1.
Паразитофауна окуня Богучанского водохранилища
| Вид паразита | 2012 г. n = 34 |
2013 г. n = 15 |
2014 г. n = 15 |
2015 г. n = 30 |
2016 г. n = 30 |
2019 г. n = 15 |
||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| % | ИО, экз. | % | ИО, экз. | % | ИО, экз. | % | ИО, экз. | % | ИО, экз. | % | ИО, экз. | |
| Dermocystidium percae | – | – | – | – | – | – | 10.0 | 0.16 | – | – | – | – |
| Henneguya lobosa | 8.82 | 0.54 | – | – | – | – | 3.3 | 0.1 | 3.33 | 0.03 | 6.6 | 0.06 |
| Myxobolus guyenoti | 11.76 | 0.64 | 20.0 | 1.0 | – | – | – | – | – | – | – | – |
| Capriniana piscium | – | – | – | – | – | – | 13.3 | + | – | – | – | – |
| Apiosoma сampanulatum | 38.23 | + | 80.0 | + | 80.0 | ++ | 43.3 | ++ | 56.3 | ++ | 46.6 | ++ |
| Apiosoma minimicronucleatum | – | – | – | – | – | – | 16.6 | ++ | 26.6 | ++ | 26.6 | ++ |
| Apiosoma piscicolum | – | – | – | – | – | – | 13.3 | + | 23.3 | + | 6.6 | + |
| Apiosoma conicum | – | – | – | – | – | – | – | – | – | – | 13.3 | ++ |
| Apiosoma sp. | – | – | – | – | 6.6 | + | – | – | – | – | – | – |
| Epistylis lwoffi | – | – | 26.6 | + | 6.6 | + | 3.3 | + | 90.0 | +++ | 20.0 | ++ |
| Trichodina acuta | 5.88 | + | 13.3 | + | 33.3 | + | 36.6 | 2.36 | 56.6 | + | 13.3 | + |
| T. intermedia | – | – | – | – | 26.6 | + | 10.0 | + | – | – | – | – |
| T. urinaria | 5.88 | ++ | 6.6 | + | – | – | 3.3 | + | 10.0 | + | – | – |
| Trichodinella epizootica | 5.88 | + | 6.6 | + | 40.0 | ++ | 50.0 | ++ | 30.0 | + | 26.6 | ++ |
| Gyrodactylus lucii | – | – | – | – | – | – | – | – | 3.3 | 0.03 | – | – |
| G. cernuae | – | – | – | – | – | – | – | – | 6.6 | 0.46 | – | – |
| Gyrodactylus sp. | 2.94 | 0.03 | – | – | – | – | – | – | – | – | – | – |
| Ancyrocephalus percae | 8.82 | 0.17 | – | – | – | – | – | – | 3.3 | 0.23 | – | – |
| Caryophyllidea gen. sp. | 2.94 | 0.03 | – | – | – | – | – | – | – | – | – | – |
| Proteocephalus percae | – | – | 13.3 | 0.26 | – | – | 66.6 | 1.96 | 83.3 | 2.3 | 20.0 | 0.33 |
| P. torulosus | – | – | – | – | – | – | 6.6 | 0.06 | – | – | – | – |
| Triaenophorus nodulosus (pl) | – | – | – | – | – | – | – | – | – | – | 26.6 | 0.46 |
| Bunodera luciopercae | 5.88 | 0.41 | – | – | – | – | – | – | – | – | – | – |
| Ichthyocotylurus variegatus | 97.06 | 23.08 | 20.0 | 1.33 | 6.6 | 0.33 | – | – | – | – | – | – |
| Diplostomum spathaceum | 20.58 | 0.32 | 13.3 | 0.46 | – | – | – | – | – | – | – | – |
| Diplostomum volvens | 70.58 | 3.73 | 73.3 | 2.66 | – | – | 10.0 | 0.8 | – | – | – | – |
| Tylodelphys clavata | 8.82 | 0.29 | – | – | 13.3 | 0.73 | – | – | – | – | – | – |
| Camallanus lacustris | 26.47 | 0.7 | 26.6 | 0.73 | 26.6 | 1.0 | 23.3 | 0.3 | 6.67 | 0.06 | 46.6 | 1.53 |
| Raphidascaris acus (larva) | – | – | – | – | – | – | 6.6 | 0.06 | 3.33 | 0.06 | – | – |
| Achtheres percarum | 11.7 | 0.11 | 13.3 | 0.13 | – | – | 6.6 | 0.06 | 3.33 | 0.03 | 6.6 | 0.13 |
| Unionidae gen. sp. | 8.82 | 0.17 | – | – | – | – | – | – | – | – | – | – |
| Характеристика хозяев | ||||||||||||
| Длина тела АВ (мм) | 145–350 (197.6±7.5) | 158–350 (254.0±13.4) | 152–270 (200.8±8.16) | 160–242 (190.8±4.7) | 192–307 (210.8±3.67) | 160–245 (207.6±5.84) | ||||||
| Масса тела, г. | 32–616 (124.2±19.6) | 58–946 (289.5±57.6) | 46–337 (118.7±19.3) | 45–196 (91.4±8.3) | 80–147 (113.2±2.58) | 45–181 (117.46±9.50) | ||||||
| Возраст, лет | 2+–5+ | 2+–8+ | 3+–4+ | 3+– 4+ | 4+ | 4+–7+ | ||||||
В период наполнения водохранилища (2013–2014 гг.) уровень воды и границы литоральной зоны менялись каждый месяц. При этом видовой состав и структура фауны паразитов окуня претерпели значительные изменения за короткий период. В 2013 г. было найдено уже 12 видов, из них еще 5 представлены гельминтами. На следующий год при дальнейшем обеднении видового состава паразитов из оставшихся 9 видов, 6 представлены инфузориями и всего 3 вида паразитов со сложным циклом развития (Tylodelphys clavata Nordmann, 1832, I. variegatus, C. lacustris).
Полное заполнение водохранилища до проектной величины достигнуто в мае 2015 г. К этому периоду отмечается заметный рост видового богатства паразитов: зарегистрировано 17 видов, из которых 4 представлены гельминтами, имеющими планктонный тип жизненного цикла. Однако преобладающее число видов относится к представителям простейших. Среди гельминтов доминирующее положение занимают цестоды Proteocephalus percae (Müller, 1780) (66.6%) и нематоды C. lacustris (23.3%) (см. табл. 1).
Показательным фактором является отсутствие, наиболее часто встречаемых в предшествующий период, метацеркарий трематод I. variegatus и сокращение встречаемости метацеркарий р. Dilostomum.
Паразитофауна окуней, исследованных в период 2016–2019 гг., показала устойчивое нарастание встречаемости и интенсивности заражения рыб цестодами P. percae по сравнению с показателями 2015 г. Гельминты представлены 3 видами: нематоды C. lacustris, цестоды P. percae и впервые в составе паразитарного сообщества появились плероцеркоиды Triaenophorus nodulosus (Pallas, 1781). Важно отметить полное отсутствие трематод в составе паразитофауны окуня начиная с этого периода. Причем исчезли не только виды, попадающие в хозяина через кормовые объекты, но и активно нападающие.
Особенности и различия видового богатства компонентных сообществ паразитов окуня в начальный период и спустя 3 года после зарегулирования (2015 г.), по-видимому, связаны с изменениями богатства инфрасообществ. Для наиболее корректного анализа рассмотрены одновозрастные выборки рыб. Сравнивали видовое богатство инфрасообществ окуней (3+) в 2012 г. и в 2015 г. При этом в начальный период это были рыбы, выклюнувшиеся еще в реке и обитавшие в естественных условиях, а спустя три года – это уже окуни, появившиеся и выросшие в водохранилище.
Инфрасообщества паразитов и характеристика кривых накопления видового богатства компонентных сообществ. Распределение видового богатства инфрасообществ паразитов окуня в исследованные годы практически всегда носило агрегированный характер, при котором в популяции доминировали рыбы с малым числом видов паразитов. Особи с большим числом видов паразитов были единичны.
В 2012 г. незараженные рыбы в выборке отсутствовали, в составе инфрасообществ обнаружено от 1 до 7 видов паразитов. У рыб в возрасте 3+ лет доминировали особи, зараженные 3-мя видами паразитов. В 2015 г. в выборке также доминировали рыбы с 3-мя видами паразитов, однако распределение инфрасообществ было более равномерным (рис. 2 ). Распределения видового богатства инфрасообществ паразитов окуня в начальный период создания водохранилища и при полном заполнении (2012–2015 гг.) имели достоверные отличия (тест Колмогорова–Смирнова DN = 0.51 при p < 0.05).
Рис. 2.
Гистограммы распределения видового богатства инфрасообществ паразитов окуня 3+ лет в разные этапы формирования Богучанского водохранилища. Здесь и на рис. 3 по оси ординат – частоты, по оси абсцисс – число видов.
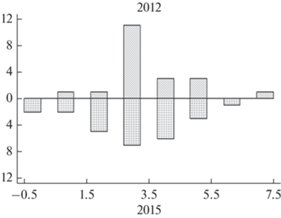
В 2016 г., когда рыбы достигли возраста 4+ лет, доминирующее число их инфрасообществ составляют 4 и 5 видов, также представленных инфузориями, но к ним присоединяется уже цестода P. percae. Распределение графически смещено вправо и плосковершинное (рис. 3 ).
Рис. 3.
Гистограммы распределения видового богатства инфрасообществ паразитов окуня в возрасте 3+ и 4+ лет (2015 и 2016 гг.).
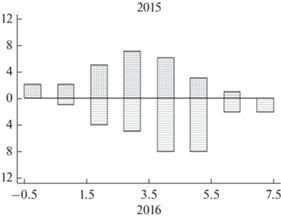
Рис. 4.
Кривые накопления видового богатства компонентных сообществ паразитов окуня в разные периоды формирования водохранилища (⚪ – 2012 г.; ◻ – 2015 г.; * – 2016 г.).
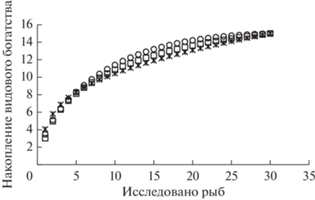
Несмотря на видимые графические различия сравниваемые распределения видового богатства паразитов окуня в возрасте 3+ лет (2015 г.) и 4+ лет (2016 г.) достоверно не различаются (DN = 0.35, р ≥ 0.05).
По данным каждого исследованного периода построены рандомизированные ряды накопления видового богатства и рассчитаны значения коэффициентов a и b уравнения степенной регрессии (табл. 2). Различия кривых накопления видового богатства компонентных сообществ паразитов, построенные для паразитарных сообществ окуня возрастной группы 3+ лет (в 2012 и 2015 гг.) (рис. 4 ), оценивались по распределению коэффициентов a и b. Как для коэффициента a, который характеризует видовое богатство инфрасообществ, так и для коэффициента b, определяющего скорость накопления видового богатства, достоверных отличий не обнаружено (тест Колмогорова–Смирнова для коэффициента a DN = = 0.17 при p > 0.11; для коэффициента b DN = 0.15 при p < 0.21).
Таблица 2.
Коэффициенты степенной регрессионных моделей S = aMb накопления видового богатства в зависимости от числа исследованных рыб в разные годы
| Показатель | 2012 г. | 2015 г. | 2016 г. | |||
|---|---|---|---|---|---|---|
| a | b | A | b | a | b | |
| Минимальные значения | 2.75 | 0.16 | 1.67 | 0.20 | 1.97 | 0.19 |
| Максимальные значения | 8.94 | 0.52 | 8.41 | 0.68 | 7.12 | 0.62 |
| Средняя | 4.89 | 0.36 | 4.61 | 0.37 | 4.72 | 0.35 |
| Мин. доверительный интервал | 4.66 | 0.34 | 4.37 | 0.35 | 4.52 | 0.34 |
| Макс. доверительный интервал | 5.10 | 0.37 | 4.84 | 0.38 | 4.92 | 0.36 |
Анализ двух группировок окуней в 2015 г., в возрасте 3+ лет и в 2016 г. в возрасте 4+ лет показывает, что кривые накопления видового богатства также не имели достоверных отличий (для коэффициентов a DN = 0.12, b DN = 0.17 при p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В июне 2012 г., т.е. сразу после зарегулирования р. Ангары и создания Богучанского водохранилища, окунь имеет паразитов, заражение которыми произошло еще в речной период. Среди паразитов, чье развитие включает промежуточных хозяев, только один вид (C. lacustris) развивается с участием различных копепод семейства Cyclopoidae. Окончательными хозяевами для этой нематоды являются рыбы семейства Percidae, но в жизненный цикл могут быть вовлечены и другие группы рыб. Так в качестве постциклических хозяев выступают многие хищные рыбы (Salmonidae, Esocidae), и ряд других групп (Cobitidae, Cyprinidae, Esocidae, Salmonidae и др.) могут выступать в роли паратенических хозяев (Пугачев, 2004).
Остальные паразиты включают в свой жизненный цикл бентосные организмы. С участием олигохет развиваются цестоды Caryophyllidea gen. sp., миксоспоридии Henneguya lobosa (Cohn, 1895) и Myxobolus guyenoti (Naville, 1928). Моллюски (двустворчатые и брюхоногие) служат промежуточными хозяевами для трематод. Основу трематодофауны окуня формируют виды, паразитирующие у рыб на стадии метацеркария и заканчивающие свое развитие в рыбоядных птицах. Первыми промежуточными хозяевами для I. variegates (Creplin, 1825) служат двустворчатые моллюски р. Valvata, а для глазных трематод D. spathaceum, D. volvens, T. clavata – брюхоногие моллюски р. Lymnaea. Заражение окуня данными видами происходит перкутантно и не связано с питанием, в отличие от Bunodera luciopercae (Müller, 1776) Lühe, 1909. Окунь заражается бунодерой, поедая каланоидных веслоногих рачков – вторых промежуточных хозяев паразита (Соколов и др., 2013).
Заполнение Богучанского водохранилища происходило очень быстро. К 08.11.2012 г., т.е. фактически за полгода, была достигнута промежуточная отметка 185 м, из планируемых 208 м. В 2013 г. водохранилище практически наполнено, его уровень составляет 192.7 м. Столь резкая трансформация реки в водохранилище негативно сказалась в первую очередь на донных биоценозах. Кроме того, на ранних этапах еще не сформирована береговая линия и отсутствует литоральная зона. Большие глубины, разрушение затопленной растительности и переформирование грунтов привело к разрушению и отмиранию исходных реофильных донных сообществ.
Уже в первый год наполнения водоема видовое разнообразие паразитов сокращается до 12 видов, 3 из которых, связанные с бентосом (Caryophyllidea gen. sp., B. luciopercae и глохидии моллюсков), в последующие годы не были зарегистрированы. В 2014 г., когда уровень водохранилища поднялся еще на 11 м (203.4 м), продолжалось падение числа видов паразитов до 9. Основу фауны формируют инфузории (6 видов), среди которых доминируют A. сampanulatum (80%), Trichodinella epizootica (Raabe, 1950) (40%) и Trichodina acuta (Lom, 1961) (33.3%). Благоприятными факторами для развития одноклеточных простейших является уменьшение проточности и прогреваемость водоема. Напротив, донные сообщества гидробионтов разрушены, а планктонные – сильно разбавлены и еще не сформированы. Кроме того, рыбы в новых условиях оказались разрежены и не образуют плотных скоплений. В результате разобщения паразитов и их хозяев у окуня в этот период отсутствуют моногенеи и паразитические ракообразные.
После завершения наполнения водоема (2015 г.) из паразитов, чье развитие протекает с участием бентоса, остаются миксоспоридии H. lobosa (встречаемость которых единична)и метацеркарии D. volvens, зараженность которыми сократилась в 7 раз по сравнению с годом зарегулирования. Доминирующим видом становится цестода P. percae, нарастание численности которой продолжается в последующий год. В 2016 г. лидирующее положение по-прежнему занимают паразитические инфузории, фауна которых, по-видимому, уже сформирована. Трематоды в составе паразитофауны окуня не регистрируются.
Спустя 7 лет существования водоема (2019 г.) обнаружено 12 видов паразитов. Моногенеи в составе фауны отсутствуют, очевидно, вследствие своей низкой численности, а из 4-х видов паразитов со сложным циклом развития 3 вида окунь получает за счет планктонного питания. При этом впервые в составе паразитофауны появились плероцеркоиды T. nodulosus (26.6%). Известно, что в условиях водохранилищ с замедленным течением, хорошей прогреваемостью, ростом численности и биомассы зоопланктона создаются благоприятные условия для развития этого лимнофильного вида паразита (Изюмова, 1977). Скорее всего, мы наблюдаем начало формирования очага триенофороза в Богучанском водохранилище.
Накопление видового богатства компонентного сообщества паразитов окуня имеет степенную зависимость от числа обследованных особей хозяина. Степенная или взаимосвязанная с ней логарифмическая зависимость между данными параметрами – одна из общих закономерностей организации компонентных паразитарных сообществ (Walther et al., 1995; Dove, Cribb, 2006; Sarabeev, 2015). Отсутствие отличий между кривыми накопления по коэффициенту а и b, построенными для сообществ паразитов окуня (рис. 4 ) в разные периоды перехода речной биоты в озерную, подтверждается сходством видового богатства инфрасообществ. Согласно концепции экологического соответствия, колонизация окунем водохранилища будет сопровождаться сменой трофических преференций. Окунь имеет высокую экологическую пластичность и способен специализироваться как планктофаг (Жаков, 1984). Поэтому главной причиной обеднения видового богатства гельминтов в инфра и компонентных сообществах паразитов окуня мы считаем утрату в пищевом рационе окуня представителей бентоса, что является экологическим последствием начальных этапов существования водохранилища.
Сходство кривых накопления видового богатства компонентных сообществ паразитов сопровождается кардинальными отличиями по видовому составу. Так в 2012 г. 53% паразитофауны составляли виды, использующие в своем развитии бентосные организмы, а в 2015 г. 60% фауны формировали виды с простым циклом развития. Доминирующее число видов в двух сообществах составляют 3 вида паразитов. В исходный период это метацеркарии трематод, спустя 3 года ядро паразитофауны формируют цестоды P. percae, и паразитические инфузории A. сampanulatum, T. epizootica. В 2016 г. состав инфрасообществ паразитов не изменился по сравнению с предыдущим годом. Через 7 лет существования водохранилища наряду с паразитическими простейшими ведущее положение начинают занимать гельминты с планктонным путем развития.
***
В условиях трансформирования водоема река → → водохранилище, видовой состав, структура инфра и компонентных сообществ паразитов окуня претерпевает существенные изменения. Несмотря на практически равное количество видов в начале зарегулирования и после заполнения, качественный состав паразитофауны изменился. Ведущее положение по видовому разнообразию заняли паразитические инфузории родов Apiosoma и Trichodina, причем вспышка численности апиосом наблюдалась уже на второй год существования водохранилища.
После зарегулирования р. Ангары быстрое эвтрофирование привело к росту продукции зоопланктона и увеличению его роли в питании рыб, в результате чего в настоящее время наблюдается нарастание встречаемости и интенсивности заражения рыб цестодами и нематодами, цикл развития которых включает планктонных Copepoda.
Наблюдая происходящие изменения паразитофауны и проводя сравнение с Красноярским водохранилищем, можно утверждать, что в Богучанском водохранилище также будет чрезвычайно бедный состав паразитофауны, цикл развития которых включает бентосные организмы. Доминировать будут гельминты с планктонным путем развития. Очевидно произойдет формирование очага триенофороза, а с началом промышленного лова рыбы и усиления антропогенной нагрузки на водоем – развития очага дифиллоботриоза.
Финансирование. Работа выполнена в рамках государственных заданий (076-00005-20-02 и 0218-2019-0075).
Благодарность. Авторы глубоко признательны за помощь в сборе ихтиологического материала сотрудникам Красноярского филиала ФГБНУ “ВНИРО” (“НИИЭРВ”) Ю.В. Перепелину, А.В. Рожкову, А.В. Назарову.
Список литературы
Бажина Л.В., Клеуш В.О. Макрозообентос Красноярской акватории реки Ангара до наполнения водохранилища Богучанской ГЭС // Чтения памяти В.Я. Леванидова. 2014. Вып. 6. С. 66–77.
Барабанова Е.А. Водохранилища водосбора арктических морей России // Водные ресурсы. 2019. Т. 46. № 2. С. 123–131.
Быховская–Павловская И.Е. Паразиты рыб. Руководство по изучению. Л.: Наука, 1985. 122 с.
Глущенко Л.А. Фитопланктон периода формирования Богучанского водохранилища // XII Съезд гидробиологического общества при РАН: тез. докл., г. Петрозаводск, 16–20 сентября 2019 г. Петрозаводск: КарНЦ РАН, 2019. С. 109–111.
Джиллер П. Структура и экологическая ниша. М.: Мир, 1988. 184 с.
Доровских Г.Н., Степанов В.Г. Методы сбора и обработки ихтиопаразитологических материалов (учебное пособие). Сыктывкар: Сыктывкарский ун-т, 2009. 131 с.
Жаков Л.А. Формирование и структура рыбного населения озер Северо-Запада СССР. М.: Наука, 1984. 144 с.
Иешко Е.П., Коросов А.В. Оценка видового богатства паразитофауны рыб: экологический подход // Принципы экологии. 2012. Т. 1. № 4. С. 28–40.
Иешко Е.П., Коросов А.В., Соколов С.Г. Видовое богатство сообществ паразитов ротана Perсcottus glenii (Actinopterygii: Odontobutidae) в нативной и приобретенной частях ареала хозяина // Паразитология. 2019. Т. 53. Вып. 2. С. 145–158. https://doi.org/10.1134/S0031184719020066
Изюмова Н.А. Паразитофауна рыб водохранилищ СССР и пути ее формирования. Л.: Наука, 1977. 284 с.
Корпачев В.П., Пережилин А.И. Андрияс А.А. Оценка объема затопления древесной массы в водохранилище Богучанской ГЭС // Вестник ПГТУ. Лес. Экология. Природопользование. 2013. № 1. С. 50–56.
Корпачев В.П., Пережилин А.И., Андрияс А.А., Гудаева Е.А. Морфометрические характеристики проектируемых водохранилищ ГЭС Сибири // Хвойные бореальной зоны. 2018. Т. 36. № 5. С. 411–417.
Мастицкий С.Э., Шитиков В.К. Статистический анализ и визуализация данных с помощью R. Электронная книга. 2014. http://r-analytics.blogspot.com (23 ноября 2018).
Машонская Ю.О. Видовое разнообразие, численность и биомасса личинок хирономид (Diptera, Chironomidae) на разных участках акватории Богучанского водохранилища // Экология южной Сибири и сопредельных территорий. Материалы XXIII Междунар.науч. школы-конференции студентов и молодых ученых. Абакан, 20–22 ноября 2019 г. Абакан: Хакасский госуниверситет им. Н.Ф. Катанова, 2019. С. 52–53.
Олифер С.А. Рыбохозяйственное освоение Усть-Илимского водохранилища // Изв. Гос-НИОРХ. Рыбохозяйственное освоение водохранилищ Сибири. 1977. Т. 115. С. 65–96.
Петрушевский Г.К., Петрушевская М.Г. Достоверность количественных показателей при изучении паразитофауны рыб // Паразитологический сборник ЗИН РАН. 1960. № 19. С. 333–343.
Понкратов С.Ф. Перспективы рыбохозяйственного использования Богучанского водохранилища // Вестник рыбохозяйственной науки. 2014. Т. 1. № 3. С. 29–40.
Пугачев О.Н.Каталог паразитов пресноводных рыб Северной Азии. Нематоды, скребни, пиявки, моллюски, ракообразные, клещи. СПб., Тр. ЗИН РАН, 2004. Т. 304. 250 с.
Соколов С.Г., Протасова Е.Н., Черевичко А.В. Новый таксономический статус трематод Bunodera luciopercae s. str. и Bunodera acerinae stat. n. (Trematoda, Allocreadiidae) и второй промежуточный хозяин Bunodera lucioperca es. str. // Зоологический журн. 2013. Т. 92. № 2. С. 184–193.
Тугарина П.Я. Иркутское водохранилище и продуктивность его ихтиоценозов // Изв. Гос-НИОРХ. Рыбохозяйственное освоение водохранилищ Сибири. 1977. Т. 115. С. 44–54.
Шевелева Н.Г., Воробьева С.С. Состояние и развитие фито- и зоопланктона нижнего участка Ангары, прогноз формирования планктона в Богучанском водохранилище // J. Siberian Federal University. Biology. 2009. № 3. С. 313–326.
Шевелева Н.Г., Пастухов М.В., Зайцева Е.П., Полетаева В.И. Сообщество зоопланктона верхнего участка Богучанского водохранилища в период его заполнения // География и природные ресурсы. 2016. № 6. С. 81–85.
Dove A.D., Cribb T.H. Species accumulation curves and their applications in parasite ecology // Trends in Parasitology. 2006. V. 22. P. 568–574.
Hammer O., Harper D., Ryan P. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4(1). P. 9.
Holmes J.C., Price P.W. Communities of parasites. In: Kikkawa J. and Anderson D.J. (eds.). Community ecology: patterns and processes. Melbourne, Blackwell Scientific Publications. 1986. P. 187–213.
Llopis-Belenguer C., Pavoine S., Blasco-Costa I., Antonio Balbuena J. Assembly rules of helminth parasite communities in grey mullets: combining components of diversity // Intern. J. Parasitology. 2020. https://doi.org/10.1016/j.ijpara.2020.06.006
Pelegrini L.S., Januário F.F., Kozlowisky de Azevedo R., Abdallah V.D. Biodiversity and ecology of the parasitic infracommunities of Loricaria prolix (Siluriformes: Loricariidae) from the Tietê-Batalha Basin, SP, Brazil // Acta Scientiarum. Biological Sciences.2018. V 40, e36294. https://doi.org/10.4025/actascibiolsci.v40i1.36294
Salgado-Maldonado G., Novelo-Turcotte M.T., Caspeta-Mandujano J.M., Vazquez-Hurtado G., Quiroz-Martínez B., Mercado-Silva N., Favila M. Host specificity and the structure of helminth parasite communities of fishes in a Neotropical river in Mexico // Parasite.2016. V. 23 P. 1–11. https://doi.org/10.1051/parasite/2016073
Sarabeev V. Helminth species richness of introduced and native grey mullets (Teleostei: Mugilidae) // Parasitology International.2015. V. 64. P. 6–17.
Usoltseva M.V., Titova L.A. Phytoplankton of the Boguchany reservoir in 2016–2017 at the stations in front of the hydroelectric dam // Acta Biologica Sibirica. 2017. V. 3(3). P. 57–65. https://doi.org/10.14258/abs.v3i3.3616
Walther B.A., Cotgreave P., Price R.D., Gregory R.D., Clayton D.H. Sampling effort and parasite species richness // Parasitology Today.1995. V. 11(8). P. 306–310.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая