Известия РАН. Серия биологическая, 2022, № 3, стр. 300-311
Распределение бактерий, пикофитопланктона и флагеллят в устьевой области р. Меконг
Д. Б. Косолапов 1, 2, *, Н. Г. Косолапова 1, А. И. Цветков 1, Динь Нгуен Ку 3
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, пос. Борок, 109, Россия
2 Череповецкий государственный университет
162600 Вологодская обл., Череповец, просп. Луначарского, 5, Россия
3 Южное отделение Российско-Вьетнамского тропического центра, № 3
Хошимин, улица 3/2, округ 11, Вьетнам
* E-mail: dkos@ibiw.ru
Поступила в редакцию 21.08.2020
После доработки 21.09.2020
Принята к публикации 21.09.2020
- EDN: PRMIUE
- DOI: 10.31857/S102634702203009X
Аннотация
В устьевой зоне р. Меконг (Вьетнам) впервые определены численность и биомасса основных компонентов планктонной микробной трофической сети: бактерий, пикофитопланктона, гетеротрофных и фототрофных флагеллят, изучены особенности их пространственного распределения, а также видовое разнообразие гетеротрофных флагеллят. В этой продуктивной загрязненной тропической речной экосистеме гетеротрофные бактерии имели крупные размеры, и их биомасса достигала высоких значений, характерных для гипертрофных вод. Они вносили основной вклад (в среднем, 73.8%) в формирование общей биомассы планктонного микробного сообщества. Вклад пикофитопланктона, гетеротрофных и фототрофных флагеллят составил 20.5, 3.9 и 1.9% соответственно. Идентифицировано 29 видов и форм гетеротрофных флагеллят, относящихся к восьми крупным таксонам и группе неопределенного систематического положения.
Бактерии и другие микроорганизмы – самые многочисленные и разнообразные компоненты водных экосистем (Gasol et al., 1997). Они формируют микробные трофические сети (микробную “петлю”), в которых бактерии усваивают растворенные органические вещества, а простейшие выполняют функцию связующего звена между бактериями и мельчайшими водорослями и зоопланктоном, т.е. между микробной петлей и пастбищной пищевой цепью (Sanders, Wickham, 1993; Pomeroy et al., 2007). Микроорганизмы играют важные роли в биогеохимических круговоротах углерода и других элементов, формировании качества воды и донных отложений, образовании и потреблении парниковых газов (Falkowski et al., 2008).
Одна из центральных проблем экологии состоит в понимании закономерностей распределения организмов в водных экосистемах. В этой связи особый интерес вызывают устьевые участки рек, где в результате смешивания пресных речных и соленых морских вод возникают вертикальные и горизонтальные градиенты солености и других физико-химических параметров, которые определяют характер пространственно-временной изменчивости гидробионтов. Эстуарии и дельты характеризуются высоким содержанием биогенных элементов, взвешенных и растворенных органических веществ, и вследствие этого, высокой продуктивностью (Telesh, Khlebovich, 2010; Cloern et al., 2017).
Меконг – крупнейшая река юго-восточной Азии, которая имеет длину 4800 км и протекает по территории шести государств. Площадь водосбора Меконга составляет 795 000 км2, а его устьевой области – 65 170 км2. Последняя принадлежит к дельтово-эстуарному типу и расположена в южной части Вьетнама в зоне тропического климата (Михайлов, Аракельянц, 2010). Меконг испытывает мощное хроническое загрязнение и интенсивно используется в качестве источника питьевого водоснабжения и орошения, приемника промышленных, сельскохозяйственных и бытовых сточных вод и для судоходства.
В нижнем течении р. Меконг проводили большое количество микробиологических исследований, которые были посвящены в основном изучению либо патогенных микроорганизмов (Ozaki et al., 2014; Wilbers et al., 2014), либо специфических групп бактерий, осуществляющих биодеградацию и трансформацию загрязняющих веществ (Asta et al., 2019; Le et al., 2017). Определение количества и активности бактериопланктона и других компонентов микробной трофической сети в дельте Меконга до сих пор не исследовали. Опубликованы данные по динамике бактериопланктона в прудах по разведению креветок и рыбы, расположенных в этом регионе (Alongi et al., 1999; Wada et al., 2016). Вместе с тем результаты, полученные при изучении устьевых участков других рек, показывают, что микроорганизмы играют важную роль в трофодинамике этих динамичных экосистем (Findlay et al., 1992; Crump et al., 2004).
Цель работы – определение численности и биомассы основных компонентов планктонной микробной трофической сети: бактерий, пикофитопланктона и флагеллят, выявление особенностей их пространственного распределения и изучение видового разнообразия гетеротрофных флагеллят в устьевой области р. Меконг.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили 5–18 декабря 2018 г. на трех рукавах нижнего течения р. Меконг: Хамлуонг, Котьен и Бассак (только пресноводная часть). В этих рукавах визуально выделяли характерные участки, на которых осуществляли отбор проб воды по поперечному профилю: в медиали и рипали правого и/или левого берега. Пробы воды были получены на 50 станциях, большинство из которых находилось в пресноводной зоне (рис. 1). Воду из поверхностного слоя отбирали с помощью батометра Ван-Дорна, и сразу же помещали в стерильные пластиковые флаконы объемом 60 мл. Водные пробы фиксировали 40%-ным формальдегидом до конечной концентрации 2%, хранили в темноте при температуре 4°С и обрабатывали в лаборатории в течение 2 мес. Все используемые для учета микроорганизмов растворы реактивов предварительно фильтровали через фильтры с диаметром пор 0.2 мкм.
Рис. 1.
Карта-схема расположения станций отбора проб в устьевой области р. Меконг 5–18 декабря 2018 г.

Численность и размеры бактерий, пикофитопланктона, гетеротрофных и фототрофных флагеллят определяли методом эпифлуоресцентной микроскопии с использованием микроскопа Olympus BX51 (Япония) с системой анализа изображений при увеличении 1000 раз (Porter, Feig, 1980; Caron, 1983; MacIsaac, Stockner, 1993). Объемы микробных клеток рассчитывали по формулам объемов цилиндра, шара или эллипсоида. Сырую биомассу вычисляли путем умножения их численности на средний объем клеток. Содержание углерода в бактериальных клетках (С, фг С/кл) рассчитывали с использованием следующего аллометрического уравнения:
С = 120 × V0.72 (Norland, 1993). Для перевода биомассы пикофитопланктона в единицы углерода использовали коэффициент, равный 200 (Weisse, 1993), флагеллят – 220 фг C/мкм3 (Borsheim, Bratbak, 1987).
Гетеротрофных жгутиконосцев идентифицировали до вида или рода в нефиксированных пробах воды с помощью фазово-контрастной микроскопии и компьютерной системы анализа изображений. Обнаруженных жгутиконосцев диагностировали по морфологическим признакам и особенностям их поведения (Жуков, 1993; Vørs, 1992). Выделение трофических групп жгутиконосцев и дифференцирование их видов по типу питания проводили, как это описано ранее (Sanders, 1991).
Измерения температуры, электропроводности и солености воды, концентрации растворенного кислорода проводили с использованием многопараметрического зонда YSI ProPlus через 1 м по всему столбу воды. В поверхностном слое воды определяли мутность с помощью портативного турбидиметра Hach 2000P и pH – с использованием портативного зонда Hanna HI 98121. Скорость течения на поверхности измеряли с помощью микрокомпьютерного скоростемера-расходомера МКРС.
При установлении зависимостей между количественными характеристиками микроорганизмов и параметрами окружающей среды применяли ранговый коэффициент корреляции Спирмена для уровня значимости 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Физико-химическая характеристика. Температура воды в устьевой области р. Меконг в декабре 2018 г. колебалась в узком диапазоне: от 28.0 до 30.0°С. Значения рН воды находились в пределах 6.32–7.90 (в среднем, 6.92 ± 0.45). Электропроводность воды изменялась от 147 на пресноводных участках рукавов до 12 622 мкСм/см по мере приближения к морю, что соответствовало солености от 0.06 до 14.77 PSU, причем расслоение водной толщи в рук. Котьен было более выражено, чем в рук. Хамлуонг. Концентрация растворенного кислорода изменялась в пределах 4.03–7.61 мг/л, что соответствовало 52.7–99.3% насыщения, и мало различалась в поверхностном и придонном слоях воды: в среднем 5.67 ± 0.87 и 5.40 ± 0.79 мг/л соответственно. Скорость течения на разных участках колебалась от 0.1 до 1.2 м/с. Вода содержала большое количество взвешенных органических и минеральных частиц, и ее мутность составляла 20.5–121.0 (в среднем, 49.4 ± 24.2) NTU.
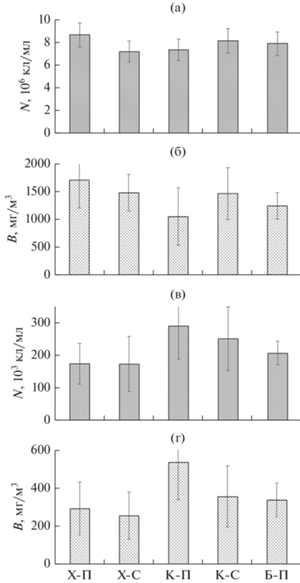
Бактериопланктон. Общее количество гетеротрофного бактериопланктона в дельте Меконга изменялось в пределах (6.20–10.76) × 106 кл/мл и составило в среднем (7.88 ± 1.11) × 106 кл/мл (рис. 2а). Наибольшие значения этого показателя, превышающие 107 кл/мл, зарегистрированы как в пресноводной, так и в солоноватоводной зонах. Минимальная численность бактериопланктона обнаружена в медиали пресноводного участка рук. Котьен.
Рис. 2.
Общая численность (а) и биомасса (б) гетеротрофного бактериопланктона и общая численность (в) и биомасса (г) пикофитопланктона на разных участках рукавов Меконга: пресноводном (Х-П) и солоноватоводном (Х-С) участках рук. Хамлуонг, пресноводном (К-П) и солоноватоводном (К-С) участках рук. Котьен и пресноводном участке (Б-П) рук. Бассак.
Средние для пробы объемы бактериальных клеток варьировали в пределах 0.078–0.304 (в среднем, 0.177 ± 0.053) мкм3. Максимальное и минимальное значения этого показателя были обнаружены в пресноводной части рукавов Хамлуонг и Котьен соответственно.
Максимальная (2983 мг/м3) и минимальная (496 мг/м3) биомасса бактериопланктона была зарегистрирована на тех же пресноводных участках дельты, где максимальными и минимальными были объемы бактериальных клеток (рис. 2б). Средняя биомасса оказалась равной 1404 ± 486 мг/м3. Численность бактерий была менее вариабельным показателем (коэффициент вариации (CV) составил 14.1%), чем объем их клеток (CV = 30.0%) и биомасса (CV = 34.6%).
В среднем численность, объем клеток и биомасса гетеротрофного бактериопланктона на пресноводных и солоноватоводных участках рукавов Меконга отличались незначительно: 7.98 × 106 и 7.73 × × 106 кл/мл, 0.167 и 0.192 мкм3, 1360 и 1476 мг/м3 соответственно. Численность и биомасса бактериопланктона были выше в пресноводной части рук. Хамлуонг, чем в его солоноватоводной части: в среднем, (8.63 ± 1.06) × 106 кл/мл и 1713 ± 502 мг/м3, (7.18 ± 0.93) × 106 кл/мл и 1484 ± 332 мг/м3 соответственно. Эти показатели в пресноводной зоне рук. Котьен, наоборот, в среднем, были ниже по сравнению с солоноватоводной: (7.93 ± 0.93) × × 106 кл/мл и 1057 ± 519 мг/м3, (8.13 ± 1.08) × × 106 кл/мл и 1470 ± 465 мг/м3 соответственно.
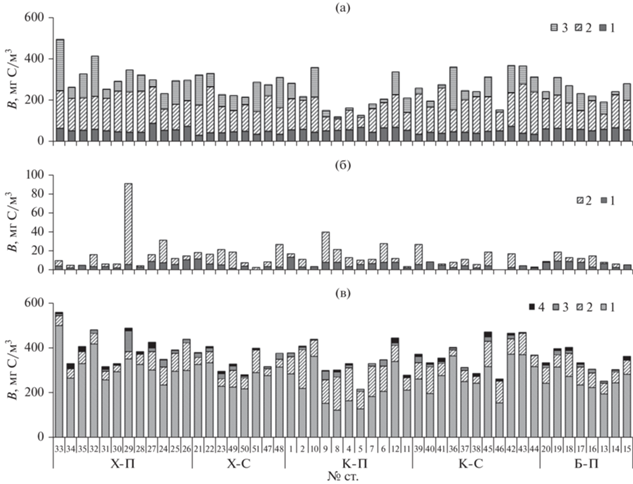
В бактериопланктоне дельты Меконга выделяли три размерные группы: мелкоразмерные (объем клеток (V) < 100 мкм3), среднеразмерные (V = = 100–500 мкм3) и крупноразмерные (V > 500 мкм3). Бактерии с объемом клеток менее 100 мкм3 составляли в среднем 58.9% общей численности бактериопланктона и 21.3% его общей биомассы (рис. 3а). Большую часть общей биомассы (54.1%) занимали клетки средних размеров. Они же составляли 31.5% общей численности. Вклад крупных палочек и нитей (V > 500 мкм3) в формирование общей численности и биомассы бактериопланктона оказался равным 9.6 и 24.6% соответственно.
Рис. 3.
а – Вклад бактерий с объемами клеток <100 (1), 100–500 (2) и >500 (3) мкм3 в формирование общей биомассы бактериопланктона; б – вклад мелких (2–5 мкм) (1) и крупных (>5 мкм) (2) организмов в формирование общей биомассы гетеротрофных нанофлагеллят; в – суммарная биомасса планктонного микробного сообщества и вклад в ее формирование гетеротрофных бактерий (1), пикофитопланктона (2), гетеротрофных (3) и фототрофных (4) нанофлагеллят.
Пикофитопланктон. При проведении исследований мы отнесли к пикофитопланктону фотосинтезирующих организмов с линейными размерами менее 3 мкм, поскольку как было установлено ранее, клада, объединяющая пикоцианобактерий (Synechococcus/Prochlorococcus/Cyanobium), образована кокковидными и палочковидными клетками диаметром до 3 мкм (Callieri, 2010). Количество пикофитопланктона в дельте Меконга изменялось в пределах (88–530) × 103 (в среднем, (222 ± 92) × × 103) кл/мл и было на 1–2 порядка ниже количества гетеротрофного бактериопланктона (рис. 2в). Биомасса пикофитопланктона находилась в пределах 137–870 (в среднем. 361 ± 175) мг/м3 (рис. 2г). Максимальные значения этих параметров зарегистрированы в рипали пресноводной части рук. Котьен: численности – на ст. 8. биомассы – на ст. 2. Минимальная численность и биомасса пикофитопланктона отмечались в солоноватых водах рукавов Хамлуонг и Котьен соответственно. Эти параметры варьировали в более широких пределах (CV = 41.3 и 48.7% соответственно) по сравнению с таковыми гетеротрофного бактериопланктона.
На разных участках пикофитопланктон составлял от 6.0 до 60.1% (в среднем 21.9 ± 12.6%) суммарной биомассы пикофитопланктона и гетеротрофного бактериопланктона. Только на двух станциях, расположенных в пресноводной части рук. Котьен (ст. 4 и 8), где были максимальными размеры и численность пикофитопланктона, он занимал более половины суммарной биомассы. На всех остальных участках биомасса бактерий превышала биомассу пикофитопланктона.
Средняя численность пикофитопланктона в пресно- и солоноватоводной частях дельты оказалась примерно одинаковой: 223 × 103 и 218 × × 103 кл/мл соответственно, а средний объем его клеток и биомасса в пресноводной зоне были в 1.2–1.3 раза выше, чем в солоноватоводной: 1.73 и 1.43 мкм3, 390 и 313 мг/м3 соответственно. Численность и биомасса пикофитопланктона в рук. Котьен (в среднем, (270 ± 100) × 103 кл/мл и 445 ± ± 198 мг/м3 соответственно) были выше таковых в рукавах Бассак (в среднем, (207 ± 36) × 103 кл/мл и 336 ± 90 мг/м3 соответственно) и Хамлуонг (в среднем, (174 ± 70) × 103 кл/мл и 277 ± 131 мг/м3 соответственно).
Гетеротрофные флагелляты. В дельте Меконга было идентифицировано 29 видов и форм гетеротрофных жгутиконосцев, относящихся к восьми крупным таксонам и группе неопределенного систематического положения (табл. 1). Наибольшим видовым разнообразием отличался отр. Хризофитовые (9 видов). Остальные таксоны содержали в своем составе не более 4 видов. Все обнаруженные виды являются типичными обитателями морских и пресных вод.
Таблица 1.
Таксоны и виды гетеротрофных жгутиконосцев
| Таксон | Вид или форма |
|---|---|
| Chrysophyceae (Pascher, 1914) | Paraphysomonas imperforata (Lucas, 1967) Siphomonas fritschii (Pringcheim, 1946) Spumella cylindrica (Skuja, 1956) S. minuta S. major (Scuja, 1956) S. vivipara (Ehrenb.) (Pascher, 1912) Spumella sp. 1 Spumella sp. 2 Stokesiella longipes (Stokes, 1888) (Lemmermann, 1910) |
| Kinetoplastea (Honigberg, 1963) | Bodo curvifilis (Griessmann, 1913) B. designis (Skuja, 1948) B. saltans (Ehrenberg, 1832) Bodo sp. |
| Cercomonadida (Poche, 1913), (emend. Vickerman, 1983), (emend. Mylnikov, 1986) | Bodomorpha globosa (Stein, 1878) B. minima (Hollande, 1942) (Mylnikov and Karpov, 2004) Protaspis simplex (Vørs, 1992) Cercomonas sp. |
| Choanomonada (Kent, 1880) | Monosiga marina (Paasche, 1961) Salpingoeca minor (Dangeard, 1910) S. pixidium (Kent, 1880) |
| Bicosoecida (Grassé, 1926), (emend. Karpov, 1998) | Bicosoeca campanulata (Lackey, 1942) (Bourrelly, 1953) B. conica (Lemmermann, 1914) Cafeteria roenbergensis (Fenchel and Patterson, 1988) |
| Euglenida (Bütschli, 1884), emend. Simpson, 1997 | Peranema sp. |
| Dictyochophyceae (Silva, 1980) | Actinomonas mirabilis (Kent, 1880) |
| Colpodellida (Cavalier-Smith, 1993) (emend. Adl et al., 2005) | Colpodella angusta (Dujardin, 1841) (Simpson and Patterson, 1996) |
| Incertae sedis EUKARYOTA | Ancyromonas sigmoides (Kent, 1880) Amastigomonas debruynei (De Saedeleer, 1931) Massisteria marina (Larsen and Patterson, 1990) |
В среднем в одной пробе отмечалось 3.1 вида, что свидетельствует о низком уровне альфа-разнообразия сообщества. Максимальное число видов (8) было зарегистрировано в солоноватоводной рипали рук. Котьен (ст. 41, 0.18 PSU). Наиболее часто (более чем в 30% проб) встречались Cafeteria roenbergensis и Spumella sp. 1. Однако основу разнообразия составляли редкие виды, частота встречаемости которых не превышала 20%. Они составляли 85.5% всех идентифицированных видов. Некоторые организмы были обнаружены только в одной пробе – это Actinomonas mirabilis, Bodomorpha minima, Bicosoeca campanulata, Bodo curvifilis, Cercomonas sp., Monosiga marina, Massisteria marina, Salpingoeca pixidium и Protaspis simplex. Наибольшее число таких видов (3) отмечено на солоноватоводном участке рук. Котьен.
Большинство идентифицированных в дельте Меконга жгутиконосцев по типу питания относились к бактерио-детритофагам. Были обнаружены также один вид-эврифаг (Paraphysomonas imperforata) и один хищный вид (Colpodella angusta).
Численность, средний объем клеток и биомасса гетеротрофных нанофлагеллят изменялись в широких пределах: от 214 до 3631 (в среднем, 1390 ± ± 681) кл/мл (рис. 4а), от 13.2 до 242.0 (в среднем, 46.5 ± 36.0) мкм3 и от 5.1 до 413.6 (в среднем, 64.8 ± ± 62.3) мг/м3 (рис. 4б) соответственно. Максимальное значение численности нанофлагеллят зарегистрировано в медиали пресноводного участка рук. Котьен, биомассы – в рипали пресноводного участка рук. Хамлуонг. На последнем участке биомасса жгутиконосцев существенно превышала значения этого параметра на других участках, поскольку здесь был обнаружен крупный пресноводный вид Peranema sp., размеры которого составляли 38 × 11 мкм. На других участках реки линейные размеры гетеротрофных нанофлагеллят не превышали 9 мкм. Минимальные значения их численности и биомассы зарегистрированы в солоноватых водах рук. Котьен.
Рис. 4.
Общая численность (а) и биомасса (б) гетеротрофных флагеллят, и общая численность (в) и биомасса (г) фототрофных флагеллят. Обозначения участков реки, как на рис. 2.

Учитывали два размерных класса гетеротрофных нанофлагеллят: мелких (2–5 мкм) и крупных (>5 мкм). Численность мелких флагеллят значительно превышала таковую крупных флагеллят: первые составляли, в среднем, (81 ± 13%) их общей численности. Вклад мелких и крупных организмов в формирование общей биомассы был примерно одинаковым: в среднем 52.2 и 47.8% соответственно (рис. 3б).
Фототрофные флагелляты. Фототрофные флагелляты встречались не на всех участках рукавов Меконга: они не были зарегистрированы на 8 пресноводных и 4 солоноватоводных станциях. Там, где они были обнаружены, их численность изменялись от 107 до 534 кл/мл, биомасса – от 5 до 115 мг/м3 (рис. 4в и 4г). Максимальная численность фитофлагеллят зарегистрирована в рипали солоноватоводного участка рук. Котьен, биомасса – в рипали пресноводного участка рук. Хамлуонг. Линейные размеры фототрофных флагеллят находились в пределах 3–30 мкм, объем их клеток в среднем оказался в 3.2 раза больше такового гетеротрофных флагеллят. Однако биомасса фитофлагеллят на большинстве участках рукавов была ниже биомассы гетеротрофных флагеллят и составляла, в среднем, 31.5% суммарной биомассы фототрофных и гетеротрофных флагеллят.
Суммарная биомасса планктонного микробного сообщества (гетеротрофных бактерий, пикофитопланктона, гетеротрофных и фототрофных флагеллят) в дельте Меконга изменялась в пределах 954–3267 (в среднем, 1860 ± 444) мг/м3 или 215–558 (в среднем, 364 ± 69) мг С/м3 (рис. 3в). Большую ее часть занимали бактерии: на разных участках рукавов от 40.1 до 90.5%, а, в среднем, 73.8 ± 11.4%. Вклад пикофитопланктона, гетеротрофных и фототрофных флагеллят составил, в среднем, 20.5 ± 10.6, 3.9 ± 3.3 и 1.9 ± 1.7% соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Количество бактериопланктона в дельте Меконга в начале сухого сезона достигало значений, характерных для эвтрофных, а его биомасса – для гипертрофных вод (Копылов, Косолапов, 2007). Большие размеры бактерий и значительная доля в сообществе очень крупных бактерий, обусловлены, по-видимому, мощным хроническим загрязнением и эвтрофированием этой тропической реки. Размеры гетеротрофных бактерий существенно зависят от концентрации и состава органических веществ в окружающей среде, и обычно их клетки достигают крупных размеров в богатых субстратами и биогенными элементами водах.
Соленость воды – один из ведущих абиотических факторов, влияющих на развитие гидробионтов, и распределение последних в устьевых участках рек в значительной степени определяется градиентом солености (Cloern et al., 2017). Ранее при изучении эстуариев было показано, что количество, структура и динамика бактериопланктона отличаются в их пресноводной и солоноватоводной частях (Selje, Simon, 2003; Crump et al., 2004; Li et al., 2017). Обычно численность бактериопланктона выше на пресноводных участках эстуариев, что обусловлено тем, что загрязненные речные воды по мере приближения к устью разбавляются более чистой морской водой.
В начале сухого сезона, когда проводились наши исследования, и морские воды поднимались примерно на 25 км от устья Меконга, показатели количественного развития гетеротрофного бактериопланктона и пикофитопланктона на пресноводных и солоноватоводных участках рукавов отличались незначительно. Вероятно, такой равномерный характер распределения микроорганизмов, связан с постоянным перемешиванием воды и донных отложений из-за быстрого течения и влияния приливов и отливов, постоянной температурой, высокой мутностью и повсеместным мощным загрязнением. Ранее при изучении бактериопланктона крупнейшего в США эстуария – Чесапикского залива было показано, что сезонные флуктуации и пространственное распределение бактериальных популяций во многом отражали колебания таких факторов окружающей среды, как соленость и температура воды. Несмотря на резкие градиенты этих и других факторов, в каждый из сезонов года бактериальное сообщество залива было гомогенным, тогда как сезонные различия были существенными (Kan et al., 2007). В мелководном заливе Ионического моря (Греция), испытывающего антропогенное влияние, сезонные изменения состава бактериопланктона проявлялись более резко, чем пространственные, и распределение бактерий в разные сезоны было однородным (Meziti et al., 2015).
В соответствии с концепцией относительности и множественности зон барьерных соленостей (Аладин, Плотников, 2013) в рукавах дельты Меконга можно выделить две основные зоны: пресноводную (<2‰) и солоноватоводную (5–8‰) и две переходные: пресноводную-солоноватоводную (2–5‰) и солоноватоводную-морскую (>8‰). Причем основная солоноватоводная зона соответствует зоне критической солености, которая представляет собой экологический и эволюционный барьер, при переходе через который меняется ряд важных свойств на разных уровнях биологической организации и где происходят нелинейные изменения скоростей и направлений абиотических и биотических процессов. Здесь же проходит граница распространения пресноводной и морской фауны (Telesh, Khlebovich, 2010).
В устье Меконга численность и биомасса гетеротрофных микроорганизмов были минимальными в основной солоноватоводной зоне (критической солености), а фототрофных – в переходной солоноватоводной-морской (табл. 2). Максимальное количественное развитие пикофитопланктона и фитофлагеллят отмечалось в пресноводной-солоноватоводной зоне. Численность и биомасса гетеротрофных жгутиконосцев возрастали в пресноводной и пресноводной-солоноватоводной зонах. Минимальные значения этих параметров характерны для зоны критической солености. В результате в этой зоне оказалась наименьшей общая биомасса микробного сообщества, а наибольшей она была в пресноводной-солоноватоводной зоне.
Таблица 2.
Численность (N) и биомасса (В) различных групп микроорганизмов и общая биомасса микробного сообщества (В∑) в разных соленостных зонах дельты р. Меконг
| Зона | Соленость, ‰ | Гетеротрофные бактерии |
Пикофитопланктон | Гетеротрофные флагелляты |
Фототрофные флагелляты |
В∑, мг С/м3 |
||||
|---|---|---|---|---|---|---|---|---|---|---|
| N, 106 кл/мл |
В, мг/м3 |
N, 103 кл/мл |
В, мг/м3 |
N, кл/мл |
В, мг/м3 |
N, кл/мл |
В, мг/м3 |
|||
| Пресноводная | <2 | 7.95 ± ± 1.12* | 1377 ± ± 507 | 212 ± ± 89 | 364 ± ± 184 | 1572 ± ± 678 | 69.2 ± ± 69.3 | 161 ± ± 134 | 32.0 ± ± 30.5 | 363 ± ± 71 |
| Пресноводная-солоноватоводная | 2–5 | 8.34 ± ± 1.50 | 1586 ± ± 476 | 273 ± ± 120 | 403 ± ± 189 | 1282 ± ± 446 | 72.1 ± ± 36.2 | 257 ± ± 162 | 48.0 ± ± 35.7 | 408 ± ± 60 |
| Солоноватоводная | 5–8 | 6.93 ± ± 0.51 | 1190 ± ± 371 | 234 ± ± 87 | 352 ± ± 152 | 662 ± ± 324 | 36.0 ± ± 31.3 | 175 ± ± 128 | 27.6 ± ± 17.3 | 316 ± ± 53 |
| Солоноватоводная-морская | >8 | 7.91 ± ± 0.62 | 1689 ± ± 341 | 226 ± ± 103 | 288 ± ± 132 | 801 ± ± 185 | 52.8 ± ± 49.9 | 54 ± ± 107 | 15.2 ± ± 30.4 | 381 ± ± 65 |
Пространственно-временная изменчивость микробных сообществ в эстуариях и дельтах рек зависит от взаимодействия многих одновременно действующих факторов, наиболее важными из которых, кроме солености, являются концентрация растворенных и взвешенных органических веществ, соединений биогенных элементов и кислорода, температура, активность консументов и вирусов-бактериофагов (Findlay et al., 1992; Crump et al., 2004; Li et al., 2017). Для фотосинтезирующих микроорганизмов важна также освещенность. Все эти факторы в значительной степени определяются гидрологическими и метеорологическими условиями. На распределение микроорганизмов в дельте Меконга также оказывает влияние перераспределение стока по рукавам. Наиболее активны в современный период северные рукава (Кыатьеу, Митхо, Балай), в которых активно идут русловые процессы, чему способствует высокая скорость течения. При продвижении к югу, рукава теряют свою активность (Михайлов, Аракельянц, 2010), в них снижаются скорости течения, повышается прозрачность и увеличивается риск “цветения” воды фитопланктоном. По всей видимости, это связано с уменьшением транспортирующей способности реки.
Биомасса пикофитопланктона обычно возрастает в градиенте трофии, тогда как ее вклад в формирование общей биомассы морского и пресноводного фитопланктона уменьшается (Bell, Kalff, 2001). Это связано с тем, что маленькие размеры и высокое отношение площади поверхности к объему клеток позволяют пикопланктону выигрывать конкуренцию за биогенные элементы у крупноразмерного фитопланктона и доминировать в олиготрофных водах. Однако пикопланктон, представленный прокариотными цианбактериями и эукариотными водорослями, может быть также главным компонентом фитопланктона в продуктивных эстуариях и прибрежных морских районах (Tsai et al., 2010). Отношение биомасс гетеротрофного и фототрофного компонентов пикопланктона в градиенте трофии уменьшается: автотрофные компоненты вносят больший вклад в формирование биомассы пикопланктона в мезо- и эвтрофных водах, тогда как гетеротрофные – в олиготрофных (Santiс et al., 2014).
Биомасса гетеротрофного бактериопланктона в дельте Меконга отрицательно коррелировала с численностью (r = –0.316) и биомассой (r = –0.448) пикофитопланктона, что свидетельствует как о возможных конкурентах взаимоотношениях между этими группами микроорганизмов, так и о том, что их развитие могут контролировать разные факторы.
Исследования, проведенные в эстуарии р. Чжуцзян (Китай), выявили существенные различия в динамике гетеротрофных бактерий и пикоцианобактерий на пресноводных и солоноватоводных участках в сухой и влажный сезоны (Li et al., 2017). Количество как пикоцианобактерий, в составе которых доминировали Synechococcus spp., так и гетеротрофных бактерий, возрастало во влажный сезон. Ключевым фактором формирования структуры бактериопланктона была соленость.
В дельте Меконга численность и биомасса гетеротрофного бактериопланктона были наименее вариабельными параметрами (CV = 14.1 и 34.6% соответственно) по сравнению с таковыми пикофитопланктона (41.3 и 48.7%), гетеротрофных (49.0 и 96.2%) и фототрофных (84.4 и 96.6%) жгутиконосцев. Известно, что бактерии являются наиболее стабильным компонентом биоты водоемов: таких резких, как у других групп гидробионтов, сезонных колебаний их количества не происходит, что свидетельствует об их устойчивости к изменению факторов окружающей среды и сбалансированности процессов их размножения и отмирания.
Разнообразие гетеротрофных нанофлагеллят в нижнем течении Меконга в начале сухого сезона было сравнительно невысоким: всего было идентифицировано 29 видов и форм из 8 крупных таксонов и группы неопределенного систематического положения. Численность и биомасса этих простейших, зарегистрированные в дельте Меконга, находятся в диапазоне этих параметров, определяемых в других морских и пресноводных экосистемах, в т. ч. в эстуариях рек, где их количество варьирует от <102 до >104 кл/мл, обычно достигая наибольших значений летом (McManus, Fuhrman, 1990; Huang et al., 2008; Tsai et al., 2010; Vargas et al., 2012).
Гетеротрофные нанофлагелляты являются основными потребителями бактерий и пикофитопланктона и представляют собой источник пищи для инфузорий и зоопланктона, тем самым, играя важную роль в переносе углерода пикопланктона на более высокие уровни трофических сетей (Sanders, Wickham, 1993). К бактериотрофам относятся в основном мелкие флагелляты, тогда как более крупные виды могут выедать значительную часть биомассы фитопланктона (Verity et al., 2002). Кроме бактерий и водорослей гетеротрофные нанофлагелляты могут использовать другие источники пищи, в частности, взвешенные и коллоидные органические вещества (Tranvik et al., 1993; Scherwass et al., 2005). Воды нижнего течения Меконга содержат большое количество органических и минеральных частиц, а большинство идентифицированных здесь видов гетеротрофных флагеллят относится к бактерио-детритофагам.
Количество и биомасса простейших в устьевых участках рек обычно уменьшаются по направлению к морю (McManus, Fuhrman, 1990; Rychert et al., 2014). В дельте Меконга общая численность гетеротрофных флагеллят, а также численность и биомасса мелких флагеллят отрицательно коррелировали с соленостью и положительно – с мутностью воды. Достоверных корреляционных связей общей биомассы флагеллят с этими абиотическими параметрами обнаружено не было, но знаки коэффициентов корреляции были такими же. Зависимости между количественными показателями гетеротрофных флагеллят, бактерий и пикофитопланктона не были выявлены. По-видимому, это связано с тем, что в окружающей водной среде одновременно действует множество факторов, влияющих на развитие микроорганизмов. Кроме гетеротрофных и миксотрофных флагеллят другие консументы, такие как, инфузории, используют в пищу как бактерий, так и флагеллят. Среди главных факторов, контролирующих пространственное распределение флагеллят в эстуариях, находятся соленость, температура, концентрация биогенных элементов и хлорофилла, количество пищевых объектов и активность консументов (McManus, Fuhrman, 1990; Huang et al., 2008; Tsai et al., 2010; Vargas et al., 2012; Rychert et al., 2014).
Отношение численности бактерий к численности гетеротрофных флагеллят изменялось на разных участках в нижнем течении Меконга от 1709 до 31563 (в среднем, 7375 ± 4781). Биомасса гетеротрофных флагеллят составляла 0.75–26.44% (в среднем, 5.31 ± 5.30%) биомассы бактериопланктона и 0.44–19.83% (в среднем.3.85 ± 3.52%) суммарной биомассы бактерио- и пикофитопланктона. Это свидетельствует о хорошей обеспеченности жгутиконосцев пищевыми объектами, которые, по-видимому, не лимитировали их развитие. Вероятно, помимо абиотических факторов, важную роль в контроле гетеротрофных флагеллят в дельте Меконга играют инфузории и многоклеточный зоопланктон (контроль “сверху”). При этом надо учитывать, хотя гетеротрофные флагелляты избирательно выедают крупных и активных бактерий, самых крупных палочек и нитей, которые составляют заметную часть бактериопланктона в дельте Меконга, большинство флагеллят не способно использовать в пищу.
В прибрежных морских водах более половины общего количества нанофлагеллят могут составлять фототрофные организмы (Hall et al., 1993; Tsai et al., 2011; Vargas et al., 2012). Хотя не все из них способны к фаготрофии, т.е. являются миксотрофами, последние могут вносить существенный, иногда основной вклад в потребление бактерий (Nygaard, Tobiesen, 1993; Unrein et al., 2007; Tsai et al., 2011). Так, фитофлагелляты были ответственны за 86% потребления бактерий всеми флагеллятами в верхнем слое водной толщи зал. Орхус (Дания) (Havskum, Riemann, 1996).
В дельте Меконга фитофлагелляты были минорным компонентом микробного сообщества: их вклад в формирование общей микробной биомассы не превышал 6.0%, а в среднем, оказался равным 1.9%. Биомасса фототрофных флагеллят составляла, в среднем, 31.5% общей биомассы флагеллят и была больше биомассы гетеротрофных флагеллят только на 20% исследованных участков, в основном пресноводных.
***
Количество и распределение планктонных микроорганизмов в устьевой области р. Меконг зависит, в первую очередь, от гидрологических условий, а именно: стока реки и проникновения морских вод. В начале сухого сезона 2018 г. большая часть дельты находилась под влиянием пресных речных вод, и бактерии и другие микроорганизмы достигали высоких значений численности и биомассы. Это предполагает, что значительная часть потока углерода в этой тропической загрязненной экосистеме проходит через микробную петлю, представляющую собой важное связующее звено между первичными продуцентами и верхними уровнями планктонных трофических сетей. Дельта Меконга характеризовалась равномерным распределением микроорганизмов: значительных различий между пресными и солоноватыми участками обнаружено не было, что обусловлено быстрым течением, влиянием приливов и отливов, постоянной и высокой температурой, большой мутностью, действующим повсеместно мощным антропогенным воздействием. Флагелляты были в достаточной степени обеспечены своей основной пищей – пикопланктоном, и, по-видимому, их развитие, кроме гидрологических факторов, контролировалось “сверху” консументами. Дальнейшее изучение распространения, динамики, разнообразия и взаимоотношений микроорганизмов позволит оценить их значение в структурно-функциональной организации устьевых участков тропических рек и прогнозировать их реакции на антропогенные воздействия и климатические изменения.
Финансирование. Работа выполнена в рамках государственного задания № 121051100102-2. Экспедиционные исследования в устьевой зоне р. Меконг проведены при финансовой и организационной поддержке Совместного Российско-Вьетнамского тропического центра.
Список литературы
Аладин Н.В., Плотников И.С. Концепция относительности и множественности зон барьерных соленостей и формы существования гидросферы // Тр. Зоол. ин-та. РАН. 2013. Прил. № 3. С. 7–21.
Жуков Б.Ф. Атлас пресноводных гетеротрофных жгутиконосцев (биология, экология, систематика). Рыбинск: Дом печати, 1993. 160 с.
Копылов А.И., Косолапов Д.Б. Микробиологические индикаторы эвтрофирования пресных вод // Биоиндикация в мониторинге пресноводных экосистем. Сборник материалов Межд. конф. / СПб.: Изд-во “Лема”, 2007. С. 176–181.
Михайлов В.Н., Аракельянц А.Д. Особенности гидрологических и морфологических процессов в устьевой области р. Меконг // Водн. рес. 2010. Т. 37. № 3. С. 259–273.
Alongi D.M., Dixon P., Johnston D.J. et al. Pelagic processes in extensive shrimp ponds of the Mekong delta, Vietnam // Aquaculture. 1999. V. 175. P. 121–141.
Asta M.P., Wang Y., Frutschi M. et al. Microbially mediated release of As from Mekong Delta peat sediments // Environ. Sci. Technol. 2019. V. 53. № 17. P. 10208–10217.
Bell T., Kalff J. The contribution of picophytoplankton in marine and freshwater systems of different trophic status and depth // Limnol. Oceanogr. 2001. V. 46. P. 1243–1248.
Borsheim K.Y., Bratbak G. Cell volume to carbon conversion factors for a bacterivorous Monas sp. enriched from seawater // Mar. Ecol. Prog. Ser. 1987. V. 36. P. 171–175.
Callieri C. Single cells and microcolonies of freshwater picocyanobacteria: a common ecology // J. Limnol. V. 69. 2010. P. 257–277.
Caron D.A. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy, and comparison with other procedures // Appl. Environ. Microbiol. 1983. V. 46. № 2. P. 491–498.
Cloern J.E., Jassby A.D., Schraga T.S. et al. Ecosystem variability along the estuarine salinity gradient: Examples from long-term study of San Francisco Bay // Limnol. Oceanogr. 2017. V. 62. № S1. P. S272–S291.
Crump B.C., Hopkinson C.S., Sogin M.L., Hobbie J.E. Microbial biogeography along an estuarine salinity gradient: combined influences of bacterial growth and residence time // Appl. Environ. Microbiol. 2004. V. 70. P. 1494–1505.
Falkowski P.G., Fenchel T., DeLong E.F. The microbial engines that drive Earth’s biogeochemical cycles // Science. 2008. V. 320. P. 1034–1039.
Findlay S., Pace M.L., Lints D., Howe K. Bacterial metabolism of organic carbon in the tidal freshwater Hudson Estuary // Mar. Ecol. Prog. Ser. 1992. V. 89. P. 117–153.
Gasol J.M., del Giorgio P.A., Duarte C.M. Biomass distribution in marine planktonic communities // Limnol. Oceanogr. 1997. V. 42. № 6. P. 1353–1363.
Hall J.A., Barrett D.P., James M.R. The importance of phytoflagellate, heterotrophic flagellate and ciliate grazing on bacteria and picophytoplankton sized prey in a coastal marine environment // J. Plankton Res. 1993. V. 15. P. 1075–1086.
Havskum H., Riemann B. Ecological importance of bacterivorous, pigmented flagellates (mixotrophs) in the Bay of Aarhus, Denmark // Mar. Ecol. Prog. Ser. 1996. V. 137. P. 251–263.
Huang B., Lan W., Cao Z. et al. Spatial and temporal distribution of nanoflagellates in the northern South China Sea // Hydrobiologia. 2008. V. 605. P. 143–157.
Kan J., Suzuki M.T., Wang K. et al. High temporal but low spatial heterogeneity of bacterioplankton in the Chesapeake Bay // Appl. Environ. Microbiol. 2007. V. 73. № 21. P. 6776–6789.
Le H.P., Le T.K., Nguyen T.P.O. Isolation and characterization of carbendazim-degrading bacteria in rice paddy soil in Can Tho, Vietnam // Int. J. Adv. Res. 2017. V. 5. № 6. P. 863–870.
Li J., Jiang X., Jing Z. et al. Spatial and seasonal distributions of bacterioplankton in the Pearl River Estuary: The combined effects of riverine inputs, temperature, and phytoplankton // Mar. Pollut. Bull. 2017. V. 125. P. 199–207.
Maclsaac E.A., Stockner J.G. Enumeration of phototrophic picoplankton by autofluorescence microscopy // Handbook of methods in aquatic microbial ecology / Eds Kemp P.F. et al. Boca Raton: Lewes Publishers, 1993. P. 187–197.
McManus G.B., Fuhrman J.A. Mesoscale and seasonal variability of heterotrophic nanoflagellate abundance in an estuarine outflow plume // Mar. Ecol. Prog. Ser. 1990. V. 61. P. 207–213.
Meziti A., Kormas K.A., Moustaka-Gouni M., Karayanni H. Spatially uniform but temporally variable bacterioplankton in a semi-enclosed coastal area // Syst. Appl. Microbiol. 2015. V. 38. P. 358–367.
Norland S. The relationship between biomass and volume of bacteria // Handbook of methods in aquatic microbial ecology / Eds Kemp P.F. et al. Boca Raton: Lewis Publishers, 1993. P. 303–308.
Nygaard K., Tobiesen A. Bacterivory in algae: A survival strategy during nutrient limitation // Limnol. Oceanogr. 1993. V. 38. № 2. P. 273–279.
Ozaki H., Co T.K., Le A.K. et al. Human factors and tidal influences on water quality of an urban river in Can Tho, a major city of the Mekong Delta, Vietnam // Environ. Monit. Assess. 2014. V. 186. P. 845–858.
Pomeroy L.R., Williams P.J.leB., Azam F., Hobbie J.I. The microbial loop // Oceanography. 2007. V. 20. № 2. P. 28–33.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943–948.
Rychert K. Kownacka J. Wielgat-Rychert M. Pluto-Prądzyńska A. Protozoan communities in the Vistula River estuary (Baltic Sea) // J. Ecol. Prot. Coastline. 2014. V. 18. P. 39–53.
Sanders R.W. Trophic strategies among heterotrophic flagellates // The biology of free-living heterotrophic flagellates. Oxford: Clarendon Press, 1991. P. 21–38.
Sanders R.W., Wickham S.A. Planktonic protozoa and metazoan: predation, food quality and population control // Mar. Microb. Food Webs. 1993. V. 7. № 2. P. 121–256.
Šantic D., Šestanovic S., Šolic M. et al. Dynamics of picoplankton community from coastal waters to the open sea in the Central Adriatic // Medit. Mar. Sci. 2014. V. 15. № 1. P. 179–188.
Scherwass A., Fischer Y., Arndt H. Detritus as a potential food source for protozoans: utilization of fine particulate plant detritus by a heterotrophic flagellate, Chilomonas paramecium, and a ciliate, Tetrahymena pyriformis // Aquat. Ecol. 2005. V. 39. P. 439–445.
Selje N., Simon M. Composition and dynamics of particle-associated and free-living bacterial communities in the Weser estuary, Germany // Aquat. Microb. Ecol. 2003. V. 30. P. 221–237.
Telesh I.V., Khlebovich V.V. Principal processes within the estuarine salinity gradient: A review // Mar. Pollut. Bull. 2010. V. 61. P. 149–155.
Tranvik L.J., Sherr E.B., Sherr E.F. Uptake and utilization of “colloidal DOM” by heterotrophic flagellates in seawater // Mar. Ecol. Prog. Ser. 1993. V. 92. P. 301–309.
Tsai A.Y., Gong G.C., Sanders R.W. et al. The impact of the Changjiang River plume extension on the nanoflagellate community in the East China Sea // Estuar. Coast. Shelf Sci. 2010. V. 89. P. 21–30.
Tsai A.Y., Gong G.C., Sanders R.W. et al. Importance of bacterivory by pigmented and heterotrophic nanoflagellates during the warm season in a subtropical Western Pacific coastal ecosystem // Aquat. Microb. Ecol. 2011. V. 63. P. 9–18.
Unrein F., Massana R., Alonso-Saez L., Gasol J.M. Significant year-round effect of small mixotrophic flagellates on bacterioplankton in an oligotrophic coastal system // Limnol. Oceanogr. 2007. V. 52. P. 456–469.
Vargas C.A., Contreras P.Y., Iriarte J.L. Relative importance of phototrophic, heterotrophic, and mixotrophic nanoflagellates in the microbial food web of a river-influenced coastal upwelling area // Aquat. Microb. Ecol. 2012. V. 65. P. 233–248. https://doi.org/10.3354/ame01551
Verity P.G., Wassmann P., Frischer M.E. et al. Grazing of phytoplankton by microzooplankton in the Barents Sea during early summer // J. Mar. Syst. 2002. V. 38. P. 109–123. https://doi.org/10.1016/S0924-7963(02)00172-0
Vørs N. Heterotrophic amoebae, flagellates and Heliozoa from the Tvärminne Area, Gulf of Finland, in 1988–1990 // Ophelia. 1992. V. 36. № 1. P. 1–109.
Wada M., Mori F. Yokouchi K. et al. Comparison of planktonic microbial abundance and dissolved oxygen consumption between the aquaculture ponds of mudskippers and shrimps in the Mekong Delta, southern Vietnam // Fish Sci. 2016. V. 82. P. 787–797.
Weisse T. Dynamics of autotrophic picoplankton in marine and freshwater ecosystems // Adv. Microb. Ecol. 1993. V. 13. P. 327–370.
Wilbers G.-J., Becker M., Nga L.T. et al. Spatial and temporal variability of surface water pollution in the Mekong Delta, Vietnam // Sci. Total Environ. 2014. V. 485–486. P. 653–665.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


