Известия РАН. Серия биологическая, 2022, № 4, стр. 412-426
Гормоны поджелудочной железы, состав насыщенных жирных кислот и их взаимосвязь с уровнем глюкозы в зависимости от индекса массы тела у жителей Арктики
Ф. А. Бичкаева 1, Т. Б. Грецкая 1, *
1 ФГБУН ФИЦ комплексного изучения Арктики им. академика Н.П. Лаверова УрО РАН
163001 Архангельск, ул. Ломоносова, 249, Россия
* E-mail: tatyana-rab@yandex.ru
Поступила в редакцию 17.11.2020
После доработки 03.07.2021
Принята к публикации 03.07.2021
- EDN: LFSLUD
- DOI: 10.31857/S1026347022030040
Аннотация
Изучено содержание гормонов поджелудочной железы, состав насыщенных жирных кислот (НЖК) и их взаимосвязь с уровнем глюкозы (Глю) в зависимости от индекса массы тела (ИМТ) у аборигенного (А) и местного европеоидного населения (МЕ) Арктики. У МЕ населения с ИМТ 18.4 < ИМТ < 25 кг/м2 выявлены высокое содержание средне- и длинноцепочечных НЖК, величины Caro, проинсулин/инсулин и низкий уровень короткоцепочечных НЖК, инсулина (Инс), величины HOMA (р < 0.001), что свидетельствует о более высоких гипергликемических состояниях по сравнению с А. В содержании С-пептида у А значимых изменений не установлено, а у МЕ его содержание значимо повышается при повышении ИМТ. Изучение данных показателей у лиц с ИМТ > 25 кг/м2 разной этнической принадлежности показало аналогичную картину, но с большей степенью выраженности.
Избыточная масса и ожирение являются одной из значимых проблем современного здравоохранения, распространенность которых обусловлена изменением образа жизни (увеличением потребляемых с пищей калорий), снижением уровня физической активности, социальными (алкоголь, стресс, курение и др.) и демографическими факторами (пол, возраст) (Коробицын, Иванова, 1996; Tchernof, Després, 2013). В настоящее время в Российской Федерации, как и во многих странах мира, отмечен рост распространения избыточной массы тела (ИзМТ) и ожирения среди взрослого и детского населения. Так, в России ~60% как городского, так и сельского населения старше 30 лет имеет излишний вес, а ~25% страдает ожирением, что. по данным ВОЗ, соответствует показателям других стран (Козлов и др., 2011). Так, популяционными исследованиями доказано, что у латиноамериканского населения выявлен самый высокий риск ожирения по сравнению с европейским, афроамериканским и азиатским населением (Tchernof, Després, 2013). Полученные данные свидетельствуют о том, что частота встречаемости ИзМТ и ожирения (62.7%) у обследованных лиц, проживающих в условиях Арктики выше (57.3%), чем, в среднем, по стране (Батурин и др., 2017). В свою очередь, ожирение является результатом непропорционально высокого поступления наиболее энергоемких материалов (углеводов и жиров) по сравнению с их расходом и вызвано нерациональным питанием и, как следствие, изменением метаболизма, закрепленного на генетическом уровне у аборигенного населения Арктики (Когай и др., 2008; Батурин и др., 2017). Вместе с тем показано, что более высокое потребление насыщенных жиров, особенно длинноцепочечных, с одной стороны, связано с повышенным риском сахарного диабета (СД), дислипидемии, сердечно-сосудистых заболеваний и др. (Volk et al., 2014). А с другой, действует как стрессорный фактор на метаболизм как целого организма, так и отдельных органов, включая печень, мышцы и поджелудочную железу (ПЖ), что приводит к инсулинорезистентности (ИР), т.е. повышение содержания циркулирующих насыщенных жирных кислот (НЖК) в крови и развитие ИР ассоциировано с избыточной массой тела и ожирением (Figueiredo et al., 2017). Действительно, экспериментальные исследования на грызунах показали, что введение в их питание определенных видов ЖК (повышение ненасыщенных и снижение насыщенных) заметно улучшает действие инсулина (Инс), подавляя при этом синтез глюкозы (Глю) (Казначеев, 1980а; Наследов, 2008; Jumpertz et al., 2012; Дудинская и др., 2014; Смирнова, 2016). При этом исследования на дельфинах с высоким содержанием насыщенных жиров в рационе, наоборот, подтвердили повышение уровней Инс и Глю, как и у людей, тогда как у дельфинов, получавших модифицированную диету, – нормализацию уровней данных показателей (Baird et al., 2015). У лиц с высоким содержанием НЖК наблюдалась дисфункция β-клеток ПЖ, сопровождающаяся снижением Инс и повышением уровня Глю (Doliba et al., 2017), что обусловлено особенностями питания и нейрогуморальной регуляции (El-Azzouny et al., 2014). Следовательно, на увеличение массы тела и развитие ожирения могут оказывать влияние как состав употребляемых насыщенных жиров с пищей, так и соотношение их в крови (Arab et al., 2011; Hodson et al., 2018).
В настоящее время накоплен значительный материал о состоянии гомеостаза Глю и гормонов ПЖ у северян разных этнических групп (Догадин и др., 1996; Хаснулин, 1998). Однако взаимосвязь гормонов β-клеток ПЖ, НЖК с уровнем Глю в зависимости от индекса массы тела (ИМТ) у северян является мало изученной и имеет особую актуальность (Догадин и др., 1996; Хаснулин, 1998; Смирнова, 2016) поскольку роль гормонов ПЖ заключается не только в снижении уровня Глю в крови, но и в их антилиполитическом действии (Аметов, 2008). По данным ряда авторов, в условиях суровых климатических факторов Севера при “полярном метаболическом типе” снижение уровня Глю сопровождается понижением уровня Инс и повышением триглицеридов (ТГ) в крови как одного из энергоемких субстратов (Панин, 1978; Казначеев, 1980а; Miller et al., 1994; Догадин, 1996). При дезадаптации, наоборот, могут существенно повышаться одновременно содержание Глю и НЖК при низких уровнях Инс в крови (Хаснулин и др., 2014). Кроме того, исследования последних лет показали, что у коренных жителей Севера отмечены ранее не встречающиеся социально значимые заболевания (ожирение, СД2, артериальная гипертензия и др.), что является мало изученным (Панин, 1978; Смирнова, 2016). Следовательно, изучение предикторов развития социально значимых заболеваний у клинически здоровых северян имеет особую актуальность в виду наличия северной специфики эндокринно-метаболического профиля (Панин, 1978; Казначеев, 1980б; Хаснулин, 1998).
Цель исследования – изучить содержание гормонов ПЖ, состав НЖК (коротко-, средне- и длинноцепочечных) и их взаимосвязь с уровнем Глю в зависимости от ИМТ у аборигенного (А) (ненцы, коми) и местного европеоидного (МЕ) населения Арктики.
МАТЕРИАЛЫ И МЕТОДЫ
С 2009 по 2020 гг. выполнено поперечное исследование 1085 человек в возрасте от 20 до 74 лет, родившихся и постоянно проживающих в 15 арктических населенных пунктах Ямало-Ненецкого и Ненецкого автономного округа (ЯНАО и НАО), включающих 643 человек – аборигены (ненцы – 352 чел., коми – 291 чел.) и 442 человек – местное европеоидное (русское) население.
Рассматриваемое нами аборигенное население ненцев и коми, проживающих на севере России, отличается по длительности проживания: ненцы с конца II тысячелетия до н.э., относятся к самодийской этнической группе (Хлобыстин, 1969; Хомич, 1976; Васильев, 1979), популяция коми, относящаяся к угро-финской группе, превышает всего несколько столетий (Лащук, 1972). Самая молодая популяция представлена местным русским населением, предки которых проживают в Заполярье) – на протяжении нескольких поколений (Кушнер, 1960). Ранее считалось, что ненцы и коми представляют генетически закрепленный адаптивный “метаболический тип” к комплексу климатогеографических условий Крайнего Севера (Андронова, Неверова, 1969; Алексеева, 1986). В настоящее время в связи с изменением образа жизни (бытовые условия и ритм трудовой деятельности, структура питания) аборигенного населения было решено объединить ненцев и коми в одну группу, так как они формируют схожий метаболический адаптивный тип, отличающийся от местного европеоидного населения. В целях сравнения изучаемых показателей на современном этапе местное европеоидное население обследовалось в тех же поселках, что и аборигены.
Одновременно проводился опрос с заполнением стандартной анкеты (возраст, национальность пациента и их родителей, перенесенные заболевания, вредные привычки, питание, артериальное давление, антропометрические параметры и др.) и физикальным осмотром врача. На основании анамнестических и анкетных данных врач делал заключение о состоянии здоровья участников исследования. Применялись следующие критерии невключения в исследование – сердечно сосудистые заболевания и их осложнения, сахарный диабет, заболевания щитовидной железы, острые патологические состояния и обострение хронических болезней. Кроме того, в исследовании принимали участие коренные жители, ведущие “кочевой” образ жизни.
Исследование, получившее одобрение этического комитета, проведено согласно с этическими нормами Хельсинкской декларации Всемирной медицинской ассоциации 1964 г. (изменения и дополнения от 2013 г.). Участники исследования подписали форму согласия, утвержденную Комиссией по биомедицинской этике (научный совет Института физиологии природных адаптаций ФИЦКИА РАН).
При осмотре обследуемым измеряли длину тела и вес. Был рассчитан ИМТ по формуле: масса тела (кг)/рост тела (м2). Исходя из его значений, обследованные лица были поделены на три группы (Когай и др., 2008): первая группа (232 человек А и 142 МЕ) служила контролем и состояла из лиц с нормальной массой тела (18.0 < ИМТ < 24.9 кг/м2); вторая группа (207 человек А и 151 МЕ) включала лица с ИзМТ (25.0 < ИМТ < 29.9 кг/м2); третья группа (123 человек А и 92 МЕ) - с ожирением (ИМТ > 25 кг/м2).
Был проведен забор венозной крови натощак (с 800 до 1000). Кровь центрифугировали, отбирали сыворотку, фасовали в пробирки, замораживали при –80°С в жидком азоте и сохраняли ее до начала анализов. Определение спектра НЖК в сыворотке крови проводили в лаборатории биологической и неорганической химии ИФПА ФИЦКИА РАН г. Архангельска. Методом газожидкостной хроматографии на хроматографе Agilent 7890A с пламенно-ионизационным детектором на капиллярных колонках ВРХ-90 SGE (60 м–0.25 мм–0.25 мкм) после предварительной экстракции липидов и последующим получением метиловых эфиров ЖК определяли содержание следующих НЖК: короткоцепочечных (КЦ ЖК) – капроновой (С6:0), каприловой (С8:0), пеларгоновой (С9:0), каприновой (С10:0), ундециловой (С11:0); среднецепочечных (СЦ ЖК) -пентадекановой (С15:0), тридециловой (С13:0), миристиновой (С14:0), лауриновой (С12:0) и длинноцепочечных (ДЦ ЖК) – пальмитиновой (С16:0), маргариновой (С17:0), стеариновой (С18:0), арахиновой (С20:0), генэйкозановой (С21:0), бегеновой (С22:0), трикоциловой (С23:0), лигноцериновой (С24:0) кислот. Рассчитывали суммарные величины ∑НЖК, ∑КЦ ЖК, ∑СЦ ЖК и ∑ДЦ ЖК. Экстрагирование липидов и метилирование ЖК в сыворотке крови проводили методом (Бичкаева и др., 2019). Идентификацию ЖК осуществляли с использованием стандарта Nu-Chek Prep Ins 569 B (США), а количественный расчет ЖК проводили методом внутреннего стандарта С19:0 (нонадекановая кислота) в программе “Agilent Chem Station B.03.01” (США). Иммунно-ферментативным методом с помощью наборов “DRG Instruments GmbH” на планшетном анализаторе для ИФА (ELISYS Uno, Human GmbH, Германия) и фотометре Stat Fax 303 (США) в сыворотке крови определено содержание проинсулина (ПроИнс), Инс и С-пептида (С-пеп). Уровень Глю был измерен спектрофотометрическим методом на биохимическом анализаторе “ФУРУНО СА-270” (Япония) с использованием наборов Chronolab AG (Швейцария). Модель гомеостаза оценки инсулина (HOMA-IR) рассчитывали по формуле уровень глюкозы в сыворотке крови натощак (ммоль/л) * уровень инсулина натощак (МЕд/л)/22.5, а Сaro по формуле уровень глюкозы (ммоль/л)/инсулин (мкЕД/мл). Нормы изучаемых показателей представлены в табл. 1.
Таблица 1.
Содержание (Ме – 25; 75%) глюкозы и гормонов поджелудочной железы у А и МЕ населения с нормальной (ИМТ от 18 до 24.9 кг/м2) и избыточной (ИМТ от 25.0 до 29.9 кг/м2) массой тела, ожирением (ИМТ > 30.0 кг/м2)
| Показатели, норма | Этническая принадлежность | Индекс массы тела (ИМТ) | Статистическая значимость (Р) | |||
|---|---|---|---|---|---|---|
| М ± m; М (25; 75); мин, мак | ||||||
| норма (контрольная группа) 18–24.9 (1) | ИзМТ 25.0–29.9 (2) | ожирение >30.0 (3) | ||||
| n (человек) | А | 135 | 114 | 68 | между группами ИМТ | между аналогичными группами ИМТ А и МЕ |
| МЕ | 81 | 96 | 64 | |||
| Возраст | А | 38.0 (28; 50) 17/73 | 44.50 (33; 53) 20/77 | 49.0 (38; 55) 22/84 | 1-2 = 0.008 1-3 < 0.0012-3 = 0.073 | 1-1 < 0.001 2-2 = 0.024 3-3 = 0.006 |
| МЕ | 49.0 (40; 56.5) 16/83 | 48.0 (38; 56) 21/85 | 53.0 (45; 59.75) 24/78 | 1-2 = 0.788 1-3 = 0.019 2-3 = 0.007 | ||
| ИМТ | А | 22.77 (21.64; 23.87) 14.88/24.99 | 27.39 (26.15; 28.52) 24.46/30.3 | 31.67 (30.83; 32.89) 30.22/35.25 | 1-2 < 0.001 1-3 < 0.001 2-3 < 0.001 | 1-1 = 0.801 2-2 = 0.402 3-3 = 0.670 |
| МЕ | 22.58 (21.45; 23.75) 17.99/25 | 27.61 (26.62; 28.64) 25.06/30.47 | 31.60 (31.02; 32.63) 25.28/34.96 | 1-2 < 0.001 1-3 < 0.001 2-3 < 0.001 | ||
| Глю 3.9–6.1ммоль/л | А | 4.55 (3.97; 5.12) 2.71/6.25 | 4.46 (4.08; 5.1) 2.99/7.15 | 4.73 (4.25; 5.45) 3.36/7.22 | 1-2 = 0.964 1-3 = 0.041 2-3 = 0.041 | 1-1 = 0.535 2-2 = 0.0043-3 = 0.076 |
| МЕ | 4.70 (3.96; 5.18) 2.98/6.29 | 4.87 (4.39; 5.55) 3.16/7.71 | 5.2 (4.6; 5.66) 2.9/6.94 | 1-2 = 0.040 1-3 = 0.0012-3 = 0.092 | ||
| Инс 2.1–22 мкЕд/мл | А | 6.96 (4.23; 13.47) 1.12/54.59 | 7.47 (4.12; 14.79) 1.49/34.43 | 7.99 (4.39; 12.9) 1.81/38.41 | 1-2 = 0.870 1-3 = 0.516 2-3 = 0.461 | 1-1 = 0.013 2-2 = 0.590 3-3 = 0.150 |
| МЕ | 4.98 (3.61; 9.0) 1.28/30.34 | 6.19 (4.62; 10.63) 2.1/30.32 | 9.23 (6.08; 14.17) 1.79/30.34 | 1-2 = 0.027 1-3 < 0.001 2-3 = 0.001 | ||
| ПроИнс 0.7–4.3 пмоль/л | А | 2.2 (1.42; 3.11) 0.21/31.97 | 2.33 (1.4; 3.44) 0.23/48.1 | 2.4 (1.6; 4.45) 0.23/10.58 | 1-2 = 0.648 1-3 = 0.314 2-3 = 0.546 | 1-1 = 0.493 2-2 = 0.394 3-3 = 0.501 |
| МЕ | 2.39 (1.6; 3.97) 0.22/25.46 | 2.42 (1.79; 3.22) 0.2/42.35 | 2.27 (1.8; 4.9) 0.31/15.8 | 1-2 = 0.563 1-3 = 0.201 2-3 = 0.646 | ||
| С-пеп 166–1059 пмоль/л | А | 515.63 (175.25; 809.73) 7.3/1814 | 429.87 (231.73; 834.78) 7.41/1714 | 435.78 (321.34; 688.87) 16.91/1358 | 1-2 = 0.846 1-3 = 0.840 2-3 = 0.662 | 1-1 = 0.959 2-2 = 0.030 3-3 = 0.001 |
| МЕ | 423.13 (289.82; 663.97) 24.46/1347.15 | 539.10 (439.24; 708.74) 266.78/1711.74 | 674.90 (532.42; 915.05) 273.37/1521 | 1-2 = 0.008 1-3 < 0.001 2-3 = 0.027 | ||
| НОМА >0.33 усл.ед. | А | 1.60 (0.86; 3.07) 0.17/14.11 | 1.53 (0.76; 3.22) 0.26/10.89 | 1.65 (0.85; 2.87) 0.28/11.26 | 1-2 = 0.893 1-3 = 0.552 2-3 = 0.369 | 1-1 = 0.014 2-2 = 0.965 3-3 = 0.093 |
| МЕ | 1.03 (0.62; 2.14) 0.21/9.11 | 1.36 (0.91; 2.48) 0.39/9.07 | 2.16 (1.32; 3.35) 0.45/8.15 | 1-2 = 0.017 1-3 < 0.001 2-3 = 0.003 | ||
| Caro <2.86 усл.ед. | А | 0.62 (0.37; 1.02) 0.11/3.7 | 0.65 (0.33; 1.06) 0.14/2.96 | 0.61 (0.33; 1.09) 0.12/2.86 | 1-2 = 0.888 1-3 = 0.811 2-3 = 0.814 | 1-1 = 0.004 2-2 = 0.169 3-3 = 0.278 |
| МЕ | 0.93 (0.52; 1.35) 0.17/3.28 | 0.71 (0.49; 1.1) 0.16/2.72 | 0.55 (0.35; 0.73) 0.17/3.18 | 1-2 = 0.046 1-3 < 0.001 2-3 = 0.003 | ||
| ПроИнс/Инс | А | 0.26 (0.14; 0.65) 0.01/4.15 | 0.34 (0.14; 0.69) 0.02/6.17 | 0.25 (0.13; 0.9) 0.02/4.81 | 1-2 = 0.506 1-3 = 0.822 2-3 = 0.837 | 3-3 = 0.027 2-2 = 0.536 3-3 = 0.980 |
| МЕ | 0.43 (0.21; 0.88) 0.04/1.95 | 0.41 (0.2; 0.59) 0.01/2.88 | 0.28 (0.15; 0.54) 0.02/2.88 | 1-2 = 0.362 1-3 = 0.034 2-3 = 0.012 | ||
Статистическую обработку данных проводили с помощью пакета программы SPSS 17.0. Критический уровень значимости считали равным p ≤ 0.05. Для большинства показателей в группах была выявлена асимметрия рядов распределения, поэтому использована непараметрическая обработка данных. Учитывались показатели: медиана (Ме), значения 25-го и 75-го перцентилей Me (25, 75%), медианы в группах сравнивались по U-критерию Манна–Уитни (Наследов, 2008).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В связи с тем, что одним из факторов развития ИР и СД2 является избыточная масса и ожирение (Майоров, 2011), то для начала целесообразно было провести оценку ИМТ. Установлено, что медиана значений ИМТ различных этнических групп населения Арктики с избыточной массой тела и ожирением не попадала в диапазон значений. Все три группы различные по ИМТ отличались по возрасту. При этом испытуемые с признаками избыточной массы тела и ожирения были старше по сравнению с контролем (табл. 1).
Оценивая интегральный показатель углеводного обмена, следует отметить, что уровень Глю у А (р1-2 = 0.209, р1-3 = 0.001) и МЕ (р1-2 = 0.016, р1-3 = 0.002) населения повышался с увеличением ИМТ, и у А населения у лиц 3-й группы относительно 2-й (р2-3 = 0.063). Сравнивая аналогичные по ИМТ группы А и МЕ населения, отмечены статистически значимо высокие уровни Глю во 2-й (р2-2 = 0.001) и 3-й (р3-3 = 0.050) группе у МЕ. Таким образом, независимо от этнической принадлежности у лиц, проживающих в Арктическом регионе, с увеличением ИМТ уровень Глю повышался, особенно у МЕ 2-й и 3-й группы.
Вместе с тем статистически значимых изменений в содержании Инс у А населения с увеличением ИМТ не установлено, а у МЕ, наоборот, оно повышалось как относительно контрольной группы (р1-2 = 0.07; р1-3 < 0.001), так и 2-й (р2-3 = 0.001). Кроме того, уровень Инс был значимо выше в контрольной группе у МЕ населения относительно А (р1-1 = 0.013). С увеличением ИМТ у лиц А населения частота встречаемости низких уровней Инс повышалась относительно МЕ населения (29.0, 35.4 и 34.3% против 52.0, 32.0 и 16.0%). Независимо от этнической принадлежности также процент лиц с превышением значений нормы Инс увеличивался у А населения с 9.0 до 16.4%, а у МЕ с 6.3 до 14.3%. Аналогичные изменения были установлены в отношении С-пеп, но в отличие от Инс, уровень С-пеп был значимо выше в 3-й группе МЕ населения (р1-3 = 0.024) относительно сходной по ИМТ группы А населения. При этом в отличие от Инс содержание С-пеп независимо от этнической принадлежности было смещено в группах в сторону высоких значений и у 19.3, 23.8 и 28.1% А населения и у 15.0, 20.0 и 20.5% МЕ населения превышали значения нормы. В содержании ПроИнс с увеличением ИМТ статистически значимых различий не установлено, но с увеличением ИМТ как А населения, так и у МЕ частота встречаемости высоких уровней ПроИнс увеличивались 19.0, 21.1 и 31.1% и 25.0, 17.6 и 34.0% соответственно. Следовательно, с повышением ИМТ уровни Инс и С-пептида значимо увеличивались у жителей Арктики, наиболее выраженно у МЕ 2-й и 3-й групп.
Индекс НОМА более точно выявляет ИР у лиц, имеющих нарушения в углеводном обмене, а индекс Caro более чувствителен при отсутствии изменений в углеводном статусе (Крючкова, Адамчик, 2009). Анализ Me значений НОМА показал, что с увеличением ИМТ у А и МЕ населения ее значения повышались аналогично Инс. Сходные изменения с увеличением ИМТ были установлены и в величине Caro у представителей МЕ, но ее величина, наоборот, в отличие от HOMA, статистически значимо снижалась. При сравнении аналогичных по ИМТ групп А и МЕ значимо выше его значение было в 1-й группе А (р1-1 = 0.014) на фоне низкого значения Caro (р1-1 = 0.004). Статистически значимых изменений в значениях НОМА и Caro у А населения с увеличением ИМТ не установлено. Несмотря на это, процент лиц с превышением нормы величины HOMA с увеличением ИМТ во всех группах А и МЕ был высоким и составил у А 40.0, 38.0 и 42.4% и 26.3, 35.5 и 54.0% у МЕ, а Caro, наоборот, низким у 17.3, 18.6 и 19.9% и 8.0, 10.7, 16.4% соответственно у А и МЕ, что говорит о скрытых у них нарушениях в гомеостазе Глю и риске развития СД2, особенно у А населения 1-й и 2-й группы. Таким образом, у МЕ населения по сравнению с А с увеличением ИМТ индекс НОМА значимо повышался, а Caro, наоборот, снижался, особенно у 2-1 и 3-й групп.
∑НЖК с увеличением ИМТ у А населения повышалось, но значимо в 3-й группе (р1-3 = 0.010) относительно 1-й, а у МЕ как с увеличением ИМТ (р1-3 = 0.009), так и у лиц 3-й группы, относительно 2-й (р2-3 = 0.018). Сравнивая аналогичные ИМТ группы А и МЕ населения установлено, что у МЕ населения ∑НЖК статистически было значимо выше во всех группах (р1-1 = 0.002, р2-2 = = 0.020, р3-3 = 0.034). Вместе с тем, превышающих норму ∑НЖК с увеличением ИМТ было высоким, как у А, так и МЕ, но значимо лишь в 3-й группе МЕ (35.0% против 48.0%, р = 0.05).
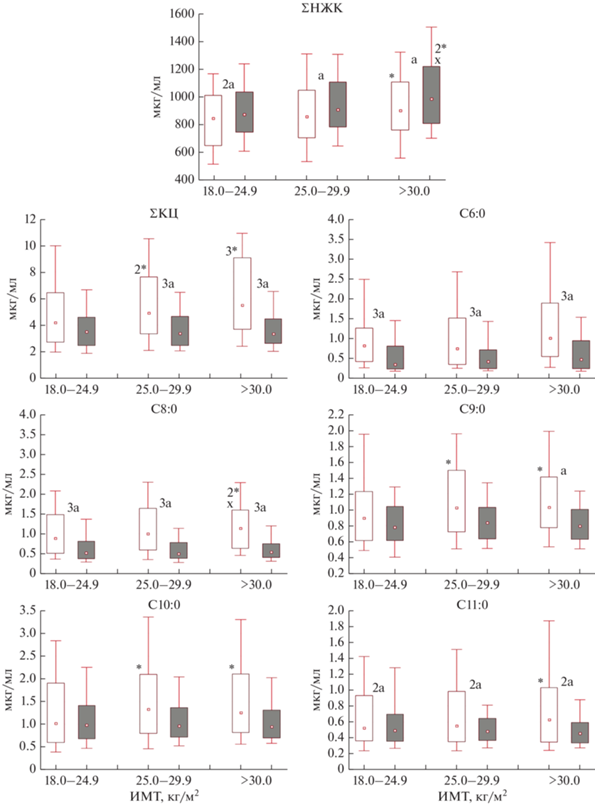
∑КЦ ЖК и индивидуальные их значения у А населения значимо повышались с увеличением ИМТ как относительно нормы, так и МЕ населения, способствуя увеличению синтеза ДЦ из КЦ ЖК, что, вероятно, связано с менее активным их использованием в качестве энергетического субстрата (рис. 1).
Рис. 1.
Содержание короткоцепочечных насыщенных жирных кислот (КЦ НЖК) в крови у практически
здоровых жителей А и МЕ населения Арктики с учетом ИМТ.  – диапозон колебаний 10 и 90 процентиль;
– диапозон колебаний 10 и 90 процентиль;  – диапозон колебаний 25 и 75 процентиль,
– диапозон колебаний 25 и 75 процентиль,  – медиана;
– медиана;  – аборигенное население (А);
– аборигенное население (А);  – местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * ×a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
– местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * ×a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
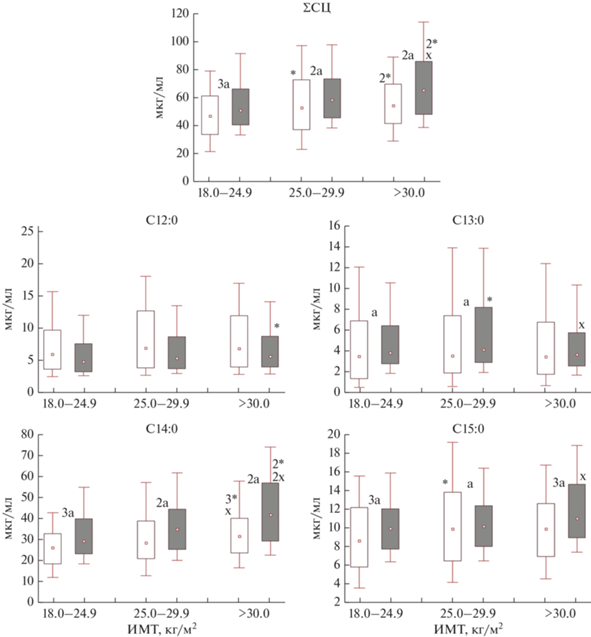
∑СЦ ЖК в крови с увеличением ИМТ у А населения повышались (р1-2 = 0.041, р1-3 = 0.002), а у МЕ населения было статистически значимо выше у лиц 3-й группы относительно 1-й (р1-3 = 0.005) и 2-й (р1-3 = 0.050). Следует отметить, что у МЕ во всех группах ИМТ были значимо выше аналогичных А населения (р1-1 < 0.001, р2-2 = 0.002, р3-3 = 0.005). Наиболее значимое повышение с увеличением ИМТ в профиле СЦ ЖК был С14:0 у А (р1-2 = 0.076, р1-3 < 0.001, р2-3 = 0.030), а у МЕ населения лишь в 3-й группе (р1-3 = 0.002, р2-3 = = 0.001). При этом у МЕ населения в аналогичных ИМТ группах уровень данной кислоты был выше, чем у А (р1-1 < 0.001, р2-2 = 0.001, p3-3 = 0.001). Содержание С15:0 у МЕ населения был статистически значимо выше в 3-й группе как относительно 1-й (р1-3 = 0.067), так и 2-й (р2-3 = 0.031), тогда как у А во 2-й (р1-2 = 0.012) и в 3-й группах наблюдалась лишь тенденция повышения содержания С15:0 (р1-3 = 0.082). Сравнивая аналогичные ИМТ группы А и МЕ населения отмечено, что уровень данной кислоты также был выше у МЕ населения (р1-1 < 0.001, р2-2 = 0.015, р3-3 < 0.001). В содержании остальных СЦ ЖК статистически значимых изменений не установлено, за исключением С12:0, где ее уровень во 2-й группе у МЕ населения был значимо выше относительно 1-й (р1-2 = 0.035). Кроме того, более высокий процент лиц выше нормы с содержанием С14:0 наблюдался у МЕ населения относительно А (15.5, 16.5 и 35.9% и 6.0, 13.6, и 14.6% соответственно, р = 0.002, р = 0.446, р = 0.001). При этом наибольшая частота встречаемости высоких уровней С15:0 установлена во 2-й группе у А населения (24.3%) по сравнению с МЕ (13.6%, р = 0.012, рис. 2).
Рис. 2.
Содержание среднецепочечных насыщенных жирных кислот (СЦ НЖК) в крови у практически
здоровых жителей А и МЕ населения Арктики с учетом ИМТ.  – диапозон колебаний 10 и 90 процентиль;
– диапозон колебаний 10 и 90 процентиль;  – диапозон колебаний 25 и 75 процентиль,
– диапозон колебаний 25 и 75 процентиль,  – медиана;
– медиана;  – аборигенное население (А);
– аборигенное население (А);  – местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
– местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
∑ДЦ ЖК с учетом ИМТ значимо повышались как у А (р1-3 = 0.009, р2-3 = 0.085), так и МЕ в 3-й группе относительно 1-й (р1-3 = 0.013, р2-3 = 0.020), при этом у МЕ населения в аналогичных ИМТ группах содержание кислот было выше, чем у А (р1-1 = 0.001, р2-2 = 0.011, р3-3 = 0.048). Анализ индивидуальных значений ДЦ ЖК показал, что у МЕ населения с увеличением ИМТ рассматриваемые нами уровни большинства ДЦ ЖК повышались по сравнению с А (табл. 2). При этом в содержании С20:0, С22:0, С23:0 и С24:0 статистически значимых различий не установлено, но их средние значения у большинства исследуемого МЕ населения были выше аналогичных ИМТ групп А населения. Следовательно, у жителей Арктического региона с увеличением ИМТ повышаются уровни ЖК: у А населения КЦ ЖК, а у МЕ населения – СЦ и ДЦ ЖК (рис. 3, 4).
Таблица 2.
Межсистемные корреляционные взаимосвязи между исследуемыми показателями у аборигенного (А) и местного европеоидного (МЕ) населения Арктики в зависимости от ИМТ
| Показатели | Этническая группа | Норма 18–25 кг/м2 | ИзМТ 25–30 кг/м2 | Ожирение >30 кг/м2 |
|---|---|---|---|---|
| Глю | А | ИнС(r = 0.34; р = 0.000); НОМА (r = 0.52; р = 0.000) | ИнС(r = 0.42; р = 0.000); С-пеп. (r = 0.41; р < 0.001); НОМА (r = 0.58; р = 0.000) | ИнС(r = 0.35; р = 0.004); НОМА (r = 0.54; р = 0.000); С15:0 (r = 0.42; р = 0.000); С17:0 (r = 0.32; р = 0.000); СЦ (r = 0.32; р = 0.000) |
| МЕ | Инс. (r = 0.46; р = 0.000) С-пеп (r = 0.31; р = 0.017); НОМА (r = 0.605; р = 0.000) | Инс. (r = 0.31; р = 0.002) НОМА (r = 0.54; р = 0.000) | НОМА (r = 0.41; р = 0.001) | |
| Инс | А | С-пеп (r = 0.8; р = 0.000); НОМА (r = 0.97; р = 0.000); Caro (r = –0.96; р = 0.000); С6:0 (r = –0.31; р = 0.003); С22:0 (r = 0.43; р = 0.000) | С-пеп (r = 0.73; р = 0.000); НОМА (r = 0.98; р = 0.000); Caro (r = –0.97; р = 0.000); С6:0 (r = –0.35; р = 0.002); С9:0 (r = 0.4; р = 0.001); С22:0 (r = 0.34; р = 0.001) | С-пеп (r = 0.86; р = 0.000); НОМА (r = 0.97; р = 0.000); Caro (r = –0.97; р = 0.000); КЦ (r = –0.405; р = 0.002) |
| МЕ | С-пеп (r = 0.71; р = 0.000); НОМА (r = 0.98; р = 0.000); Caro (r = –0.95; р = 0.000); С16:0 (r = 0.34; р = 0.004); С18:0 (r = 0.35; р = 0.003); С22:0 (r = 0.35; р = 0.003) НЖК (r = 0.37; р = 0.002); ДЦ (r = 0.36; р = 0.002) | С-пеп (r = 0.76; р = 0.000); НОМА (r = 0.95; р = 0.000); Caro (r = –0.93; р = 0.000); С8:0 (r = 0.45; р = 0.000); С10:0 (r = 0.33; р = 0.002); С12:0 (r = 0.36; р = 0.001); С16:0 (r = 0.32; р = 0.002); С22:0 (r = 0.31; р = 0.004) НЖК (r = 0.33; р = 0.002); КЦ (r = 0.41; р = 0.000); СЦ (r = 0.32; р = 0.003); ДЦ (r = 0.33; р = 0.002) | С-пеп (r = 0.83; р = 0.000); НОМА (r = 0.97; р = 0.000); Caro (r = –0.95; р = 0.000); С17:0 (r = –0.32; р = 0.02); С18:0 (r = –0.32; р = 0.02); С20:0 (r = –0.34; р = 0.011) | |
| ПроИнс | А | С24:0 (r = –0.36; р = 0.000) | ||
| МЕ | С6:0 (r = 0.305; р = 0.03) | С8:0 (r = –0.33; р = 0.031) С14:0 (r = 0.38; р = 0.012); С16:0 (r = 0.35; р = 0.02); С18:0 (r = 0.32; р = 0.036); С20:0 (r = 0.33; р = 0.033); С21:0 (r = 0.32; р = 0.034); С22:0 (r = –0.46; р = 0.002); НЖК (r = 0.34; р = 0.025); СЦ (r = 0.32; р = 0.033) ДЦ (r = 0.32; р = 0.033) | ||
| С-пептид | А | НОМА (r = 0.76; р = 0.000); Caro (r = –0.77; р = 0.000); С6:0 (r = –0.35; р = 0.001); С22:0 (r = 0.55; р = 0.000) | НОМА (r = 0.75; р = 0.000); Caro (r = –0.66; р = 0.000); С6:0 (r = –0.43; р = 0.000); С9:0 (r = 0.43; р = 0.000); С22:0 (r = 0.33; р = 0.001) | НОМА (r = 0.84; р = 0.000); Caro (r = –0.81; р = 0.000); С6:0 (r = –0.36; р = 0.011); С11:0 (r = –0.35; р = 0.016); С14:0 (r = –0.403; р = 0.002); С20:0 (r = –0.33; р = 0.015); КЦ (r = –0.42; р = 0.001) |
| С-пептид | МЕ | НОМА (r = 0.73; р = 0.000); Caro (r = –0.62; р = 0.000); С12:0 (r = 0.302; р = 0.018); С15:0 (r = 0.35; р = 0.005); С22:0 (r = 0.34; р = 0.007); С24:0 (r = 0.38; р = 0.002); СЦ (r = 0.31; р = 0.015) | НОМА (r = 0.76; р = 0.000); Caro (r = –0.67; р = 0.000); С12:0 (r = 0.39; р = 0.002); С13:0 (r = 0.41; р = 0.001); С17:0 (r = 0.32; р = 0.012); С18:0 (r = 0.31; р = 0.014); СЦ (r = 0.35; р = 0.007) | НОМА (r = 0.76; р = 0.000); Caro (r = –0.803; р = 0.000) |
| НОМА | А | Caro (r = –0.88; р = 0.000); С6:0 (r = –0.301; р = 0.005); С22:0 (r = 0.44; р = 0.000) | Caro (r = –0.92; р = 0.000); С6:0 (r = –0.4; р = 0.000); С9:0 (r = 0.33; р = 0.007); С22:0 (r = 0.37; р = 0.000) | Caro (r = –0.91; р = 0.000); КЦ (r = –0.34; р = 0.012) |
| МЕ | Caro (r = –0.87; р = 0.000); С16:0 (r = 0.35; р = 0.003); С17:0 (r = 0.302; р = 0.012); С18:0 (r = 0.35; р = 0.003); С22:0 (r = 0.37; р = 0.002); НЖК (r = 0.37; р = 0.002); ДЦ (r = 0.37; р = 0.002) | Caro (r = –0.81; р = 0.000); С8:0 (r = 0.41; р = 0.000); С10:0 (r = 0.31; р = 0.004); С12:0 (r = 0.35; р = 0.001); С16:0 (r = 0.39; р = 0.000); С18:0 (r = 0.34; р = 0.001); НЖК (r = 0.38; р = 0.000); КЦ (r = 0.35; р = 0.001); СЦ (r = 0.32; р = 0.003); ДЦ (r = 0.39; р = 0.000) | Caro (r = –0.85; р = 0.000); С20:0 (r = –0.34; р = 0.012) | |
| Саro | А | С22:0 (r = –0.41; р = 0.000) | С9:0 (r = –0.44; р = 0.000); С22:0 (r = –0.32; р = 0.002) | С14:0 (r = 0.35; р = 0.009); КЦ (r = 0.4; р = 0.003) |
| МЕ | С18:0 (r = –0.33; р = 0.006); С22:0 (r = –0.303; р = 0.012); НЖК (r = –0.33; р = 0.005); ДЦ (r = –0.32; р = 0.007) | С6:0 (r = –0.38; р = 0.000); С8:0 (r = –0.45; р = 0.000); С9:0 (r = –0.35; р = 0.001); С10:0 (r = –0.34; р = 0.001); С12:0 (r = –0.34; р = 0.001); С22:0 (r = –0.34; р = 0.001); КЦ (r = –0.46; р = 0.000); СЦ (r = –0.3; р = 0.005) | С14:0 (r = 0.34; р = 0.018); С15:0 (r = 0.32; р = 0.018); С17:0 (r = 0.36; р = 0.007); С18:0 (r = 0.35; р = 0.01); С20:0 (r = 0.32; р = 0.019) |
Рис. 3.
Содержание длинноцепочечных насыщенных жирных кислот (ДЦ НЖК) в крови у практически
здоровых жителей А и МЕ населения Арктики с учетом ИМТ.  – диапозон колебаний 10 и 90 процентиль;
– диапозон колебаний 10 и 90 процентиль;  – диапозон колебаний 25 и 75 процентиль,
– диапозон колебаний 25 и 75 процентиль,  – медиана;
– медиана;  – аборигенное население (А);
– аборигенное население (А);  – местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
– местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
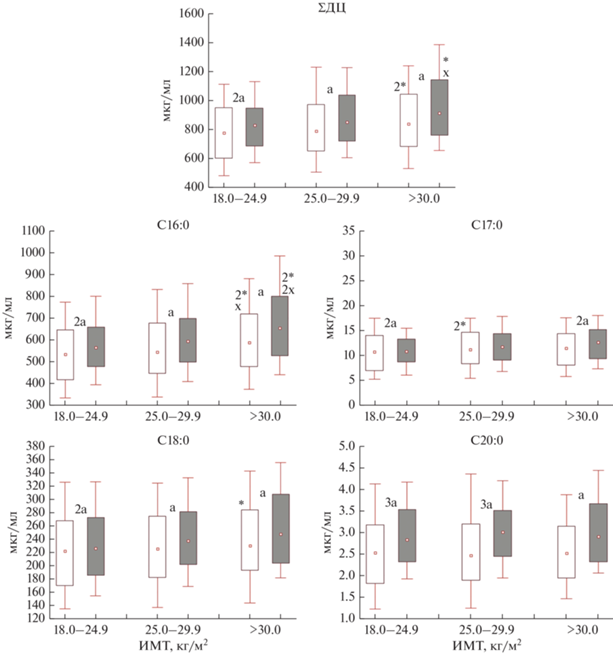
Рис. 4.
Содержание длинноцепочечных насыщенных жирных кислот (ДЦ НЖК) в крови у практически
здоровых жителей А и МЕ населения Арктики с учетом ИМТ.  – диапозон колебаний 10 и 90 процентиль;
– диапозон колебаний 10 и 90 процентиль;  – диапозон колебаний 25 и 75 процентиль,
– диапозон колебаний 25 и 75 процентиль,  – медиана;
– медиана;  – аборигенное население (А);
– аборигенное население (А);  – местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.
– местное европеоидное население (МР); статистическая значимость различий: * – относительно
нормальной массы тела; × – относительно ИзМТ; a – между выборками А и МЕ; * × a – р < 0.05; 2*2 ×2 a – р < 0.01; 3*3 ×3 a – р < 0.001.

По данным корреляционного анализа, независимо от ИМТ в группах А и МЕ населения отмечена прямая связь уровня Глю с Инс и величиной HOMA (табл. 2). У А населения с ожирением прослеживалось влияние СЦ и ДЦ ЖК на гомеостаз Глю. Кроме того, у жителей арктических территорий, особенно МЕ населения, отмечались прямые корреляционные взаимоотношения КЦ, СЦ и ДЦ ЖК с Инс, который, в свою очередь, оказывает влияние на изменение концентрации Глю в крови. Также корреляционным анализом показаны взаимосвязи С-пептида как с КЦ, СЦ и ДЦ ЖК, так и с показателем НОМА, который влияет на содержание Глю. Таким образом, независимо от этнической принадлежности и ИМТ, у жителей Арктического региона в корреляционные взаимоотношения с Глю вступают Инс и НОМА, и опосредованно оказывается влияние на гомеостаз Глю ЖК через влияние на Инс и С-пептидом на НОМА, что более выраженно у МЕ населения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выявленные другими авторами низкие уровни Инс связывают с высоким содержанием ПроИнс в крови при недостаточной активности его превращения в Инс и С-пеп. При этом предполагают, что гиперпроинсулинемия связана с увеличением спроса на Инс, истощением пула зрелых гранул и мобилизацией Инс из резервного пула, который содержит значительное количество незрелого инсулинового предшественника (Таптыгина и др., 2007).
Наше исследование показало, что у А и МЕ населения Арктики медианные значения Глю, гормонов ПЖ и НЖК в крови с учетом ИМТ соответствовали рекомендуемым физиологическим нормам. Однако полученные данные не согласовались с имеющимися в литературе и свидетельствовали о том, что независимо от этнической принадлежности и ИМТ у северян установлена активация жирового обмена и гомеостаза Глю. Это, вероятно, связано с большей степенью активации симпатоадреналовой системы относительно гипоталамо-гипофизарной (Агбалян, 2012). Так, уровень Глю независимо от этнической принадлежности был достоверно выше у лиц с ИзМТ относительно контрольной группы, особенно у лиц МЕ. Межэтнических в аналогичных ИМТ группах различий в содержании ПроИнс не отмечено, но соотношение ПроИнс/Инс у северян (особенно МЕ) значимо понижалось у лиц с ИзМТ и ожирением, относительно контрольной группы, что отражает снижение процессинга ПроИнс в Инс, то есть активного Инс. Это может привести к повышению уровня Глю, связанного, с одной стороны, с нарушением передачи сигнала от рецептора Инс к его мишеням, а с другой, с изменениями во внутриклеточных инсулинзависимых сигнальных каскадах, то есть в пострецепторных механизмах действия Инс (Furukawa et al., 1999; Schafer et al., 2011; Зубова, 2015; Шаройко, Тенникова, 2015; Макишева, 2016), что было доказано в нашем исследовании смещением НОМА в сторону высоких значений, а Caro – низких, особенно у А населения.
Известно, что Инс снижает не только уровень Глю, но и оказывает антилиполитическое действие на НЖК (Титов, 2015), которые являются наиболее энергоемким материалом в жестких климатических условиях Севера. С учетом особенностей метаболизма и переноса все НЖК делятся на КЦ ЖК (С6-С11), СЦ ЖК (С12-С15) и ДЦ ЖК (С16-С24). При этом КЦ и СЦ ЖК этерифицируются в короткие ТГ, не связанные с апобелками, а ДЦ формируют длинные ТГ, которые структурирует апоВ-48 в состав хиломикронов в энтероцитах. Согласно литературным данным, КЦ и СЦ ЖК, с одной стороны, могут быстро окисляться с образованием энергии и кетоновых тел, с другой стороны, избыточное их поступление может повышать затраты кислорода в тканях организма и, тем самым, усиливать метаболический ацидоз и их превращения в ДЦ ЖК. При этом ДЦ ЖК, в отличие от КЦ и СЦ ЖК, включается в состав липопротеинов, циркулируют в крови и запасаются в жировом депо, то есть могут выступать маркером повышения Глю крови и атерогенности липидов, что ассоциируется с риском развития соматических заболеваний. Кроме того, отток КЦ и СЦ ЖК от энтероцитов происходит в вены портальной системы, в частности в вены сальника, а ДЦ – в крупные вены большого круга кровообращения, что может иметь непосредственное отношение к изолированному алиментарному ожирению с развитием метаболического синдрома (Ашмарин и др., 2005; Титов и др., 2014). Изучение спектра НЖК у лиц разной этнической принадлежности с повышением ИМТ показало, что наиболее высокое содержание С16:0, С17:0, С18:0, С20:0, С21:0, С23:0 ДЦ ЖК было отмечено у МЕ, а С8:0, С9:0, С10:0, С11:0 КЦ и С13:0 СЦ ЖК у А населения. Следовательно, при повышении ИМТ у А населения увеличение уровня Глю в крови сочеталось преимущественно с повышением содержания КЦ (С8:0, С9:0, С10:0, С11:0) на фоне смещения уровня ПроИнс, С-пептида в сторону высоких значений и Инс – низких, а у МЕ населения – с повышением ДЦ ЖК (С16:0, С17:0, С18:0, С20:0, С21:0, С23:0) при смещении уровня ПроИнс и С-пеп в сторону высоких значений и дисбалансе концентрации Инс.
Результаты корреляционного анализа подтвердили наше предположение, что у северян с увеличением массы тела повышение НЖК, способных изменять процессинг в β-клетках ПЖ и секрецию ее гормонов, выражено в разной степени у А и МЕ населения. Более ранним исследованием показано, что у жителей Заполярья низкие концентрации адипонектина в крови в сочетании с ИзМТ могут являться одним из пусковых механизмов развития ИР, способствующей повышению уровней Глю и ЖК в крови (Бичкаева и др., 2014). В работах некоторых авторов отмечено, что высокие уровни ПроИнс в крови у лиц с ожирением и метаболическим синдромом связаны с недостаточной активностью его превращения в Инс и С-пеп, приводящего к ухудшению функций β-клеток ПЖ (Аметов, 2008; Дедов и др., 2015). В нашем исследовании выявленная гиперпроинсулинемия с увеличением ИМТ была обусловлена выбросом β-клетками ПЖ в кровь ПроИнс вместо Инс.
Так, с повышением ИМТ у северян (особенно у МЕ) увеличение уровня НЖК на фоне снижения Инс может активировать липолиз, который, в свою очередь, стимулирует глюконеогенез (Титов, 2013), т.е. повышение уровня Глю связано как с массой тела и увеличением содержания НЖК, так и смещением уровня Инс в сторону низких значений (Cintra et al., 2012).
Таким образом, различия в показателях жирового обмена, Глю и гормонов ПЖ между обследуемым А и МЕ населением является отражением как этнических особенностей, так и пищевых привычек. По своему типу и природно-климатической привязке традиционное питание северного населения представлено не только рыбой, мясом оленей, но и присутствием в последнее время большого количества как жиров, так и углеводистой пищи, консервированных и синтетических продуктов (Miller, Colagiuri, 1994; Хаснулин, 1998; Arab et al., 2011). Экспериментальными исследованиями на мышах доказано, что снижение в рационе питания насыщенных жиров может способствовать уменьшению метаболических нарушений, связанное со снижением активности ферментов десатуразы и элонгазы (Казначеев, 1980а; Schwab et al., 2008; Bjursell et al., 2014;). И наоборот, высокое потребление растительных жиров понижает риск развития метаболического синдрома (Guess et al., 2016; Rogero, Calder, 2018; Neuenschwander et al., 2020).
Таким образом, рекомендуется соблюдать принципы сбалансированного питания. В противном случае при избыточном потреблении одновременно жиров животного происхождения и сложных углеводов, НЖК не используются как энергетический материал, а активно откладываются “про запас”, повышая ИМТ, который, по результатам нашего исследования, являлся одним из модифицирующих факторов риска развития метаболического синдрома.
Выявленные изменения в содержании рассматриваемых показателей углеводного обмена – глюкозы и гормонов, регулирующих ее гомеостаз (инсулина, проинсулина, соотношения проинсулин/инсулин), а также насыщенных жирных кислот на фоне избыточной массы тела и ожирения у обследуемых лиц свидетельствуют о напряжении указанных звеньев и наличии сформированных метаболических дисбалансов как у аборигенного, так и местного европеоидного населения, что требует дальнейших исследований. Результаты данного исследования могут быть использованы как маркеры факторов риска метаболического синдрома, диагностики донозологических состояний и других нарушений обмена веществ (сахарный диабет, сосудистые поражения и др.), а также планировании профилактических мероприятий в отношении риска развития соматических заболеваний у А и МЕ населения.
Финансирование. Работа выполнена в соответствии с планом НИР центра “Изучение адаптивных возрастных эндокринно-метаболических перестроек у жителей арктических территорий” (НИОКТР АААА-А19-119121090063-7).
Список литературы
Агбалян Е.В. Оценка фактического питания мигрантов Арктики и активность симпатоадреналовой системы // Гигиена и санитария. 2012. № 5. С. 40–42.
Алексеева Т.И. Адаптивные процессы в популяциях человека. М.: Изд. МГУ, 1986. 215 с.
Аметов А.С. Роль β-клеток в регуляции гомеостаза глюкозы в норме и при сахарном диабете 2 типа // Сахарный диабет. 2008. № 4. С. 6–11.
Андронова Т.И., Неверова Н.П. К вопросу о содержании белка и белковых фракций крови в процессе акклиматизации в Арктике // Акклиматизация человека в условиях полярных районов. Тез. докл. Новосибирск, 1969. С. 107–108.
Ашмарин И.П., Каразеева Е.П., Карабасова М.А. Патологическая физиология и биохимия: учебное пособие для вузов. М.: Экзамен, 2005. 480 с.
Батурин А.К., Погожева А.В., Кешабянц Э.Э., Старовойтов М.Л., Кобелькова И.В., Камбаров А.О. Изучение питания, антропометрических показателей и состава тела у коренного и пришлого населения российской Арктики // Вопр. питания. 2017. Т. 86. № 5. С. 11–16.
Бичкаева Ф.А., Баранова Н.Ф., Власова О.С. Третьякова Т.В., Нестерова Е.В., Шенгоф Б.А., Бичкаев А.А., Волкова Н.И. Методика измерений массовой концентрации метиловых эфиров жирных кислот (МЭЖК) в сыворотке крови методом газожидкостной хроматографии // Патент. Свид. об аттестации методики измерений № 88-16365-004-75 RA. RU.31065-2019 от 21 февраля 2019 г. ФР.1.31.2019.33472. http://docs.cntd.ru/document/437227508 (дата обращения: 09.10.19).
Бичкаева Ф.А., Типисова Е.В., Бичкаев А.А. Особенности жирно-кислотного состава и гормонов поджелудочной железы у аборигенного и местного русского населения Заполярья // Вест. Уральской медицинской академии науки, 2014. № 2(48). С. 116–119.
Васильев В.И. Проблемы формирования северосамодийских народностей. М.: Наука, 1979. 243 с.
Дедов И.И., Смирнова О.М., Кононенко И.В. Новые представления о нарушении глюкозостимулированной секреции инсулина при развитии сахарного диабета 2 типа. Клинические последствия // Сахарный диабет. 2015. Т. 18, № 3. С. 23–31.
Догадин С.А., Ноздрачев К.Г., Манчук В.Т. Содержание инсулина и С-пептида у коренных жителей Севера Сибири // Актуальные проблемы эндокринологии: Тез. докл. III Всерос. съезда эндокринологов. М., 1996. С. 47.
Дудинская Е.Н., Браилова Н.В., Стражеско И.Д. Роль инсулинорезистентности в процессах сосудистого старения // Проф. медицина. 2014. № 2. С. 35–41.
Зубова А.В., Потеряева О.Н., Русских Г.С., Геворгян М.М. Иммунноферментный анализ проинсулина в сыворотке крови больных сахарным диабетом 2 типа // Медицинские науки. 2015. № 1. С. 1–8.
Казначеев В.П. Механизмы адаптации человека в условиях высоких широт. М.: Медицина, 1980 а. 217 с.
Казначеев В.П. Современные аспекты адаптации. Новосибирск, 1980 б. 259 с.
Когай М.А., Лутов Ю.В., Пинхасов Б.Б., Селятицкая В.Г., Шорин Ю.П. Метаболический синдром у лиц с избыточной массой тела и ожирением. Вест. новых мед. технологий. 2008. Т. XV. № 1. С. 141–143.
Козлов А.И., Боринская С.А., Санина Е.Д. “Экономный генотип” s4/s4 по гену APOE и риск метаболических нарушений в популяциях уральских народов // Экологическая генетика 2011. № 11(2). С. 17–23.
Коробицын А.А., Иванова Т.Н. Ишемическая болезнь сердца и ее факторы риска у работающего населения Европейского Севера. Архангельск, 1996. 134 с.
Крючкова И.В., Адамчик А.С. Возможности коррекции нарушений углеводного обмена при метаболическом синдроме // Рос. кард. журн. 2009. № 2. С. 44–48.
Кушнер П.Н. Материалы и исследования по этнографии русского населения Европейской части СССР. М.: Изд. АН СССР, 1960. 317с.
Лащук Л.П. Формирование народности коми. М.: Изд. МГУ, 1972. 292 с.
Майоров А.Ю. Инсулинорезистентность в патогенезе сахарного диабета 2 типа // Сахарный диабет. 2011. № 1. С. 35–42.
Макишева Р.Т. Адаптивный смысл инсулинорезистентности // Вест. новых мед. технологий. 2016. № 1. С. 71–81.
Наследов А.Д. SPSS 15.0 Профессиональный статистический анализ данных. Санкт-Петербург, 2008. 416 с.
Панин Л.Е. Энергетические аспекты адаптации. Л., 1978. 190 с.
Смирнова О.М. Нарушение секреции инсулина – главный эндокринный дефект при сахарном диабете 2 типа // Воронежская региональная общественная организация: Воронежское общество эндокринологов и диабетологов. ГУ Эндокр. науч. центр РАМН. М. 2016. http://doi.org/voed.ru/insulin_secr_dist.htm (дата обращения 03. 03. 2018).
Таптыгина Е.В., Яскевич Р.А., Поликарпов Л.С., Хамнагадаев И.И. Нарушение углеводного обмена у мужчин различных соматотипов с артериальной гипертонией и ишемической болезнью сердца у мужчин различный // Сиб. мед. журн. 2007. № 2. С. 38–41.
Титов В.Н. Регуляция инсулином метаболизма жирных кислот, а затем глюкозы // Биохимия. 2015. № 3. С. 2–3.
Титов В.Н. Статины, холестерин, жирные кислоты и сахарный диабет // Научный диалог. 2013. № 3(15). С. 148–183.
Титов В.Н., Рожкова Т.А., Амелюшкина В.А. Клиническая биохимия гиперлипидемии и гипергликемии. Инсулин и метаболизм жирных кислот. Гипогликемическое действие гиполипидемических препаратов // Клин. лаб. диагностика. 2014. № 3. С. 4–6.
Хаснулин В.И. Введение в полярную медицину. Новосибирск: СО РАМН, 1998. 337 с.
Хаснулин В.И., Артамонова В.Г., Хаснулина А.В., Павлов А.Н. Адаптивные типы мобилизации приспособительных резервов организма и устойчивость к артериальной гипертензии на Севере // Экология человека. 2014. № 7. С. 24–29.
Хлобыстин Л.П. О расселении предков самодийских народов в эру бронзы (II тыс. до н.э.) // Этногенез народов Северной Азии. Тез. докл. Новосибирск, 1969. С. 134.
Хомич Л.В. Проблемы этногенеза и этнической истории ненцев. Л.: Наука ЛО, 1976. 188 с.
Шаройко В.В., Тенникова Т.Б. Молекулярные механизмы секреции инсулина β-клетками островков Лангерганса и перспективные мишени фармакологического воздействия для лечения сахарного диабета // Наука и образование. 2015. № 2. С. 90–97.
Arab L., Tseng Ch.-H., Ang A., Jardack P. Validity of a multipass, web-based, 24-hour self-administered recall for assessment of total energy intake in blacks and whites // Am. J. Epidemiol. 2011. V. 174(11). P. 1256–1265.
Baird M., Stevenson S., Carlin K., Daniels R. Increased dietary intake of saturated fatty acid heptadecanoic acid (C17:0) associated with decreasing ferritin and alleviated metabolic syndrome in dolphins // PLoS ONE. 2015. V. 10(7).
Bjursell M., Xu X., Admyre T., Böttcher G., Lundin S., Nilsson R. The beneficial effects of n-3 polyunsaturated fatty acids on diet induced obesity and impaired glucose control do not require Gpr120 // PLoS ONE. 2014. V. 9(12).
Cintra D.E., Ropelle E.R., Moraes J.C., Pauli J.R., Morari J., de Souza C.T. Unsaturated fatty acids revert diet-induced hypothalamic inflammation in obesity // PLoS ONE. 2012. V. 7(1).
Doliba N.M., Liu Q., Li Ch., Chen P., Liu Ch., Naji A., Matschinsky F.M. Inhibition of cholinergic potentiation of insulin secretion from pancreatic islets by chronic elevation of glucose and fatty acids: protection by casein kinase 2 inhibitor // Mol. Metab. 2017. V. 6(10). P. 1240–1253.
El-Azzouny M., Evans Ch.R., Treutelaar M.K., Kennedy R.T., Burant Ch.F. Increased glucose metabolism and glycerolipid formation by fatty acids and GPR40 receptor signaling underlies the fatty acid potentiation of insulin secretion // Biol. Chem. 2014. V. 289(19). P. 13575–13588.
Figueiredo P.S., Inada A.C., Marcelino G., Cardozo C.M., Freitas K., Guimarães R., de Castro A., Nascimento V., Hiane P. Fatty acids consumption: the role metabolic aspects involved in obesity and its associated disorders // Nutrients. 2017. V. 9(10). P. 1158.
Furukawa H., Carroll L.J., Swift H.H., Steiner D.F. Long-term elevation of free fatty acids leads to delayed processing of proinsulin and prohormone convertases 2 and 3 in pancreatic beta-cell line MIN 6 // Diabetes. 1999. V. 48. P. 1395–1401.
Guess N., Perreault L., Kerege A., Strauss A., Bergman B.C. Dietary fatty acids differentially associate with fasting versus 2-hour glucose homeostasis: Implications for the management of subtypes of prediabetes // PLoS ONE. 2016. V. 11(3).
Hodson L., Crowe F.L., McLachlan K.J., Skeaff C.M. Effect of supplementation with flaxseed oil and different doses of fish oil for 2 weeks on plasma phosphatidylcholine fatty acids in young women // Eur. J, Clin, Nutr. 2018. V. 72(6). P. 832–840.
Jumpertz R., Guijarro A., Pratley R.E., Mason C.C., Piomelli D., Krakoff J. Associations of fatty acids in cerebrospinal fluid with peripheral glucose concentrations and energy metabolism // PLoS ONE. 2012. V. 7(7).
Miller J.C., Colagiuri S. The carnivore connection: dietary carbohydrate in the evolution of NIDDM // Diabetologia. 1994. V. 37(12). P. 1280–1286.
Neuenschwander M., Barbaresko J., Pischke C.R., Iser N., Beckhaus J., Schwingshackl L., Schlesinger S. Intake of dietary fats and fatty acids and the incidence of type 2 diabetes: a systematic review and dose-response meta-analysis of prospective observational studies // PLoS ONE. 2020.
Rogero M.M., Calder P.C. Obesity, inflammation, toll-like receptor 4 and fatty acids // Nutrients. 2018. V. 3. P. 122–126.
Schafer S.A., Machicao F., Fritsche A. New type 2 diabetes risk genes provide new insights in insulin secretion mechanisms // Diabetes research and clinical practice. 2011. V. 93. P. 9–24.
Schwab U., Seppänen-Laakso T., Yetukuri L., Ågren J., Kolehmainen M., Laaksonen D.E. Triacylglycerol fatty acid composition in diet-induced weight loss in subjects with abnormal glucose metabolism – the GENOBIN study // PLoS ONE. 2008. V. 3(7).
Tchernof A., Després J. Pathophysiology of human visceral obesity: an update // Physiol Rev 2013. V. 93. P. 359–404.
Volk B.M., Kunces L.J., Freidenreich D.J., Kupchak B.R., Saenz C., Artistizabal J.C. Effects of step-wise increases in dietary carbohydrate on circulating saturated fatty acids and palmitoleic acid in adults with metabolic syndrome // PLoS ONE. 2014. V. 9(11).
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


