Известия РАН. Серия биологическая, 2022, № 4, стр. 427-437
Сообщества зообентоса термальных и холодных карстовых водных экосистем урочища Пымвашор Большеземельской тундры
О. А. Лоскутова 1, *, Е. Б. Фефилова 1, Т. А. Кондратьева 2, М. А. Батурина 1
1 Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
2 Управление по гидрометеорологии и мониторингу окружающей среды Республики Татарстан
420021 Казань, ул. Заводская, 3, Россия
* E-mail: loskutova@ib.komisc.ru
Поступила в редакцию 14.01.2021
После доработки 13.04.2021
Принята к публикации 22.04.2021
- EDN: NANJNA
- DOI: 10.31857/S1026347022040084
Аннотация
Исследована летняя структура зообентоса нескольких термальных и низкотемпературных источников гидроэкосистемы Большеземельской тундры (ручей Пымвашор). Термальные источники по сравнению с холодными характеризовались более низким разнообразием групп донной фауны, но более высоким видовым богатством некоторых из них. В сообществах гидротермальных биотопов по численности доминировали олигохеты и личинки двукрылых (сем. Chironomidae), в карстовых холодных водах преобладали личинки двукрылых (сем. Chironomidae) и остракоды. Наибольшую биомассу в термальных источниках определяли моллюски, олигохеты либо двукрылые (сем.Tipulidae), в низкотемпературных – хирономиды и моллюски. Фауна состояла преимущественно из широко распространенных эвритермных видов, но присутствовали и стенотермные гидробионты. Не обнаружены характерные для других термальных вод мира эндемичные формы, однако, впервые для Большеземельской тундры найдены представители экстразональной фауны. На исследованном участке русла руч. Пымвашор структура зообентоса достаточно однообразна вне зависимости от отепляющего или охлаждающего влияния источников.
Источниками, родниками или ключами называют естественные выходы подземных вод на поверхность Земли; они представляют собой уникальные по своим характеристикам микроэкосистемы, напрямую связующие наземную и подземную части гидросферы (Жадин, 1950; Тахтеев и др., 2010). Температура воды в родниках в местах их выхода из-под земли отличается стабильностью – незначительной годовой амплитудой, не превышающей 1–2°С, устойчивым гидрологическим и гидрохимическим режимами. Разгрузка термальных источников приводит к выносу из недр Земли горячих минерализованных вод и формирует на земной поверхности водотоки с повышенной температурой, создавая условия аналогичные доминировавшим на ранних этапах развития жизни на Земле (Жадин, 1950; Болотов и др., 2012). В результате изучения фауны беспозвоночных горячих источников мира (Pritchard, 1991; De Jong et al., 2005; De Mattia, 2007; Duggan et al., 2007; Friberg et al., 2009; Suzuki et al., 2017), в том числе, восточносибирской области России (Леванидов, Леванидова, 1976; Круглов, Старобогатов, 1989; Тахтеев и др., 2000, 2006, 2010; Еропова и др., 2016), сложилось представление об особенностях ее состава, связанных с присутствием редких азональных форм и эндемичных видов.
Исследования донных сообществ (макрозообентоса) пресноводных экосистем в условиях стабильно низких температур также показали своеобразие состава беспозвоночных, выраженное в высоком разнообразии стенотермных холодолюбивых организмов, преимущественно личинок хирономид, и наличии реликтов (Illies, 1952; Milner et al., 2001; Чертопруд, 2006; Ивановский, 2010; Тахтеев и др., 2010; Паньков, Крашенинников, 2012; Savić et al., 2017).
Уникальность исследованного нами водотока Большеземельской тундры – руч. Пымвашор – состоит в том, что в него разгружаются единственные на Крайнем Севере Европы естественные горячие источники, соседствующие с холодными карстовыми. Благодаря различиям по температуре и химическому составу воды (Функционирование…, 2011), они создают широкий градиент условий для гидробионтов на небольшом отрезке русла и водосбора. Как определено в работах по зимней гидрологии, гидрохимии и гидробиологии урочища Пымвашор (Беспалая и др., 2011; Функционирование…, 2011; Болотов и др., 2012), этот градиент обусловливает повышенное обилие и разнообразие некоторых представителей донной фауны в небольшом водотоке и его притоках в период, который для пресноводных сообществ высоких широт характеризуется, как правило, сезонной депрессией.
Целью наших исследований было впервые изучить таксономический состав, структуру и количественные показатели зообентоса термальных и холодных карстовых источников Большеземельской тундры в летнее время, выявить возможное влияние теплых и устойчиво низкотемпературных вод на распределение зообентоса в руч. Пымвашор.
МАТЕРИАЛЫ И МЕТОДЫ
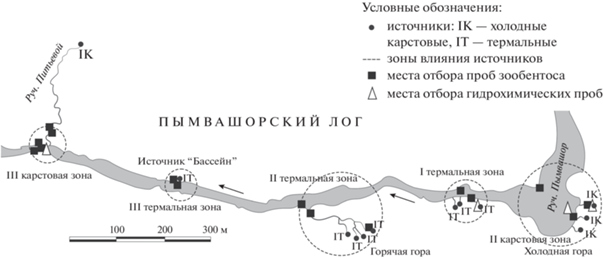
Руч. Пымвашор, протекающий в восточной части Большеземельской тундры выше Северного полярного круга (67°09′76′′ с.ш., 60°51′20′′ в.д.), является притоком третьего порядка р. Печора. Он представляет собой типичный предгорный водоток с выраженными перепадами в скорости течения и каменистым дном. На участке ручья протяженностью ~1.5 км в него разгружается восемь термальных и пять холодных источников, образуя гидротермальную систему. Ранее в зимний период по ландшафтным и гидрологическим параметрам было проведено зонирование урочища с выделением шести термальных и низкотемпературных карстовых зон, находящихся под непосредственным влиянием разгружающихся подземных вод (Функционирование…, 2011). Труднодоступность и удаленность от населенных пунктов способствует сохранению естественного состояния водных объектов, включенных в 2000 г. в состав памятников природы регионального значения – “Пымвашор”.
В пяти из выделенных ранее зон: в русле руч. Пымвашор, его притоках (ручьи Питьевой, Горячий) и в источниках, в августе 2019 г. нами были отобраны 4 гидрохимические и 14 гидробиологических проб, девять интегральных количественных и 5 качественных проб (рис. 1).
Рис. 1.
Карта отбора гидрохимических и гидробиологических проб на руч. Пымвашор. Для рисунка использована с изменениями карта из книги (Функционирование…, 2011).
Количественные пробы зообентоса отбирали с помощью гидробиологического скребка (Шубина, 2006) и промывали через капроновое сито c размером ячеи 0.23 мм. Интегральная количественная проба охватывала от 410 до 680 см2 и объединяла 4–5 субпроб, каждую из которых собирали с разной площади дна на одном участке. В ряде источников, в виду их расположения в небольших чашеобразных углублениях с плотным грунтом, отбирали качественные пробы капроновым сачком с размером ячеи 0.1 мм. Также для более полного учета фауны проводили специальные смывы с поверхности камней и мхов. Все гидробиологические пробы сразу фиксировали 4%‑ным формальдегидом или 96%-ным этиловым спиртом. Одновременно с отбором гидробиологических и гидрохимических проб измеряли температуру воды (ртутным термометром), регистрировали морфоэдафические характеристики биотопов. Гидробиологические пробы обрабатывали в лаборатории по стандартным методикам (Шубина, 2006). Количественный химический анализ проб воды был выполнен в экоаналитической лаборатории ИБ ФИЦ Коми НЦ УрО РАН (аттестат аккредитации № РОСС RU.0001.511257) по аттестованным методикам измерений. Определены значения pH, минерализации и электропроводности.
При изучении фауны до возможно низшего таксономического уровня были идентифицированы следующие группы беспозвоночных: олигохеты (Oligochaeta), моллюски (Mollusca), ветвистоусые (Cladocera) и веслоногие (Copepoda: Cyclopoida и Harpacticoida) раки, поденки (Ephemeroptera), веснянки (Plecoptera), ручейники (Trichoptera), жуки (Coleoptera), личинки двукрылых из семейств Chironomidae, Ceratopogonidae, Limoniidae, Tipulidae, Psychodidae, Empididae.
Для сравнения видовых составов модельных групп использовали коэффициент общности Чекановского-Серенсена: IS (Песенко, 1982). Статистическая обработка данных проведена с использованием Statistica 6.0 для Windows (StatSoft). Для попарного сравнения выборок численности и биомассы зообентоса применяли непараметрический статистический U-критерий Манна–Уитни (для независимых выборок).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В период исследований температурная разница между изученными водными объектами и участками руч. Пымвашор составляла 24.2°С. Согласно классификации подземных вод (Щербаков, 1979), исследованные нами источники подразделяли на холодные (с температурой воды до 20°С) и термальные (теплые или субтермальные) воды (с температурой 20–27.2°С). Температура воды в самом руч. Пымвашор до впадения всех исследованных термальных источников составляла ~6°С. Ниже по течению ручья, несмотря на впадение в него горячих либо холодных источников, температура воды в период исследований изменялась незначительно: после первой термальной зоны она была 11.1°С, а ниже руч. Питьевой – 12°С. Исключением являлось место разгрузки в ручей источника “Бассейн” (III термальная зона), где температура составляла 15.4°С. В то же время в холодных источниках и руч. Питьевой летом регистрировалась температура 3.0–6.1°С, в теплых источниках и руч. Горячий – 19.0–27.2°С.
Полученные нами значения минерализации и электропроводности воды показали большой разброс и изменялись в соответствии с рангами вод обследованных биотопов от пресных гипогалинных (в русле руч. Пымвашор) до солоноватых β-мезогалинных (в одном из термальных источников) (табл. 1). Кислотность воды (pH), напротив, колебалась в пределах слабощелочной и различалась по водоемам не существенно. В некоторых из них по запаху и желтовато-белому налету на донном субстрате явно определялось присутствие сероводорода. В источниках I термальной зоны наличие красно-бурого осадка свидетельствовало о возможной избыточности в воде реакцинноспособного железа.
Таблица 1.
Гидрохимические характеристики исследованных водных объектов урочища “Пымвашор”, 24 августа 2019 г.
| Показатель | Русло руч. Пымвашор | Источники | ||
|---|---|---|---|---|
| III карстовая зона | II карстовая зона | II карстовая зона | I термальная зона | |
| pH | 7.69 | 7.70 | 7.90 | 7.68 |
| Электропроводность, мкСм/см | 460 | 138 | 790 | 3030 |
| Минерализация (сухой остаток), мг/дм3 |
330 | 120 | 470 | 2070 |
Таксономическая структура и количественное развитие зообентоса. В исследованных термальных источниках (IT-I, IT-II, IT-III) и руч. Горячий зарегистрировано 15 групп гидробионтов, из которых количественно в термальных источниках преобладали олигохеты или личинки двукрылых – хирономид и типулид (рис. 2). Кроме этих трех групп, встречались нематоды (Nematoda), моллюски (Mollusca), остракоды (Ostracoda), гарпактикоиды (Harpacticoida), клещи (Hydracarina), ногохвостки (Collembola), жуки (Coleoptera), ручейники (Trichoptera) и личинки двукрылых – мокрецы (Ceratopogonidae), бабочницы (Psychodidae) и толкунчики (Empididae).
Рис. 2.
Структура численности зообентоса в термальных и карстовых зонах (I – источники, RG – ручей Горячий, RP – ручей Питьевой, P – ручей Пымвашор, T и K – термальные и карстовые зоны, римские цифры – номера зон).
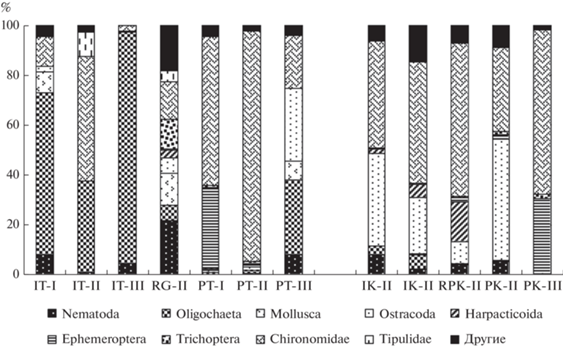
В источнике с самой высокой температурой воды (“Бассейн”) зообентос состоял лишь из семи групп гидробионтов, из которых более 90% общей численности составляли олигохеты. В двух других термальных источниках обнаружено 8–9 групп при доминировании олигохет либо двукрылых – хирономид и типулид. Более разнообразным был зообентос устья руч. Горячий, образованный слиянием 4 термальных источников, в котором при температуре воды 26.0°С обнаружены все 15 групп гидробионтов.
В биомассе доминирующие группы гидробионтов в разных термальных источниках отличались: в одном преобладали моллюски (88% биомассы зообентоса), в других – олигохеты (73.1%) либо крупные личинки двукрылых сем. Tipulidae (69.3%).
В холодных источниках в целом установлен гораздо более богатый состав донных беспозвоночных, представленный 22 группами. Таксономическая структура зообентоса существенно отличалась от таковой в горячих источниках (рис. 2). При низких температурах по численности доминировали хирономиды и остракоды, по биомассе – хирономиды и моллюски, однако, видовой состав хирономид и моллюсков был иной, чем в термальных источниках (табл. 2). Только в карстовых источниках, дополнительно к выявленным в термальных водах группам, обнаружены ветвистоусые раки (Cladocera), циклопоиды (Cyclopoida), пауки (Araneina), веснянки (Plecoptera) и двукрылые: болотницы (Limoniidae), львинки (Stratiomyidae) и мошки (Simuliidae).
Таблица 2.
Различия в составе модельных групп гидробионтов в контрастных по температуре условиях в экосистеме руч. Пымвашор, август 2019 г.
| Таксоны | Общее число видов и форм | Источники и притоки | Русло руч. Пымвашор | ||
|---|---|---|---|---|---|
| IT, RG | IK, RP | PT | PK | ||
| OLIGOCHAETA | 26 | 12 | 13 | 14 | 9 |
| Amphichaeta sp. | + | ||||
| Nais alpina Sperber | + | ||||
| N. barbata Müller | ++ | + | |||
| N. communis Piguet | +++ | ++ | |||
| N. elinguis Müller | ++ | ||||
| N. pardalis Piguet | ++ | + | |||
| N. variabilis Piguet | +++ | ++ | |||
| Piguetiella blanci (Piguet) | ++ | + | |||
| Spirosperma ferox Eisen | ++ | + | |||
| Tubifex tubifex (Müller) | ++ | ||||
| Lumbriculus variegatus (Müller) | + | ||||
| Rhynchelmis sp. | + | ||||
| MOLLUSCA | 2 | 1 | 1 | 1 | 0 |
| Lymnaea lagotis (Schranck) | +++ | +++ | |||
| Valvata piscinalis (O.F. Müller) | ++ | ||||
| CLADOCERA | 6 | 0 | 1 | 5 | 4 |
| CYCLOPOIDA | 5 | 0 | 1 | 1 | 4 |
| HARPACTICOIDA | 3 | 1 | 3 | 1 | 1 |
| Bryocamptus cf. pygmaeus (Sars) | ++ | +++ | |||
| Attheyella nordenskioldii (Lilljeborg) | +++ | ++ | ++ | ||
| EPHEMEROPTERA | 5 | 1 | 1 | 2 | 5 |
| Baetislapponicus (Bengtsson) | + | ++ | +++ | +++ | |
| B.inexpectatus (Tschernova) | ++ | ||||
| Ephemerella mucronata (Bengtsson) | + | ||||
| E. ignita (Poda) | + | ||||
| Heptagenia sulphurea Bengtsson | + | ||||
| PLECOPTERA | 6 | 0 | 1 | 0 | 6 |
| Taeniopteryx nebulosa (Linnaeus) | + | ||||
| Nemoura cinerea (Retzius) | +++ | ||||
| Leuctra digitata Kempny | + | ||||
| L. fusca (Linnaeus) | + | ||||
| TRICHOPTERA | 10 | 3 | 4 | 7 | 7 |
| Rhyacophila nubila Zetterstedt | + | + | + | ||
| Rhyacophila juv. | ++ | +++ | |||
| Hydroptila sp. | + | + | +++ | ||
| Hydropsyche sp. | + | ++ | |||
| CHIRONOMIDAE | 36 | 24 | 18 | 24 | 16 |
| Chironomus anthracinus Zetterstedt | ++ | ||||
| C. parathummi Keyl | ++ | ||||
| Camptochironomus tentans (Fabricius) | +++ | ||||
| Stictochironomus crassiforceps (Kieffer) | +++ | ||||
| Pseudodiamesa nivosa (Goetghebuer) | +++ | ||||
| Chaetocladius dentiforceps (Edwards) | +++ | ||||
| C. piger (Goetghebuer) | ++ | ||||
| Eukiefferiella claripennis (Lundbeck) | + | +++ | ++ | +++ | |
Примечание. IT – термальные источники, IK – карстовые холодные источники, RG – руч. Горячий, RP – руч. Питьевой, PT – термальные зоны русла руч. Пымвашор, PK – карстовые зоны русла руч. Пымвашор; “+” – единичное присутствие вида (формы): <5 особей в качественных пробах и/или <55.5 экз./м2 в количественных пробах; “++” – присутствие вида (формы): >5 особей в качественных пробах и/или >55.5 экз./м2 в количественных пробах; “+++” – наиболее многочисленные виды (формы): >50 особей в качественных пробах, >1 тыс. экз./м2.
Таксономическая структура зообентоса исследованного участка руч. Пымвашор была довольно однообразной на всем протяжении. Как в термальных, так и карстовых зонах, по численности доминировали хирономиды и поденки, либо – в карстовой зоне верхнего участка ручья (PK-II) – хирономиды и остракоды (рис. 2). Всего в карстовых зонах встречено 20 групп беспозвоночных, в термальных – 19 (отсутствовали Tipulidae). В биомассе существенным был вклад хирономид, ручейников и поденок.
По предварительным данным, общая численность зообентоса максимально высокой была в карстовых зонах руч. Пымвашор (134.6–151.0 тыс. экз./м2), в термальных зонах она была существенно ниже (57.7–89.7 тыс. экз./м2). Карстовые источники отличались невысокими показателями количественного развития зообентоса (7.0–27.8 тыс. экз./м2), наименьшая численность наблюдалась в одном из термальных источников (3.2 тыс. экз./м2). Достоверные различия по численности оказались между термальными источниками и термальными и карстовыми зонами ручья Пымвашор (p < 0.024).
Биомасса зообентоса источников и ручья Пымвашор соответствовала показателям олиготрофных экосистем и была довольно низкой по всей длине исследованного участка, как в термальных, так и в карстовых зонах (1.2–5.0 г/м2). Лишь в одной из проб, отобранных в ручье, вытекающем из источника “Бассейн”, биомасса была значительно выше благодаря присутствию моллюсков – 9.8 г/м2. Однако, по критерию Манна-Уитни различия по биомассе оказались недостоверными.
Фауна донных беспозвоночных. Общее видовое разнообразие идентифицированных групп в составе зообентоса руч. Пымвашор и его притоков было высоким. Мы выявили закономерности в его распределении по зонам с различными температурными условиями, связанные с изменением состава некоторых (модельных) групп (табл. 2).
Малощетинковые черви. Общий систематический список олигохет исследованных водоемов включает 26 таксонов (из них 14 видов) и состоит из семейств Lumbriculidae (один вид и две формы неопределенного видового статуса), Enchytraeidae (один вид и шесть форм) и Naididae (sensu Erséus et al., 2008) (всего 16 видов и форм), которое включает виды из двух подсемейств - Naidinae (10 видов и одна форма) и Tubificinae (два вида и три формы). Несмотря на одинаковое число видов и надвидовых таксонов (по 18 видов и форм), сходство фаун олигохет в теплых и холодных зонах было умеренным: Is = 0.37 (0.36 – между источниками; 0.30 – между зонами ручья Пымвашор). Различные виды рода Nais (п/сем. Naidinae) отмечены в пробах из обеих зон. Наиболее часто встречались Nais bretsheri Michaelsen, Nais communis Piguet. Высокая встречаемость была так же характерна и для ювенильных особей п/сем. Tubificinae. Помимо наидид только в карстовых зонах обнаружены представители родов: Amphichaeta, Piguetiella (п/сем. Naidinae), Lumbriculus (сем. Lumbriculidae); только в термальных – Spirosperma (п/сем. Tubificinae), Rhynchelmis (сем. Lumbriculidae). Представители сем. Enchytraeidae наиболее многочисленны и разнообразны были в источниках, преимущественно холодных, а только в ручье отмечались Nais barbata Müller, Nais pardalis Piguet (п/сем. Naidinae) (табл. 2).
Моллюски были представлены двумя видами, из которых один встречался в термальных источниках, другой – в карстовых (табл. 2).
Ракообразные также не отличались разнообразием состава (табл. 2). Из ветвистоусых раков наиболее часто встречались Chydorus sphaericus (O.F. Müller) и Alona affinis (Leydig). Из веслоногих раков наибольший интерес представляли гарпактикоиды, в распределении двух из трех видов которых обнаружена закономерность, связанная с градиентом условий (табл. 2). Bryocamptus cf. pygmaeus массово развивался в источниках и обоих обследованных притоках руч. Пымвашор (как холодных, так и в термальных зонах) и совершенно отсутствовал в самом ручье. В термальной зоне он отмечен лишь в руч. Горячий, тогда как в теплых источниках гарпактикоиды (равно как и другие кладоцеры и копеподы) не найдены. Attheyella nordenskioldii была обычным видом для всех обследованных холодноводных биотопов, но не встречалась в теплых.
Амфибиотические и водные насекомые в качественных и количественных пробах зообентоса представлены 65 таксонами из отрядов Coleoptera, Ephemeroptera, Plecoptera и Diptera. Наибольшее разнообразие установлено для семейства хирономид и отряда ручейников.
Наиболее часто встречающимися из таксонов EPT (Ephemeroptera-Plecoptera-Trichoptera) были ювенильные личинки ручейников Apatania и Hydroptila sp. Все таксоны ручейников обнаружены только в холодных карстовых зонах за исключением лишь одной личинки Hydroptila sp., встреченной в термальном источнике. Самыми многочисленными были ювенильные личинки Rhyacophila.
В карстовых зонах руч. Пымвашор отмечалась очень высокая численность поденок Baetis lapponicus (Bengtsson), при этом в руч. Горячий при температуре 26°С встречено лишь три личинки этого вида. Все другие виды поденок встречались единично лишь в карстовых зонах (табл. 2).
Веснянки в бентосе были представлены шестью видами, среди которых в самом руч. Пымвашор, как в термальных, так и в карстовых зонах, наиболее часто встречались и количественно преобладали ювенильные личинки Capnia. В термальных источниках веснянки не обнаружены.
Из жуков доминирующими по встречаемости и численности всюду были личинки и имаго Oulimnius tuberculatus (Müller).
Отряд двукрылых представлен восемью семействами, наиболее многочисленными и разнообразными из которых были хирономиды.
Состав хирономид бассейна руч. Пымвашор включает 36 таксонов из 5 подсемейств: Orthocladiinae – 19, Chironominae – 11, Tanypodinae – 3, Diamesinae – 2, Prodiamesinae – 1. Наибольшее разнообразие хирономид отмечено в руч. Пымвашор, где обнаружено 25 таксонов. В термальных зонах ручья и термальных источниках выявлено по 24 таксона хирономид, в карстовых зонах и источниках обнаружено меньшее их количество (табл. 2). Несмотря на то, что основная масса видов хирономид относились к эвритермным, выявлены некоторые особенности состава хиромидофауны в теплых и холодных источниках (табл. 2). Комплекс видов, доминирующих по встречаемости и численности в бассейне руч. Пымвашор, формируют Eukiefferiella claripennis, Eukiefferiella gracei (Edwards), Cricotopus bicinctus (Meigen) и Cricotopus trifascia (Edwards). Ряд видов хирономид, таких как Thienemannimyia geijskesi (Goetghebuer) и C. bicinctus, встречались как в холодных, так и термальных источниках с диапазоном температур от 5 до 27°С.
Личинки других семейств двукрылых отмечались в составе зообентоса руч. Пымвашор единично. В термальных источниках несколько выше, по сравнению с карстовыми, была численность Tipulidae, в карстовых – Psychodidae.
Фауна всех амфибиотических насекомых в термальных и карстовых источниках существенно различалась (Is = 0.31), более высоким сходство фауны установлено для термальных и карстовых зон руч. Пымвашор (Is = 0.54).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В летний период температура воды термальных источников урочища Пымвашор оказалась сопоставима или была даже ниже зимней, когда при температуре воздуха –30°С вода сохраняла температуру до 20.3–28.5°С (Функционирование…, 2011). Полученные нами показатели минерализации и pH в руч. Пымвашор и его притоках в целом соответствовали таковым, полученным зимой (Функционирование…, 2011). Так же как в период ледостава некоторые источники характеризовались повышенной величиной минерализации воды, характерным запахом и цветом донных осадков, что позволяет предположить особенный химический состав их сред в разных источниках и в летнее время: хлоридно-натриевый, сульфатный, железосодержащий.
По сравнению с результатами зимних исследований гидротермальной экосистемы урочища Пымвашор (Функционирование…, 2011), когда было обнаружено 11 групп донных беспозвоночных (из них 3 семейства моллюсков), зообентос в летний период был гораздо более разнообразным. Дополнительно к имеющемуся списку нами обнаружены как представители мейобентоса (нематоды и низшие ракообразные), так и макрозообентоса (полуводные коллемболы и пауки, поденки, семь семейств двукрылых). Из таксонов макрозообентоса летом не найдены только указанные ранее редкие личинки стрекоз. Наиболее многочисленными (97% от общей численности зообентоса) в зимний период во всех зонах руч. Пымвашор были моллюски, представленные пятью видами, остальные группы составляли ≤1%. Авторы зимних исследований подчеркнули (Болотов и др., 2012), что специфические сообщества гастроподного типа, где доминантами выступают моллюски из сем. Lymnaeidae и Planorbidae, формируются в большинстве исследованных термальных источников мира. При этом остальные группы зообентоса немногочисленны и не играют значимой роли в населении гидротерм. В августе в большинстве изученных нами термальных источников количественно преобладали олигохеты. Эти черви постоянно присутствовали в донных сообществах разных по условиям биотопов и характеризовались высоким видовым богатством, причем показатели их разнообразия отличались в теплых и холодных зонах несущественно, а вклад в обилие зообентоса возрастал при повышенных температурах. Для большинства учтенных групп организмов наблюдалось обеднение разнообразия, кроме семейства хирономид, и понижение количественного развития в источниках по сравнению с руслом ручья и в теплых водах по сравнению с холодными. Это связано с наличием в холодных и термальных гидроэкосистемах комплекса факторов, негативных для развития зональной фауны беспозвоночных: повышенной температуры, общей минерализации, присутствия сероводорода и т.д. Воздействие на фаунистическое разнообразие пресноводных беспозвоночных сероводорода и повышенной минерализации воды мы обсуждали ранее (Лоскутова и др., 2020). Рост температуры может усиливать отрицательный эффект воздействия этих факторов, вызывая дисгармонию в совокупности химических реакций, лежащих в основе жизненных процессов гидробионтов, особенно холодолюбивых (Адаменко, 1985). Так с повышением температуры растет их потребность в кислороде, а с изменением минерализации меняются плотность и вязкость среды их обитания, и в свою очередь, экологическое значение температуры.
Преобладание в составе мейофауны остракод наряду с нематодами и гарпактикоидами ранее отмечалось в холодных родниках Прибайкалья (Тахтеев и др., 2010). В этих водоемах гарпактикоиды были представлены обычным в Большеземельской тундре (Фефилова, 2015) видом Attheyella nordenskioldii, который в Прибайкалье является арктическим реликтом, выходящим далеко за южную границу основного ареала (Тахтеев и др., 2010). Полученные нами данные по распределению гарпактикоиды A. nordenskioldii в экосистемах руч. Пымвашор подтверждают ее принадлежность к стенотермным холодолюбивым организмам. Новые сведения об экологии микроракообразных связаны с находкой другой гарпактикоиды – B. cf. pygmaeus. Эта форма была указана впервые для Большеземельской тундры, ранее ее единичные особи регистрировались нами лишь в Вычегодском бассейне и таежной части Печорского (Фефилова, 2015), в том числе в холодном сероводородном источнике руч. Иска-шор, где популяция рачка характеризовалась высоким обилием (Лоскутова и др., 2020). Таким образом, благодаря установленным особенностям распределения B. cf. pygmaeus в исследованных бассейнах и руч. Пымвашор складывается представление о связи происхождения этой гарпактикоиды с подземными водами, а кроме того, об исключительно широком диапазоне ее экологических возможностей. Диапазон температур, минерализации, химического состава воды, при которых встречался B. cf. pygmaeus, позволяет отнести его к экстримофилам (среди копепод).
Все выявленные в летнее время в водоемах урочища Пымвашор виды олигохет отмечались ранее в водоемах Большеземельской тундры (Попченко, 1978; Финогенова, 1966; Baturina et al., 2020). Большинство видов наидид, обнаруженных в исследованных водотоках, являются эвритермными, к холодноводным стенотермным относится лишь N. elinguis, отмеченный только в ручье Пымвашор в термальной зоне при температуре 15.4°С (табл. 2). Возможно, этот факт подтверждает мнение (Тимм, 1987), что вид является оппортунистическим, способным развиваться в экстремальных условиях абиотической среды. В зимних пробах (по неопубликованным данным) олигохеты: виды сем. Lumbriculidae (Lumbriculus sp., Rhynchelmis sp.), сем. Lumbricidae (Eiseniella tetraedra (Savigny)), п/сем Tubificinae (Spirosperma ferox) встречены только в руч. Горячем и термальных ручьях. Виды Rhynchelmis sp. и S. ferox в летних пробах были встречены тоже только в термальных источниках. Крупные черви р. Rhynchelmis, как и большинство люмбрикулид, относятся к холодолюбивым, однако в наших сборах они отмечены при температуре 17.0–22.0°C зимой и 26.0°C летом.
Ранее было показано (Lewin et al., 2013), что таксоны EPT очень чувствительны к температуре. Подтвердился тот факт, что холодные воды характеризуются большим разнообразием насекомых таксонов EPT, чем термальные (Zivić et al., 2006). Причиной этого является происхождение ряда групп бентосных насекомых, за исключением поденок и стрекоз, из холодных проточных вод, и если даже некоторые из них адаптировались к теплым непроточным водам в процессе эволюции, то большинство остаются лучше адаптированными к холоду, чем к теплым водным местообитаниям (Mitchell et al., 1974; Ward, Stanford, 1982; Pritchard et al., 1996). Все обнаруженные нами таксоны амфибиотических и водных насекомых известны как обычные представители донной фауны северных рек (Биоразнообразие…, 2007). Подавляющее их число зарегистрировано в холодных карстовых зонах бассейна руч. Пымвашор. Например, личинки веснянок, встреченные зимой в термальных источниках единично (Функционирование…, 2011), нами обнаружены исключительно в карстовых зонах. Считается, что поденки, в целом адаптированы к более теплым условиям (Pritchard et al., 1996), однако многие виды, например, Baetis lapponicus широко распространены на Севере, массово встречаются в холодных реках Полярного Урала (Биоразнообразие…, 2007).
В термальных водах Сербии (Zivić et al., 2006) и Новой Зеландии (Duggan et al., 2007), напротив, было отмечено полное отсутствие поденок. В наших сборах в термальных источниках поденки также не обнаружены за исключением руч. Горячий, где найдены единичные ювенильные личинки.
Редко встречающиеся в термалях зимой малочисленные личинки двукрылых в летнее время отмечались в значительных количествах в большинстве проб, причем представители двукрылых были достаточно разнообразны (относились к 7 семействам). Согласно Г. Притчарду (Pritchard, 1991), двукрылые – наиболее многочисленный и разнообразный отряд насекомых, чьи личинки развиваются в термальных ручьях, температура воды и субстрата которых не превышает 35°С (Пржиборо, 2011). Согласно исследованиям термальных источников разных географических зон (Пржиборо, 2011), двукрылые в них отличаются бедностью видового состава и сходны по структуре фауны на уровне родов и семейств. Было показано (Pritchard, 1991), что в гидротермах численность и биомасса хирономид при повышении температуры уменьшаются. Нами также установлено, что количественные характеристики развития личинок хирономид в исследованных водоемах различались по температурному градиенту: наибольшая численность наблюдалась в русле руч. Пымвашор с умеренными температурами от 10 до 15°С, а минимальная – в термальных источниках.
Характерной чертой исследованных нами термальных и карстовых источников является полное отсутствие амфипод, являющихся постоянным, а иногда и доминирующим компонентом фауны источников других регионов России (Тахтеев и др., 2000, 2006; Еропова и др., 2016). Другой особенностью является отсутствие реликтов и эндемиков (моллюсков, подземных амфипод и ручейников), которые характерны для других термальных экосистем (Жадин, 1950; Леванидов, Леванидова, 1976; Ситникова, Тахтеев, 2006; Тахтеев и др., 2010; Еропова и др., 2016), что, впрочем, не исключает возможности их присутствия в другие сезоны или среди организмов, чья видовая принадлежность не была установлена.
Предполагается (Болотов и др., 2012), что наибольшего разнообразия и количественного развития в гидротермах достигают виды, формирование которых шло по пути приспособления к освоению экстремальных местообитаний. Такие приспособления могут проявляться в адаптивном поведении, географической, локальной и сезонной изменчивости, адаптивной ритмике биологических процессов и т.д. (Чернов, 2008), в формировании маловидовых сообществ с высокой плотностью отдельных видов (Болотов и др., 2012). В гидротермальных экосистемах эта закономерность выполняется для доминирующих групп беспозвоночных (Zivić et al., 2006): обычно в каждой из них по численности превалирует один вид. В термальных источниках урочища Пымвашор среди олигохет доминировал только N. communis, из хирономид – Chironomus anthracinus. Копеподы формировали моновидовые таксоценозы, представленные одним видом Harpacticoida – B. cf. pygmaeus.
Ранее было показано (Болотов и др., 2012), что в зимних сообществах руч. Пымвашор моллюски реагируют на особенный температурный режим укорочением жизненных циклов, уменьшением размеров особей, круглогодичным размножением. Высокая биомасса зообентоса в термальных источниках Сербии, например, также была обусловлена высокой численностью гастропод, которые из всех макробеспозвоночных показывают наивысшую степень термофилии (Pennak, 1953). Большинство найденных нами в руч. Пымвашор таксонов имеет весьма широкое географическое распространение, их успешное развитие в гидротермах было бы невозможным без эффективных приспособлений к изменениям температуры в выявленном диапазоне. Известно, что олигохеты, например, адаптируются к существованию при тепловом стрессе созданием агрегированных популяций (Kalinnikova et al., 2003), ускоренным темпом бесполого размножения (Lochhead, Learner, 1983; Chapman, Mitchell, 1986). Последнее явление, по видимому, наблюдалось в одном из обследованных нами источников – “Бассейн”. Здесь отмечалась наибольшая численность эвритермных N. communis и N. variabilis, большинство особей которых находилось в процессе паратомического деления (их цепочки состояли из двух-трех зооидов). Физиологические адаптации к пониженным концентрациям кислорода личинок хирономид рода Chironomus связаны с особенным составом их крови, содержащей уникальный гемоглобин (Большаков, Фефилова, 2020). Такие же адаптации предполагались нами ранее для гарпактикоиды B. cf. pygmaeus, развивающейся в условиях повышенной минерализации и высокой концентрации сероводорода в источнике руч. Иска-Шор (Лоскутова и др., 2020) и найденной в источниках руч. Пымвашор.
ЗАКЛЮЧЕНИЕ
В летнее время донные сообщества гидротермальной экосистемы руч. Пымвашор представлены 23 таксономическими группами организмов, что характеризует их как значительно более разнообразные по сравнению с зимними. В отличие от количественно доминирующих в зимнее время брюхоногих моллюсков, летом в составе донных сообществ термалей преобладали олигохеты либо хирономиды, причем последние отличались здесь низким количественным развитием, но большим разнообразием по сравнению c холодными водами. Однако для большинства учтенных групп организмов наблюдалось обеднение видового богатства и понижение количественного развития в источниках по сравнению с руслом ручья и в теплых водах по сравнению с холодными. Это связано с наличием в холодных и термальных гидроэкосистемах условий, негативных для развития зональной фауны беспозвоночных. Своеобразные бентосные сообщества термальных источников существенно отличались от таковых холодных вод: в них зарегистрировано небольшое число таксономических групп беспозвоночных и низкая численность зообентоса, биомасса имела схожие значения. Донные сообщества всех обследованных биотопов урочища представлены в основном группами и видами, характерными для Большеземельской тундры. Однако в их составе присутствовали виды, впервые встреченные на этой широте – представители азональной фауны. К ним относилась гарпактикоида B. cf. pygmaeus, в массе развивающаяся лишь в источниках (холодных и горячих). Вероятно, что северная граница ареала этого вида на северо-востоке европейской части России определяется распространением подземных вод и их воздействием на поверхностные гидроэкосистемы. Особенностью исследованной экосистемы является отсутствие реликтов и эндемиков, которые характерны для термальных вод других регионов. Структура зообентоса руч. Пымвашор достаточно однообразна вне зависимости от отепляющего или охлаждающего влияния источников и соответствуют характерным для региона показателям.
Благодарности. Авторы благодарят Ю.С. Рафикову за помощь в определении личинок ручейников и двукрылых (без хирономид).
Финансирование. Работа выполнена в рамках государственного задания ИБ ФИЦ Коми НЦ УрО РАН по теме “Разнообразие и пространственно-экологическая структура животного населения европейского северо-востока России и сопредельных территорий в условиях изменения окружающей среды и хозяйственного освоения” № 1021051101423-9-1.6.12;1.6.13;1.6.14 и при поддержке грантов РФФИ: 18-44-110017 р_а, 20-04-00145А.
Список литературы
Адаменко В.Н. Климат и озера (К оценке настоящего, прошлого и будущего). Л.: Гидрометеоиздат, 1985. 264 с.
Беспалая Ю.В., Болотов И.Н, Усачева О.В. Население моллюсков субарктической гидротермальной экосистемы в зимний период // Зоол. журн. 2011. Т. 90. № 11. С. 1304–1322.
Биоразнообразие экосистем Полярного Урала / Отв. ред. М.И. Гецен. Сыктывкар, 2007. С. 90–112.
Болотов И.Н., Беспалая Ю.В., Усачева О.В. Экология и эволюция гидробионтов в горячих источниках Субарктики и Арктики: формирование аналогичных сообществ, адаптации видов и микроэволюционные процессы // Усп. совр. биол. 2012. Т. 1. С. 77–86.
Большаков В.В., Фефилова Е.Б. Особенности кариотипа и состав гемоглобинов комара-звонца Chironomus sp. Ya3 (Diptera, Chironomidae) из дельты реки Печора // Зоол. журн. 2020. Т. 99. № 1. С. 39–44.
Еропова И.О., Тахтеев В.В., Ситникова Т.Я., Хадеева Е.Р., Лопатовская О.Г. Макрозообентос некоторых термальных источников Северного Прибайкалья в ранневесенний период // Байкальский зоологический журн. 2016. Вып. 2(19). С. 54–60.
Жадин В.И. Жизнь в источниках / Ред. Павловский Е.Н., Жадин В.И. // Жизнь пресных вод СССР. М.–Л.: Изд-во АН СССР, 1950. Т. 3. С. 707–724.
Ивановский А.А. Типы сообществ макрозообентоса в родниках Пензенской области // Вест. МГОУ. Сер. Естественные науки. 2010. № 3. С. 72–79.
Круглов Н.Д., Старобогатов Я.И. Морфология и систематика моллюсков подрода Radix рода Lymnaea из Сибири и Дальнего Востока СССР // Зоол. журн. 1989. Т. LXVIII(68). Вып. 5. С. 17–30.
Леванидов В.Я., Леванидова И.М. Первые итоги изучения фауны пресноводных беспозвоночных Чукотского п-ва // Пресноводная фауна Чукотского п-ва. 1976. Т. 36(139). С. 3–14.
Лоскутова О.А., Кононова О.Н., Кондратьева Т.А., Фефилова Е.Б., Батурина М.А., Кудрин А.А., Рафикова Ю.С. Сообщества беспозвоночных в сероводородных источниках крайнего Севера (бассейн р. Уса, Россия) // Тр. КарНЦ РАН. Серия “Биогеография”. 2020. № 1. С. 71–86.
Паньков Н.Н., Крашенинников А.Б. Зообентос родников Урала и Предуралья (Пермское Прикамье) // Вест. Пермского унив-та. Биология. 2012. Вып. 1. С. 18–24.
Песенко Ю.А. Принципы и методы количественного анализа в фаунистических исследованиях / Ю.А. Песенко. М.: Наука, 1982. 287 с.
Попченко В.И. Малощетинковые черви // Флора и фауна водоемов Европейского Севера / Ред. Гецен М.В. Л.: Наука, 1978. С. 51–58.
Пржиборо А.А. Разнотипные термальные источники восточной Палеарктики как биотопы для двукрылых – сходства и различия таксономической структуры // Экология малых рек в 21 в.: биоразнообразие, глобальные изменения и восстановление экосистем. Тольятти, 2011. С. 134.
Ситникова Т.Я., Тахтеев В.В. Брюхоногие моллюски (Gastropoda) и горячих источников Прибайкалья // Гидробиология водоемов юга восточной Сибири (Биоразнообразие Байкальского региона: Труды биолого-почвенного факультета ИГУ. Вып. 6). Иркутск: Изд-во Иркут. ун-та, 2006. С. 137–150.
Тахтеев В.В., Галимзянова А.В., Амбросова Е.В., Кравцова Л.С., Рожкова Н.А., Окунева Г.Л., Семерной В.П., Помазкова Г.И., Лопатовская О.Г. Сообщества зообентоса и их сезонная динамика в незамерзающих источниках Прибайкалья // Изв. РАН. Сер. биол. 2010. № 6. С. 740–749.
Тахтеев В.В., Ижболдина Л.А., Помазкова Г.И. и др. Биота некоторых термальных источников Прибайкалья и связанных с ними водоемов // Исследования водных экосистем Восточной Сибири. Иркутск: Изд-во Иркут. ун-та, 2000. С. 55–100.
Тахтеев В.В., Судакова Е.А., Егорова И.Н. и др. К характеристике водных и наземных биоценозов в местах выходов термальных источников в восточном Прибайкалье // Гидробиология водоемов юга Восточной Сибири. Иркутск: Изд-во Иркут. ун-та, 2006. С. 111–136.
Тимм Т. Малощетинковые черви (Oligochaeta) водоемов Северо-Запада СССР / Брауер М., Метсар Ю. Таллин: Валгус, 1987. 298 с.
Фефилова Е.Б. Веслоногие раки (Copepoda) // Фауна европейского Северо-Востока России. Веслоногие раки. Т. XII. М.: КМК, 2015. 319 с.
Финогенова Н.П. Малощетинковые черви Вашуткиных озер // Гидробиологическое изучение и хозяйственное освоение озер Крайнего Севера СССР. М.: Наука, 1966. С. 63–70.
Функционирование субарктической гидротермальной экосистемы в зимний период / Ред. Боголицин К.Г., Болотов И.Н. Екатеринбург: УрО РАН, 2011. 252 с.
Чернов Ю.И. Экология и биогеография. Избранные работы. М.: КМК, 2008. 580 с.
Чертопруд М.В. Родниковые сообщества макробентоса Московской области // Журн. общ. биол. 2006. Т. 67. № 5. С. 376–384.
Шубина В.Н. Бентос лососевых рек Урала и Тимана / Ред. Н.Н. Смирнов. С.-Пб.: Наука, 2006. 401 с.
Щербаков А.В. Термальные воды // Справочное руководство гидрогеолога. Л.: Недра, 1979. Ч. 1. С. 163–176.
Baturina M.A., Kaygorodova I.A., Loskutova O.A. New data on species diversity of Annelida (Oligochaeta, Hirudinea) in the Kharbey lakes system, Bolshezemelskaya tundra (Russia) // ZooKeys. 2020. V. 910. P. 43–78.
Chapman P.M., Mitchell D.G. Acute tolerance tests with the oligochaetes Nais communis (Naididae) and Ilyodrilus frantzi (Thbificidae) // Hydrobiologia. 1986. V. 137. P. 61–64.
De Jong G., Canton S.P., Chadwick J.W. Macroinvertebrates occurring in sunbeam hot spring in Idaho, USA // J. Freshwater Ecology. 2005. V. 20(3). P. 611–613.
De Mattia W. A new subterranean hydrobiid from thermal spring in eastern Slovenia: “Iglica” velkovrhi n.sp. (Gastropoda: Prosobranchia: Hydrobiidae) // Mollusca. 2007. V. 25(1). P. 27–31.
Duggan I.C., Boothroyd I.K.G., Speirs D.A. Factors affecting the distribution of stream macroinvertebrates in geothermal areas: Taupo Vocanic zone, New Zealand // Hydrobiologia. 2007. V. 592(1). P. 235–247.
Erséus C., Wetzel M.J., Gustavsson L.N. IZCD rules – a farewell to Tubificidae (Annelida, Clitellata). Zootaxa. 2008. V. 1744(1): 66–68.
Friberg N., Dubkjaer J.B., Olaffson J.S., Gislason G.M., Larsen S.E., Lauridsen T.L. Relationships between structure and function in streams contrasting in temperature // Freshwater Biol. 2009. V. 54. P. 2051–2068.
Illies J. Die Mölle. Faunistisch-ökologische Untersuchungen an einem Forellenbach im Lipper Bergland // Arch. Hydrobiol. 1952. V. 46. P. 424–612.
Kalinnikova T.B., Gainutdinov T.M., Seraziev R.Kh., Gainutdinov M.Kh. The effect of ambient temperature on intraspecific interactions controlling heat Tolerance in the oligochaetes Enchytraeus albidus and Tubifex tubifex // Rus. J. Ecology. 2003. V. 34. № 3. P. 198–201.
Lewin I., Czerniawska I., Lawniczak A., Jusik S. Biological indices applied to benthic macroinvertebrates at reference conditions of mountain streams in two ecoregions (Poland, the Slovak Republic) // Hydrobiologia. 2013. V. 709. P. 83–200.
Lochhead G., Learner M.A. The effect of temperature on asexual population growth of three species of Naididae (Oligochaeta) // Hydrobiologia. 1983. 98. P. 107–112.
Milner M.A., Brittain E.J., Castella E., Petts E.G. Trends of macroinvertebrate community structure in glacier-fed rivers in relation to environmental conditions: a synthesis // Freshwater Biol. 2001. V. 46. P. 1833–1847.
Mitchell R. The evolution of thermophily in hot springs // Q. Rev. Biol. 1974. V. 49. P. 229–242.
Pennak R.W. Freshwater invertebrates of the United States. Gastropoda. New York: The Ronald Press Company, 1953. Chapter 36. 681 p.
Pritchard G. Insects in thermal springs // The Memoirs of the Entomological Society of Canada. 1991. V. 123. Sup. 155. P. 89–106.
Pritchard G., Harder L.D., Mutch R.A. Development of aquatic insect eggs in relation to temperature and strategies for dealing with different thermal environments // Biol. J. Linnean. Soc. 1996. V. 58. P. 221–244.
Savić A., Dmitrović D., Pešić V. Ephemeroptera, Plecoptera and Trichoptera assemblages of karst springs in relation to some environmental factors: a case study in central Bosnia and Herzegovina // Turk. J. Zool. 2017. V. 41. P. 119–129.
Suzuki A.C., Kagoshima H., Chilton G., Grothman G.T., Johansson C., Tsujimoto M. Meiofaunal Richness in Highly Acidic Hot Springs in Unzen-Amakusa National Park, Japan, Including the First Rediscovery Attempt for Mesotardigrada // Zool. Sci. 2017. V. 34(1). P. 11–17.
Ward V.J., Stanford A.J. Thermal responses in the evolutionary ecology of aquatic insect // Annu. Rev. Entomol. 1982. V. 27. P. 97–117.
Zivić I., Marković Z., Brajković M. Influence of the temperature regime on the composition of the macrozoobenthos community in a thermal brook in Serbia // Biologia, Bratislava. 2006. V. 61(2). P. 179–191.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


