Известия РАН. Серия биологическая, 2022, № 4, стр. 351-362
Интерференция факторов в конкурентном взаимодействии чужеродного вида Pulmonaria saccharata (Mill) с банком семян в условиях интродукции
Е. В. Черняева 1, *, В. П. Викторов 1
1 Московский государственный педагогический университет
129164 Москва, ул. Кибальчича, 6/3, Россия
* E-mail: ev.chernyaeva@mpgu.su
Поступила в редакцию 18.03.2021
После доработки 16.05.2021
Принята к публикации 20.12.2021
- EDN: KPBMHU
- DOI: 10.31857/S1026347022040059
Аннотация
В опытных посадках чужеродного вида – медуницы Pulmonaria saccharata обнаружен транспорт фитотоксичных фенолов со смывами с листьев в почву подкроновой области. При концентрации в смывах от 0 до 15.7 мкг/мл содержание фенолов в почве достигало 13.9 мкг/г. Показатели биомассы, отрастающей из банка семян растительности, достоверно зависели от накопления почвой фенольных веществ, интенсивности вегетативного размножения P. saccharata и освещенности. Эффект плотностно-зависимой аллелопатии вызвал лаг-фазу в накоплении фенолов почвой. Предложена модель фенологически согласованного взаимодействия конкурентных признаков вида, включающиего аллелопатический фактор. Отмечено, что предложенный подход может способствовать выяснению специфичности влияния чужеродных видов на аборигенные виды и сообщества.
В ряде исследований особая роль в успешности инвазивных видов отведена аллелопатии – способности растений с помощью фитотоксичных экзометаболитов подавлять рост конкурентов. Мета-анализ глобальной библиотеки исследований в области аллелопатии выявил продуцирование большинством изученных инвазивных видов (51.4%) аллелопатических веществ и распространение аллелопатии в 71% семейств высших растений (Kalisz et al., 2021). По данным еще одного мета-анализа 384-х исследований чужеродные, в том числе инвазивные виды, подавляют ростовые процессы аборигенных видов чаще и в большей степени, чем другие аборигеные виды (Zhang et al., 2020).
Учитывая большое разнообразие экзометаболитов, производимых растениями, высока вероятность существования столь же разнообразных механизмов, лежащих в основе успеха инвазий – от прямых аллелопатических воздействиий (Callaway, Ridenour, 2004; Fujii, 2017) до косвенных через взаимодействие с почвой (Dalton et al., 1989; Blum at al., 1999; Klironomos, 2002), почвенными микроорганизами (Blum, Gerig, 2005; Zhu et al., 2011), арбускулярной микоризой (Blossey, NoEtzold, 1995; Callaway et al., 2008; Ehlers, 2011). К настоящему времени сложилось устойчивое мнение о необходимости учета большого количества разнообразных факторов, влияющих на проявление аллелопатии, в том числе биогеографического (Yuan et al., 2012; Lyytinen, Linsdstrom, 2019), фенологического (Reigosa, Carballeira, 2016), метеорологического (Goldenstein, Suding, 2014). Гипотеза “плотностно-зависимой аллелопатии” предполагает зависимость дозы фитотоксина, получаемой каждой особью вида-мишени, от плотности его популяции (“density-dependent allelopathy”: Thijs et al., 1994; Belz et al., 2005; Barto, Chipollini, 2009; Симагина, 2010). Степень детерминированности аллелопатических эффектов, в особенности механизмов транспорта экзометаболитов, от биотических и абиотических факторов, ставит под сомнение феномен аллелопатического преимущества инвазивных видов.
В то же время растет число сообщений о более высокой конкурентности видов с аллелопатическими свойствами (Nilsson, 2004; He et al., 2012; Quasem, 2017; Liu et al., 2020). При этом сами аллелопатические эффекты оценены как сравнительно слабые, вклад аллелопатии в общую конкурентность изученных видов в среднем не превышал 10–25%, влияние фактора корневой конкуренции значительно превалировало. В настоящее время вопрос о возможности экспериментального разделения эффектов аллелопатии и ресурсной конкуренции остается дискуссионным (Weidenhamer, 1989; Weidenhamer et al., 1989; Inderjit, del Moral, 1997; Uddin, Robinson, 2017). В свете изложенных проблем актуальным является экологически реалистичное изучение механизмов интерференции конкурентных признаков и аллелопатического фактора, выявление условий реализации аллелопатического потенциала растений. Предполагается, что иерархия ответной реакции целевых видов образует ряд: аллелопатия < конкуренция < аллелопатия + конкуренция (Fernandez et al., 2016).
Чужеродный вид медуница сахарная или белопятнистая Pplmonaria. saccharata Mill. является интересным объектом для изучения эколого-физиологического аспекта аллелопатии в целях лучшего понимания механизмов биоинтерференции, способствующих инвазиям. По нашим наблюдениям, в многолетних куртинах медуницы практически отсутствует сорная растительность. В своем предыдущем исследовании мы обнаружили биологическую активность экстрактов листьев и вытяжек почвы из подкроновой области P. saccharata (Chernyaeva, Viktorov, 2020). Обнаруженная фитотоксичность почвы означает, что средопреобразующее воздействие P. saccharata может вызывать трансформацию почвенного банка семян. Хотя исследования в этом направлении установили высокую вариабельность эффектов, чаще незначительные изменения разнообразия и численности банков семян, и меньшую чувствительность по сравнению с вегетирующей растительностью (Gooden, French, 2014; Gioria et al., 2014; Веселкин и др., 2018), этот вопрос требует дальнейшего изучения.
Мы предположили, что экзометаболиты медуницы транспортируются в почву в виде смывов естественными осадками. Целью работы было определение вклада алелопатического фактора P. saccharata в подавление конкурирующей растительности в сопоставлении с другими конкурентными, или влияющими на конкурентность факторами – плотностью листового полога, интенсивностью вегетативного развития и размножения, условиями освещения.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. P. saccharata – коротко-корневищный травянистый поликарпик, мезоксерофит южноевропейского происхождения из семейства Boraginaceae (Juss.), введен в культуру в XVIII в. в качестве лекарственного и декоративного почвопокровного растения, вторичный ареал охватывает весь умеренный пояс (Puppi, Cristofolini, 1996). Размножается преимущественно вегетативно, образует напочвенный покров высотой 0.35–0.45 м. Летние листья в условиях Подмосковья вегетируют до установления снежного покрова, далее часть из них остаются зелеными до конца весны следующего года. P. saccharata свойственен весенне-летне-осеннезеленый феноритмотип, в условиях интродукции сезонные ритмы устойчивы, вид адаптировался к новым условиям обитания (Васильева, Фомина, 2016). Для представителей семейства Boraginaceae характерно густое опушение из железистых волосков (трихом), способных накапливать вторичные метаболиты фенольной природы (Тамахина, Ахкубекова, 2018).
Эксперимент разработали с учетом представления о динамическом течении процесса конкуренции (Trinder et al., 2013). Для этого в опытной посадке (новопосадке) проводили определение биологической активности и содержания суммы фенольных соединений в почве и смывах с листьев (1) в течение одного вегетационного сезона, фиксировали интенсивность вегетативного размножения особей P. saccharata (2) при разной плотности посадки (3) и освещенности (4). Одновременно под листовым пологом медуниц cобирали образцы свободно произрастающей из семян почвенного банка растительности (травостоя) для определения влияния названных факторов на ее биомассу.
Закладка опытных посадок. Посадочный материал P. saccharata получили из коллекции почвопокровных растений учебно-опытного участка кафедры ботаники МПГУ (Черняева и др., 2014). Опытные посадки заложили в третьей декаде августа 2019 г. на территории городского округа Пушкино Московской области на многолетней залежи близи опушки соснового бора (56°06′00′′ с.ш., 37°83′84.5′′ в.д.). Две пары гряд (2 × 3.5 м каждая гряда) с дерново-подзолистой почвой суглинистого состава расположили на расстоянии 3 м друг от друга на открытой хорошо освещенной площадке. Первая пара гряд – вариант опыта “L” (“light”). Вторую пару гряд затенили притеночными щитами таким образом, чтобы интервалы прямого солнечного освещения не превышали 4 ч в день в совокупности – вариант опыта “S” (“shade”). Все локации находились вдали от крупных деревьев и кустарников, в окружении естественно произрастающего разнотравья. На каждую гряду высадили по 50 особей P. saccharata. Пары гряд отличались плотностью высадки растений – 25 × 25 см и 45 × 45 см (варианты опыта “L25”, “L45”, “S25”, “S45”). При посадке в почву не вносили удобрения, предварительно выбрали корневища многолетних растений, обработку гербицидами и ручную прополку в течение эксперимента не проводили. В образцах почвы с каждой гряды определили pHводный в соотношении почвы и воды 1 : 5 с помощью анализатора Checker® pH Tester HI 98103 “Hanna Instruments” (pH 6.5–6.7). В течение вегетационного сезона 2020 г. проводили сбор образцов и мониторинг развития растений.
Смывы с листьев. Пластиковые кюветы с закрепленной по верху пластиковой сеткой 5 × 5 мм расставили на отрезки геотекстиля (для устранения попадания почвы) под листовым пологом медуниц по 5 шт. на гряду рандомизированно (всего 20 шт.). Смывы собирали после дождя немедленно, обьединяли в один смешанный образец, фильтровали через двойной бумажный фильтр “Красная лента” и помещали в закрытые стеклянные емкости. В качестве контроля использовали дождевую воду, собранную в кюветы с сеткой на открытой площадке без растительности не далее 10 м от опытных растений. Искусственные смывы с листьев получали двумя методами. Срезанные листья помещали в сосуды с дистиллированной водой в соотношении 1 : 4 масса листьев/объем экстрагента на 24 ч. Срезанные листья весом 300 г раскладывали на решетке и омывали мелкодисперсным потоком водопроводной воды объемом 500 мл. Полученные образцы использовали для биотестов и определений в тот же день или хранили при 4°C в течение 1–2 сут до анализа.
Образцы почвы. Образцы почвы собирали в первой декаде каждого месяца из-под полога медуниц с глубины 0–5 см методом “конверта” по 10 образцов с каждой гряды, из них получали один смешанный образец. Первый образец взяли с гряд до высадки растений. Почву высушили до воздушно-сухого состояния и просеяли через сито с ячейкой 2 мм, далее хранили при комнатной температуре в бумажных пакетах.
Образцы травостоя. В первой декаде каждого месяца с мая по октябрь с гряд собирали по 5 образцов травостоя по 1 дм2. каждый, рандомизированно. Первые образцы собрали через две недели после посадки в первой декаде сентября 2019 (“X19”). Почву с растениями вырезали садовым ножом на глубину 10 см, корни отмывали водопроводной водой, полученные образцы высушивали до воздушно-сухого состояния и хранили при комнатной температуре в бумажных пакетах. Для определения сухого веса (биомассы) собранные образцы поместили на 72 ч в термостат при 70°С и затем взвесили на аналитических весах.
Биотесты. Биологическую активность смывов и образцов почвы определяли по стандартной методике. В контрольных вариантах использовали дождевую воду и почву с гряд до высадки растений. В качестве тест-культуры во всех биотестах использовали кресс салат сорта Весенний, предварительно тестировали семена на всхожесть по ГОСТу (97%). Биотесты проводили в 2-х биологических и 5-ти аналитических повторностях. Ежесуточно в течение 5 дней отмечали всхожесть, длину корней и гипокотиля.
Определение суммарного содержания растворимых фенольных соединений. В образцах почвы и смывах с листьев содержание суммы фенолов определяли спектрофотометрическим методом Фолина и Чокальтеу в модификации Синглетона и Росси (Singleton et al., 1999; Коннова и др., 2015). Фенольные соединения почвы экстрагировали 24 ч в соотношении 1 : 1.5 w/v, в качестве экстрагента использовали 80%-ный этиловый спирт. Вытяжки центрифугировали 5000 об./мин 20 мин на центрифуге, супернатант использовали для определений. Оптическую плотность измеряли при 765 нм на спектрофотометре SmartSpec Plus Spectrophotometer “BioRad Laboratories” (США). При построении градуировочной зависимости в качестве стандарта применяли галловую кислоту. Определение проводили в 2-х биологических и 5‑ти аналитических повторностях. Содержание суммы фенолов выражали в эквивалентах галловой кислоты в пересчете на единицу массы воздушно-сухой почвы или объема смывов.
Коэффициент вегетативного размножения (КВР). Число эпигеогенных корневищ с почками у каждой особи медуницы во всех вариантах опыта подсчитали во второй декаде мая.
Анализ данных. Относительную скорость роста (Relative Growth Rate) корня и гипокотиля проростков тест-культуры в биотестах рассчитали для второго, третьего и четвертого дней после посева семян по формуле:
Соотношение длины подземной и надземной частей проростков “Root/Aerial part ratio” (RA) расcчитали по данным 4-го дня от посева для опытных и контрольных растений в биотестах по формуле:
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
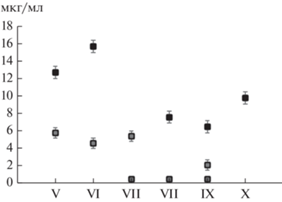
Содержание фенольных соединений и биологическая активность смывов с листьев. Концентрация фенолов в дождевых смывах в течение периода наблюдений варьировала от 0 до 15.7 мкг/мл (рис. 1), кислотность – от 5.8 до 6.2.
В смывах после слабых или длительных затяжных дождей, а также полученных искусственным способом, биологическая активность отсутствовала, содержание фенолов было ниже порога чувствительности метода определения. Самые высокие концентрации получали после кратковременных обильных осадков, однако и в этих случаях нередко фиксировали средние, низкие или нулевые значения (рис. 1, 2).
Рис. 2
Распределение осадков по месяцам и декадам в период вегетации P. saccharata в 2020 г. (по данным метеостанции в Шереметьево МО).

Образцы смывов с содержанием фенольных соединений 9–15 мкг/мл оказали следующее влияние на ростовые процессы тест-культуры. Первые 1–2 сут всхожесть семян в опыте превышала контрольные значения на 25–30%, затем показатели выравнивались. Первые и вторые сутки с момента прорастания наблюдали ускорение роста гипокотиля и корня проростков в 1.8–1.9 раза в сравнении с контролем (рис. 3).
Рис. 3
Влияние смывов с листьев P. saccharata на длину корня и гипокотиля проростков кресс-салата, содержание фенолов в образце 12.7 мкг/мл. RGRr – относительная скорость роста корня (а), RGRhp – относительная скорость роста гипокотиля (б); 2–4 – дни опыта. Темные столбцы – контроль, светлые столбцы – опыт. Бары – стандартная ошибка среднего. Разные буквы над столбцами обозначают различия между группами данных согласно Тьюки тесту на уровне p ≤ 0.05.

На третий день относительная скорость роста гипокотиля затормозилась до значения в 2.5 раза ниже контрольного, на четвертый – сравнялась с контролем.
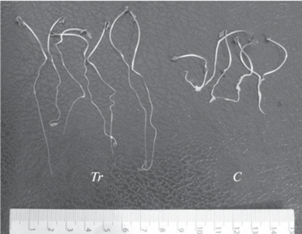
На четвертые сутки корни проростков опытного варианта значительно превосходили по длине корни контроля, что привело к достоверной, более чем трехкратной, разнице в соотношении надземной и подземной частей растений, (RA = = 1.71 ± 0.11 и 0.47 ± 0.03 соответственно, p < 0.001, Тьюки тест при n = 21). Корни опытных растений отличались повышенной жесткостью и прочностью, отсутствием всасывающих корешков (рис. 4).
Рис. 4.
Проростки кресс-салата на 4-ый день биотеста. Tr – влияние смывов с листьев P. saccharata, С – контроль (дождевая вода). Содержание фенолов в образце смывов 12.7 мкг/мл.
При концентрации фенольных веществ 4–7 мкг/мл смывы обладали меньшей активностью (удлинение корней на 10–35% по сравнению с контролем). Примерно в трети образцов регистрируемая активность отсутствовала.
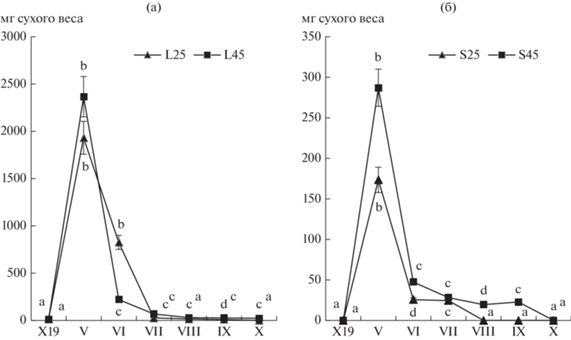
Содержание фенольных соединений и биологическая активность в образцах почвы. Образцы почвы с подготовленных гряд до высадки растений, содержали следовые количества фенолов. К весне следующего года концентрация фенолов увеличилось в 4–5 раз по вариантам опыта, в вариантах L25 и L45 к началу мая, в S25 и S45 – к началу июня (рис.5).
Рис. 5.
Динамика содержания фенолов в почве подкроновой области P. saccharata по вариантам опыта L (а) и S (б). V–X – месяцы. Бары – стандартная ошибка среднего. Разные буквы обозначают различия между группами данных согласно Тьюки тесту (Tukey HSD) на уровне p ≤ 0.05.
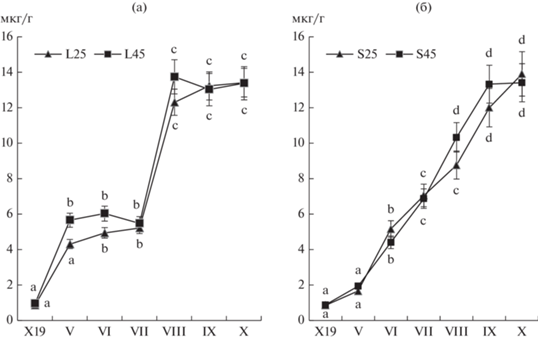
В вариантах L25 и L45 накопление фенолов почвой происходило неравномерно, с выраженными лаг-фазой в мае-июне. В течение июля содержание фенолов в почве более чем двукратно увеличилось и далее не изменялось до конца периода наблюдений. В вариантах S25 и S45 накопление происходило более равномерно.
Всхожесть семян в биотестах с почвой на второй день составляла 119%, удлинение корней проростков к пятому дню привело к достоверной разнице значений RA контрольных и опытных растений (0.51 ± 0.06 и 1.16 ± 0.08 соответственно, p = 0.0161 согласно Тьюки тесту).
Изменения биомассы травостоя. Динамика изменения показателей биомассы была аналогичной во всех вариантах опыта (рис. 6). В начале мая значения достоверно различались на освещенных и затененных грядах в 10 раз. В течение мая и июня в вариантах L45 и L25 биомасса уменьшилась в 10 раз, в вариантах S45 и S25 – в 5 и 7 раз соответственно, далее в июле и августе во всех вариантах опыта – колебалась от относительно низких до близких к нулевым значений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные о специфической биологической активности в дождевых смывах с листьев подтвердили нашу гипотезу о механизме транспорта экзометаболитов P. saccharata.
В конце мая, июне и октябре концентрация фенолов в смывах была наибольшей (рис. 1). но в целом зависела от сложной динамики выпадения осадков (рис. 2). Высокая вариабельность концентрации экзометаболитов в смывах не позволила выявить связь с фенологией P. saccharata. Фенологические максимумы синтеза биологически активных веществ у значительной части инвазивых видов приходятся на весну и осень (Reigosa, Carballeira, 2016), у аборигенных видов медуниц – на середину лета (Худоногова, 2006). Вероятно, следующие факторы снижали концентрацию фенолов в смывах: a) разведение обильными осадками; б) малое количествo зрелых трихом из-за частых осадков; в) устойчивость трихом к слабым осадкам (поэтому искусственные смывы не показали биологической активности); г) снижение интенсивности синтеза вторичных метаболитов под влиянием биотических и абиотических факторов. Феномен устойчивости трихом к слабому дождю (в том числе к замачиванию и орошению при получении искусственных смывов) может быть объяснен его заведомой неэффективностью для промачивания почвы. Мы полагаем, что транспорт фенолов и их аккумуляция в почве происходили в том числе при запредельно низких для количественного определения концентрациях при условии большого объема осадков. Возможен перенос фенолов в почву талыми водами.
Биологическая активность смывов и почвенных образцов была стимулирующей. Аналогия реакций тест-культур на смывы с листьев и вытяжки из почвы подтверждает идентичность аллелопатических веществ P. saccharata в смывах и почве. В наших предыдущих экспериментах низкие концентрации экзометаболитов P. saccharata вызывали такие же первичные эффекты (Chernyaeva, Viktorov, 2020). За ними следовало торможение ростовых процессов на фоне нарушения водного обмена и снижения скорости накопления сухого вещества. Возможными причинами этого явления могли быть преждевременное истощение запасов питательных веществ семени, нарушения механизмов поглощения воды корнями и водного транспорта. Полученные данные согласуются с сообщениями о высокой скорости роста на экспоненциальной стадии прорастания семян, нарушении баланса надземной и подземной частей, недоразвитии тонких корней, лигнификации ксилемной части сосудистых пучков и нарушении водного обмена в качестве повреждающих факторов воздействия аллелопатических веществ фенольной природы (Кефели, 1974; Blum, Gerig, 2005; Li et al., 2010; Симагина, Лысикова, 2010). Важно, что у тест-культур с низкой всхожестью экзометаболиты P. saccharata значительнее увеличивали долю проросших диаспор, то есть активировали прорастание в том числе покоящихся и невыполненных семян. Однако, не только в лабораторных условиях, но и в естественной среде перечисленные метаболические нарушения были нелетальными и обратимыми, по крайней мере часть проростков могла выживать и продолжать развитие. Поскольку фенольные вещества P. saccharata накапливаются в почве, слабая токсичность важна для исключения аутоинтоксикации донора. Таким образом, этого слабого воздействия не достаточно для полного устранения конкурентов в подкроновой области.
Мы полагаем, что под влиянием экзометаболитов почвы и смывов происходила активация и синхронизация прорастания семян почвенного банка в опытных посадках P. saccharata с результирующим снижением жизненности проростков.
В мае биомасса травостоя достоверно с высокой детерминацией зависела от освещенности, и не зависела от плотности посадки (табл. 1). Численность и разнообразие банка семян, вероятно, не отличались по вариантам опыта, но на затененных грядах проростки погибали от недостатка света. Всего мы обнаружили на всех грядах 14 видов трав. В начале мая, на пике развития, в образцах с гряд с полным освещением было по 10–22 особи, с затененных – по 6–10.
Таблица 1.
Значимость влияния факторов на биомассу и содержание фенолов в почве в дисперсионном анализе ANOVA
| Признаки | Факторы | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Освещенность | Плотность посадки | КВР | |||||||||||
| Коэффи-циенты | F | df | $R_{{{\text{adj}}}}^{2}$ | P | F | df | $R_{{{\text{adj}}}}^{2}$ | p | F | df | $R_{{{\text{adj}}}}^{2}$ | p | |
| Биомасса | V | 73.01 | 2 | 0.9600 | 0.0134 | 0.0405 | 2 | 0.4702 | 0.8590 | 292.67 | 2 | 0.9948 | 0.0412 |
| VI | 2.5983 | 2 | 0.3475 | 0.2482 | 0.5057 | 2 | 0.1972 | 0.5507 | 887.56 | 2 | 0.9983 | 0.0237 | |
| VII | 0.8295 | 2 | 0.0602 | 0.4585 | 1.3940 | 2 | 0.1160 | 0.3591 | 106.36 | 2 | 0.9859 | 0.6840 | |
| VIII | 0.8731 | 2 | 0.0441 | 0.4487 | 4.200 | 2 | 0.5164 | 0.1768 | 0.5870 | 2 | 0.0379 | 0.6782 | |
| IX | 0.1908 | 2 | 0.3693 | 0.7048 | 17.522 | 2 | 0.8463 | 0.0526 | 0.3715 | 2 | 0.7211 | 0.7574 | |
| X | 0.9002 | 2 | 0.0032 | 0.4245 | 0.7353 | 2 | 0.0967 | 0.4815 | 76.50 | 2 | 0.9805 | 0.0805 | |
| Содержание фенолов в почве | V | 21.58 | 2 | 0.8727 | 0.0433 | 0.1250 | 2 | 0.4117 | 0.7574 | 150.59 | 2 | 0.0990 | 0.0575 |
| VI | 0.8679 | 2 | 0.0460 | 0.4498 | 0.2249 | 2 | 0.3483 | 0.6820 | 4.34 | 2 | 0.6905 | 0.3211 | |
| VII | 104.976 | 2 | 0.9719 | 0.0093 | 0.0011 | 2 | 0.4991 | 0.9755 | 82.04 | 2 | 0.9818 | 0.0778 | |
| VIII | 159.06 | 2 | 0.9813 | 0.0062 | 0.0251 | 2 | 0.4813 | 0.8885 | 83.38 | 2 | 0.9821 | 0.0772 | |
| IX | 0.0558 | 2 | 0.1738 | 0.5336 | 0.8299 | 2 | 0.061 | 0.4584 | 0.1493 | 2 | 0.5067 | 0.8775 | |
| X | 1.1196 | 2 | 0.0383 | 0.4009 | 1.1195 | 2 | 0.0383 | 0.4009 | 0.2827 | 2 | 0.9640 | 0.7992 | |
Тесная отрицательная корреляция между динамикой изменения биомассы и накоплением фенолов почвой подтверждает гипотезу о статистически значимом вкладе аллелопатического фактора P. saccharata в подавление конкурирующей растительности (табл. 2). Данные анализа различались по вариантам опыта L и S. Коэффициенты детерминации регрессионной модели были значительно ниже и также различались по вариантам опыта. Этому явлению требуется иное обьяснение, чем логически и смыслово очевидная опосредованность связи между признаками или возможное несовершенство математических моделей. Необходимо учесть прямое влияние еще двух факторов, один из которых изменил динамику накопления фенолов почвой, а другой вызвал резкое снижение значений биомассы.
Таблица 2.
Значимость корреляции и регрессии между накоплением почвой фенольных соединений и динамикой биомассы сорных растений
| Признак | Фактор | |||||
|---|---|---|---|---|---|---|
| Биомасса | содержание фенолов в почве | |||||
| Вид анализа | корреляционный анализ | регрессионный анализ | ||||
| Вариант опыта Коэффициенты |
ρ | p | F | $R_{{{\text{adj}}}}^{2}$ | p | Log b |
| L + S | –0.7370 | 0.0133 | 9.1460 | 0.3115 | 0.0076 | –0.59 |
| L | –0.6690 | 0.0173 | 15.4365 | 0.5675 | 0.0282 | –0.78 |
| S | –0.8933 | <0.0001 | 20.9639 | 0.6447 | <0.001 | –0.82 |
Эффект плотностно-зависимой аллелопатии (density-dependent allelopathy) заключается не только в обратной пропорциональности дозы фитотоксина плотности особей-мишеней, но и в его поглощении целевыми растениями, то есть расходовании. В вариантах L25 и L45 весенняя стимуляция прорастания семян почвенного банка экзометаболитами привела к ускоренному набору биомассы травостоя и одновременно повышенному расходованию экзометаболитов, как поступающих со смывами, так и аккумулированных в почве. Смещение динамического баланса накопления, потерь и расходования фенолов в сторону убыли стало причиной лаг-фазы накопления фенолов почвой в мае и июне (рис. 5). Теснота связи корреляции между анализируемыми признаками в этих вариантах опыта была наименьшей (табл. 2). В вариантах опыта S25 и S45 в связи с сравнительно более низкими значениями биомассы баланс был смещен в сторону накопления, процесс развивался по линейной модели, теснота связи была наибольшей.
В условиях интродукции в сравнении с аборигенными представителями рода фенофазы у P. saccharata проходят на 7–10 дней позже (Васильева, Фомина, 2016). В начале второй декады апреля мы отметили первые цветущие особи в опытных насаждениях. Перезимовавшая особь несла 3–4 прошлогодних вегетирующих листа и немногочисленные весенние листья на генеративно-вегетативных побегах. В период весеннего светового “окна” со второй декады апреля по вторую декаду мая под изреженным пологом насаждений P. saccharata сложились благоприятные условия для прорастания семян почвенного банка. Со второй декады мая до середины июня длилась фаза развития эпигеогенных корневищ с розетками. Значительное увеличение размеров отдельной особи P. saccharata происходило в короткий срок в результате формирования клона с погружающимися в почву 5–9 новообразованными корневищами длиной 6–8 см с придаточными корнями и парциальными розетками летних листьев. С этой фенофазой совпало по времени 5–10 кратное снижение биомассы травостоя (рис. 5).
Показатель КВР отражает интенсивность пространственной экспансии, накопления надземной биомассы и увеличения плотности листового полога, что в совокупности является важным конкурентным признаком вида в борьбе за пространство и ресурсы. Значения КВР в вариантах L25 и L45 составили 6.02 ± 0.1 и 5.5 ± 0.09, в вариантах S25 и S45 – 7.62 ± 0.13 и 7.82 ± 0.14. Как фактор детерминации КВР достоверно оказывал обратно пропорциональное влияние на динамику биомассы, с максимальными коэффициентами в мае и июне ($R_{{{\text{adj}}}}^{2}$ = 0.9948, 0.9983, p = 0.0412, 0.0237 соответственно) (табл. 1).
Значения КВР были в высокой степени детерминированы условиями освещения ($R_{{{\text{adj}}}}^{2}$ = 0.9419, p = 0.001), в вариантах L25 и L45 – еще и плотностью высадки ($R_{{{\text{adj}}}}^{2}$ = 0.6034, p < 0.01). В природном ареале мезоксерофит P. saccharata обитает в полутени под пологом разреженных лесов, на открытых площадках растения могут страдать от перегрева и иссушения (Puppi, Cristofolini, 1996). Поэтому значения КВР достоверно различались между световым и теневым вариантами опыта, а также между L45 и L25 (р = 0.0276, согласно Тьюки тесту). В последнем случае разницу можно объяснить самозатенением растений.
Предположительно, значения КВР связаны обратно пропорциональной зависимостью с накоплением фенолов почвой (p = 0.0575, 0.0772, 0.0778 в мае, июле, августе соответственно, близкие к достоверности) (табл. 1). Таким образом, в неблагоприятных условиях избыточной инсоляции возможна аллокация ресурсов с роста и развития на синтез экзометаболитов. В июле и августе на накопление фенолов косвенно оказал достоверное положительное влияние фактор освещенности (табл. 1), что объяснимо зависимостью фотосинтеза и образования вторичных метаболитов от интенсивности освещения.
На основе полученных данных мы создали экологически реалистичную модель конкурентности P. saccharata по отношению к банку семян аборигенных видов. В варианте L45 в неблагоприятных для P. saccharata условиях значение КВР было минимальным. Экзометаболиты индуцировали дружное прорастание семян почвенного банка и формирование проростков с низкой конкурентностью. В условиях достаточного освещения значение биомассы в этом варианте опыта было максимальным. Доза экзометболитов в этом случае снизилась (Tseng et al., 2003), но фитотоксичность могла оставаться относительно высокой, если предположить сравнительно большую чувствительность вегетирующих растений. Затем дублирующее взаимодействие аллелопатического фактора и вегетативного развития особей P. saccharata с усилением конкуренции за ресурсы и пространство, привело к практически полной элиминации конкурирующей растительности в этом, и во всех других вариантах опыта (рис. 5). Мы полагаем, что своевременную весеннюю актививацию прорастания семян почвенного банка вызвали экзометаболиты, накопленные почвой в предыдущем сезоне, а не смывы, поскольку в фазах отрастания и цветения перезимовавшие особи находились в состоянии физиологического компромисса между ростом, развитием и синтезом экзометаболитов.
Таким образом, успех в борьбе с конкурирующей растительностью определялся фенологической согласованностью индукции прорастания банка семян фенолами и форсированного разрастания особей P. saccharata в фазе вегетативного развития и размножения (рис. 7).
Рис. 7.
Схема фенологически согласованных процессов в насаждениях P. saccharata в условиях интродукции.

Полученные нами данные, на первый взгляд, не противоречат ранее опубликованным в отношении банка семян. Его численность находится в динамическом равновесии между ежегодным восполнением и убылью проросших и погибших диаспор. Истощение возможно при условии, если плотный листовой полог P. saccharata летом и осенью препятствует заносу семян. Летне-осенняя лаг-фаза в накоплении фенолов в условиях высокой конкуренции могла быть связана с продолжающимися в меньших объемах процессами активации прорастания и элиминации, или с сезонным снижением интенсивности синтеза метаболитов, или сложением этих факторов (рис. 5). Таким образом, вопросы восстановления численности и сохранения разнообразия банка семян остаются открытыми, хотя видовые различия могут сглаживаться в условиях эффективного взаимодействия аллелопатии и ресурсной конкуренции (Fernandez et al., 2016).
Таким образом, проведенное исследование эколого-физиологических особенностей конкурентности P. saccharata может пролить свет на вопрос, насколько специфичными могут быть эффекты со стороны чужеродных видов на аборигенные виды и сообщества.
Предложенная нами модель конкурентности P. saccharata по отношению к банку семян обладает инвариантностью благодаря связи аллелопатического фактора с регулярными метеорологическими явлениями, и интеграции с конкурентными признаками вида в плоскостях фенологии, физиологии, морфологии, экологии. Согласно этой модели, экзометаболиты транспортируются в почву с осадками. Накопленные почвой в предыдущем сезоне фенольные вещества стимулируют раннее и дружное прорастание семян почвенного банка, затем ослабленные фитотоксинами растения не выдерживают конкуренции за ресурсы и пространство в результате форсированного вегетативного развития P. saccharata. В условиях интродукции процесс характеризуется фенологической согласованностью. Расход экзометаболитов на подавление конкурирующей растительности в период вегетации и естественные потери компенсируют регулярные поступления со смывами с листьев, поддерживающие динамический баланс фенольных соединений в почве.
Нам не удалось выявить фенологические максимумы секреции экзометаболитов, нет ясности в дальнейшей судьбе банка семяи, что может быть предметом будущих исследований. Поскольку аллелопатическая интерференция является относительно слабым взаимодействием, просто секреции экзометаболитов не достаточно для реализации конкурентного преимущества. Представляется, что роль аллелопатии в конкурентном успехе видов целесообразно оценивать не столько по уровню фитотоксичности, сколько по согласованности и устойчивости динамического взаимодействия между конкурирующими растениями, включающего аллелопатическй фактор.
Список литературы
Васильева О.Ю., Фомина Т.И. Особенности сезонного развития видов рода Pulmonaria L. в условиях интродукции // Вестник КрасГАУ. 2016. № 5. С. 50–56.
Веселкин Д.В., Киселева О.А., Екшибаров Е.Д., Рафикова О.С., Коржиневская А.А. Богатство и численность проростков из почвенного банка семян в куртинах инвазивного вида Acer negundo L. // Рос. Журн. Биол. Инв. 2018. № 1. С. 18–25.
Кефели В.И. Природные регуляторы роста и фитогормоны. М.: Наука, 1974. 253 с.
Коннова С.А., Каневский М.В., З.О., Шувалова Е.П. Методы выделения и анализа флавоноидов высших растений и исследование их активности в отношении ризобактерий. Саратов: Изд-во Сарат. Ун-та, 2015. 31 с.
Симагина Н.О. Особенности проявления фитотоксического эффекта в модельных системах. Уч. зап. Тавр. нац. унив. им. В.И.Вернандского // Сер. “Биол. и хим.”. 2010. Т. 23(62). № 4. С. 181–187.
Симагина Н.О., Лысикова Н.Ю. Влияние аллелопатических взаимодействий на лигнификацию анатомических структур однолетних галофитов // Экосистемы, их оптимизация и охрана. 2010. Вып. 2. С. 18–20.
Тамахина А.Я., Ахкубекова А.А. Микроморфологические особенности эпидермы и гистохимические методы идентификации вторичных метаболитов в листьях травянистых растений семейства Boraginaceae // Экол. раст. 2018. Т. 13. № 3. С. 31–41.
Худоногова Е.Г. Связь между фазами фенологического развития медуницы мягонькой и накоплением активно действующих веществ // Вестник КрасГАУ. Сер. Биол. наук. 2006. № 11. С. 110–113.
Черняева Е.В., Викторо В.П., Овчинникова Е.А. Формирование коллекции почвопокровных видов на учебно-опытном участке кафедры ботаники МПГУ // Труды IX межд. конф. по экол. морф. р-ий. М.: МПГУ. 2014. Т. 2. С. 454–455.
Barto E., Chipollini D. Density-dependent phytotoxicity of Impatiens pallida plants exposed to extracts of Alliaria petiolate // J. Chem. Ecol. 2009. V. 35. P. 495–504.
Belz R.G., Hurle K., Duke S.O. Dose-response – a challenge for allelopathy? // Nonlin. in biol., tox., med. 2005. V. 3(2). P. 173–211.
Blossey B., NoEtzold R. Evolution of increased competitive ability in invasive on-indigenous plants: a hypothesis // J. Ecol. 1995. V. 85. P. 887–889.
Blum U., Shafer S.R., Lehman M.E. Evidence for inhibitory allelopathic interactions involving phenolic acids in field soils: concepts vs. an experimental model // Crit. Rev. Plant. Sci. 1999. V. 18. P. 673–693.
Blum U., Gerig T.M. Relationships between phenolic acid concentrations, transpiration, water utilization, leaf area expansion, and uptake of phenolic acids: nutrient culture studies // J. Chem. Ecol. 2005. V. 31(8). P. 1907–1932.
Callaway R.M., Ridenour W.M. Nowel weapon: invasive success and the evolution of increased competitive ability // Front. Ecol. Environ. 2004. V. 2. P. 436–443.
Callaway R.M., Chipollini D., Barto K., Thelen G., Hallett S., Prati D., Stinson K., Klironomos J. Nowel weapons: invasive plants suppresses fungal mutualists in America but not in native Europe // Ecology. 2008. V. 89. P. 1043–1055.
Chernyaeva E.V., Viktorov V.P. New bioassay method to study allelopathic activity of sugar lungwort Pulmonaria saccharata Mill. // A. J. 2020. V. 51(1). P. 93–112.
Dalton B.R., Blum U., Weed S.B. Plant phenolic acids in soils: sorption of ferulic acid by soil and soil components sterilized by different techniques // Soil Biol. and Biochem. 1989. V. 21. P. 1011–1018.
Ehlers B.K. Soil microorganisms alleviate the allelochemical effects of a thyme monoterpene on the performance of an associated grass species // PLoS ONE. 2011. V. 6. P. e26321.
Fujii Y. Toxic chemicals from invasive alien plants // Plant Toxins. 2017. V. 17. P. 25–36.
Fernandez C., Monnier Y., Santonja M., Gallet C., Weston L.A., Prevosto B., Souier A., Bady V., Bousquet-Melou A. The impact of competition and allelopathy on the trade-off between plant defense and growth in two contrasting plant species // Front Plant Sci. 2016. V. 7. P. 594.
Gioria M., Jarosi K.V., Pysek P. Impact of invasions by alien plants on soil seed bank communities: emerging patterns // Persp. Plant Ecol. 2014. V. 16(3). P. 132–142.
Goldenstein L.J., Suding K.N. Intra-annual rainfall regime shifts competitive interactions between coastal sage shrub and invasive grasses // Ecology. 2014. V. 95. P. 425–435.
Gooden B., French K. Impact of alien grass invasion in coastal seed banks vary amongst native growth forms and dispersal strategies // Biol. Cons. 2014. V. 171. P. 114–126.
He H.B., Wang H.B., Fang C.X., Lin Z.H., Yu Z.M., Lin W.X. Separation of allelopathy from resource competition using rice/barnyardgrass mixed-cultures // PLoS ONE. 2012. V. 7(5). e37201.
Inderjit., del Moral R. Is separating resource competition from allelopathy realistic? // Bot. Rev. 1997. V. 63. P. 221–230.
Kalisz S., Kilvin S., Bialic-Murphy L. Allelopathy is pervasive in invasive plants // Biol. Invas. 2021. V. 23. P. 367–371.
Klironomos J. Feedback with soil biota contributes to plant rarity and invasiveness in communities // Nature. 2002. V. 417. P. 67–70.
Li Z.U., Wang Q., Ruan Y., Pan C.D., Jiang D.A. (2010) Phenolics and plants allelopathy // Molecules. 2010. V. 15. P. 8933–8952.
Liu C., Bu Z.-J., Mallik A.U., RochefortL., Hu X., Yu Z. Resource competition and allelopathy in two peat mosses: implication for niche differentiation // Plant and Soil. 2020. V. 446. P. 229–242.
Lyytinen A., Lindstrom L. Responses of a native plant species from invaded and uninvaded areas to allelopathic effects of an invider // Ecol. Evol. 2019. V. 9. P. 6116–6123.
Nilsson M. Separation of allelopathy and resource competition by the boreal dwarf shrub Empetrum hermaphroditum (Hagerup) // Oecol. 2004. V. 98. P. 1–7.
Puppi G., Cristofolini G. Systematics of the complex Pulmonaria saccharata, P. vallarsae and related species (Boraginaceae) // Webbia. 1996. V. 51. P. 1–20.
Quasem J.R. A new technology separating allelopathy from competition in pot experiments // Int. J. Agr. Sci. and Food Tec. 2017. V. 3(1). P. 19–25.
Reigosa M.J., Carballeira A. Phenological phase influenses allelopathic potential of water leachates of Acacia dealbata obtained using simulated rain // JAI. 2016. V. 2(2). P. 9–15.
Singleton V.L., Orthofer R., Lamuela-Raventos R.M. Analysis of total phenols and other oxidations substrates and antioxidans by means of Folin-Ciocalteu reagent // Met. in Enzym. 1999. V. 299. P. 152–178.
Thijs H., Shann J.R., Weidenhammer J.D. The effect of phytotoxins on competitive outcome in a model system // Ecol. 1994. V. 75. P. 1959–1964.
Trinder C.J., Brooker R.W., Robinson D. Plant ecology’s guilty little secret: understanding the dynamics of plants competition // Func. Ecol. 2013. V. 27. P. 918–929.
Tseng M.-H., Kuo Y.-H., Chen Y.-M., Chou C.-H. Allelopathic potential of Macaranga tanarius (L.) (Muell) // Arg. J. Chem. Ecol. 2003. V. 29. P. 1269–1286.
Uddin M.N., Robinson R.W. Allelopathy and resource competition: the effect of Phragmites austrais // Bot. Stud. 2017. V. 8(1). P. 29.
Weidenhamer J.D. Distinguishing resource competition and allelopathic interference in plants // J. Ap. Ecol. 1989. V. 26 (2). P. 613–624.
Weidenhamer Y.D., Hartnett D.C., Romeo J.T. Density-dependent phytotoxicity distinguishing resource competition and allelopathic interference in plants // J. Ap. Ecol. 1989. V. 26. P. 613–624.
Yuan Y., Bing W., Shanshan Z., Tang J., Tu C., Hu S., Yong J.W.H., Chen X. Enchansed allelopathy and competitive ability of invasive plant Solidago canadensis in its introduced range // J. Plant Ecol. 2012. V. 6(3). P. 253–263.
Zhu Y., Zhang J., Ma K. Soil biota reduse allelopathic effects of the invasive Eupatorium adenophorum // PLoS One. 2011. V. 6(9). P. e25393.
Zhang Z., Liu Y., Weber E., Lin Y., van Kleunen M. Effect of allelopathy on plant performance: a meta-analysis // Ecol. Let. 2020. V. 24(2). P. 348–362.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая