Известия РАН. Серия биологическая, 2022, № 4, стр. 339-350
О возможности изучения процессов взаимопревращения легколетучих соединений хвои у хвойных растений на основе статических данных в популяционных выборках
И. В. Тихонова *
Западно-Сибирское отделение Института леса им. В. Н. Сукачева СО РАН – филиал ФИЦ КНЦ СО РАН
639982 Новосибирск, ул. Жуковского, 100/1, Россия
* E-mail: azimut360@mail.ru
Поступила в редакцию 10.03.2021
После доработки 24.12.2021
Принята к публикации 24.12.2021
- EDN: ATNMWE
- DOI: 10.31857/S1026347022040138
Аннотация
Приведены результаты исследования популяционной структуры биохимических признаков (большого числа летучих терпеноидов хвои) на больших выборках деревьев сосны обыкновенной. Данные анализировали с помощью корреляционного, кластерного анализов и метода главных компонент. Установлена значительная сопряженность содержания всех выделенных соединений хвои. Особенности корреляционной структуры терпеноидов свидетельствуют о том, что у растений могут одновременно запускаться процессы их группового синтеза. Сделан вывод о возможности использования статических данных, полученных на больших выборках деревьев для предварительного изучения процессов взаимопревращений терпеноидных соединений у хвойных растений, отличающихся высокой реакционной способностью и сложностью их исследования химическими методами.
Как известно, в тканях хвойных растений синтезируется большое количество разнообразных терпеноидов (Пентегова и др., 1987; Ламоткин и др., 2008), которые выполняют важные функции в метаболизме: участвуют в защитных и адаптационных реакциях деревьев, в процессах гормональной регуляции роста, репродукции, сигнальной системе (Pallardy, 2008; Pulido et al., 2012). Они являются ценным лекарственным и химическим сырьем для различных отраслей хозяйства (Чернодубов, Дерюжкин, 1990; Племенков, 2001; Mccreath, Delgoda, 2016): монотерпены составляют основную часть живицы хвои, кислородосодержащие соединения часто используются в составе антибактериальных, фунгицидных, инсектицидных, пестицидных и антигельминтных препаратов (Племенков, 2001). Поэтому их изучение представляет большой интерес и пользу в широком перечне решений научных и практических вопросов. В частности, изучение биохимического разнообразия соединений, разнообразия “хемотипов” в популяциях (Чудный, Проказин, 1973; Юмадилов и др., 1991; Степень, 2000; Домрачев и др., 2011; Тараканов и др., 2012; Тихонова и др., 2012; Кузьмин и др., 2020) является составной частью раздела, посвященного проблемам исследования и сохранения биоразнообразия и устойчивости природных экосистем.
Ранее нами были выявлены наиболее тесно связанные легколетучие компоненты (Тихонова и др., 2014). Данное исследование является продолжением и развитием предыдущей работы. Его цель – изучение общей корреляционной структуры всего набора соединений, а также проверка возможности использования результатов анализа статических данных для изучения процессов образования и взаимопревращения терпеноидов в популяционных выборках сосны обыкновенной (Pinus sylvestris L.).
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на популяциях сосны обыкновенной, произрастающих на юге Средней Сибири: в Балгазынском бору в Туве (51°10′ с.ш., 95°5′ в.д.) в сосняке разнотравно-злаковом (10С, бонитет II–III) – Р1 и в окр. п. Шира в Хакассии (54°24′ с.ш., 89°59′ в.д.) в сосняке каменисто-лишайниковом (7С2Б1Л, бонитет V–Va) – Р2. В популяциях на репрезентативной выборке, соответственно, 100 и 75 деревьев у каждого дерева в начале октября 2011 г. собирали хвою с 10–20 побегов текущего года роста в средней части кроны с 4-х сторон. Образцы собирали непосредственно перед анализом и непродолжительное время хранили в специальных герметично закрытых пробирках в холодильнике.
Для определения компонентного состава летучих соединений в образцах хвои использовали хромато-масс-спектрометр “Agilent 5975С-7890А” (США) и парофазный пробоотборник HeadSpace Sampler G1888. Использовали 30-метровую кварцевую колонку НР-5 с внутренним диаметром 0.25 мм (сополимер 5%-дифенил-95%-диметилсилоксан), газом-носителем служил гелий. Температуру колонки повышали от 50°С (10 мин), до 200°С со скоростью 4°С/мин; в парофазном пробоотборнике температура термостата составляла 100°С, температура петли – 110°С, температура HS-интерфейса – 115°С, время выдержки образца в термостате пробоотборника – 7 мин; температура испарителя – 280°С, температура ионизационной камеры – 170°С, энергия ионизации – 70 эВ. Компоненты в образце идентифицировали с помощью программы AMDIS, учитывая абсолютное время удерживания, линейные индексы удерживания и масс-спектры ионов, сравнивая их с имеющимися собственными стандартами и сведениями из литературы (Ткачев, 2008 и др.). Линейные индексы удерживания считали по формуле: Jx = Jn + + 100k(tRx – tRn)/(tR(n + k)– tRn), где Jn = 100n – индекс удерживания н-алкана, содержащего n атомов углерода, tR – абсолютное время удерживания компонентов: tRx – время удерживания исследуемого компонента, tR(n + k)– tRn – время удерживания ближайших реперных н-алканов с числом атомов углерода, соответственно, n и n + k. Относительное количество компонента с содержанием не менее 0.01% в образце считали по площади пиков на хроматограмме, сумму площадей пиков (в пределах линейных индексов удерживания 700–1900) принимали за 100%, корректирующие коэффициенты не использовали. Количественные доли компонентов с перекрывающимися пиками считали исходя из интенсивности индивидуальных ионов.
Всего был выделен 81 отчетливый пик, из них определены 34 компонента, остальные приводятся под порядковыми номерами в соответствии со временем их удерживания на хроматограмме (табл. 1). Определяли процентное содержание каждого компонента в образце. Общими для всех деревьев обеих популяций были 22 компонента. Изменчивость содержания компонентов в популяциях оценивали по коэффициенту вариации (CV, %).
Таблица 1.
Компонентный состав легколетучих терпеноидов хвои в исследуемых популяциях сосны обыкновенной
| № | Jx | Название (m/z) | Частота встречаемости, % | Относительное содержание, % | ||
|---|---|---|---|---|---|---|
| Р1 | Р2 | Р1 | Р2 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Монотерпены | ||||||
| 34 | 909 | Трициклен | 95.0 | 97.4 | 0.51–3.50 | 0.60–2.51 |
| 35 | 920 | β-туйен | 25.0 | 17.1 | 0.14–0.34 | 0.14–0.44 |
| 36 | 926 | α-пинен | 97.0 | 98.7 | 18.1–75.96 | 31.97–77.52 |
| 37 | 944 | Камфен | 97.0 | 98.7 | 1.38–11.14 | 2.26–7.87 |
| 38 | 977 | Сабинен | 49.0 | 34.2 | 0.11–0.82 | 0.06–0.89 |
| 39 | 979 | β-пинен | 97.0 | 98.7 | 1.03–13.60 | 1.33–10.72 |
| 40 | 1001 | β-мирцен | 95.0 | 98.7 | 0.69–3.17 | 0.78–2.77 |
| 41 | 1020 | ∆3-карен | 73.0 | 38.2 | 0.23–35.34 | 8.51–38.19 |
| 42 | 1028 | α-терпинен | 6.0 | 6.6 | 0.13–0.18 | 0.10–0.16 |
| 43 | 1041 | Лимонен* | 95.0 | 97.4 | 0.51–2.75 | 0.62–4.25 |
| 44 | 1056 | β-транс-оцимен | 14.0 | 28.9 | 0.11–0.18 | 0.10–0.15 |
| 45 | 1066 | β-цис-оцимен | 83.0 | 84.2 | 0.12–2.14 | 0.15–1.61 |
| 46 | 1075 | γ-терпинен | 34.0 | 23.7 | 0.13–0.39 | 0.19–0.41 |
| 48 | 1106 | Терпинолен | 88.0 | 81.6 | 0.18–3.20 | 0.13–3.15 |
| 50 | 1154 | Камфора | 2.0 | – | 0.10–0.13 | 0.0 |
| 51 | 1177 | Борнеол | 21.0 | 5.3 | 0.11–1.47 | 0.08–1.10 |
| 53 | 1303 | Борнилацетат | 60.0 | 75.0 | 0.14–1.75 | 0.10–1.88 |
| Сесквитерпены | ||||||
| 54 | 1353 | Бициклоэлемен | 86.0 | 51.3 | 0.07–0.68 | 0.09–0.53 |
| 55 | 1365 | α-кубебен | 48.0 | 47.4 | 0.08–0.48 | 0.10–0.52 |
| 56 | 1390 | Копаен | 88.0 | 79.9 | 0.13–0.98 | 0.11–0.60 |
| 57 | 1399 | β-боурбонен | 38.0 | 43.4 | 0.08–0.84 | 0.11–0.55 |
| 58 | 1406 | β-элемен | 95.0 | 88.2 | 0.19–3.34 | 0.12–0.86 |
| 59 | 1436 | Кариофиллен | 95.0 | 94.7 | 0.32–8.67 | 0.39–4.62 |
| 60 | 1446 | β-кубебен | 41.0 | 27.6 | 0.08–0.44 | 0.09–0.20 |
| 61 | 1456 | Лонгифолен | 48.0 | 28.9 | 0.07–0.52 | 0.07–0.40 |
| 64 | 1492 | β-копаен | 9.0 | 7.9 | 0.07–0.52 | 0.07–0.13 |
| 65 | 1495 | Кадинен | 97.0 | 77.6 | 0.24–1.71 | 0.10–0.59 |
| 66 | 1500 | Гермакрен | 97.0 | 94.7 | 0.54–11.52 | 0.30–3.58 |
| 67 | 1505 | β-селинен | 89.0 | 81.6 | 0.14–1.26 | 0.09–0.75 |
| 69 | 1514 | α-селинен | 64.0 | 40.8 | 0.26–1.52 | 0.21–0.61 |
| 70 | 1516 | Элемен | 96.0 | 96.1 | 0.45–3.13 | 0.19–2.04 |
| 71 | 1519 | α-мууролен | 97.0 | 85.5 | 0.27–2.4 | 0.19–0.88 |
| 72 | 1533 | γ-мууролен | 97.0 | 94.7 | 0.48–5.51 | 0.28–2.64 |
| 73 | 1543 | β-кадинен | 97.0 | 98.7 | 1.10–10.86 | 0.43–5.14 |
| Неидентифицированные компоненты | ||||||
| 1 | 723 | 41, 44, 51, 66, 78, 94 | – | 5.3 | 0.0 | 0.38–0.95 |
| 2 | 723 | 44, 55, 66, 78, 94, 168 | 3.0 | 5.3 | 0.42–0.74 | 0.63–1.05 |
| 3 | 748 | 44 | 97.0 | 98.7 | 0.14–4.12 | 0.52–21.51 |
| 4 | 750 | 44, 86 | 68.0 | 61.8 | 0.06–14.75 | 0.04–16.41 |
| 5 | 749 | 45 | 60.0 | 51.3 | 0.07–1.21 | 0.06–0.63 |
| 6 | 751 | 45, 46 | 7.0 | 5.3 | 0.17–0.62 | 0.08–0.12 |
| 7 | 751 | 44, 57 | 91.0 | 67.1 | 0.07–1.94 | 0.07–0.94 |
| 8 | 751 | 44, 45 | 2.0 | 1.3 | 0.07–1.94 | 0.23 |
| 9 | 753 | 76 | – | 1.3 | 0.25–0.4 | 0.08 |
| 10 | 755 | 44, 75 | 5.0 | 1.3 | 0.15–0.34 | 0.09 |
| 11 | 756 | 43, 86, 94 | 2.0 | 2.6 | 0.09–0.10 | 0.07–0.08 |
| 12 | 757 | 43, 57, 72, 86 | – | 6.6 | 0.0 | 0.03–0.13 |
| 13 | 758 | 43, 44, 60, 75, 186 | 11.0 | 7.9 | 0.05–0.37 | 0.07–0.68 |
| 14 | 758 | 41, 43, 53, 59, 71 | 29.0 | 25.0 | 0.05–1.43 | 0.05–2.48 |
| 15 | 759 | 43, 61, 70, 88 | 33.0 | 26.3 | 0.09–1.75 | 0.07–3.86 |
| 16 | 760 | 43, 45, 60 | 1.0 | 6.6 | 0.20 | 0.70–1.30 |
| 17 | 760 | 43, 45, 60 | 6.0 | 2.6 | 0.03–0.24 | 0.40–1.38 |
| 18 | 761 | 43, 45, 60 | – | 1.3 | 0.0 | 0.65 |
| 19 | 762 | 43, 44, 45, 60 | – | 2.6 | 0.0 | 0.14–1.85 |
| 20 | 764 | 44, 58, 71 | 5.0 | 5.3 | 0.04–0.16 | 0.03–10.61 |
| 21 | 768 | 43, 57, 67 | 15.0 | 22.4 | 0.03–0.12 | 0.05–0.15 |
| 22 | 769 | 55, 84 | – | 5.3 | 0.0 | 0.03–0.08 |
| 23 | 771 | 44, 57, 86 | 13.0 | 2.6 | 0.04–0.28 | 0.07–0.17 |
| 24 | 774 | 43, 44, 86 | 5.0 | 6.6 | 0.15–0.80 | 0.23–0.55 |
| 25 | 780 | 41, 55, 57, 70 | 9.0 | – | 0.07–0.40 | 0.0 |
| 26 | 792 | 41, 44, 55, 57, 68, 86 | – | 2.6 | 0.0 | 0.06–0.09 |
| 27 | 795 | 41, 53, 67, 71, 86 | 1.0 | – | 0.263 | 0.0 |
| 28 | 798 | 43, 45, 57, 75 | 5.0 | – | 0.37–0.52 | 0.0 |
| 29 | 803 | 41, 43, 45, 47, 57, 75 | 6.0 | – | 0.09–0.66 | 0.0 |
| 30 | 805 | 41, 44, 56, 72, 82 | 24.0 | 28.9 | 0.08–0.54 | 0.10–0.73 |
| 31 | 839 | 41, 55, 57, 69, 83, 98 | 29.0 | 35.5 | 0.11–0.92 | 0.19–1.08 |
| 32 | 842 | 41, 55, 67, 69, 82, 100 | 1.0 | 2.6 | 0.27 | 0.11–0.14 |
| 33 | 853 | 41, 43, 56, 69, 84 | 6.0 | – | 0.08–1.01 | 0.0 |
| 47 | 1104 | 41, 53, 67, 79, 91, 93, 105, 121, 136 | 2.0 | 2.6 | 0.10–0.15 | 0.09–0.11 |
| 49 | 1130 | 40, 65, 77, 91, 103, 122 | 1.0 | – | 0.24 | 0.0 |
| 52 | 1188 | 41, 43, 55, 69, 71, 93, 111, 121, 136, 154 | 1.0 | – | 0.54 | 0.0 |
| 62 | 1472 | 41, 53, 67, 80, 93, 107, 121, 147, 161, 189, 204 | 84.0 | 71.1 | 0.15–1.18 | 0.09–0.47 |
| 63 | 1481 | 41, 69, 77, 91, 105, 119, 135, 147, 161, 204 | – | 1.3 | 0.0 | 0.10 |
| 68 | 1511 | 41, 55, 69, 71, 91, 105, 119, 133, 161, 204 | 3.0 | 2.6 | 0.08–0.19 | 0.08–0.09 |
| 74 | 1551 | 41, 55, 69, 77, 91, 105, 119, 161, 204 | – | 1.3 | 0.0 | 0.10 |
| 75 | 1556 | 41, 81, 91, 105, 119, 161, 175, 189, 204 | 33.0 | 13.2 | 0.06–0.30 | 0.07–0.15 |
| 76 | 1593 | 41, 81, 91, 105, 119, 134, 161, 182, 204 | 85.0 | 76.3 | 0.12–2.88 | 0.12–1.66 |
| 77 | 1597 | 41, 55, 69, 81, 91, 105, 119, 133, 161, 189, 204 | 1.0 | – | 1.06 | 0.0 |
| 78 | 1662 | 41, 43, 55, 69, 77, 81, 91, 95, 1105, 119, 134, 161, 189, 204 | 8.0 | 5.3 | 0.11–0.40 | 0.13–0.21 |
| 79 | 1676 | 41, 43, 55, 67, 71, 77, 81, 93, 95, 105, 109, 121, 133, 148, 161, 164, 189, 204 | 18.0 | 13.2 | 0.07–0.58 | 0.08–0.20 |
| 80 | 1843 | 57, 69, 83, 93, 109, 122, 133149, 161, 177, 191, 272 | 14.0 | 6.6 | 0.23–2.46 | 0.30–0.42 |
| 81 | 1845 | 41, 44, 55, 69, 81, 93, 109, 119, 133, 149, 161, 177, 191, 204, 257 | – | 1.3 | 0.0 | 3.55 |
Полученные данные анализировали с помощью корреляционного, кластерного и многофакторного анализов, в последнем случае использовали метод главных компонент (Ефимов, Ковалева, 2007). В анализ сопряженности не были включены компоненты (20 шт.), встречающиеся в выборках с частотой менее 5%. Так как распределение некоторых компонентов существенно отличалось от нормального, данные предварительно нормировали по формуле: (xij ‒ xmin)/(xmax ‒ xmin). Популяции сравнивали между собой с помощью F-критерия для того, чтобы оценить повторяемость результатов, полученных на разных выборках деревьев, выросших в разных условиях. Достоверность коэффициентов корреляции оценивали с помощью tr критерия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для изучения разнообразия природных терпеноидов иногда используют метод провокации – растения помещают в условия стресса, в которых синтезируются редкие для обычных условий компоненты (Племенков, 2001). Среди исследованных нами выборок деревья первой популяции (Р1) находились в лучших, а второй (Р2) – в худших почвенных и климатических условиях (на каменистых почвах, большего дефицита летних и зимних осадков, сильных иссушающих ветров). Комплексным индикатором условий служил бонитет насаждений.
Ранее было отмечено, что с ухудшением условий для роста у сосны обыкновенной увеличивается содержание более легких монотерпенов и сокращается доля сесквитерпенов (Фуксман и др., 1997), что подтвердили и наши исследования. Из табл. 1 видно, что при одинаковом числе выделенных в популяциях летучих компонентов хвои во второй популяции выше была не только общая относительная масса монотерпенов (соответственно 79.0 и 89.5%, различия достоверны при F = 10.56, P < 0.000), но и относительное содержание и разнообразие более легких соединений по сравнению с первой популяцией (на 7 компонентов из первых 26). Таким образом, в неблагоприятных условиях произрастания выше доля и разнообразие более легких монотерпенов, в благоприятных – более тяжелых сесквитерпенов, что вполне объяснимо их функциональным значением, так как первые преобладают в живице, вторые относятся к ростовым и аллелопатическим веществам. Суммарное индивидуальное относительное содержание монотерпенов у деревьев в двух популяциях характеризуется низким уровнем изменчивости, соответственно, – 4 и 9%, а содержание сесквитерпенов – высоким уровнем изменчивости (35 и 38%).
В известной нам отечественной и зарубежной литературе, посвященной изучению популяционной изменчивости и наследуемости содержания терпенов у хвойных растений, приводятся результаты сравнения географических популяций видов по значениям коэффициентов корреляции между парами только небольшой группы (4–12) соединений (Meier, Goggans, 1978; Yazdani et al., 1982; Hanover, 1992; Степень, 2000; Пляшечник, и др., 2011; Тараканов и др., 2012). В рекомендациях по использованию методов статистики в химии отмечается, что коэффициенты корреляции и регрессии чаще описывают не тесные функциональные зависимости, когда химик сталкивается с решением более сложных задач, включая определение трудно поддающихся анализу компонентов (Налимов, 1960; Дёрффель, 1994). Восполняя пробелы предыдущей нашей работы (Тихонова и др., 2014), отметим, что сделанные нами выводы о множественных корреляциях между выделенными компонентами, их структуре и предложения по применению полученных сведений оказались близки ряду исследований, использующих методы пространственного моделирования: в теоретической гистологии (Савостьянов, 2005), а также методы комбинаторной (алгебраической) топологии, – в анализе сложных химико-технологических процессов, в квантовой физике, программировании и автоматизации (Азаров и др., 1975; Кафаров, Дорохов, 1979; Хатчер, 2011). Выявление таких систем позволяет обоснованно разложить их на блоки и указать наиболее вероятные каналы их взаимодействия. Специфика их использования в химии заключается в том, что эти блоки могут быть не разграничены в реальном пространстве, их топология абстрактна. В этой связи перспективным также представляется использование подобного сравнительного анализа корреляций у близкородственных видов – от биологии к химии, и обратно.
После исключения редких для обеих популяций соединений (с частотой <5%) был проведен корреляционный анализ изменчивости содержания 59 компонентов в первой и 57 во второй популяции. При этом учитывали только наиболее тесные связи со значениями коэффициентов корреляции r ≥ 0.87. Пороговое значение выбрано, исходя из уровня достоверности значений коэффициента корреляции (р = 0.05–0.01) для наиболее редких соединений из учтенных. Единственную мощную корреляционную плеяду в первой популяции образуют 58 соединений, 32 из них входят в “ядро” плеяды (в т. ч. 22 при r = 0.99–1.0). Все они коррелированы с признаком – индикатором плеяды под № 6 (не идентифицированный компонент). К некоторым из них присоединяются еще 26 дополнительных соединений. Таким образом из включенных в анализ соединений только 1 не вошло в состав плеяды – β-пинен. Большая часть терпеноидов внутри “ядра” плеяды тесно коррелируют не только с ключевым компонентом № 6, но и между собой, участвуя в образовании от 8 до 25 связей каждое, в их числе борнеол, α-кубебен, копаен, кадинен, β-селинен, α-селинен, γ-муролен, β-кадинен, лонгифолен и соединения под № 13, 20, 21, 23, 24, 25, 30, 33, 75, 78, 81. Большая часть компонентов “ядра” плеяды (25) характеризуется положительными значениями коэффициентов корреляции с ключевым, образующим плеяду соединением, в обратной связи с ним находятся только 6 терпеноидов (трициклен, камфен, сабинен, β‑мирцен, ∆3-карен, соединение № 79). Из соединений, не входящих в “ядро” плеяды, наибольшее число связей (8–10) образую компоненты № 10, 17, 29 и β-копаен (№ 64). Так графически выстраиваются основные плеяды в обеих популяциях (рис. 1), из-за сложности их изображения в 3 координатах, корреляционная структура признаков показана на плоскости, где один и тот же дополняющий компонент повторяется столько раз, сколько связей он образует относительно “ядра плеяды”.
Рис. 1.
Корреляционные плеяды легколетучих соединений хвои (номера) двух популяционных выборок сосны обыкновенной Р1 и Р2.
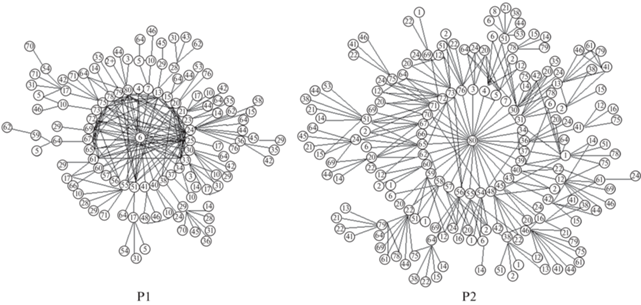
Во второй популяционной выборке в плеяду вошли все 57 компонентов со значениями коэффициентов корреляции r = 0.87–1.0. “Ядро” плеяды образуют 31 соединение с признаком – индикатором под номером 80, его дополняют 26 соединений, 16 из которых связаны с 8–25 соединениями (№ 1, 2, 6, 12, 20, 22, 24, 62, 75, 78, ∆3-карен, α-терпинен, γ-терпинен, борнеол, лонгифолен, β-копаен). В “ядре” плеяды Р2 большее число компонентов находится в обратной связи с признаком-индикатором – сесквитерпеном № 80 (это соединения № 4, 5, 7, 30, 31, α-пинен – № 36, α-кубебен – № 55, кариофиллен – № 59, элемен – № 70, соединение № 62).
При общем сходстве структуры и полноты плеяды, ее единственности, в первой популяции обращает на себя внимание бόльшая простота конструкции: бόльшая коррелированность “ядра” плеяды (три тесно связанных между собой группы: соединения № 20–33; борнеол–кариофиллен; сесквитерпены № 65–80), а также наличие меньшего числа “конгломератов” за пределами ядра плеяды (4). Причем внутри “ядра” плеяды все 5 соединений (№ 6, 24, 25, 33, 80), образующих наибольшее число связей (17‒31), тесно и прямо коррелированы между собой. Корреляционная плеяда во второй популяции, наоборот, отличалась слабой коррелированностью между компонентами внутри “ядра” плеяды и более тесной – между всеми компонентами “ядра” плеяды и дополняющими ее соединениями. Соединения № 2, 12, 20 и 24, образующие наибольшее число связей (18–30), оказались вне “ядра” плеяды, не связанными между собой и с ключевым компонентом № 80. На основании этого можно заключить, что у сосны обыкновенной во второй популяции наблюдается определенная децентрализация корреляционной структуры летучих терпеноидов (с сохранением общей плеяды) по сравнению с первой популяцией. Топологически первая плеяда Р1 образует пирамиду с вершиной (соединение № 6) и 4-угольным основанием, включающим 31 соединение, к большей части из них прикрепляются 4 крупных и несколько более мелких групп соединений (анализу некоторых из них посвящена предыдущая наша работа, Тихонова и др., 2014). Вторая плеяда Р2 также представляет собой двухсоставную пирамиду с вершиной (соединение № 80), промежуточным 4-угольным основанием (№ 20, 30, 72, 73), в пределах которого группируются 30 соединений “ядра” плеяды, и 8-угольным основанием второй части (№ 1, 2, 12, 22, 24, 75, борнеол, β‑копаен), по бокам ее “закрепляют” несколько более мелких групп, ключевыми для которых являются сабинен, α-терпинен, γ-терпинен, лонгифолен, соединения № 6, 78 с числом коэффициентов корреляции 8–10 каждое. Отметим, что подобные корреляционные структуры, где все признаки входят в одну плеяду, редко можно наблюдать при исследовании морфологических и анатомических признаков деревьев, и только в худших условиях для роста (Тихонова, 2005), так как генотипические корреляции сильнее фенотипических (Ростова, 2002).
Для того, чтобы учесть более слабые связи, еще раз провели корреляционный анализ, ограничив набор наиболее часто обнаруживаемыми в популяциях соединениями (50 – в Р1 и 43 – в Р2), здесь принимали во внимание достоверные для соответствующих выборок значения коэффициентов корреляции ≥0.51–0.62. В результате анализа снова были получены подобные структуры с теми же перечисленными выше особенностями строения плеяд и проявлением 2-го ключевого признака, из-за чего плеяда приобрела форму октаэдра или отображенного конуса (рис. 2). В Р1 48 компонентов образуют плеяду (в “ядро” вошли 38 более тесно связанных соединений), в Р2 это, соответственно, 43 и 32 соединения. В первой популяции 2 ключевых признака с одинаковым числом связей (один из наиболее легких и наиболее тяжелый компоненты № 4 и 80) прямо коррелированы между собой (r = 0.94). Интересно, что в первой популяции большее число компонентов плеяды (22) характеризуется высокими коэффициентами корреляции с суммарным содержанием (моно-) сесквитерпенов, во второй их 10. Отсутствие корреляций между ключевым компонентом № 4 и сесквитерпенами в Р2, а также между содержанием отдельных монотерпенов и суммарным содержанием моно- (сесквитерпенов), по-видимому, является следствием в 4 раза более высокой индивидуальной изменчивости состава компонентов: коэффициент вариации соотношения массы монотерпенов и сесквитерпенов в Р1 и Р2 составляет, соответственно 48 и 207%, из-за чего коэффициент корреляции между этими показателями снижается с ‒0.92 в Р1 до ‒0.45 в Р2.
Рис. 2.
Корреляционная структура относительного содержания наиболее часто обнаруживаемых легколетучих соединений хвои (по номерам) в популяциях сосны обыкновенной Р1 и Р2 (кружками обведены соединения, обнаруживающие сопряженность с общим содержанием моно- и сесквитерпенов).

С помощью многофакторного анализа данных были выделены 8 и 9 главных компонент, объясняющих 82 и 81% общей дисперсии признаков, из них первые 4 главные компоненты с суммарной дисперсией 64 и 54% в выборках Р1 и Р2, соответственно, могут быть интерпретированы как факторы взаимосвязи между тремя группами соединений I‒III. Это же подтверждают результаты анализа корреляционных матриц: группа II ‒ монотерпены от трициклена до терпинолена в Р1 и до кислородосодержащего борнеола в Р2 (соответственно соединения № 34–48 и 34–51, включая широко используемые в селекции сосны маркеры α‑пинен и ∆3-карен), по их суммарному содержанию обратно коррелированы с более легкими соединениями № 1–33 (группа I) (r = ‒0.86 в обеих выборках) и с сесквитерпенами (группа III) (r = ‒ 0.91 в Р1 и r = ‒0.35 в Р2). Соединения II группы отличаются меньшим числом связей с другими компонентами и устойчивостью связей внутри этой группы, например, между соединениями ∆3-карен, α-пинен, сабинен, α-терпинен, γ-терпинен, терпинолен (и борнеол во второй популяции), объясняющих 11% дисперсии в третьих главных компонентах в обеих популяциях. Из литературы известно, что характерной особенностью бициклических монотерпенов (туйен, α-пинен, камфен, ∆3-карен, борнеол, борнилацетат) является их способность к глубоким изменениям структуры, например, α-пинен легко превращается в большую часть соединений этой группы в присутствии органических кислот (Маркевич и др., 1987). Достоверные корреляции между соединениями в группе II отмечены и для других видов хвойных (Пляшечник и др., 2011), как и их взаимопревращения (Degenhardt et al., 2010). Обратная связь между ∆3-кареном и α-пиненом отмечена во многих работах, посвященных изучению терпеноидов у сосны (Чернодубов, Ламоткин, 1990; Степень, 2000; Тараканов и др., 2012). В исследуемых популяциях величина коэффициента корреляции возрастает с ухудшением условий произрастания деревьев (с r = –0.61 в Р1 до r = –0.90 в Р2, оба значения достоверны t = 7.50 и 17.64, р < < 0.0001). Сесквитерпены от бициклоэлемена и выше (компоненты № 54–80, III) положительно коррелированы между собой и с легкими терпеноидами (до соединения № 24, I) (r = 0.59 в Р1). Эти корреляции в первой и второй главных компонентах объясняют 46% общей изменчивости признаков в Р1 и 34% в Р2. Учитывая, что в обеих популяциях вторая по молекулярной массе компонентов группа монотерпенов (II) преобладает среди всех терпеноидов (их суммарная масса составляет 74 и 83% соответственно), отрицательно коррелирована с соседними группами (коэффициент множественной корреляции rxyz = –0.99) и каждая из групп внутри себя в целом коррелирована положительно, можно предположить, что: 1) у хвойных растений одновременно запускаются процессы группового синтеза соединений (трех крупных групп и множества мелких подрупп); 2) каждая из групп может служить поставщиком для соседней группы; однако, наиболее вероятно, учитывая более тесные связи, преобразование компонентов 2-й группы монотерпенов (№ 34–51) в сесквитерпены либо более легкие терпеноиды. Очевидно, у растений существуют механизмы, позволяющие во много раз сэкономить время для образования необходимых наборов легколетучих соединений и быстрой реакции на внешние или внутренние раздражители. Этот процесс не хаотичный, имеет устойчивую структуру, в которой выделяются 3 взаимодействующих “блока”. Внутри “блоков” обнаруживаются более мелкие структуры, подобные общей, их больше в выборке из второй популяции: в Р1 выделяются 3 прямо связанных друг с другом компонента, характеризующихся широким и полным охватом всего имеющегося спектра соединений (№ 6, 24, 80), в Р2 их 9, не связанных между собой (№ 2, 6, 12, 20, 22, 24, 51, 64, 80).
Необходимо отметить, что наблюдаемая нами “гроздьевидная” или “зонтичная” структура основной корреляционной плеяды вполне согласуется с некоторыми известными особенностями биогенеза терпеноидов, в частности, с изопреновым правилом синтеза групп терпеноидов через образование промежуточных соединений (Полтавченко, Рудаков, 1973; McGarvey, Croteau, 1995; Племенков, 2001), с таким явлением как “древо гермакрена” ‒ большая группа модификаций одного соединения (Ткачев, 2008, С. 141), с установленными фактами синтеза множественных продуктов (более половины всех моно- и сескивтерпенов) одними и теми же терпен-синтазами благодаря особенностям структуры белка ферментов (Degenhardt et al., 2010). Выявленные нами корреляции не только между кратно изопрену (С5Н8) различающимися крупными группами соединений (2 изопреновые группировки образуют монотерпены, три – сесквитерпены) или изомерами одного соединения, но и внутри групп монотерпенов и сесквитерпенов, свидетельствуют о наличии разнообразных реакций взаимопревращений внутри этих групп или конкуренции между ними за один субстрат (отрицательные связи), а также об одновременном синтезе (положительные связи) большого числа сходных наборов соединений у разных особей популяции, что подтверждают высокие коэффициенты корреляции внутри плеяды. Отсутствие β-пинена в плеяде первой популяции, с одной стороны, может объясняться его образованием в хлоропластах, где протекает альтернативный “метил-4-фосфатный” путь биогенеза терпенов (основной “мевалонатный” путь осуществляется на наружной мембране оболочки митохондрий и ядра, в цитозоле, пероксисомах и эндоплазматическом ретикулуме) (Meier, Goggans, 1978; Pallardy, 2008; Degenhardt et al., 2010; Pulido et al., 2012), с другой, – его чувствительностью к условиям спектрометрического анализа и частичным преобразованием в α-пинен (Ткачев, 2008). В литературе приводятся результаты экспериментов, доказывающих сопряженность процессов синтеза соединений, отнесенных нами ко второй группе, с освещением и фотосинтезом, на основании чего выдвинуто предположение о синтезе этих соединений не в митохондриях, а в хлоропластах (Loreto et al., 1996; Degenhardt et al., 2010), т. е. группы II и I, III могут быть разделены в пространстве. Косвенно это также подтверждается сведениями о зависимости содержания монотерпенов от прозрачности атмосферы (Коломиец и др., 2019). Однако, на наш взгляд, образование терпенов из продуктов фотосинтеза может протекать и в митохондриях, их локализация в хлоропластах пока не доказана. Усилением роли альтернативного “метил-4-фосфатного” превращения терпенов, участием большего числа обходных путей синтеза и преобразования соединений, вероятно, можно также объяснить особенности строения корреляционной плеяды в популяции Р2. По-видимому, 9 наиболее сопряженных компонентов в Р2, в первую очередь, вовлекаются в реакции, приводящие к появлению многих других терпеноидов, и на их основе осуществляется пополнение состава терпеноидов. Благодаря этому может сокращаться время на образование необходимых для жизнедеятельности деревьев в данных условиях роста компонентов. Подобный анализ, проведенный на тех же выборках деревьев в начале вегетационного сезона, либо в других экологических условиях, возможно, позволил бы получить сведения и о других компонентах.
С помощью кластерного анализа оценивали структуру индивидуального разнообразия популяций по относительному содержанию и разнообразию трех групп легколетучих соединений хвои (I–III). В двух популяциях выборки подразделяются, соответственно, на 4 и 3 кластера при Eij = 0.97–0.42 (Р1) и 1.08–0.65 (Р2). Небольшую часть выборок составляют деревья с высоким разнообразием и содержанием редких терпеноидов I и III групп: в Р1 и Р2 соответственно, 19% и 6% деревьев (рис. 3, табл. 2). Следующие 2 кластера, включающие большую часть выборок, характеризуются постепенным уменьшением массы и числа компонентов в этих группах. Последний 4-й кластер в Р1 образуют 11% деревьев с невысокой относительной массой компонентов I и III групп, но наибольшими показателями их разнообразия. В выборках Р1, ограниченных деревьями 1 и 4 кластеров с наиболее полным составом терпеноидов, коэффициенты корреляции между тремя группами соединений увеличились до rI, II = ‒0.89, rII, III = = ‒0.96, rI, III = 0.67 по сравнению с приведенными выше значениями.
Рис. 3.
Дендрограмма сходства особей внутри выборок Р1 и Р2 по соотношению групп легколетучий компонентов хвои деревьев: по оси х – деревья, по оси у – Евклидово расстояние.
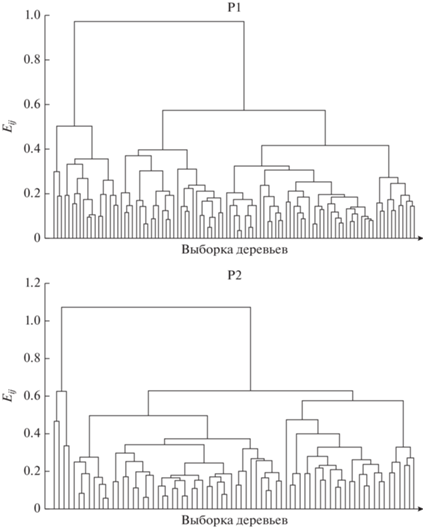
Таблица 2.
Краткая характеристика кластеров в двух популяциях сосны обыкновенной
| Кластер Eij |
Доля деревьев в выборке, % | Относительная масса компонентов группы, % | Среднее число компонентов внутри группы | ||||
|---|---|---|---|---|---|---|---|
| I | II | III | I | II | III | ||
| Р1 | |||||||
| 1 Eij = 0.97 |
19 | 15.7 | 54.1 | 29.6 | 6.9 | 9.0 | 16.0 |
| 2 Eij = 0.57 |
29 | 5.7 | 70.4 | 23.5 | 4.5 | 9.3 | 16.4 |
| 3 Eij = 0.42 |
41 | 2.1 | 84.4 | 13.2 | 3.7 | 10.7 | 16.5 |
| 4 Eij= 0.42 |
11 | 7.9 | 76.8 | 15.2 | 7.8 | 10.6 | 16.9 |
| Р2 | |||||||
| 1 Eij = 1.17 |
6 | 13.3 | 67.6 | 18.9 | 7.0 | 8.8 | 17.5 |
| 2 Eij = 0.65 |
36 | 9.0 | 80.1 | 10.8 | 6.7 | 9.1 | 15.2 |
| 3 Eij = 0.65 |
58 | 2.7 | 87.6 | 9.8 | 2.4 | 9.2 | 13.2 |
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования свидетельствуют о существовании тесной сопряженности всего состава легколетучих терпеноидов в хвое сосны обыкновенной и, соответственно, процессов их взаимопревращений. Они образуют единственную мощную корреляционную плеяду в виде октаэдра с двумя ключевыми компонентами на “входе” и “выходе”, внутри которой выделяются группы более тесно связанных компонентов, коррелирующих между собой. В неблагоприятных условиях произрастания связи между ними ослабевают, изменяется корреляционная структура, но единство плеяды сохраняется. При этом в несколько раз увеличивается число соединений, образующих связи по всему спектру терпеноидов. Предположительно, с их участием протекают реакции, приводящие к появлению многих других необходимых для жизнедеятельности деревьев терпеноидов. Эти, не идентифицированные нами компоненты, после уточнения молекулярного строения могут быть использованы в качестве индикаторов вовлечения тех или иных биохимических реакций в процессы адаптации деревьев.
С помощью метода главных компонент внутри плеяд обеих популяций выделены 3 устойчивых “блока”: I – легкие компоненты до трициклена, II – монотерпеноиды от трициклена до кислородосодержащего борнеола, III – сескивтерпеноиды. Внутри “блоков” обнаруживаются более мелкие структуры, подобные общей. Терпены II группы отрицательно коррелированы с компонентами смежных групп. Обратные связи между ними, как и корреляции терпенов внутри II группы, объясняют 54–64% дисперсии содержания наборов компонентов внутри выборок. Особенности корреляционной структуры признаков свидетельствуют о том, что у хвойных растений могут одновременно запускаться процессы группового синтеза соединений, бициклические компоненты 2-й группы монотерпенов (туйен, α-пинен, ∆3-карен, камфен и др.), по-видимому, служат субстратом для образования соединений соседних групп.
Небольшую часть исследованных выборок составляют деревья с высоким разнообразием и содержанием более редких терпеноидов. Внутри этой выборки деревьев коэффициенты корреляции выше, чем в общей выборке. Отмечена тесная (r = |0.91‒0.95|) корреляция ∆3-карена с α-пиненом (отрицательная), а также с γ-терпиненом и терпиноленом (положительная). Отметим, что в “ядро” корреляционной плеяды в первой популяции входит ∆3-карен, а во второй ‒ α-пинен. Последний коррелирует с суммарным содержанием трех перечисленных соединений в обеих выборках (r = ‒0.58 и ‒0.82). Поэтому для пополнения списка селективно значимых для сосны обыкновенной признаков предлагается проверить уровни наследуемости большего числа монотерпенов II группы, а также суммарное содержание компонентов, входящих в I, II и III группы терпеноидов и их соотношение.
Так как не все соединения определяются с помощью масс-спектрометрии и отдельные важные промежуточные компоненты могут ускользнуть от внимания исследователей, неизвестно строение всех соединений, поэтому с помощью данных методов и предлагаемого подхода можно рассматривать только общую структуру, соотношение групп терпеноидов, отдельные корреляции. Таким образом, не только методы химического анализа могут применяться в биологии, но и методы популяционной биологии могут быть полезны химикам, в том числе, используя межвидовые сравнения в филогенетических рядах. Общее представление о структуре биохимических признаков имеет важное значение для лучшего понимания объекта исследований и уточнения направления поисков, например, в разработке подобных конструкций с целью искусственного синтеза новых соединений или их смесей.
Благодарности. Автор выражает признательность Анискиной А.А. (ИЛ СО РАН) за помощь в работе.
Финансирование. Работа выполнена в рамках бюджетного проекта ФГБНУ ЗСО ИЛ СО РАН, ФИЦ КНЦ СО РАН (проект№ 0287-2021-0009, Рег. НИОКТР № 121031500336-9) на оборудовании Красноярского регионального центра коллективного пользования ФИЦ КНЦ СО РАН.
Список литературы
Азаров В.Л., Лупичев Л.Н., Тавризов Г.А. Математические методы исследования сложных физических систем. М.: Наука, 1975. 342 с.
Дёрффель К. Статистика в аналитической химии: пер. с нем. М.: Мир, 1994. 268 с. [Doerffel K. Statistik in der analytischen Chemie. Leipzig: Deutscher Verlag für Grundstoffindustrie, 1990. 236 s. https:doi.org/10.1002/zfch.19900301119].
Домрачев Д.В., Карпова Е.В., Горошкевич С.Н., Ткачев А.В. Сравнительный анализ летучих веществ хвои пятихвойных сосен Северной и Восточной Евразии // Химия растит.сырья. 2011. № 4. С. 89-98.
Ефимов В.М., Ковалева В.Ю. Многомерный анализ биологических данных. Горно-Алтайск: РИО Горно-Алтайск. Госун-та, 2007. 75 с.
Кафаров В.В., Дорохов И.Н. Системный анализ процессов химической технологии: Топологический принцип формализации. М.: Наука, 1979. 394 с.
Коломиец Н.Э., Абрамец Н.Ю., Бондарчук Р.А., Ширеторова В.Г., Тыхеев Ж.А., Агеева Л.Д. Компонентный состав эфирного масла почек Pinus sylvestris L., произрастающей в урбоусловиях Томского района // Химия растит. сырья. 2019. № 1. С. 181–190. https://doi.org/10.14258/jcprm.2019014293
Кузьмин С.Р., Анискина А.А., Пермякова Г.В. Летучие вещества в хвое сосны обыкновенной с разной устойчивостью к грибным патогенам в условиях географических культур // Лесоведение. 2020. № 4. С. 346–356. https://doi.org/10.31857/S0024114820030079
Ламоткин С.А., Шпак С.И., Скаковский Е.Д., Гайдукевич О.А., Тычинская Л.Ю., Ламоткин А.И., Рыков С.В., Котов А.А. Анализ состава эфирных масел хвои сосен различных видов // Биополимеры, биосистемы и биомедицинские объекты. М.–Йошкар-Ола: МарГТУ, 2008. С. 120–121.
Маркевич Р.М., Ламоткин А.И, Резников В.М. Развитие взглядов на механизм превращений α-пинена в условиях кислотного катализа // Химия древесины. 1987. № 1. С. 3–20.
Налимов В.В. Применение математической статистики при анализе вещества. М.: Физматгиз, 1960. 430 с.
Пентегова В.А., Дубовенко Ж.В., Ралдугин В.А., Шмидт Э.Н. Терпеноиды хвойных растений. Новосибирск: Наука СО, 1987. 97 с.
Племенков В.В. Введение в химию природных соединений. Казань: КазГУ, 2001. 376 с.
Пляшечник М.А., Анискина А.А., Лоскутов С.Р. Сезонное изменение соотношения монотерпенов хвои Picea obovata (Pinaceae) // Растит. ресурсы. 2011. Т. 47. № 1. С. 80–86.
Полтавченко Ю.А., Рудаков Г.А. Эволюция биосинтеза монотерпенов в семействе сосновых // Растит. ресурсы. 1973. Т. 9. Вып. 4. С. 481–493.
Ростова Н.С. Корреляции: структура и изменчивость. СПб.: Изд-во СПб. Ун-та, 2002. 308 с.
Савостьянов Г.А. Основы структурной гистологии. Пространственная организация эпителиев. СПб.: Наука, 2005. 375 с.
Степень Р.А. Хемотипы Красноярской популяции сосны обыкновенной (Pinus sylvestris L.) // Сибирский экол. журн. 2000. № 6. С. 705–709.
Тараканов В.В., Ткачев А.В., Кальченко Л.И., Ефимов В.М., Роговцев Р.В. Изменчивость состава терпентинных масел хвои и устойчивость клоновых плантаций и географических культур сосны в Западной Сибири // Интерэкспо Гео-Сибирь. 2012. Т. 4. С. 115–122.
Тихонова И.В. Морфологические признаки пыльцы Pinus sylvestris L. в связи с состоянием деревьев в сухой степи // Лесоведение. 2005. № 1. С. 63–69.
Тихонова И.В., Анискина А.А., Лоскутов С.Р. Коррелированность содержания легколетучих соединений хвои в популяционных выборках сосны обыкновенной на юге Сибири // Экология. 2014. № 4. С. 257–264. https:dor.org/10.1134/S1067413614040122
Тихонова И.В., Анискина А.А., Мухортова Л.В., Лоскутов С.Р. Индивидуальная изменчивость состава летучих выделений хвои сосны обыкновенной в популяциях Хакасии и Тувы //Сибирский экол. журн. 2012. № 3. С. 397–405. https://doi.org/10.1134/S1995425512030171
Ткачев А.В. Исследование летучих веществ растений. Новосибирск: Офсет, 2008. 969 с.
Фуксман И.Л., Шредер С.М., Канючкова Г.К., Чиненова Л.А., Пойхалайнен Я. Физиолого-биохимическая индикация состояния сосны обыкновенной в связи с воздействием промышленных поллютантов // Экология. 1997. № 3. С. 213–217.
Хатчер А. Алгебраическая топология: пер. с англ. М.: МЦНМО, 2011. 688 с.
Чернодубов А.И., Дерюжкин Р.И. Эфирные масла сосны: состав, получение, использование. Воронеж: Изд-во ВГУ, 1990. 112 с.
Чудный А.В., Проказин Е.П. Географическая изменчивость состава терпентинных масел сосны обыкновенной на территории СССР // Растит. ресурсы. 1973. Т. 9. № 4. С. 494–503.
Юмадилов Н.Х., Адлер Э.М., Рошаль И.Д., Тимирьянов А.Ш. Хемотипы популяции сосны обыкновенной в Башкирии // Растит. ресурсы. 1991. Т. 27. № 2. С. 67–73.
Degenhardt J., Kollner T.G., Gershenzon J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants // Phytochem. 2010. V. 70. P. 1621–1637. https://doi.org/10.1016/j.phytochem.2009.07.030
Hanover J.W. Applications of terpene analysis in forest genetics // New Forests. 1992. № 6. P. 159–178. https://doi.org/10.1007/978-94-011-2815-5_9
Loreto F., Ciccioli P., Cecinato A., Brancaleoni E., Frattoni M., Fabozzi C., Tricoli D. Evidence of the photosynthetic origin of monoterpenes emitted by Quercus ilex L. leaves by 13C labeling // Plant Physiol. 1996. V. 110. P. 1317–1322. https://doi.org/10.1104/pp.110.4.1317
Mccreath S.B., Delgoda R. Pharmacognosy: fundamentals, fpplications and strategies. London, 2016. 687 p.
McGarvey D.J., Croteau R. Terpenoid metabolism // The Plant Cell. 1995. V. 7. P. 1015–102. https://doi.org/10.1105/tpc.7.7.1015
Meier R.J., Goggans J.F. Heritability and correlations of the cortical monoterpens of Virginia pine (Pinus virginiana Mill.) // Silvae genet. 1978. V. 27. № 2. P. 79–84.
Pallardy S.G. Physiology of woody plants. Amsterdam; Boston: Academic Press, 2008. 454 p.
Pulido P., Perello C., Rodriguez C.M. New insights into plant isoprenoid metabolism // Molec. Plant. 2012. V. 5. № 5. P. 964–967. https://doi.org/10.1093/mp/sss088
Yazdani R., Rudin D., Alden T., Lindgren D., Harbom B., Ljung K. Inheritance pattern of five monoterpens in scots pine (Pinus sylvestris L.) // Heredity. 1982. V. 97. P. 261–272. https://doi.org/10.1111/j.1601-5223.1982.tb00879.x
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


