Известия РАН. Серия биологическая, 2022, № 4, стр. 438-448
Онтогенетическая, виталитетная структура и состояние ценопопуляций Neottia ovata (L.) Bluff & Fingerh в нарушенных местообитаниях Кировской области
Н. Ю. Егорова 1, 2, В. Н. Сулейманова 1, 2, *
1 ВНИИ охотничьего хозяйства и звероводства им. Б.М. Житкова
610000 Киров, ул. Преображенская, 79, Россия
2 Вятский государственный агротехнологический университет
610017 Киров, Октябрьский проспект, 133, Россия
* E-mail: venera_su@mail.ru
Поступила в редакцию 25.12.2020
После доработки 02.04.2021
Принята к публикации 24.06.2021
- EDN: ZUKLMQ
- DOI: 10.31857/S1026347022040060
Аннотация
Приведена интегральная оценка состояния ценопопуляций Neottia ovata (L.) Bluff & Fingerh. (сем. Orchidaceae Juss.) на основе популяционных характеристик: качество популяций, индекс генеративности, индекс возобновляемости, плотность популяций, виталитетный и онтогенетический типы популяций. Установлено, что онтогенетическая структура ценопопуляций N. ovata нормальная, неполночленная, левостороннего типа. Отмечены незначительные колебания количественного соотношения разных онтогенетических состояний. Представлен анализ структуры изменчивости морфологических признаков. Описаны онтогенетические тактики и стратегии выживания вида в условиях техногенно нарушенных биотопов. По характеру проявления согласованности в организации морфологической структуры растений для вида выявлена стрессово-защитная онтогенетическая стратегия.
При всем многообразии форм антропогенного воздействия на естественную природную среду наиболее сильное влияние на нее оказывают последствия промышленной деятельности человека. Они ведут к катастрофическому нарушению целостности ландшафтов, естественное восстановление которых продолжается десятки лет (Курченко, Егорова, 2009). Еще одним из негативных проявлений техногенеза является разрушение и уничтожение характерных ценобиотопов многих видов растений, что приводит к сокращению их естественных ареалов. Особенно чувствительны к техногенному стрессу представители семейства Orchidaceae. Как правило, орхидеи представлены малочисленными популяциями, приуроченными к определенным экологическим нишам, характеризуются низкой конкурентоспособностью (Мамаев и др., 2004). Деградация и утрата типичных местообитаний этих растений в условиях усиливающегося техногенного пресса способствует тому, что некоторые виды этого семейства нередко встречаются во вторичных и нарушенных типах местообитаний. Анализ зарубежных и отечественных исследований по распространению орхидных в антропогенно трансформированных экотопах, включая территории, нарушенные добывающей и перерабатывающей промышленностью, показал, что на ранних стадиях сукцессии данные территории активно заселяются представителями этого семейства (Jurkiewicz et al., 2001; Быченко, 2004; Shefferson et al., 2008; Полетаева и др., 2014).
Neottia ovata (L.) Bluff & Fingerh. (сем. Orchidaceae) – поликарпическое многолетнее травянистое растение с коротким горизонтальным ползучим корневищем; евро-сибирский умеренно бореальный вид (Preston, Hill, 1997). Neottia ovata – эвритопный вид, который встречается в широком диапазоне местообитаний: лиственные и смешанные леса, лесные опушки, заросли кустарников, суходольные луга, пастбища, известковые луга, песчаные дюны, болота и поймы (Вахрамеева и др., 2014; Блинова, 2016), заходит в горы до границ субальпийского и альпийского поясов (Салманова, 2020). Имеются данные, что N. ovata растет и в нарушенных местообитаниях: по обочинам шоссейных и железных дорог (Вахрамеева и др., 2014), в условиях урбанизированных (Пушай, 2007) и техногенно нарушенных территорий (Малева и др., 2020).
В большинстве стран Европы вид, не считается находящимся под угрозой исчезновения, включен в Приложение II Конвенции о международной торговле CITES (Convention of international trade in endangered species of wild fauna and flora, 2016). Несмотря на это, по данным М. Fay (2015), этот таксон в Великобритании и Ирландии практически полностью исчез с равнинных участков, которые были утрачены в результате сельско- и лесохозяйственной деятельности. В России N. ovata занесен в Красные книги 35 регионов (Плантариум, 2020).
Цель настоящего исследования – на основе комплексного анализа выявить эколого-биологические особенности Neottia ovata (L.) Bluff & Fingerh. для оценки состояния ценопопуляций вида в условиях антропогенно трансформированных экотопов.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования N. ovata проведены в техногенно нарушенных местообитаниях в 2020 г. Изучены 4 ценопопуляции (ЦП) (табл. 1), расположенные на не рекультивированном карьере по добыче известняка (окр. п. Первомайский, Слободской район, Кировская область). Карьер находится в верхней части крутого склона коренного берега р. Вятка (подзона южной тайги). Породы отвала: известняки с прослоями мергелей и глин. Зарастание отвалов карьера осуществляется в основном за счет заноса семян из окружающих его лесных и луговых фитоценозов. Возраст лесных растительных сообществ ~45 лет. Лесные фитоценозы характеризуются сомкнутостью 0.2–0.6. Общее проективное покрытие травяно-кустарничкового яруса – 20–40%. Выражен слой листового опада (1.5–2.5 см), что, как отмечает Е.И. Филимонова с соавт. (2014), благоприятствует произрастанию видов семейства Orchidaceae в растительных сообществах, формирующихся на промышленных отвалах.
Таблица 1.
Характеристика исследованных ценопопуляций Neottia ovata (L.) Bluff & Fingerh.
| Тип фитоценоза | Номер ценопопуляций | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| Сосняк
грушанковый (7С2Е1И + Б) |
Опушка ельника
с примесью осины
и сосны (5Е3Ос2С + И + Б) |
Ивняк
грушанковый (6ИВД4С + Ос + Б) |
Сосняк грушанково-зеленомошный (8С2Е + Ос + ИВД) |
|
| Географические координаты | N 58°41′07.3′′, E 50°10′11.6′′ |
N 58°41′07.0′′, E 50°10′17.6′′ |
N 58°41′53.4′′, E 50°09′41.6′′ |
N 58°41′14.9′′, E 50°11′23.3′′ |
| Возраст древостоя | 30 | 40 | 45–50 | 35–40 |
| Степень сомкнутости крон древостоя | 0.2 | 0.3 | 0.5-0.6 | 0.2 |
| Высота древостоя | 12 | 10–12 | 17 | 14–16 |
| Общее проективное покрытие травяно- кустарничкового яруса, % | 20 | 35–40 | 35–40 | 40 |
| Экологические факторы | ||||
| Hd | 12.13 | 12.51 | 12.79 | 12.45 |
| Tr | 6.32 | 6.17 | 6.11 | 6.51 |
| Nt | 4.85 | 5.09 | 5.20 | 5.13 |
| Rc | 6.77 | 6.79 | 6.91 | 7.10 |
| Lc | 3.79 | 3.94 | 4.00 | 3.93 |
| Fh | 5.13 | 5.27 | 5.02 | 5.30 |
Исследованием были охвачены все особи в пределах ЦП. Выделенные ЦП расположены на отвалах отработанной породы на площади от 25 до 320 м2 и удалены друг от друга на расстояние от 500 до 2000 м.
Описание исследованных растительных сообществ осуществляли в соответствии с общепринятыми геоботаническими методами и подходами (Андреева и др., 2002). Латинские названия сосудистых растений приведены в соответствии с базой данных Plants of the World Online (http:// www.plantsoftheworldonline.org/). Условия местообитания N. ovata оценивали индикаторными методами с использованием шести амплитудных шкал Д.Н. Цыганова (1983): Hd – увлажнения почвы, Tr – солевого режима почв, Nt – богатства почв азотом, Rc – кислотности почв, fH – переменности увлажнения, Lc – освещенности-затенения.
Онтогенетическую и виталитетную структуру популяций N. ovata изучали в рамках популяционно-демографического подхода (Жукова, 1995; Животовский, 2001; Злобин, 2009), определяли такие демографические показатели как численность, общую и эффективную плотность (De) (Животовский, 2001). Выделение возрастных состояний осуществляли с учетом описаний М.Б. Фардеевой и Г.Р. Исламовой (2004). При анализе онтогенетической структуры использовали индексы возрастности (Δ) и эффективности (ω) (Уранов, 1975; Животовский, 2001), индекс генеративности (Iген), индекс возобновляемости (Iвозобн) (Коваленко, 2005), которые учитывают не только соотношение разных онтогенетических групп растений в популяции, но и соразмерны с общей численностью особей локальных популяций. Тип ЦП определяли по классификации “дельта-омега” (Животовский, 2001), с учетом поправок, предложенных Н.А. Виляевой (2014).
Анализ структуры изменчивости признаков выполнен в соответствии с рекомендациями Н.С. Ростовой (2002). Морфометрические параметры изучали в природных условиях у генеративных растений в фазу цветения.
Оценку жизненного состояния ценотических популяций N. ovata проводили с помощью интегрального показателя качества популяций (Q), оцениваемого по соотношению особей разного виталитета (низшего, среднего, высшего). Определение границ классов виталитета особей производилось с учетом средних арифметических значений каждого признака. Группировка особей по классам виталитета осуществлялась по принципу – высший класс виталитета (класс а) составляют особи со значением признака более х + t0.05sx, средний (класс b) – в пределах х ± t0.05sx, низший (класс с) – меньше х – t0.05sx. Виталитетный тип популяции определялся с помощью индекса Q = = 1/2(а + b). Популяция относится к процветающим, если Q > c, если же Q < c, популяция депрессивная, равновесные популяции характеризуются равенством встречаемости особей всех виталитетных классов, то есть Q = с (Злобин, 2009).
При оценке типов онтогенетических тактик и стратегий использовали методические разработки Ю.А. Злобина (2009). Для координации ценопопуляций по градиенту комплексного фактора благоприятности условий применяли индекс виталитета ценопопуляций (IVC), т.е. коэффициент жизненности, с использованием выравнивания средних значений параметров по ценопопуляциям, методом взвешивания (Ишбирдин, Ишмуратова, 2004), рассчитываемый как:
Наибольшее значение коэффициента соответствует наилучшим условиям произрастания, наименьшее – наихудшим.
Статистический анализ полученных данных выполнен с использованием Microsoft Office Excel 2010, PAST 3.15 (Hammer et al., 2001) и Statistica 10.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По данным геоботанических описаний определена фитоценотическая характеристика N. ovata в условиях техногенной среды, находящейся в стадии вторичной сукцессии и формирования лесных, луговых сообществ и переходных зон (лесо-луговые экотоны) (табл. 1). В результате проведенных исследований установлено, что основными древесными породами, участвующими в формировании лесных фитоценозов, являются Pinus sylvestris L., Picea abies (L.) Karst и Salix caprea L. Подлесок средней сомкнутости (0.1–0.2), в основном образован Sorbus aucuparia L., Frangula alnus Mill., Salix caprea L., Chamaecytisus ruthenicus (Fisch. ex Woloszcz.) Klásk., Hippophae rhamnoides L., Viburnum opulus L., Lonicera xylosteum L., реже Padus avium Mill., Rosa majalis Herrm. Средняя высота подлеска 1.5–2.0 м. Всего в составе подлеска отмечено 9 видов кустарников.
Общее проективное покрытие травяно-кустарничкового яруса варьирует от 20% в сосняке грушанковом до 35–40% на опушке ельника с примесью осины и сосны разнотравного. Высота травостоя, в среднем, составляет ~25 см. Всего в составе травяно-кустарничкового отмечено 73 вида сосудистых растений. В исследуемых местообитаниях число видов варьирует от 36 в ивняке грушанковом до 53 на опушке ельника с примесью осины и сосны разнотравного. В сложении травяного яруса с наибольшим постоянством принимают участие Pyrola rotundifolia L., Pyrola minor L., Epipactis atrorubens (Hoffm.) Besser, Prunella vulgaris L., Polygala tenuifolia Willd., Hieracium umbellatum L., Plantago lanceolata L., Origanum vulgare L., Alchemilla xanthochlora Rothm., Trifolium hybridum L., Melica nutans L., Fragaria vesca L., Tussilago farfara L., Gymnadenia conopsea (L.) R. Br., Veronica chamaedrys L., Pimpinella saxifraga L., Centaurea jacea L., Festuca pratensis Huds., Chamaenerion angustifolium (L.) Scop. и др. Моховой покров образуют 2 вида листостебельных мхов Pleurozium schreberi (Brid.) Mitt. и Hylocomium splendens (Hedw.) Bruch et al. с покрытием от 3–5% (фрагментарно, пятнами) до 40–50%.
Расчет значений экологических факторов индикаторным методом по видовому составу фитоценозов показал, что местообитания ЦП N. ovata имеют освещенность (Lс) в пределах 3.79–4.00 балла, что соответствует условиям полуоткрытых пространств и светлых лесов (табл. 1). Значения эдафических показателей следующие: увлажнение (Hd) изменяется от 12.13 до 12.79 баллов, переменность увлажнения (fH) от 5.02 до 5.30 баллов, кислотность (Rc) от 6.77 до 7.10 баллов, а обеспеченность азотом (Nt) от 4.85 до 5.20 баллов. Следовательно, почвенные условия в местах произрастания N. ovata варьируют от сухолесолугового до влажнолесолугового слабопеременного режима, соответствуют слабокислым бедным азотом, что согласуется с данными приводимыми исследователями из других регионов (Hill et al., 2004).
Формирование растительного покрова на техногенно трансформированных землях процесс высоко специфичный. Антропогенно преобразованные территории характеризуются наличием свободных экологических ниш, но их занятие требует от растений особых свойств – высокой пластичности и изменчивости, т.е. способности произрастать в неблагоприятных условиях. Выживание растений в нестабильной среде возможно на основе эффективных онтогенетических адаптаций (Баштавой, 1991).
В онтогенетической структуре N. ovata в условиях техногенной среды выделены два периода (прегенеративный, генеративный) и четыре онтогенетических состояния (ювенильное (j), имматурное (im), виргинильное (v), генеративное (g). Показатели демографической структуры ценопопуляций N. ovata и основные популяционные индексы представлены в табл. 2.
Таблица 2.
Популяционно-демографические показатели ценопопуляций Neottia ovata (L.) Bluff & Fingerh.
| № ЦП | Онтогенетическое состояние, % | Численность, ос. | Плотность, ос./кв.м | Эффективная плотность (De), ос./м2 | Iвозобновляемости, % | Iгенеративности, % | Δ/ω | Тип ЦП | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| j | im | V | g | ||||||||
| 1 | 0.0 | 26.0 | 54.8 | 19.2 | 73 | 8.1 | 3.8 | 78.4 | 21.6 | 0.187/0.465 | Переходная |
| 2 | 0.0 | 13.7 | 76.8 | 9.5 | 190 | 19.0 | 8.8 | 87.3 | 12.6 | 0.163/0.461 | Молодая |
| 3 | 1.3 | 9.2 | 72.4 | 17.1 | 76 | 4.2 | 2.0 | 85.0 | 15.0 | 0.172/0.471 | Молодая |
| 4 | 0.0 | 6.2 | 85.6 | 8.2 | 97 | 5.7 | 2.5 | 92.4 | 7.5 | 0.145/0.444 | Молодая |
По наблюдениям разных авторов N. ovata более часто растет отдельными особями (Салманова, 2020), небольшими группами, изредка образует значительные скопления (Перебора, 2008; Плотникова, 2009). Исследуемые нами ЦП также преимущественно сформированы небольшими группами, включающими от 4 до 6 растений. Самое крупное скопление насчитывает 87 особей. Наиболее многочисленная ЦП 2, состоящая из 190 особей, изучена нами на опушке ельника с примесью осины и сосны. В остальных ЦП численность не превышает 100 особей (табл. 2).
Общая плотность в ЦП N. ovata варьирует от 4.2 до 19.0 ос./м2, эффективная плотность от 2.0 до 8.8 ос./м2. Во всех ценопопуляциях преобладает виргинильная фракция (54.8–85.6%). Высокая доля особей генеративной фракции отмечена в ЦП 1 (19.2%), где, согласно расчетам, условия местообитания характеризуются более высоким освещением (Lc – 3.79), более сухими (Hd – 12.13) и бедными минеральным азотом (Nt – 4.85) почвами. Здесь же больше всего имматурных растений – 26%. Особи ювенильного онтогенетического состояния определены только в ЦП 3, где их доля составила всего 1.3%.
В целом, исследуемые ЦП N. ovata характеризуются как нормальные, неполночленные (отсутствуют особи постгенеративного онтогенетического состояния) с левосторонним типом онтогенетического спектра. Сходная онтогенетическая структура локальной популяции N. ovata описана Филимоновой с соавт. (2014) на золоотвале Верхнетагильской ГРЭС. Несколько иным соотношением особей отличаются естественные популяций N. ovata. По данным разных авторов (Фардеева, Исламова, 2004; Блинова, 2016), онтогенетическая структура в таких биотопах, как правило, имеет правосторонний тип с преобладанием генеративных особей. Подобные отличия, вероятнее всего, связаны с тем, что рассматриваемые нами ЦП являются инвазионными и их онтогенетическая структура демонстрирует первые стадии освоения техногенного субстрата и внедрения вида в фитоценоз. Это подтверждает и детализация онтогенетических типов популяций N. ovata по классификации “дельта-омега” (Животовский, 2001; Виляева, 2014): ЦП 2–4 являются молодыми, ЦП 1 относится к переходным. Кроме того, популяции молодого типа N. ovata характеризуются высокими значениями индекса возобновляемости (от 85 до 92%), что свидетельствует об эффективных процессах заселения нарушенных территорий. В естественных биотопах (сосняк неморальный) индекс возобновления у N. ovata имеет более низкие значения – 68% (Klymenko et al., 2017). Для всех исследуемых ЦП характерна низкая степень репродуктивной активности N. ovata. Генеративность его популяций (Iгенер, %) варьирует от 7.5 до 21.6% и снижается на эколого-ценотическом градиенте, построенном по IVC.
Анализ популяционных и биоценотических параметров показал, что на различия в онтогенетической и демографической структуре в исследуемых ценопопуляциях влияют, главным образом, два фактора – освещенность и влажность субстрата. Так, ЦП 1, описанная в условиях сосняка грушанкового, отличается от других ЦП более высокой освещенностью и меньшей влажностью субстрата. Вероятно, что более ксероморфные условия данного экотопа явились одной из причин высокой доли участия в структуре ЦП генеративных растений. Кроме того, низкая численность особей здесь сочетается с высокой генеративностью, что, на наш взгляд, связано с двойственной природой данного вида, проявляющего свойства как эксплерента, так и патиента.
В исследуемых ЦП N. ovata высота генеративного побега колеблется в достаточно широком диапазоне от 13.4 до 58.0 см, в среднем составляет 37.1 ± 1.27 см (табл. 3). Наиболее высокорослые растения встречаются в ЦП 1 – 40.8 см, несколько ниже их высота в ЦП 3 (38.8 см). В ЦП 2, 4 особи имели наименьшие размеры (34.4 и 34.0 см соответственно). Особи с минимальным диаметром основания генеративного побега отмечены в ЦП 4 – 4.1 мм. Более толстыми стеблями обладают растения ЦП 2 и 3 – 4.6 и 4.8 мм соответственно. Максимальные значения данного признака установлены у растений ЦП 1 (5.4 мм). Длина соцветия характеризуется достаточно широким диапазоном изменчивости: от 4.4 до 25.0 см (в среднем – 11.2 ± ± 0.56 см). Наиболее крупные соцветия формируются у особей в ЦП 1 – 14.6 см. В ЦП 3 среднее значение длины соцветия составляет 12.4 см. Минимальные размеры соцветия зафиксированы в ЦП 2, 4 – 8.8 и 8.9 см соответственно. Установлено, что при увеличении длины генеративного побега наблюдается и увеличение длины соцветия (r = 0.76). Общее число цветков варьирует так же довольно значительно от 11 до 47 шт. (в среднем – 25.6 ± 0.88 шт.).
Таблица 3.
Изменчивость морфологических признаков генеративных особей Neottia ovata (L.) Bluff & Fingerh. в различных ценопопуляциях
| Признаки | ЦП 1 | ЦП 2 | ЦП 3 | ЦП 4 | ||||
|---|---|---|---|---|---|---|---|---|
| $\frac{{M \pm m}}{{(\min - {\kern 1pt} \max )}}$ | CV, % | $\frac{{M \pm m}}{{(\min - {\kern 1pt} \max )}}$ | CV, % | $\frac{{M \pm m}}{{(\min - {\kern 1pt} \max )}}$ | CV, % | $\frac{{M \pm m}}{{(\min - {\kern 1pt} \max )}}$ | CV, % | |
| Длина надземного побега, см | 40.8 ± 2.57 (23.5–58.0) |
24.4 | 34.4 ± 1.42 (26.5–45.0) |
16.5 | 38.8 ± 2.36 (28.7–56.7) |
22.0 | 34.0 ± 4.01 (13.4–56.4) |
39.1 |
| Диаметр надземного побега, см | 0.5 ± 0.03 (0.4–0.8) |
18.8 | 0.5 ± 0.02 (0.3–0.6) |
20.3 | 0.5 ± 0.03 (0.4–0.7) |
20.4 | 0.4 ± 0.03 (0.3–0.6) |
26.7 |
| Длина соцветия, см | 14.6 ± 1.17 (7.5–25.0) |
31.1 | 8.8 ± 0.71 (4.4–14.0) |
32.6 | 12.4 ± 0.91 (6.7–18.5) |
26.6 | 8.9 ± 0.94 (5.1–14.7) |
35.0 |
| Количество цветков, шт. | 23.9 ± 2.06 (11–47) |
33.3 | 25.5 ± 1.40 (15.0–39.0) |
21.9 | 28.4 ± 1.83 (20.0–45.0) |
23.2 | 24.6 ± 1.83 (13.0–32.0) |
24.6 |
| Длина нижнего листа, см | 6.0 ± 0.31 (4.1–8.8) |
20.4 | 6.8 ± 0.34 (4.5–10.3) |
19.8 | 6.9 ± 0.43 (4.6–10.7) |
22.6 | 7.3 ± 0.49 (4.8–10.1) |
22.1 |
| Ширина нижнего листа, см | 4.6 ± 0.26 (3.5–7.0) |
22.0 | 5.3 ± 0.29 (3.5–7.6) |
22.0 | 5.1 ± 0.37 (3.5–8.5) |
26.5 | 5.4 ± 0.45 (3.6–7.7) |
27.8 |
| Количество жилок нижнего листа, шт. | 11.1 ± 0.33 (9.0–13.0) |
11.6 | 12.0 ± 0.50 (9.0-16.0) |
16.7 | 12.6 ± 0.63 (9.0–16.0) |
17.9 | 11.6 ± 0.59 (9.0–15.0) |
16.9 |
| Длина верхнего листа, см | 6.3 ± 0.37 (4.6–9.9) |
22.9 | 7.4 ± 0.38 (4.8–11.4) |
20.4 | 7.4 ± 0.48 (5.4–11.9) |
23.2 | 8.2 ± 0.54 (5.8–11.2) |
21.8 |
| Ширина верхнего листа, см | 4.4 ± 0.27 (3.2–6.7) |
24.0 | 5.2 ± 0.25 (3.6–7.0) |
19.3 | 4.8 ± 0.29 (3.5–7.6) |
22.1 | 5.0 ± 0.34 (3.5–6.7) |
22.3 |
| Количество жилок верхнего листа, шт. | 11.1 ± 0.31 (10.0–13) |
10.7 | 12.4 ± 0.46 (10.0–15.0) |
15.0 | 12.7±0.60 (10.0–17.0) |
17.1 | 11.7 ± 0.60 (9.0–15.0) |
17.1 |
У всех изученных генеративных растений на побеге сформированы два округлых сидячих листа. Особей с 1-м или 3-мя листьями не зарегистрировано. Длина и ширина нижнего листа варьирует от 4.1 до 10.7 см (в среднем – 6.7 ± 0.19 см) и от 3.5 до 8.5 см (в среднем – 5.1 ± 0.17 см) соответственно, верхнего листа от 4.6 до 11.9 см (в среднем – 7.3 ± 0.22 см) и от 3.2 до 7.6 см (в среднем – 4.9 ± 0.14 см) соответственно. Выявлено, что при увеличении длины и ширины нижнего листа наблюдается и увеличение длины и ширины верхнего листа (r = 0.95). Количество жилок нижнего и верхнего листа изменяется от 9 до 16 шт. (в среднем – 11.8 ± 0.25 см) и от 9 до 17 шт. (в среднем – 12.0 ± 0.25 см) соответственно. Количество жилок нижнего листа зависит от количества жилок верхнего листа (r = 0.89).
Морфобиологические параметры исследуемого вида значительно отличаются в различных типах местообитаний в пределах ареала. Так, в лесной зоне Республики Коми (Плотникова, 2009) генеративные особи N. ovata характеризуются более коротким генеративным побегом (27–30 см), меньшей высотой соцветия (8–9 см) и количеством цветков (17–18 шт.). Большие значения морфометрические параметры имеют в лесных биотопах в Польше. По данным M. Kluza, I. Maciejewska (1999) в условиях ольхово-ясеневого леса высота генеративного побега N. ovata составляет в среднем 54 см (17–84 см), длина соцветия – 22 см (9–34 см), количество цветков – 37 шт. (13–66 шт.).
Изменчивость признаков во всех исследуемых ценопопуляциях примерно однотипна и ее уровень варьирует от низкого до высокого. Средний уровень изменчивости отмечен для таких признаков как длина генеративного побега (за исключением ЦП 4), диаметр надземного побега (за исключением ЦП 4), число цветков (за исключением ЦП 1). Для длины соцветия характерен повышенный уровень изменчивости. Высокой изменчивостью отличается длина генеративного побега у особей в ЦП 4. Изменчивость параметров верхнего и нижнего листьев характеризуется сходными изменениями в исследуемых ЦП: длина и ширина имеют средний уровень изменчивости, а число жилок отличает повышенная изменчивость, за исключением ЦП 1, где данный признак имеет низкий показатель варьирования. Ни один из изученных признаков не проявляет очень низкий или очень высокий уровень изменчивости.
Структура изменчивости морфологических признаков N. ovata представлена на рис. 1. Пределы изменчивости коэффициента вариации изученных параметров колеблются от 10.66 до 39.07%, а коэффициента детерминации от 0.07 до 0.69%. Анализ изменчивости морфологических признаков N. ovata показал, что среди изученных биопараметров сильно варьирующим признаком с высоким уровнем детерминированности является ширина нижнего листа. Этот признак относится к эколого-биологическим системным индикаторам. Он наиболее изменчив, сильно коррелирует и зависит от внешних факторов. Ключевыми признаками (с высоким уровнем детерминированности при незначительном варьировании) у N. ovata являются такие параметры как длина нижнего листа, длина и ширина верхнего листа. Эти признаки являются биологическими индикаторами. Они слабо изменчивы, но определяют общее состояние популяции. В качестве таксономических признаков диагностированы следующие: диаметр генеративного побега, число жилок нижнего и верхнего листа. Эти признаки называются генотипическими (таксономическими) индикаторами и определяются преимущественно структурными и адаптивными особенностями, их отличают низкие значения коэффициентов вариации и детерминации.
Рис. 1.
Структура изменчивости морфологических признаков Neottia ovata (L.) в исследованных ценопопуляциях. По оси ординат – коэффициент вариации признака (CV), по оси абсцисс – коэффициент детерминации $\left( {r_{{{\text{ch}}}}^{{\text{2}}}} \right).$ 1 – длина надземного побега (см), 2 – диаметр надземного побега (см), 3 – длина соцветия (см), 4 – количество цветков (шт.), 5 – длина нижнего листа (см), 6 – ширина нижнего листа (см), 7 – количество жилок нижнего листа (шт.), 8 – длина верхнего листа (см), 9 – ширина верхнего листа (см), 10 – количество жилок верхнего листа (шт.)

Среди исследованных признаков N. ovata наиболее изменчивыми (высокий коэффициент вариации при низком коэффициенте детерминации) признаками являются длина генеративного побега, длина соцветия и количество цветков. Эти признаки являются экологическими индикаторами и зависят от действия факторов внешней среды. Такой признак как количество цветков диагностировался в качестве экологического индикатора и у других таксонов (Егорова, Сулейманова, 2019).
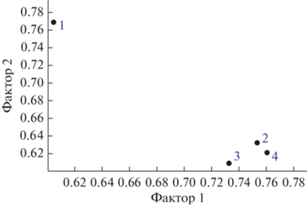
По результатам факторного анализа биоморфопараметров установлены наиболее значимые факторы, объясняющие 99.66% изменений. Наивысшие положительные значения факторной нагрузки по фактору 1 установлены для таких признаков как длина генеративного побега (1.36) и длина соцветия (1.46). Отрицательную нагрузку имеет показатель количество цветков (–0.66). Первый фактор отражает градиент исследованных ценопопуляций с меньшим количеством цветков, но более высокими значениями длины генеративного побега и соцветия. В отношении второго фактора наибольшую нагрузку испытывают такие показатели как количество цветков (2.33) и высота соцветия (1.16). Отрицательную нагрузку имеют показатели количества жилок нижнего (0.44) и верхнего (0.55) листа. На рис. 2 представлено расположение изученных ценопопуляций в пространстве этих двух факторов, для визуальной оценки их сходства между собой по данным признакам. В большинстве ценопопуляций (ЦП 2, 3, 4) особи N. ovata морфоструктурно более однотипны между собой. ЦП 1 наиболее отлична от остальных и фенотипически более разнообразна.
Виталитетный состав изученных ЦП N. ovata весьма гетерогенен (табл. 4) и обусловлен воздействием эколого-ценотических факторов. На различия в жизненном состоянии особей в популяциях других представителей сем. Орхидных вследствие различия эколого-ценотических режимов в них обращали внимание и другие исследователи (Кучер, 2013).
Таблица 4.
Характеристика виталитетной структуры ценопопуляции Neottia ovata (L.) Bluff & Fingerh.
| № ЦП | Доля особей по классам виталитета, % | Индекс качества ценопопуляций, Q | Индекс виталитета ценопопуляций, IVC | Виталитетный тип ценопопуляции | ||
|---|---|---|---|---|---|---|
| крупные a с |
средние b | мелкие c | ||||
| 1 | 20.0 | 53.33 | 26.67 | 36.67 | 0.991 | Процветающая |
| 2 | 12.50 | 68.75 | 18.75 | 40.63 | 0.988 | Процветающая |
| 3 | 23.08 | 53.85 | 23.08 | 38.46 | 1.042 | Процветающая |
| 4 | 36.36 | 27.27 | 36.36 | 31.82 | 0.980 | Процветающая |
Значение индекса качества ЦП N. ovata изменяется в ряду антропогенно трансформированных экотопов (по уменьшению) следующим образом: ЦП 2 (40.63) – ЦП 3 (38.46) – ЦП 1 (36.67) – ЦП 4 (31.82). Все рассматриваемые ЦП являются процветающими. По мнению М. М. Ишмуратовой с соавторами (2003) для корневищных видов Орхидных процветающий виталитетный тип является наиболее распространенным. ЦП 1, 2, 3 N. ovata характеризуются высокой долей особей среднего класса виталитета (от 53 до 69%). ЦП 4, напротив, отличается минимальным количеством особей среднего качества (27%) и значительным равным участием в виталитетной структуре растений высшего и низшего классов (по 36% соответственно). Согласно результатам виталитетного анализа, ЦП 1–3 можно рассматривать как существующие в наиболее благоприятных условиях. ЦП 4, имеющая самые низкие показатели жизненности, находится в не устойчивом состоянии, вследствие более мощного конкурентного воздействия видов травяно-кустарничкового яруса и развития мохового покрова. Для данной ЦП установлено также максимальное значение индекса возобновляемости (92.4%), что свидетельствует о ее более уязвимом состоянии.
На установленном градиенте комплексного фактора благоприятности условий (IVC) для N. ovata выявлено 4 типа онтогенетических тактик: конвергентная, дивергентная, дивергентно-конвергентная и конвергентно-дивергентная. Конвергентная тактика проявляется в уменьшении изменчивости признака при усилении стресса и выявлена для параметров верхнего листа: длины (рис. 3) и ширины. Так, максимальная степень изменчивости длины верхнего листа (CV = 23.22) достигается в наилучших условиях обитания (IVC = = 1.04), при ухудшении условий среды (IVC = 0.98) изменчивость признака падает (CV = 19.30%). Дивергентная онтогенетическая тактика характерна для такого признака как длина соцветия (рис.4). Наибольшая вариабельность длины соцветия (CV = 35.02%) отмечена при нарастании стресса (IVC = 0.98), при благоприятных условиях среды (IVC = 1.04) вариабельность признака уменьшается (CV = 26.55%). Дивергентно-конвергентная тактика описывает изменчивость числа цветков. Как видно из рис. 5 изменчивость признака при ухудшении условий обитания сначала повышается, а затем понижается. Конвергентно-дивергентная тактика установлена для изменчивости длины (рис. 6) и диаметра генеративного побега, параметров нижнего листа (длина, ширина, число жилок) и числа жилок верхнего листа. При этом изменчивость признаков при ухудшении условий обитания сначала понижается, а затем повышается.
Рис. 3.
Изменчивость длины верхнего листа Neottia ovata (L.) на градиенте ухудшения условий обитания: по оси ординат – коэффициент вариации (CV, %), по оси абсцисс – индекс виталитета по размерному спектру (IVC).

Рис. 4.
Изменчивость числа цветков Neottia ovata (L.) на градиенте ухудшения условий обитания: по оси ординат – коэффициент вариации (CV, %), по оси абсцисс – индекс виталитета по размерному спектру (IVC).

Рис. 5.
Изменчивость числа цветков Neottia ovata (L.) на градиенте ухудшения условий обитания: по оси ординат – коэффициент вариации (CV, %), по оси абсцисс – индекс виталитета по размерному спектру (IVC).
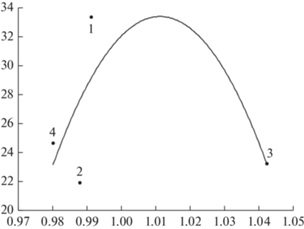
Рис. 6.
Изменчивость длины надземного побега Neottia ovata (L.) на градиенте ухудшения условий обитания: по оси ординат – коэффициент вариации (CV, %), по оси абсцисс – индекс виталитета по размерному спектру (IVC).

На основании выделенных онтогенетических тактик можно заключить, что в условиях антропогенного стресса наблюдается увеличение параметров вегетативной сферы (длина, диаметр генеративного побега, длина, ширина, число жилок листа) растений и дестабилизация параметров, определяющих репродуктивный успех (число цветков). Полученные данные согласуются с результатами, полученными Ишбирдиным и др. (2005) для Cephalanthera rubra, согласно которым в пессимальных условиях реализуется тактика растения, направленная на выживание, а в оптимальных — на размножение.
Онтогенетическая стратегия N. ovata соответствует смешанному типу с чередованием стрессовой и защитной составляющих. Первоначально при ухудшении условий роста до умеренного уровня проявляется стрессовая составляющая. При этом происходит снижение морфологической целостности, что отражается в понижении значений коэффициента детерминации до 0.28% (рис. 7). Дальнейшее усиление стресса включает защитные механизмы регуляции взаимообусловленности развития морфологических структур, компенсирующие неблагоприятные экологические и ценотические воздействия, что находит отражение в повышении индекса морфологической интеграции до 0.50 и проявлении защитной компоненты. Защитная составляющая в комбинированной онтогенетической стратегии свидетельствует о проявлении устойчивости к умеренному стрессу. Сходный тип онтогенетической стратегии отмечался нами и для C. calceolus (Егорова, Сулейманова, 2019). Как отмечают М. М. Ишмуратова и др. (2010), И. В. Блинова (2014) стрессово-защитная онтогенетическая стратегия является типичной для многих видов семейства Орхидные, которая при антропогенном прессе дополняется чертами рудеральности.
ВЫВОДЫ
В условиях вторичных формаций выведенного из эксплуатации карьера по добыче известняка, эдафические параметры местообитаний N. ovata соответсвуют условиям от сухолесолугового до влажнолесолугового слабопеременного режима увлажнения, слабокислым бедным азотом почвам. Ценопопуляции N. ovata – вегетативно-ориентированные, инвазионные, изменения их возрастной структуры характеризуют первые стадии внедрения вида в фитоценоз.
Изученные ценопопуляции в наибольшей степени различаются по таким признакам как длина генеративного побега и длина соцветия и укладываются в рамки двух факторов, объясняющих 99.66% изменчивости ЦП. Все рассматриваемые ценопопуляции являются процветающими. Наиболее благоприятные условия для N. ovata складываются в условиях опушки ельника с примесью осины и сосны (ЦП 2), где показатель качества имеет максимальное значение (Q = 40.63). Исследуемый вид обладает разнообразным набором онтогенетических тактик, что позволяет N. ovata поддерживать популяции в оптимальном состоянии в условиях антропогенно трансформированных биотопов. Свойственными типами онтогенетических тактик являются как чистые (дивергентная, конвергентная), так и комбинированные (конвергентно-дивергентная и дивергентно-конвергентная) типы. Анализ вариабельности морфологических признаков N. ovata показал, что в основном признаки проявляют конвергентно-дивергентную тактику, то есть в неблагоприятных условиях роста изменчивость признаков сначала понижается, а затем повышается.
По характеру проявления согласованности в организации морфологической структуры растений для вида установлена стрессово-защитная онтогенетическая стратегия. Подобный тип онтогенетической стратегии соответствует SR типу рудерально-стресс-толерантной эколого-ценотической стратегии. Эксплерентная составляющая эколого-фитоценотической стратегии способствует заселению N. ovata в искусственные ландшафты и антропогенно измененные фитоценозы. Это является важным механизмом адаптации N. ovata к антропогенно нарушенным экотопам и его способности к выживанию.
Список литературы
Андреева Е.Н, Баккал И.Ю., Горшков В.В., Лянгузова И.В., Мазная Е.А., Нешатаев В.Ю., Нешатаева В.Ю., Ставрова Н.И., Ярмишко В.Т., Ярмишко М.А. Методы изучения лесных сообществ. СПб.: НИИХимии СПбГУ, 2002. 240 с.
Баштавой Н.Г. Стратегия защиты у ценопопуляций сныти обыкновенной и купены многоцветковой в условиях антропогенных нагрузок // Популяции растений: принципы организации и проблемы охраны природы. Матер. Всесоюз. конф. Йошкар-Ола, 4–8 февраля 1991 г. Йошкар-Ола: Мар. гос. ун-т, 1991. С. 67.
Блинова И.В. Эколого-ценотические и онтогенетические стратегии редких видов сосудистых растений Мурманской обл. // Вест. КНЦ РАН. 2014. Т. 19. № 4. С. 83–95.
Блинова И.В. О сопряженности пространственного размещения популяций редких видов орхидных и осоковых с кислотностью и электропроводностью почв на минеротрофном и насыщенном основаниями болоте в Мурманской обл. (Россия) // Вест. КНЦ РАН. 2016. Т. 27. № 4. С. 108–120.
Быченко Т.М. Изучение ценопопуляций некоторых видов орхидных Южного Прибайкалья на техногенно нарушенных территориях // “Проблемы экологии и рационального использования природных ресурсов в Дальневосточном регионе”: Матер. региональной науч. практ. конф. Благовещенск: БГПУ, 2004. Т. 1. С. 175–179.
Вахрамеева М.Г., Варлыгина Т.И., Татаренко И.В. Орхидные России (биология, экология и охрана). М.: Товарищество научных изданий КМК, 2014. 437 с.
Виляева Н.А. Состояние популяций Platanthera bifolia (L.) Rich. и Platanthera chlorantha (Cust.) Reichenb. (Orchidaceae) в национальном парке “Смоленское Поозерье” // Вест. Рос. ун-та дружбы народов. Сер. Экология и безопасность жизнедеятельности. 2014. № 4. С. 5–10.
Егорова Н.Ю., Сулейманова В.Н. Оценка состояния ценопопуляций Cypripedium calceolus L. на выходах известняковых пород по склонам долины реки Вятка. Вест. Томского гос. ун-та. Биология. 2019. № 47. С. 40–58. https://doi.org/10.17223/19988591/47/3
Животовский Л.А. Онтогенетические состояния, эффективная плотность и классификация популяций растений // Экология. 2001. № 1. С. 3–7.
Жукова Л.А. Популяционная жизнь луговых растений. Йошкар-Ола: РИИК “Ланар”, 1995. 224 с.
Злобин Ю.А. Популяционная экология растений: современное состояние, точки роста. Сумы: универ. книга, 2009. 263 с.
Ишбирдин А.Р., Ишмуратова М.М. Адаптивный морфогенез и эколого-ценотические стратегии выживания травянистых растений // Методы популяционной биологии. Сыктывкар. 2004. Ч. 2. С. 113–120.
Ишбирдин А.Р., Ишмуратова М.М., Жирнова Т.В. Стратегии жизни ценопопуляции Cephalanthera rubra (L.) Rich. на территории Башкирского государственного заповедника // Вест. Нижегородского унив-та им. Н.И. Лобачевского. Сер. Биология. 2005. № 1. С. 85–98.
Ишмуратова М.М., Набиуллин М.И., Суюндуков И.В., Ишбирдин А.Р. Орхидеи Башкирского заповедника и сопредельных территорий. Уфа: Гилем, 2010. 176 с.
Ишмуратова М.М., Суюндуков И.В., Ишбирдин А.Р., Жирнова Т.В., Набиуллин М.И. Состояние ценопопуляций некоторых видов сем. Orchidaceae на Южном Урале. Сообщ. 2. Корневищные виды // Растительные ресурсы. 2003. Т. 39. № 2. С. 18–37.
Коваленко I.М. Структура популяцій домінантів трав'яно-чагарникового ярусу в лісових фітоценозах Деснянсько-Старогутського національного природного парку. І. Онтогенетична структура // Український ботанічний журн. 2005. Т. 62. № 5. С. 707–714.
Курченко Е.И., Егорова В.Н. Процесс естественного зарастания золоотвалов Новомосковской ГРЭС Тульской обл. // Бюл. МОИП. Отд. биол. 2009. Т. 114. Вып. 5. С. 21–28.
Кучер Е.Н. Сравнительный анализ виталитетного спектра популяций Dactylorhiza romana (Orchidaceae) // Экосистемы, их оптимизация и охрана. 2013. № 9. С. 250–257.
Малева М.Г., Филимонова Е.И., Борисова Г.Г., Желнарчук А.С., Новиков П.Е. Участие неэнзиматических антиоксидантов в адаптации редкой орхидеи (Listera ovata (L.) R.BR.) к неблагоприятным условиям золоотвала // Экобиотех. 2020. Т. 3. № 2. С. 261–270. https://doi.org/10.31163/2618-964X-2020-3-2-261-270
Мамаев С.А., Князев М.С., Куликов П.В., Филиппов Е.Г. Орхидные Урала: систематика, биология, охрана. Екатеринбург: УрО РАН, 2004. 124 с.
Перебора Е.А. Экологические особенности местообитаний Listera ovata (L.) R.Br. в условиях Северо-Западного Кавказа // Эколог. вест. Северного Кавказа. 2008. Т. 4. № 1. С. 40–61.
Плантариум: открытый онлайн атлас-определитель растений и лишайников России и сопредельных стран [Электронный ресурс]. 2007–2020.
Плотникова И.А. Состояние ценопопуляций видов рода Listera (Orchidaceae) в Печоро-Илычском заповеднике // Вест. института биологии Коми НЦ Уральского отделения РАН. 2009. № 3(137). С. 40–43.
Полетаева И.И., Дегтева С.В., Кириллова И.А. Характеристика ценопопуляций некоторых редких растений на отвалах месторождения россыпного золота (Приполярный Урал) // Растительные ресурсы. 2014. Т. 50. № 1. С. 53–66.
Пушай Е.С. Орхидные урбанизированных территорий г. Твери // Вест. ТвГУ. Сер.: Биология и экология. 2007. № 4. С. 97–100.
Ростова Н.С. Корреляции: структура и изменчивость. СПб.: Изд-во СПбГУ, 2002. 308 с.
Салманова Р.К. Распространение видов семейства Orchidaceae Juss. в кустарниковой и лесной растительности Нахичеванской автономной республики // Бюллетень науки и практики. 2020. Т. 6. № 9. С. 62–68. https://doi.org/10.33619/2414-2948/58/06
Уранов А.А. Возрастной спектр фитоценопопуляций как функция времени и энергетических волновых процессов // Биол. науки. 1975. № 2. С. 7–34.
Фардеева М.Б., Исламова Г.Р. Онтогенез тайника яйцевидного (Listera ovata (L.) R. Br.) // Онтогенет. атлас лекар. раст. Йошкар-Ола: МарГУ, 2004. Т. 4. С. 123–128.
Филимонова Е.И., Лукина Н.В., Глазырина М.А. Орхидные в техногенных экосистемах Урала // Экосистемы, их оптимизация и охрана. Симферополь: ТНУ, 2014. Вып. 11. С. 68–75.
Цыганов Д.Н. Фитоиндикация экологических режимов в подзоне хвойно-широколиственных лесов. М.: Наука, 1983. 197 с.
Convention of International Trade in Endangered Species of wild fauna and flora. Appendices I, II and III: valid from 10.03.2016. CITES–UNEP. 2016. P. 1–46.
Fay M. British and Irish orchids in a Changing world // Curtis’s Botanical Magazine. 2015. V. 32. P. 3–23.
Hammer Ø., Harper D.A. T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontologia Electronica. 2001. V. 4 (1). 9 p. http://palaeoelectronica.org/2001_1/past/issue1_01.htm
Hill M.O., Preston C.D., Roy D.B. PLANTATT – attributes of British and Irish Plants: status, size, life history, geography and habits. Centrefor Ecology and Hydrology. Huntingdon, UK. 2004. 73 p.
Jurkiewicz A., Turnau K., Mesjasz-Przybylowicz J., Przybylowicz W., Godzik B. Heavy metal localisation in mycorrhizas of Epipactis atrorubens (Hoffm.) Besser (Orchidaceae) from zinc mine tailings // Protoplasma. 2001. V. 218. P. 117–124.
Kluza M., Maciejewska I. Struktura populacji Listery jajowatej (Listera ovata) oraz Kukułki krwistej (Dactylorhiza incarnata) w obrębie użytkόw ekologicznych w południowo-zachodniej Chęści Poznania // Rocz. AR Pozn. CCCXVI, Bot. 1999. V. 2. P. 67–76.
Klymenko G., Kovalenko I., Lykholat Yu., Khromykh N., Didur O., Alekseeva A. The integral assessment of the rare plant populations // Ukr. J. Ecology. V. 7. № 2. 2017. P. 201–209. https://doi.org/10.15421/2017_37
Plants of the World Online (http://www.plantsoftheworldonline.org/).
Preston C.D., Hill M.O. The geographical relationships of British and Irish vascular plants // Bot. J. Linnean Society. 1997. V. 124. P. 1–120. https://doi.org/10.1111/j.1095-8339.1997.tb01785.x
Shefferson R., Kull T., Tali K. Mycorrhizal interactions of orchids colonizing Estonian mine tailings hills // Amer. J. Botany. 2008. V. 95(2). P. 156–164. https://doi.org/10.3732/ajb.95.2.156
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая