Известия РАН. Серия биологическая, 2022, № 4, стр. 374-384
Возрастной состав и особенности постметаморфозного роста остромордой лягушки (Rana arvalis) из местообитаний с коротким сезоном активности
С. М. Ляпков 1, *, Д. В. Ибрагимова 2, Н. В. Наконечный 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Россия
2 Институт естественных и технических наук бюджетного учреждения высшего образования ХМАО-Югры Сургутского государственного университета
628412 Сургут, Россия
* E-mail: lyapkov@mail.ru
Поступила в редакцию 13.01.2021
После доработки 13.03.2021
Принята к публикации 13.03.2021
- EDN: EFEGGV
- DOI: 10.31857/S1026347022040096
Аннотация
Анализировали межпопуляционные и половые различия демографических характеристик и особенностей постметаморфозного роста остромордой лягушки из нескольких местообитаний в Ханты-Мансийском автономном округе – Югре (ХМАО) со сравнительно коротким (~3.5 мес.) сезоном активности. В трех из четырех популяций были выявлены более высокие средние значения возраста самок, но при этом половых различий по размерам не выявлено. Как самцы, так и самки всех популяций ХМАО характеризовались максимальной скоростью ежегодных приростов в промежутке между 1-й и 2-й зимовками; между 2-й и 3-й зимовками скорость приростов оставалась сравнительно высокой. По сравнению с популяциями Брянской, Московской и Кировской областей с более длительным сезоном активности (соответственно, 7, 6 и 5 мес.), популяции ХМАО характеризовались низкими ежегодными приростами, сравнительно небольшими средними значениями длины тела в каждом из возрастов и низкими среднепопуляционными значениями длины тела. Вместе с тем особенности возрастной динамики скорости приростов в популяциях ХМАО позволили выявить ранее не отмеченный в литературе эффект отбора против градиента условий среды, проявляющийся в том, что сравнительно высокая скорость ежегодных приростов сохраняется вплоть до 5-й зимовки.
Изменчивость характеристик жизненного цикла, направленная против градиента условий среды, представляет собой межпопуляционные фенотипические различия, проявление которых противоположно генетическим изменениям, формирующимся как адаптивный ответ в популяциях, расположенных вдоль данного градиента внешних условий (обзор см. Laugen et al., 2003; Conover et al., 2009). Уже сформированные адаптивные генетические изменения можно выявить только в полевых экспериментах с реципрокными межпопуляционными переносами особей или в одинаковых условиях лабораторных опытов (Berven et al., 1979). При изучении межпопуляционной изменчивости постметаморфозного роста амфибий существует, однако, еще один, косвенный способ выявления таких генетических изменений. Суть его в том, что используются данные не только по абсолютной величине ежегодных приростов после метаморфоза в течение каждого из последовательных сезонов активности, но и по длительности сезона активности, т.е. времени, в течение которого происходят эти ежегодные приросты (Ищенко, 1999; Hjernquist et al., 2012). Далее на основании этих данных получают оценки скорости ежегодных приростов (Ляпков и др., 2009). Наше предварительное исследование, проведенное на двух широкоареальных видах бурых лягушек Евразии, остромордой (Rana arvalis) и травяной (Rana temporaria), позволило выявить у них межпопуляционную изменчивость скорости таких ежегодных приростов (но не средневозрастных размеров). Эта изменчивость была направлена против градиента климатической температуры, обусловливающего различия в длительности сезонов активности местообитаний популяций, географически удаленных друг от друга (Ляпков и др., 2009). Однако в этой работе не были исследованы популяции из местообитаний с длительностью сезона активности, близкой к минимальной. Такие данные были позднее получены нами для травяной лягушки: скорости приростов особей из популяций с предельно коротким сезоном активности были максимальны, т.е. соответствовали общей закономерности проявления изменчивости, направленной против градиента условий среды (Ляпков, 2019).
В результате исследования нами популяций остромордой лягушки в местообитаниях с коротким периодом активности (~3.5 мес.) в двух различных районах Ханты-Мансийского автономного округа – Югры (далее для краткости – ХМАО), было показано, что особи этих популяций характеризуются относительно небольшими размерами в каждом из возрастов и соответственно – низкими ежегодными приростами (Матковский и др., 2011; Ибрагимова, Ляпков, 2018). Была также выявлена слабая выраженность размерных различий между половозрелыми самками и самцами в этих популяциях ХМАО.
Позднее нами были исследованы другие популяции г. Сургута и вблизи него. В связи с этим, задачами данного исследования были: 1) определение возраста остромордых лягушек популяций ХМАО методом скелетохронологии, ретроспективная оценка длины тела и выявление особенностей их постметаморфозного роста (т.е. длины тела в каждом из возрастов и скорости ежегодных приростов) в условиях сильного ограничения продолжительности сезона активности; 2) выявление взаимосвязи половых различий по длине тела с абсолютной величиной ежегодных приростов и их скоростью в каждой из исследованных популяций; 3) сравнение по исследованным характеристикам популяций из городских местообитаний с сильной антропогенной нагрузкой с популяциями из местообитаний с относительно слабым антропогенным влиянием; 4) сравнение полученных результатов с ранее полученными нами данными по росту остромордых лягушек из популяций с более длительным сезоном активности из Брянской, Московской, и Кировской областей, а также с литературными данными.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор материала проводили в местообитаниях нескольких популяций остромордой лягушки на территории ХМАО. Местообитание первой из городских популяций находилось в промышленной зоне г. Сургут (61°15′35′′ с.ш., 73°32′45′′ в.д.), вблизи плотины Сургутской ГРЭС-2. Местообитание второй городской популяции находилось в лесопарке (смешанный мелколиственно-хвойный лес и верховое болото, 61°14′38′′ с.ш., 73°25′06′′ в.д.), третьей – в пойме Оби (ивовые вейниково-осоковые заливные луга, 61°14′04′′ с.ш., 73°25′44′′ в.д.). Данные по всем этим городским популяциям, с сильной или средней антропогенной нагрузкой, были объединены (далее для краткости – Сургут). Контрольная популяция, антропогенная нагрузка в местообитании которой практически отсутствовала, находилась в 28 км северо-восточнее Сургута (далее для краткости – Контроль, 61°38′35′′ с.ш., 73°48′35′′ в.д.). Более подробное описание местообитаний популяций Сургута и Контроля приводилось ранее (Ибрагимова, Стариков, 2013). Отлов животных в местообитаниях этих популяций осуществляли с помощью ловчих цилиндров, с мая по сентябрь 2011 г., длительность сезона активности в местообитаниях данной популяции – 3.7 мес. Местообитание еще одной исследованной популяции, также характеризующееся низкой антропогенной нагрузкой, находилось в 50 км южнее Сургута, в окрестностях дер. Юган (далее для краткости – Юган, 60°52′41′′ с.ш., 73°41′20′′ в.д.). Это местообитание включает лесные и пойменные растительные сообщества, длительность сезона активности – также 3.7 мес. Сбор материала проводили в конце мая 2017 и 2018 гг., вручную, на суше в период миграций взрослых особей к нерестовым водоемам, а также в нерестовых водоемах. Кроме того, мы использовали наши данные по 3-м популяциям северной части ХМАО (далее – СеверХМАО). Возрастной и размерный состав этих трех популяций не различается достоверно между собой (подробнее – Матковский и др., 2011), поэтому мы объединили данные по ним в одну выборку. Длительность сезона активности в местообитаниях популяций СеверХМАО – 3.5 мес.
Постметаморфозный рост изучали с помощью данных по возрасту и рассчитанной длине тела неполовозрелых и взрослых остромордых лягушек исследованных популяций. У каждой особи измеряли длину тела и определяли возраст путем изготовления срезов середины диафиза голени, окрашенных гематоксилином Эрлиха. Для определения возраста и оценки темпов резорбции эндостальной кости были использованы также немногочисленные неполовозрелые особи. Основная проблема точного определения возраста состоит в оценке количества резорбированных линий остановки роста (называемых иначе “линиями склеивания”), соответствующих первой и второй (реже) зимовкам (Hemelaar, 1985; Смирина, Макаров, 1987). Согласно проведенным измерениям, у особей популяций Сургута, Контроля и Югана диаметр линии склеивания, соответствующей первой зимовке, не превышал 0.87 мм, соответственно, при определении возраста мы принимали, что у особей с диаметром костномозговой полости более 0.87 мм произошла полная резорбция этой первой линии. Аналогичные данные (0.77 мм) были использованы для определения количества особей с резорбированной первой линией склеивания популяции СеверХМАО.
Поскольку поперечные срезы голени обычно имеют форму, близкую к эллипсу (а не правильной окружности), величину внешнего диаметра поперечных срезов и каждой из линий склеивания определяли как полусумму минимального и максимального значения измеренных диаметров (подробнее – см. Смирина, 1983). Ретроспективную оценку длины тела проводили с помощью наиболее часто используемого уравнения Даля-Лео (Marunouchi et al., 2000): Li = LDi/Dвнеш, где Li – рассчитанная длина тела в данном возрасте i, Di – диаметр соответствующей линии склеивания, Dвнеш – внешний диаметр среза, измеренный у пойманной особи, L – длина тела пойманной особи. По рассчитанным длинам тела перед данной (Li + 1) и предыдущей (Li) зимовками были вычислены ежегодные приросты: Li + 1 – Li, а по ним – скорость прироста за данный сезон: V(i → i + + 1) = (Li + 1 – Li)/t, где t (мес.) – длительность сезона активности в местообитании данной популяции. Для сравнения с популяциями ХМАО, такие же расчеты были проведены с использованием наших неопубликованных данных по популяциям Брянской, Московской и Кировской областей, для которых длительность сезона активности составляла, соответственно, 7, 6 и 5 мес. Следует особо отметить, что необходимость использовать ретроспективную оценку длины тела объясняется тем, что, поскольку в популяциях ХМАО большинство особей становится половозрелыми не раньше чем после 3-й зимовки (см. раздел “Результаты”), рассчитанные значения позволяют оценить длину тела перед 1-й и 2-й зимовками по выборкам большего объема, в сравнении с немногочисленными выборками неполовозрелых особей с измеренной длиной тела.
При статистической обработке материала применяли двухфакторную схему дисперсионного анализа (факторы: “пол” и “популяция”, модель с фиксированными эффектами) и последующие множественные сравнения средних значений, с использованием пакета статистических программ STATISTICA 8.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Возрастной состав и качественные особенности постметаморфозного роста и структуры ростовых слоев
В популяции Юган относительно небольшая часть особей размножалась впервые уже после 3-й зимовки, остальные – после 4-й зимовки, а максимальный выявленный возраст составил 10 лет (рис. 1). В остальных популяциях, т.е. СеверХМАО, Сургут и Контроль, в возрасте 3 лет размножалась большая доля особей, причем не только самцов, но и самок, и соответственно – меньшая доля 4‑летних особей (рис. 1). В отличие от популяции Юган, максимальные значения возраста особей этих трех популяций были 7 лет (СеверХМАО) и 5 лет (Сургут и Контроль).
Линия склеивания, соответствующая первой зимовке, была полностью (или почти полностью, что исключало возможность измерения ее диаметров) резорбирована у 40.9% особей популяции Сургут, у 64.1% особей популяции Контроль, у 46.9% особей популяции Юган (рис. 2) и у 85.3% особей популяции СеверХМАО. Линия склеивания, соответствующая второй зимовке, была полностью резорбирована, у 5.1, у 20.5, у 3.1 и у 27.7% особей соответственно.
Рис. 1.
Распределение (%, вертикальная ось) возрастов (горизонтальная ось) половозрелых особей исследованных популяций ХМАО. (а) – СеверХМАО, (б) – Сургут, (в) – Контроль, (г) – Юган.
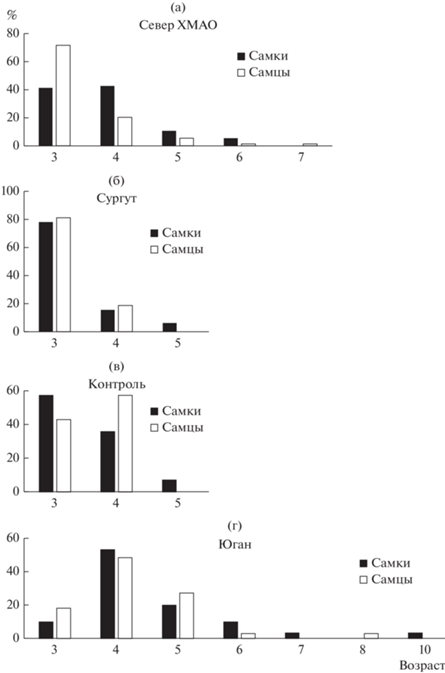
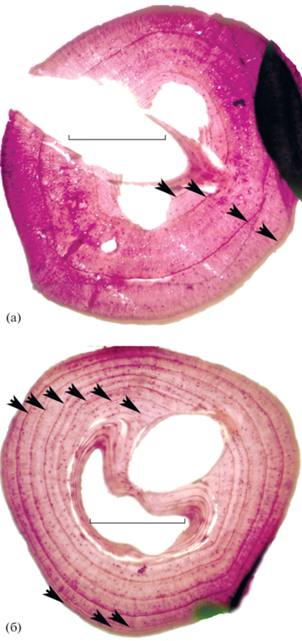
Рис. 2.
Микрофотографии срезов голени половозрелых остромордых лягушек. Длина масштабной линейки 1 мм. (а) – Юган, самец, длина тела 54 мм, 5 зимовок; (б) – Юган, самка, длина тела 57 мм, 10 зимовок. Стрелки указывают на линии склеивания, соответствующие зимовкам. У обеих особей линия, соответствующая первой зимовке, резорбирована не полностью, а линия последней зимовки не отмечена, поскольку не отошла от наружного края среза.
Межпопуляционные и половые различия по средним значениям возраста и длины тела
Сравнение исследованных популяций ХМАО в пределах одного пола выявило максимальные среднепопуляционные значения возраста (достоверно отличающиеся от всех других популяций) и у самок, и у самцов Югана, минимальные значения – и у самок, и самцов популяции Сургута (табл. 1).
Таблица 1.
Средние значения длина тела (мм) и возраста у остромордой лягушки исследованных популяций ХМАО
| Популяция | Пол | n | Возраст | Длина тела, мм |
|---|---|---|---|---|
| СеверХМАО (а) | ♀ | 75 | 3.80 | 48.24 |
| ♂ | 74 | 3.41 | 47.80 | |
| Сургут (б) | ♀ | 32 | 3.28 | 45.21 |
| ♂ | 48 | 3.19 | 46.27 | |
| Контроль (в) | ♀ | 14 | 3.50 | 45.27 |
| ♂ | 14 | 3.57 | 45.90 | |
| Юган (г) | ♀ | 30 | 4.60 | 51.10 |
| ♂ | 33 | 4.27 | 52.88 |
Примечание. Жирным шрифтом отмечены достоверные различия (p < 0.05) средних значений самок и самцов. Достоверные различия между популяциями (буквенные обозначения популяций – в левом столбце таблицы): возраст, самки: а–б, а–г, б–г, в–г; возраст, самцы: а–г, б–г, в–г; длина тела, самки: а–б, а–в, а–г, б–г, в–г.; длина тела, самцы: а–г, б–г, в–г.
Максимальной среднепопуляционной длиной тела характеризовались и самки, и самцы популяции Югана (все различия достоверные – см. табл. 1), что соответствовало максимальному значению их среднего возраста. В сравнении с двумя другими популяциями, самки популяций Сургута и Контроля характеризовались достоверно меньшими значениями средней длины тела и не различались между собой. Таким же соотношением среднепопуляционных размеров характеризовались самцы исследованных популяций (табл. 1).
Общей тенденцией половых различий во всех популяциях, кроме Контроля, были более высокие средние значения возраста самок (в популяции СеверХМАО – различия достоверные). В соответствии с выявленными различиями по возрасту, самки популяции СеверХМАО были немного (недостоверно) крупнее самцов, однако в остальных 3-х популяциях средняя длина тела самцов была несколько больше (также недостоверно), чем у самок.
Следует также отметить, что популяции из городских местообитаний Сургута с сильной антропогенной нагрузкой были наиболее сходны по средним значениям длины тела и возраста с ближайшей к ней загородной популяцией (Контроль) и все они (т.е. и Сургут, и Контроль) отличались от пространственно удаленных от них популяций Югана и СеверХМАО.
Возрастная динамика длины тела и скорости ежегодных приростов
Согласно полученной ретроспективной оценке длины тела (табл. 2), особи популяции Юган характеризовались минимальными размерами перед уходом в первую зимовку (у самцов – достоверно отличающимися от всех других популяций – см. табл. 2), а также перед 2-й зимовкой (у самок – достоверно отличающимися от всех других популяций – см. табл. 2). В дальнейшем их рост ускорялся, и перед 4-й зимовкой они были уже крупнее особей трех других популяций. При этом половых различий по средним размерам не было выявлено ни в одной из популяций и ни в одном из возрастов (исключение – особи популяции Юган перед 1-й зимовкой – см. табл. 2).
Таблица 2.
Рассчитанная длина тела (мм) в каждом из возрастов у остромордой лягушки исследованных популяций
| Популяция | СеверХМАО(а) | Сургут (б) | Контроль (в) | Юган (г) | |||||
|---|---|---|---|---|---|---|---|---|---|
| возраст | пол | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ | ♀ | ♂ |
| 1 | X | 22.23 | 23.24 | 23.03 | 22.65 | 23.93 | 24.48 | 21.98 | 19.34 |
| n | 10 | 3 | 68 | 73 | 13 | 9 | 19 | 14 | |
| min | 16.58 | 21.34 | 15.41 | 15.00 | 19.87 | 20.85 | 15.84 | 16.60 | |
| max | 24.82 | 24.19 | 29.37 | 28.38 | 27.23 | 29.96 | 27.51 | 23.00 | |
| 2 | X | 33.17 | 33.24 | 33.27 | 32.92 | 33.98 | 34.75 | 30.96 | 31.17 |
| n | 68 | 64 | 65 | 77 | 22 | 16 | 30 | 31 | |
| min | 23.83 | 22.31 | 23.10 | 19.85 | 24.68 | 29.61 | 21.43 | 23.41 | |
| max | 44.18 | 43.14 | 43.78 | 47.52 | 40.72 | 39.37 | 41.36 | 41.20 | |
| 3 | X | 40.54 | 41.81 | 42.29 | 42.85 | 41.16 | 41.61 | 42.08 | 43.88 |
| n | 72 | 73 | 21 | 29 | 11 | 13 | 30 | 33 | |
| min | 27.50 | 25.22 | 32.30 | 32.30 | 31.86 | 35.94 | 31.42 | 33.20 | |
| max | 55.00 | 53.77 | 50.78 | 52.36 | 47.98 | 46.46 | 51.72 | 52.00 | |
| 4 | X | 46.67 | 46.97 | 48.24 | 49.79 | 47.40 | 46.51 | 49.16 | 52.06 |
| n | 44 | 22 | 2 | 3 | 3 | 3 | 28 | 28 | |
| min | 36.77 | 39.87 | 46.97 | 48.41 | 45.40 | 40.70 | 40.51 | 46.61 | |
| max | 56.62 | 52.93 | 49.52 | 50.49 | 50.66 | 49.91 | 57.00 | 59.09 | |
| 5 | X | 51.88 | 49.56 | 51.87 | 52.85 | 55.25 | |||
| n | 13 | 6 | 2 | 0 | 0 | 0 | 9 | 11 | |
| min | 45.30 | 46.02 | 51.64 | 44.99 | 52.00 | ||||
| max | 57.07 | 52.13 | 52.10 | 58.00 | 62.00 | ||||
Примечанияе. X – среднее, n – объем выборки, min – минимальное значение, max – максимальное значение. Жирным шрифтом отмечены достоверные различия (p < 0.05) средних значений самок и самцов. Достоверные (p < 0.05) различия между популяциями (буквенные обозначения популяций – в заголовке таблицы): возраст 1 год, самцы: а–г, б–г, в–г; возраст 2 года, самки: а–г, б–г, в–г; возраст 2 года, самцы: в–г; возраст 4 года, самки: а–г; возраст 4 года, самцы: а–г, в–г; возраст 5 лет, самцы: Юган-СеверХМАО.
И самцы, и самки каждой из четырех популяций ХМАО характеризовались максимальной скоростью ежегодных приростов в промежутке между 1-й и 2-й зимовками (рис. 3). Между 2-й и 3-й зимовками скорость приростов оставалась такой же высокой в популяции Юган и замедлялась – у остальных трех популяций. Между 3-й и 4-й зимовками скорость приростов в популяции Юган начинала замедляться, но оставалась выше, чем у остальных популяций. Такие особенности изменения скорости ежегодных приростов популяции Юган обусловили отмеченное выше преобладание в размерах особей этой популяции в возрасте 4 и 5 лет (табл. 2).
Рис. 3.
Скорость ежегодных приростов (мм/мес.) в течение первых 4 лет жизни на суше после первой зимовки (1–2 – от выхода из 1-й зимовки до ухода во 2-ю зимовку, 2–3 – от выхода из 2-й зимовки до ухода в 3-ю зимовку, 3–4 – от выхода из 3-й зимовки до ухода в 4-ю зимовку, 4–5 – от выхода из 4-й зимовки до ухода в 5-ю зимовку) у остромордой лягушки исследованных популяций ХМАО, и из других, географически удаленных популяций с более длительным сезоном активности. (а) – самки; (б) – самцы. Примечания. Достоверные различия между самцами и самками выявлены: в интервале 1–2 – в популяциях Кировской обл., ЗБС и Брянской обл.; в интервале 2–3 – в популяциях СеверХМАО, Кировской обл. и ЗБС; в интервалах 3–4 и 4–5 достоверных различий между самцами и самками не выявлено. Достоверности различий между популяциями – см. табл. 3.

Половых различий по скорости приростов не было выявлено ни в одной из популяций и ни в одном из возрастов (единственное исключение – прирост между 2-й и 3-й зимовками в популяции СеверХМАО – рис. 3).
Отметим также, что популяции из городских местообитаний (Сургут) были наиболее сходны, как по средневозрастным значениям длины тела, так и по скорости ежегодных приростов и их возрастной динамики, с ближайшей к ней загородной популяцией (Контроль), и обе эти популяции существенно отличались от пространственно удаленной от них популяции Югана. Как уже отмечалось выше, такая же направленность межпопуляционных различий наблюдалась и по средним значениям длины тела и возраста. На этом основании можно сделать вывод, что на все рассмотренные демографические и ростовые характеристики наибольшее влияние оказывают пространственная разобщенность и соответствующие климатические различия, а не собственно антропогенная нагрузка.
По сравнению с популяциями Брянской, Московской (Звенигородская биостанция, далее для краткости – ЗБС) и Кировской областей, особи популяций ХМАО характеризовались сравнительно высокой средней скоростью ежегодных приростов в более широком диапазоне возрастов (рис. 3). В период между 1-й и 2-й зимовками высокой скоростью приростов характеризовались практически все исследованные популяции, независимо от длительности сезона активности. Однако уже в следующем теплом сезоне (между 2-й и 3-й зимовками) скорость приростов у особей популяции Брянской обл. становилась существенно ниже, чем годом раньше. Далее, между 3-й и 4-й зимовками, снижались также скорости прироста в двух более северных (чем популяция Брянской обл.) популяциях ЗБС и Кировской обл., в то время как темпы роста оставались сравнительно высокими у особей из всех 4 популяций ХМАО (за одним исключением – самцы популяции Сургут). Наиболее вероятное объяснение выявленной возрастной динамики состоит в том, что в южных популяциях большинство особей (причем не только самцов, но и самок) достигает половозрелости и в дальнейшем растут существенно медленнее (поскольку ежегодно перераспределяет существенную долю ресурсов на размножение) уже перед 2-й зимовкой, в более северных популяциях – перед 3-й зимовкой, и только в популяциях ХМАО с самым коротким сезоном активности – перед 4-й зимовкой.
В отличие от популяций ХМАО, половые различия по скорости приростов между 1-й и 2-й и 2-й и 3-й зимовками были выявлены в большинстве более южных популяций (рис. 3). Во всех этих случаях самцы росли быстрее самок, что соответствует выявленной нами общей тенденции половых различий по величине ежегодных приростов, проявляющейся в том, что обычно самцы крупнее самок в каждом из возрастов (Ляпков и др., 2007).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные по скоростям ежегодных приростов у остромордой лягушки (кроме наших данных по нескольким популяциям – Ляпков и др., 2009) в литературе отсутствуют, и поэтому мы можем сравнивать популяции вида из разных регионов только по возрастной динамике размеров. Наиболее полный набор таких литературных данных содержится в нашем обзоре (Ляпков, 2013). Уточним, что представленные в обзоре средневозрастные значения длины тела – не ретроспективная оценка на основе “обратного расчисления”, а данные, полученные непосредственно измерением лягушек. Эта возрастная динамика размеров представляет собой итог возрастных динамик приростов, специфичных, как мы показали, для популяций из регионов, сильно различающихся между собой по длительности периода активности. Рекордно низкие средние значения длины тела в каждом из возрастов выявлены в крайней северной популяции вида на Ямале (Ishchenko, 2005). При сравнении с популяциями других регионов с более длительным сезоном активности, особи исследованных четырех популяций ХМАО также характеризовались сравнительно небольшими средними значениями длины тела в каждом из возрастов и среднепопуляционными значениями длины тела (см. Ляпков, 2013, табл. 3 и рис. 3 и 4 ). Сходство в средних размерах популяций ХМАО наблюдалось лишь с популяциями из местообитаний с длительностью сезона активности, близкой к максимальной (более 7 мес.) (Ляпков и др., 2010), что объясняется существенно более высоким вкладом в репродукцию южных популяций (Ляпков и др., 2008) и соответственно – сравнительно медленным ростом по достижении половой зрелости. Не исключено также, что в некоторых южных популяциях режим влажности не является близким к оптимуму в течение всего сезона активности.
Таблица 3.
Уровни значимости различий между среднепопуляционными значениями скорости ежегодных приростов (V) в течение первых 5 лет жизни на суше (1–2 – от выхода из 1-й зимовки до ухода во 2-ю зимовку, 2–3 – от выхода из 2-й зимовки до ухода в 3-ю зимовку, и т.д.)
| Популяция | Север ХМАО |
Сургут | Контроль | Юган | Киров. обл. |
ЗБС | Брянск. обл. |
|---|---|---|---|---|---|---|---|
| V(1–2) | |||||||
| СеверХМАО | × | 0.803 | 0.301 | 0.015 | 0.982 | 0.618 | 0.061 |
| Сургут | 0.845 | × | 0.279 | 0.002 | 0.620 | 0.668 | 0.002 |
| Контроль | 0.612 | 0.141 | × | 0.164 | 0.146 | 0.346 | 0.580 |
| Юган | 0.437 | 0.136 | 0.020 | × | 0.000 | 0.002 | 0.153 |
| Киров. обл. | 0.309 | 0.002 | 0.001 | 0.611 | × | 0.207 | 0.000 |
| ЗБС | 0.735 | 0.558 | 0.065 | 0.207 | 0.001 | × | 0.000 |
| Брянск. обл. | 0.950 | 0.557 | 0.196 | 0.044 | 0.000 | 0.080 | × |
| V(2–3) | |||||||
| СеверХМАО | × | 0.045 | 0.126 | 0.000 | 0.023 | 0.001 | 0.000 |
| Сургут | 0.794 | × | 0.006 | 0.212 | 0.000 | 0.000 | 0.000 |
| Контроль | 0.004 | 0.004 | × | 0.000 | 0.737 | 0.969 | 0.018 |
| Юган | 0.020 | 0.072 | 0.000 | × | 0.000 | 0.000 | 0.000 |
| Киров. обл. | 0.000 | 0.000 | 0.538 | 0.000 | × | 0.438 | 0.000 |
| ЗБС | 0.001 | 0.004 | 0.179 | 0.000 | 0.074 | × | 0.000 |
| Брянск. обл. | 0.000 | 0.000 | 0.303 | 0.000 | 0.000 | 0.000 | × |
| V(3–4) | |||||||
| СеверХМАО | × | 0.465 | 0.036 | 0.768 | 0.000 | 0.000 | 0.000 |
| Сургут | 0.075 | × | 0.428 | 0.412 | 0.102 | 0.022 | 0.012 |
| Контроль | 0.351 | 0.520 | × | 0.030 | 0.439 | 0.119 | 0.064 |
| Юган | 0.000 | 0.000 | 0.005 | × | 0.000 | 0.000 | 0.000 |
| Киров. обл. | 0.000 | 0.870 | 0.298 | 0.000 | × | 0.012 | 0.004 |
| ЗБС | 0.000 | 0.997 | 0.365 | 0.000 | 0.588 | × | 0.242 |
| Брянск. обл. | 0.000 | 0.958 | 0.345 | 0.000 | 0.737 | 0.838 | × |
| V(4–5) | |||||||
| СеверХМАО | × | 0.656 | 0.004 | 0.004 | 0.000 | 0.009 | |
| Сургут | × | 0.262 | 0.047 | 0.015 | 0.045 | ||
| Контроль | × | ||||||
| Юган | 0.388 | × | 0.000 | 0.000 | 0.000 | ||
| Киров. обл. | 0.057 | 0.188 | × | 0.521 | 0.852 | ||
| ЗБС | 0.000 | 0.001 | 0.285 | × | 0.777 | ||
| Брянск. обл. | 0.007 | 0.029 | 0.650 | 0.425 | × | ||
Кроме уменьшения величины ежегодных приростов при сильном сокращении длительности сезона активности, уменьшению среднепопуляционных размеров способствует также сравнительно высокая смертность (и прежде всего от неблагоприятных абиотических факторов), обусловливающая снижение доли старших возрастов среди половозрелых особей, что характерно, вероятно, для многих популяций с коротким сезоном активности. Так, во всех исследованных нами популяциях ХМАО не были выявлены сравнительно высокие значения возраста, свойственные, например, некоторым горным популяциям вида (Алтай – до 17 зимовок и при этом сравнительно крупные размеры – Ishchenko, 1996).
Предложенное объяснение снижения среднепопуляционных размеров не противоречит выявленной нами компенсации сравнительно невысоких приростов в популяциях остромордой лягушки с коротким периодом активности. Эта компенсация не может быть полной, прежде всего – из-за необходимости направлять существенную долю ресурсов не на рост, а на запасание резервных веществ, необходимых для переживания длительной зимовки (обзор см. Берман и др., 2017, Берман, Булахова, 2019). Вероятно также, что при полном отсутствии такой компенсации все половозрелые особи популяций с коротким периодом активности были бы сравнительно мелкими, несмотря на более высокие среднепопуляционные значения возраста, чего не наблюдается в действительности (Ляпков, 2013, рис. 1 и 2).
Отдельно следует отметить отсутствие достоверных половых различий по размерам в каждой из исследованных популяций ХМАО. Несмотря на более высокие средние значения возраста самок (в популяции СеверХМАО – различия достоверные, см. табл. 1), самки и самцы достоверно не различались по длине тела, хотя в трех других популяциях сохранялась тенденция более крупных размеров самцов. Такие слабые половые различия в популяциях ХМАО соответствуют выявленной направленности половых различий по размерам (самцы крупнее, и в целом, и в каждом из возрастов) на большей части ареала, кроме регионов с самым коротким периодом активности (Ляпков, 2013).
Итак, наиболее очевидный эффект отбора против градиента условий среды – более высокая скорость приростов в одни и те же периоды у популяций из регионов с более коротким сезоном активности – выявлен при сравнении ряда популяций вида, местообитания которых охватывают широкий диапазон длительности сезона активности. Такие различия выявляются, например, при сравнении популяции Брянской обл. с более северной популяцией Кировской обл. (между 1-й и 2-й зимовками, а также между 2-й и 3-й зимовкой – рис. 3). При этом наблюдается большое сходство при сравнении средневозрастных значений длины тела, например, той же популяции Кировской обл. с другими популяциями вида из местообитаний со сходной длительностью сезона активности (Байтимирова, Вершинин, 2017). Другой, менее очевидный, но не менее важный для локальных адаптаций, эффект отбора против градиента условий среды проявляется в том, что в популяциях с наиболее коротким сезоном активности (в нашей работе – это популяции ХМАО – рис. 3), не происходит столь сильного, как в более южных популяциях, замедления скорости приростов между 2-й и 3-й , а также между 3-й и 4-й и между 4-й и 5-й зимовками. Такая динамика скорости приростов представляет собой частичную компенсацию сравнительно небольших размеров перед первой и следующими зимовками, обусловленных сравнительно коротким сезоном активности. Отметим, что нам не удалось найти в литературе других примеров такого эффекта отбора против градиента условий среды, по крайней мере среди эктотермных позвоночных. Известные случаи вторичного ускорения роста некоторых видов рыб (Alekseyev et al., 2013, Fig. 4 ) объясняются миграцией из небольших рек в озера и переходом на питание более крупной добычей, причем такое ускорение роста происходит уже после достижения половой зрелости. Необходимо также отметить, что иногда авторы скелетохронологических исследований амфибий ошибочно интерпретируют границу эндоста и периоста или даже линии эндоста, расположенные близко друг к другу, в качестве нескольких первых линий склеивания периоста (Kumbar, Lad, 2017, Fig. 2C; Yilmaz et al., 2005, Fig. 2). Этим объясняется случаи кажущегося нарушения закономерности быстрого роста от 1-й до 2-й зимовки и более медленного роста – в дальнейшем.
ВЫВОДЫ
1. Сильное ограничение постметаморфозного роста остромордой лягушки из популяций с наиболее коротким сезоном активности приводит к сравнительно небольшим размерам в конце каждого сезона роста и обычно – к низким средним значениям длины тела взрослых особей, а также к слабой выраженности половых различий по размерам.
2. Несмотря на сильную антропогенную нагрузку, городские популяция г. Сургута были наиболее сходны как по средним значениям длины тела и возраста, так и по скорости ежегодных приростов и их возрастной динамике с ближайшей к ним загородной популяцией и обе этих популяции отличались сильнее от других, пространственно удаленных от них, популяций ХМАО.
3. При сравнении популяций остромордой лягушки из ряда регионов, различающихся длительностью сезона активности, только в популяциях из местообитаний с наиболее коротким сезоном активности выявлен ранее не отмеченный в литературе эффект отбора против градиента условий среды, проявляющийся в том, что сравнительно высокая скорость ежегодных приростов сохраняется вплоть до 5-й зимовки.
Финансирование. Работа выполнена при финансовой поддержке РФФИ (грант 16-04-01771) и в рамках госзадания (Ч. 2 № ЦИТИС АААА-А16-116021660031-5).
Список литературы
Байтимирова Е.A., Вершинин В.Л. Межпопуляционная изменчивость темпов роста и полового созревания самцов остромордой лягушки (Rana arvalis Nilsson, 1842) // Сибир. экол. журн. 2017. Т. 24. № 1. С. 12–20.
Берман Д.И., Булахова Н.А. Граница на заморе, или Что не пускает травяную лягушку из Европы в Азию? // Природа. 2019. № 7. С. 12–26.
Берман Д.И., Булахова Н.А., Мещерякова Е.Н. Адаптивные стратегии бурых лягушек (Amphibia, Anura, Rana) в отношении зимних температур на севере Палеарктики // Зоол. журн. 2017. Т. 96. № 11. С. 1392–1403.
Ибрагимова Д.В., Ляпков С.М. Демографические характеристики и морфометрические признаки остромордой лягушки (Rana arvalis) трансформированного местообитания (Ханты-Мансийский автономный округ – Югра) // Зоол. журн. 2018. Т. 97. № 2. С. 181–189.
Ибрагимова Д.В., Стариков В.П. Амфибии в экосистемах города Сургута: проблема оптимизации городской среды. Сургут: Изд-во ООО “Библиографика”, 2013. 166 с.
Ищенко В.Г. Популяционная экология бурых лягушек фауны России и сопредельных территорий. Дис. … докт. биол. наук. СПб: Зоол. ин-т РАН, 1999. 66 с.
Ляпков С.М. Географическая изменчивость и половые различия по длине тела и возрастному составу у остромордой лягушки: формирование и закономерности проявления // Працi Украiнського герпетологiчного товариства. 2013. № 4. С. 64–86.
Ляпков С.М., Возрастной состав и особенности постметаморфозного роста травяной лягушки (Rana temporaria) из популяций с экстремально коротким сезоном активности // “Известия высших учебных заведений. Поволжский регион. Естественные науки”. 2019. № 1. С. 96–104.
Ляпков С.М., Корнилова М.Б., Марченковская А.А., Мисюра А.Н., Гассо В.Я. Особенности возрастного состава, размерных половых различий и репродуктивных характеристик у остромордой лягушки в южной части ареала // Герпетол. исслед. в Казахстане и сопредельных странах: Алматы, 2010. С. 150–165.
Ляпков С.М., Корнилова М.Б., И.А. Сербинова, Корзун Е.В., Новицкий Р.В. Формирование направленной географической изменчивости особенностей жизненного цикла бурых лягушек // Совр. герпетология. 2009. Т. 9. № 3/4. С. 103–121.
Ляпков С.М., Черданцев В.Г., Черданцева Е.М., Половые различия темпов роста и выживаемости у остромордой лягушки (Rana arvalis) после завершения метаморфоза // Зоол. журн. 2007. Т. 86. № 4. С. 475–491.
Ляпков С.М., Черданцев В.Г., Черданцева Е.М. Географическая изменчивость как результат различия в темпах эволюции признаков с широкой и узкой нормой реакции у остромордой лягушки (Rana arvalis) // Журн. общ. биол. 2008. Т. 69. № 1. С. 25–43.
Матковский А.В., Ляпков С.М., Стариков В.П. Темпы постметаморфозного роста и возрастной состав популяций остромордой лягушки вблизи северной границы ареала по данным скелетохронологии // Совр. герпетология. 2011. Т. 11. № 3/4. С. 143–156.
Смирина Э.М. Прижизненное определение возраста и ретроспективная оценка размеров тела серой жабы (Bufo bufo) // Зоол. журн. 1983. Т. 62. № 3. С. 437–444.
Смирина Э.М., Макаров А.Н. Об установлении соответствия числа слоев в трубчатых костях у амфибий возрасту особей // Зоол. журн. 1987. Т. 66. № 4. С. 599–603.
Alekseyev S.S., Gordeeva N.V., Samusenok V.P., Matveev A.N., Andreev R.S., Yur’ev A.L., Smirina E.M. Extant and extinct forms of arctic charr Salvelinus alpinus (L.) complex from the Leprindo lake system (Transbaikalia): differentiation in life history, morphology, and genetics // J. Ichthyology. 2013. V. 53. № 10. 792–803.
Berven K.A., Gill D.E., Smith-Gill S.J. Countergradient selection in the green frog, Rana clamitans // Evolution. 1979. V. 33. № 2. P. 609–623.
Conover D., Duffy T., Hice L. The covariance between genetic and environmental influences across ecological gradients // Ann. N.Y. Acad. Sci. 2009. V. 1168. P. 100–129.
Hemelaar A.S.M. An improved method to estimate the number of year rings resorbed in phalanges of Bufo bufo (L.) and its application to populations from different latitudes and altitudes // Amphibia-Reptilia. 1985. V. 6. P. 323–341.
Hjernquist M.B., Soderman F, Jonsson K.I., Herczeg G., Laurila A., Merilä J. Seasonality determines patterns of growth and age structure over a geographic gradient in an ectothermic vertebrate // Oecologia. 2012. V. 170. № 3. P. 641–649.
Ishchenko V.G. Problems of demography and declining populations of some Euroasiatic brown frogs // Russ. J. Herp. 1996. V. 3. № 2. P. 143–151.
Ishchenko V.G. Growth of brown frogs of fauna of Russia: some problems of study of growth in amphibians // Russ. J. Herpetol. 2005. V. 12. Suppl. P. 153–157.
Kumbar S.M., Lad S.B. Determination of age and longevity of road mortal Indian common toad Duttaphrynus melanostictus by skeletochronology. // Rus. J. Herpetology. 2017. V. 24. № 3. P. 217–222.
Laugen A.T., Laurila A., Rasanen K., Merila J. Latitudinal countergradient variation in the common frog (Rana temporaria) development rates – evidence for local adaptation // J. Evol. Biol. 2003. V. 16. P. 996–1005.
Marunouchi J., Kusano T., Ueda H. Validity of back-calculation methods of body size from phalangeal bones: an assessment using data for Rana japonica // Curr. Herpetology. 2000. V. 19. P. 81–89.
Yilmaz N., Kutrup B., Çobanoǧlu Ü., Özoran Y. Age determination and some growth parameters of a Rana ridibunda population in Turkey // Acta Zool. Acad. Scient. Hungaricae. 2005. V. 51. № 1. P. 67–74.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


