Известия РАН. Серия биологическая, 2022, № 4, стр. 385-394
Анализ уротомии и регенерации у агамовых ящериц рода Mantheyus (Reptilia: Sauria: Agamidae: Draconinae) с использованием методов рентгеноскопии и компьютерной микротомографии
Н. Б. Ананьева 1, *, Д. А. Гордеев 2, 3, Тао Тьен Нгуйен 4, Н. Л. Орлов 1
1 Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб. 1, Россия
2 Волгоградский государственный университет
400062 Волгоград, просп. Университетский, 100, Россия
3 Волгоградский филиал ФГБНУ “ВНИРО”
400001 Волгоград, ул. Пугачевская 1, Россия
4 Вьетнамский национальный музей природы и институт геномных исследований,
Вьетнамская академия наук и технологий
Ханой, Вьетнам
* E-mail: nananjeva09@gmail.com
Поступила в редакцию 11.01.2022
После доработки 26.01.2022
Принята к публикации 07.02.2022
- EDN: NQMKVN
- DOI: 10.31857/S1026347022040035
Аннотация
Представлен анализ проявлений и комбинаций уротомии и регенерации в хвостовом отделе позвоночника агамовых ящериц подсемейства Draconinae (Fitzinger, 1826). В связи с особым положением в системе этого подсемейства описаны результаты анализа этих явлений у агам – мантейусов рода Mantheyus Ananjeva et Stuart, 2001. Исследованы серийные материалы, хранящиеся в различных музеях мира. Использованы методы рентгеноскопии и компьютерной микротомографии с привлечением данных по скелетной морфологии из электронного ресурса MorphoSource. Обсуждаются проявления уротомии и регенерации агамовых ящериц в филогенетическом и экологическом контекстах.
В настоящее время происходят принципиальные изменения в представлениях о происхождении и родственных связях клад чешуйчатых пресмыкающихся, методологически и методически обогащенных широким применением интегративного молекулярно-генетического и геномного подхода и беспрецедентного по разнообразию и представительству изученного материала (Gauthier et al., 2012, Pyron et al., 2013; Zheng, Wiens, 2016; Ananjeva, 2019). Полученные в результате этих исследований заключения нередко противоречат выводам, основанным на морфологических данных. Важно отметить, что внутри многих клад, очерченных ранее в “морфологических” деревьях, тем не менее, сохраняются те же паттерны филогенетических взаимоотношений. Подтверждена монофилия агамовых ящериц и отдельных эволюционных линий, рассматриваемых в системе акродонтных ящериц в статусе подсемейств: Agaminae, Amphibolurinae, Draconinae, Hydrosaurinae, Leiolepidinae, Uromastycinae (Macey et al., 2000; Ананьева, 2004; Pyron et al., 2013; Grismer et al., 2016).
Подсемейство Draconinae – наиболее обширное подсемейство по числу родов (более 30) и видов (254 из общего числа 551) агам (Uetz et al., 2022), ведущих преимущественно древесный и полудревесный образ жизни. Среди этих агам Юго-Восточной Азии есть как роды, включающие от одного до трех видов ящериц, например, Aphaniotis (Peters, 1864), Cophotis (Peters, 1861) и Salea (Gray, 1845), так и более разнообразные по видовому составу, в том числе Draco (Linnaeus, 1758), Gonocephalus (Kaup, 1825) и Diploderma (Hallowell, 1861). Для подавляющего большинства представителей Draconinae характерно развитие кожных рецепторов с волоском, отсутствие бедренных пор и различные комбинации развития механизмов автотомии и регенерации хвоста (Ананьева, 2004; Ananjeva et al., 2021).
Особое положение занимает монотипический род Manthyeus (Ananjeva et Stuart, 2001), представленный одним видом дневных агам, относимых ранее к роду ассамских агам Ptyctolaemus (Peters, 1864), который отличается от остальных представителей этой эволюционной линии уникальной комбинацией наличия бедренных пор и кожных органов чувств, снабженных волоском. Эти ящерицы встречаются в горных тропических лесах на северо-востоке Таиланда и востоке Лаоса. Молекулярно-филогенетический анализ собственно драконин подтвердил гипотезу Мэйси с соавт. (Macey et al., 2000) об эволюционных линиях внутри акродонтных чешуйчатых рептилий, а также особое положение клады Manthyeus (рис. 1), которая с высокой достоверностью представляет собой сестринскую группу по отношению ко всем остальным представителям подсемейства (Schulte et al., 2004; Pyron et al., 2013; Grismer et al., 2016).
Рис. 1.
Положение рода Mantheyus на филогенетическом древе агамовых ящериц Южной и Юго-Восточной Азии подсемейства Draconinae на основе молекулярно-генетического анализа (из Grismer et al., 2016, с изменениями).
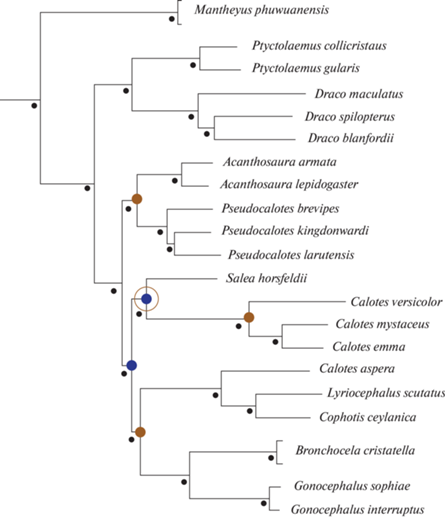
В связи с особым положением в системе агамовых ящериц специальной целью настоящего исследования стал анализ уротомии и морфологии регенератов хвоста агамовых ящериц рода Mantheyus (Ananjeva et Stuart, 2001) с использованием методов рентгеноскопии и компьютерной микротомографии на основе собственного исследования и с привлечением данных по скелетной морфологии из электронного ресурса MorphoSource.
МАТЕРИАЛЫ И МЕТОДЫ
Для данного исследования использовали экземпляры агамовых ящериц рода Mantheyus Ananjeva and Stuart, 2001, хранящиеся в пяти музеях мира (табл. 1). 3D реконструкция скелета Mantheyus phuwuanensis, полученная на основе компьютерной томографии, любезно предоставлена Дэвидом Блэкберном и хранится в репозитории MorphoSource (https://www.morphosource.org/ concern/media/000039730?locale=en). Визуализацию, анализ и перевод 3D изображения в 2D осуществляли в программе Blender 2.93.
Таблица 1.
Объем анализируемого коллекционного материала
| № п/п | Коллекции | Сокращенное название (акроним) музея | Инвентарные номера | Число экземпляров в серии |
|---|---|---|---|---|
| 1. | Музей естественной истории
(Берлин, ФРГ) The Natural History Museum (Museum für Naturkunde) |
ZMB | 49 040 (голотип); 49 041 (паратип); 59 043; 59 044; 59 045; 59 817; 59 818; 59 819; 59 820; 64 455; 64 456; 64 457; 64 458; 83 451 | 14 |
| 2. | Филдовский музей естественной истории (Чикаго, США) Field Museum of Natural History |
FMNH | 255493; 255494; 255495 | 3 |
| 3. | Музей зоологии Университета Киото (Киото, Япония) The Kyoto University Museum |
KUZR | 40 220; 40 221; 40 222; 40 223; 40 224; 40 225; 40 226; 40 227; 40 228; 40 229; 40 353; 40 355; 40 356; 40 365; 40 366; 40 367; 40 424; 40 425 | 18 |
| 4. | Зоологический институт РАН, (Санкт-Петербург, РФ) | ZISP | 30 558; 30 559; 30 560; 30 629 | 4 |
| 5. | Музей естественной истории Северной Каролины (Роли, США) North Carolina Museum of Natural Sciences |
NCSM | 77 720 | 1 |
| ∑ | 40 | |||
Полученные нами ранее (Ananjeva et al., 2021) серии снимков доступны в MorphoSource (https:// www.morphosource.org/concern/media/000376011?locale=en).
При морфологическом исследовании коллекционных экземпляров использованы стандартные промеры: длина тела от кончика морды до анального отверстия (SVL) и длина хвоста (Lcd). Проведены промеры интактных хвостов, а в случаях проявлений специализированной псевдоатотомии и регенерации – отдельные измерения нерегенерированных участков и регенератов: Lcd-nonreg. + Lcd-reg с использованием электронного штангенциркуля с точностью до 0.1. мм.
Рентгенографические исследования и фотосъемку проводили на оборудовании Зоологического института РАН.
Сокращенные названия (акронимы) музеев и институтов, где хранятся коллекционные материалы: Музей естественной истории, The Natural History Museum (Museum für Naturkunde) (ZMB); Вьетнамский национальный музей природы, National Museum of Nature, Vietnam Academy of Science and Technology, Hanoi (NMN), Зоологическая коллекция музея университета Киото, Zoological Collection, The Kyoto University Museum (KUZR); Филдовский музей естественной истории, Field Museum of Natural History (FMNH); Зоологический институт РАН, Санкт-Петербург (ZISP). Музей естественной истории Северной Каролины (Роли, США), North Carolina Museum of Natural Sciences (NCSM).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Каудальная автотомия характерна для большинства семейств чешуйчатых рептилий (Arnold, 1984, 1988; Savage, Slowinski, 1996; Bowen, 2004; Costa et al., 2014; Crnobrija-Isalović et al., 2016). Она более обычна в форме интравертебральной автотомии, когда разрыв происходит через тело позвонка. Такой вариант автотомии характерен для отряда Rhynchocephalia, а также семейств Scincidae, Cordylidae, Teiidae, Xantusiidae, Anguidae, Lacertidae, некоторых Iguanidae и большинства Gekkota. Реже встречается интервертебральная (межпозвонковая) автотомия, при которой разрыв хвоста происходит между соседними позвонками. Она достоверно отмечена у ящериц семейства Agamidae, а также у некоторых змей, в основном, семейств Colubridae и Lamprophiidae. У змей автотомия не сопровождается последующей регенерацией. В образовании регенерата после утраты исходной части хвоста важную роль играет иннервация. Экспериментально установлено (Bellairs, Bryant, 1985), что запуск регенерационных процессов или образование дополнительной ветви хвоста (в случае бифуркации) происходит при нарушении эпендимы, тогда как другие повреждения не вызывают подобного эффекта. Эти наблюдения подтверждают успешные опыты по стимуляции регенерационного процесса конечности Lacerta agilis (отсутствует в норме) методом дополнительной иннервации (Кудокоцев, 1962).
Согласно предложенной Сэвиджем и Словинским терминологии (Savage, Slowinski, 1996; Costa et al., 2014), различаются уротомия (любой тип, как интер-, так и интравертебральный), собственно автотомия, к которой авторы относят только интравертебральный тип разлома с последующей регенерацией утраченной части, а также псевдоавтотомия (межпозвонковый неспонтанный тип разломов хвоста без регенерации). В классификации агамовые ящерицы не отнесены ни к одной из выше названных категорий, они заняли неопределенное положение “промежуточного состояния” (“intermediate condition” – Savage, Slowinski, 1996). В данной работе мы будем следовать указанной терминологии с небольшими изменениями. Под специализированной псевдоавтотомией, свойственной многим агамам (Laudakia Gray, 1845, Paralaudakia Baig, Wagner, Ananjeva, Böhme, 2012 и др.), мы будем понимать неспонтанный способ отбрасывания хвоста, отмеченный с высокой частотой в природных популяциях, за которой может следовать регенерация нового придатка. Под неспециализированной псевдоавтотомией мы будем понимать потерю хвоста механическим способом. Тем не менее, накопление сведений о способах потери хвоста, особенностях морфологии интактных хвостов и регенератов, вариации способности к образованию регенерата приводит к необходимости пересмотра имеющейся терминологии.
Ранее проведенный нами анализ частот автотомии агамовых ящериц различных подсемейств по собственным и литературным данным показал значительно более слабую изученность этого явления в подсемействе драконин, тогда как для представителей номинативного подсемейства различные аспекты автономии и регенерации достаточно хорошо отражены в публикациях (Gordeev et al., 2020; Ananjeva et al., 2021). Арнольд (Arnold, 1984) указывает автотомию лишь у Psammophilus dorsalis, Otocryptis wiegmanni и Sitana ponnticeriana. Дальнейшие исследования показали, что наряду с ящерицами подсемейства Agaminae виды с различными вариантами псевоавтотомии и образования регенерата также относятся и к драконинам. Среди исследованных коллекционных материалов драконин лишь у нескольких видов были отмечены достоверные случаи проявлений комбинации псевдоавтотомии и последующей регенерации: Bronchocela cristatella, Coryphophylax subcristatus и Mantheyus phuwuanensis (Ananjeva et al., 2021). Другие виды либо не формируют регенеративные отростки на месте разломов (Calotes calotes, C. versicolor, Otocryptis wiegmanni, Psammophilus, Sitana), либо вообще лишены способности к автотомии. В работе крупного австрийского морфолога Фридриха Зибенрока (Siebenrock, 1895) о строении скелета агамовых ящериц в таблице, представляющей данные о количестве позвонков хвостового отдела, отмечены случаи регенерации и у драконин, в том числе у Gonocephalus subcristatus, Calotes calotes, C. mystaceus и Charasia blanfordiana, хотя термин автотомия вообще в работе не используется. Есть основания предполагать, что в данном случае был использован универсальный на том этапе развития морфологии термин “регенерация” для обоих явлений – автотомии и регенерации. В более поздних публикациях по систематике рода Calotes (Zug et al., 2006; Wagner et al., 2021) авторы не используют термин “псевдоавтотомия”, а называют регенерацией механический разрыв хвоста между позвонками, за которым со временем следует заживление раневой поверхности. Согласно результатам нашего анализа коллекционных материалов, такой тип псевдоавтотомии без образования регенеративных отростков часто встречается у калотов (Ananjeva et al., 2021, Table 2). Так, из 59 исследованных экземпляров у 57 были зарегистрированы поврежденные хвосты: у некоторых кончик хвоста отсутствовал, был виден оголенный позвонок; у других наблюдалось заживление раны, но без образования регенерата.
Таблица 2.
Размерные параметры изученных экземпляров Mantheyus phuwuanensis
| Инвентарный номер экземпляра | Пол | Размерные параметры (SVL/Lcd: Lcd-nonreg.+Lcd-reg.) |
Присутствие/отсутствие автотомии и регенерации; тип регенератов |
|---|---|---|---|
| ZMB 49040 | Самец Голотип |
86.0/182 | Интактный хвост |
| ZMB 49041 | Самка Паратип |
84.2/163.3 | Интактный хвост |
| ZMB 59043 | Новорожденный из разведения | 37.8/71.4 | Интактный хвост |
| ZMB 59044 | Новорожденный из разведения | 35.4/65.3 | Интактный хвост |
| ZMB 59045 | Новорожденный из разведения | 41.3/77.8 | Интактный хвост? |
| ZMB 59817 | Новорожденный из разведения | 37.1/71.5 | Интактный хвост |
| ZMB 59818 | Новорожденный из разведения | 38.4/77.8 | Интактный хвост |
| ZMB 59819 | Новорожденный из разведения | 38.9/72.2 | Интактный хвост |
| ZMB 59820 | Новорожденный из разведения | 32.7/67.8 | Интактный хвост |
| ZMB 64455 | Cамец | 90.8/64.5 | Регенерация в начальной стадии |
| ZMB 64456 | Новорожденный из разведения | 40.1/34.3 | Псевдоавтотомия без регенерации |
| ZMB 64457 | Новорожденный из разведения | 31.4/64.7 | Интактный хвост |
| ZMB 64458 | Новорожденный из разведения | 33.1/15.61 | Псевдоавтотомия без регенерации |
| ZMB 83451 | Cамец | 88.4/17.8 | Псевдоавтотомия без регенерации |
| FMNH 255493 | Cамка | 76.4/21.6 + 22.2 | Регенерат конический, палочковидный |
| FMNH 255494 | Cамец | 88.3/44.2 + 85.3 | Регенерат конический, палочковидный |
| FMNH 255495 | Cамец | 66.9/25.8 | Псевдоавтотомия без регенерации |
| KUZR 40220 | Ювенильный экземпляр | 33.7/68.5 | Интактный хвост |
| KUZR 40221 | Самец | 89.2/96.3 + 70.0 | Регенерат конический, палочковидный |
| KUZR 40222 | Самка | 79.8/156.7 | Псевдоавтотомия без регенерации, кончик обломан |
| KUZR 40223 | Самка | 81.9/38.5 | Псевдоавтотомия без регенерации |
| KUZR 40224 | Ювенильный экземпляр | 41.7/83.9 | Интактный хвост |
| KUZR 40225 | Ювенильный экземпляр | 45.3/34.4 | Псевдоавтотомия без регенерации |
| KUZR 40226 | Самец | 84.8/156.1 | Интактный хвост |
| KUZR 40227 | Самка | 77.3/89.0 + 71.3 | Регенерат конический, палочковидный |
| KUZR 40228 | Ювенильный экземпляр | 47.6/36.4 | Псевдоавтотомия без регенерации |
| KUZR 40229 | Ювенильный экземпляр | 47.3/38. 3 | Псевдоавтотомия без регенерации |
| KUZR 40353 | Самка | 80.6/38.6 + 123.8 | Регенерат конический, палочковидный |
| KUZR 40355 | Самка | 99.6/97.4 | Псевдоавтотомия без регенерации |
| KUZR 40356 | Самка | 90.4/82.2 + 82.1 | Регенерат конический, палочковидный |
| KUZR 40365 | Самец | 85.6/92.8 + 37.2 | Регенерат конический, палочковидный |
| KUZR 40366 | Самка | 81.0/63.2 | Псевдоавтотомия без регенерации |
| KUZR 40367 | Самка | 88.2/180.2 | Интактный хвост |
| KUZR 40424 | Самка | 82.4/148.3 | Псевдоавтотомия без регенерации, кончик хвоста отсутствует |
| KUZR 40425 | Самка | 75.8/44.8 + 24.3 | Псевдоавтотомия без регенерации, хвост обломан, видимо, дважды, сохранился один обломанный участок (24.3) |
| ZISP 30558 | Самка | 81.6/61.4 | Псевдоавтотомия без регенерации |
| ZISP 30559 | Самец | 91.6/66.1 + 52.4 | Регенерат конический, палочковидный |
| ZISP 30560 | Самец? | 90.3/116.0 + 38.0 | Регенерат конический, палочковидный |
| ZISP 30629 | Самка | 50.2/25.8 + 22.6 | Регенерат конический, палочковидный |
По нашим предварительным данным, комбинация псевдоавтотомии и образования регенеративных отростков среди изученных в этом отношении драконид более часто проявляются у Mantheyus phuwuanensis. Изучение более широкого набора доступных материалов по Mantheyus phuwuanensis подтверждает этот вывод и демонстрирует следующие результаты (табл. 1–3).
Таблица 3.
Частота каудальной псевдоавтотомии и регенерации у агам рода Mantheyus
| Коллекции | Число особей в серии, n (%) | Особей в серии с неповрежденными хвостами, n (%) | Псевдовтотомия без регенерации, n (%) | Псевдовтотомия с последующей регенерацией | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| в дистальной половине хвоста, n (%) | в проксимальной половине хвоста, n (%) | ||||||||||||||
| самцы | самки | juv. | самцы | самки | juv. | самцы | самки | juv. | самцы | самки | juv. | самцы | самки | juv. | |
| ZMB (14) | 2 (14.29) |
1 (7.14) |
11 (78.57) |
1 (7.14) |
1 (7.14) |
8 (57.14) |
1 (100.00) |
0 (0.00) |
2 (66.67) |
0 (0.00) |
0 (0.00) |
1 (7.14) |
1 (7.14) |
0 (0.00) |
2 (14.29) |
| FMNH (3) | 2 (66.67) |
1 (33.33) |
0 (0.00) |
0 (0.00) |
0 (0.00) |
0 (0.00) |
1 (50.00) |
0 (0.00) |
0 (0.00) |
1 (33.33) |
0 (0.00) |
0 (0.00) |
1 (33.33) |
1 (33.33) |
0 (0.00) |
| KUZR (18) | 3 (16.67) |
10 (55.56) |
5 (27.77) |
1 (5.56) |
1 (5.56) |
2 (11.11) |
0 (0.00) |
6 (66.67) |
3 (100.00) |
2 (11.11) |
5 (27.78) |
1 (5.55) |
0 (0.00) |
4 (22.22) |
2 (11.11) |
| ZISP (4) | 1 (25.00) |
3 (75.00) |
0 (0.00) |
0 (0.00) |
0 (0.00) |
0 (0.00) |
1 (100.00) |
0 (0.00) |
0 (0.00) |
0 (0.00) |
1 (25.00) |
0 (0.00) |
1 (25.00) |
2 (50.00) |
0 (0.00) |
| ∑ (39) | 8 (20.51) |
15 (38.46) |
16 (41.03) |
2 (5.13) |
2 (5.13) |
10 (25.64) |
3 (50.00) |
6 (46.15) |
5 (83.33) |
3 (7.69) |
6 (15.38) |
2 (5.13) |
3 (7.69) |
7 (17.95) |
4 (10.26) |
Из 39 экземпляров 14 (35.90%) имели неповрежденные хвосты, а 25 (64.10%) – псевдоавтотомию в дистальной (15.38% самки, 7.69% самцы, 5.13% неполовозрелые) и проксимальной (17.95% самки, 7.69% самцы, 10.26% неполовозрелые) половине хвоста. В проанализированном музейном материале выявлен лишь один из шести известных типов регенератов (Gordeev et al., 2020) – конусовидный. Он отмечен у всех особей в выборке, имеющих регенерат, что составляет 64.10% от общего числа экземпляров. Его длина может превышать длину тела и достигать 123.8 мм (табл. 2).
Анализ изображения, полученного с помощью КТ (рис. 2) и рентгеновских снимков (рис. 3) показывает, что хвостовые позвонки имеют типичное для ящериц, способных к псевдоавтотомии строение: узкие postzygapophysis, отсутствие на neurapophysis гребня и вертикально ориентированного отростка, сужение тела позвонка в его середине. Проксимальные хвостовые позвонки (в количестве 7–8) несут поперечные отростки, размеры которых уменьшаются в каудальном направлении. У изученных нами M. phuwuanensis псевдоавтотомия между ними не проходила. Наиболее проксимальный случай псевдоавтотомии произошел между 12 и 13 позвонками (KUZR 40225). У экземпляра KUZR 40226 наблюдается поломка хвоста между 10 и 11 позвонками, но поскольку хвост не был отброшен, у нас нет полной уверенности в том, что это произошло прижизненно. Тем не менее, данный случай согласуется с общей картиной: вероятно, проксимальные 7–8 хвостовых позвонков, несущих поперечные отростки, являются пигальными (неавтотомными) и поломка хвоста между ними не происходит.
Рис. 2.
Компьютерная томография Mantheyus phuwuanensis из герпетологической коллекции Музея естественных наук Северной Каролины (ncsm:herp:77720), полученная из репозитория MorphoSource (https://www.morphosource.org/concern/parent/000S10062/media/000039730). (а) – общий вид образца во фронтальной плоскости; (б) – общий вид образца в сагиттальной плоскости; (в) – увеличенный фрагмент дистальной части хвоста с регенератом в сагиттальной плоскости; (г) – увеличенный фрагмент дистальной части хвоста во фронтальной плоскости. 1 – хрящевая трубка развивающегося регенерата; 2 – дистальный (28-й) хвостовой позвонок, предшествующий месту разрыва и частично подвергшийся аблации; 3 – второй крестцовый позвонок; 4 – первые восемь хвостовых позвонков с поперечными отростками.
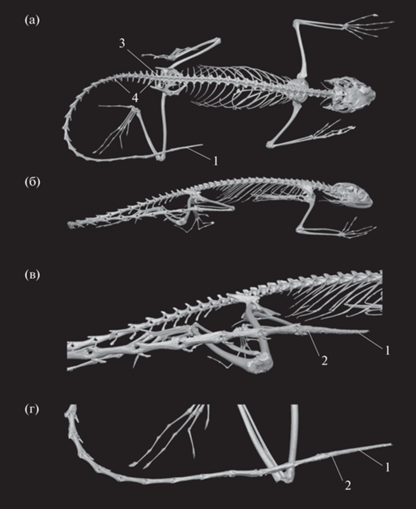
Рис. 3.
Mantheyus phuwuanensis (Tad Xay, Phou Khao Khad Nat. Prot. Area Rao PDR, 2016 Orlov N.L., Iohansen L.K.) с отброшенным и регенерированным хвостом (ZISP 30629 – верхний ряд; ZISP 3559 – нижний ряд). (а) – фотография экземпляра с вентральной стороны; (б) – фотография экземпляра с дорсальной стороны; (в) – полное рентгеновское изображение экземпляра; (г) – рентгеновское изображение дистальной части хвоста с регенератом; (д) – фотография экземпляра с вентральной стороны; (е) – фотография экземпляра с дорсальной стороны; (ж) – полное рентгеновское изображение экземпляра; (з) – рентгеновское изображение дистальной части хвоста с регенератом. 1 – интактная часть хвоста; 2 конусовидный регенерат, развившийся после специализированной псевдоавтотомии; 3 – хвостовой позвонок с поперечными отростками; 4 – частично аблитерированный дистальный позвонок, предшествующей месту специализированной псевдоавтотомии; 5 – развивающаяся хрящевая трубка.
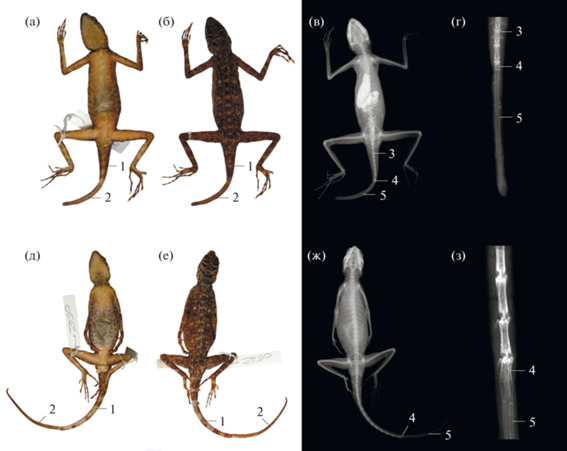
После того, как хвост был отброшен, из образовавшейся раны виден позвонок, предшествующий месту псевдоавтотомии, что характерно для многих ящериц с таким типом самоампутации. Далее происходит частичная аблация ставшего дистальным позвонка, которая, видимо, способствует заживлению раны. Частично аблитерированный позвонок хорошо заметен на рентгеновских снимках и КТ-изображениях (обозначен цифрой 2 на рис. 2 и 4 – на рис. 3), а образующаяся хрящевая трубка кальцифицируется (рис. 3г, 3з).
Преобладание в анализируемом материале экземпляров с поврежденными хвостами не согласуется с полученными ранее данными по частотам уротомии у ящериц (Bowen, 2004; Bateman, Fleming, 2009; Arribas, 2014; Pafilis et al., 2017; Gordeev et al., 2020) и может быть объяснено рядом причин. Во-первых, преобладанием в природных популяциях особей с отброшенными хвостами, например, вследствие пресса хищников. В нашу выборку входит большое количество (табл. 1, ZMB) новорожденных экземпляров из разведения в неволе, у которых факты псевдоавтотомии наблюдались реже, чем у взрослых, что косвенно может объясняться отсутствием пресса хищников. Во-вторых, снижением скорости перемещения особей с отломанными хвостами по сравнению с неповрежденными, в связи с чем, исследователю их легче поймать и таким образом пополнить выборку. В-третьих, ошибкой репрезентативности. Наиболее вероятными причинами нам представляются последние две, поскольку преобладание особей с отброшенными хвостами биологически невыгодно из-за высокой вероятности инфицирования, снижения локомоторной активности и скорости перемещения, снижения репродуктивных возможностей. Последнее происходит за счет уменьшения самками размера кладки, что, видимо, характерно для ящериц, не обладающих значительными запасами абдоминального жира (Chappel, Swain, 2002) или изменения массы яиц (Dial, Fitzpatrick, 1981; Beatty et al., 2021); при столкновении самцов в брачный период, использующие хвост как оружие, а также для видов, у которых хвост является символом статуса (Bellaris, Bryant 1985). Тем не менее, данный факт может свидетельствовать об относительной легкости, с которой псевдоавтотомия и формирование регенеративных отростков на месте разлома происходит у M. phuwuanensis, что является интересным в виду слабой изученности рассматриваемого явления у Draconinae. Известно (Werner, 1968; Jaksic, Fuentes, 1980; Arnold, 1984; 1988), что среди многих групп ящериц (гекконы, игуаниды) уротомия чаще наблюдается у представителей того эко-морфологического типа ящериц, которые живут на скальных поверхностях, чем у обитателей наземных биотопов. Среди исследованных в этом отношении агамовых ящериц также наиболее высок процент специализированной псевдоавтотомии и формирования различных типов регенератов у горных агам родов Paralaudakia и Stellagama (Arnold, 1984; Gordeev et al., 2020), специализированных петрофилов. Вероятно, такая эко-морфологическая корреляция может быть одной из причин частого проявления псевдоавтотомии у ящериц самостоятельной эволюционной линии подсемейства преимущественно древесных ящериц (рис. 1), в которую входит монотипический род Mantheyus. Эти ящерицы, как по литературным данным, так и по нашим наблюдениям практически всегда встречаются на поверхности скал, на валунах у подножия плоскогорий из песчаника, на уступах скал вдоль реки, на крупных скоплениях камней на лесных полянах, и в небольших пещерах, образованных большой грудой валунов у берега реки (Manthey, Nabhitabhata, 1991; Ananjeva, Stuart, 2001; Manthey, Manthey, 2005).
Изложенные факты подтверждают необходимость дальнейшего изучения явлений псевдоавтотомии и регенерации в различных эволюционных линиях агам и уточнения терминологии.
* *
Для изученных агам рода Mantheyus специализированная псевдоавтотомия с последующей регенерацией может считаться обычным явлением, однако, пропорции особей с регенерирующими и интактными хвостами различны в исследованных нами выборках. Отбрасывание хвоста происходит, как правило, в дистальной половине, что компенсирует затраты на последующую регенерацию, а также позволяет избежать нежелательного снижения двигательной активности и способности к репродукции. Внешне регенерат существенно отличается от интактного хвоста, имеет различную длину и относится лишь к одному типу – конусовидному.
Благодарности. Авторы выражают глубокую признательность Марку-Оливье Ределю (Mark-Oliver Rödel) и Франку Тиллаку (Frank Tillack) – ZMB; Брайану Стюарту (Bryan Stuart) – NCSM); Алану Разетару (Alan Rasetar) и Джошуа Матту (Joshua Mata) – FMNH; Хидетоши Ота (Hidetoshi Ota) – Institute of Natural and Environmental Sciences, Museum of Nature and Human Activities, University of Hyogo, Sanda, Japan; Цутому Хикида (Tsutomu Hikida) – KUZR и Давиду Блэкборну (David Blackburn) – Florida Museum of Natural History, University of Florida за доступ к коллекциям музеев, предоставление данных по экземплярам M. phuwuanensis, и помощь в работе над материалами статьи. Благодарим В.Г. Сиделеву и З.А. Жидкова (ЗИН РАН), Хидетоши Ота (Hidetoshi Ota) и Цутому Хикида (Tsutomu Hikida) за возможность провести рентгенографические исследования. Мы искренне благодарны Г.А. Ладе и Г.О. Черепанову за их вклад в работу с текстом рукописи.
Финансирование. Работа выполнена при поддержке гранта Министерства науки и высшего образования Российской Федерации (075-15-2021-1069) в рамках Гостемы (122031100282-2).
Список литературы
Ананьева Н.Б. Филогения и биогеография агамовых ящериц (Agamidae, Lacertilia, Reptilia): обзор концепций и результатов молекулярных и морфологических исследований // Успехи соврем. биологии. 2004. Т. 124. № 1. С. 44–46.
Кудокоцев В.П. Стимуляция регенерационного процесса конечности ящериц методом дополнительной иннервации // Докл. Акад. наук СССР. 1962. Т. 142. № 1. С. 233–236.
Ananjeva N.B. Current State of the Problems in the phylogeny of Squamate Reptiles (Squamata, Reptilia) // Biology Bulletin. 2019. V. 9. № 2. P. 119–128. https://doi.org/10.1134/S2079086419020026
Ananjeva N.B., Gordeev D.A., Korost D.V. The Review of the Autotomy of Agamid Lizards with Considerations about the Types of Autotomy and Regeneration // J. Dev. Biol. 2021, V. 9(3). 32 p. https://doi.org/10.3390/jdb9030032
Ananjeva N.B., Stuart B. The agamid lizard Ptyctolaemus phuwuanensis Manthey et Nabhitabhata, 1991 from Thailand and Laos represents a new genus // Russ. J. Herpetology. 2001. V. 8. № 3. P. 165–170.
Arnold E.N. Evolutionary aspects of tail autotomy in lizards and their relatives // Nat. Hist. 1984. V. 18. P. 127–169.
Arnold E.N. Caudal autotomy as a defense // Biology of the Reptilia. V. 16. Ecology B / Eds Gans C., Huey R. N.Y.: Alan R. Liss, inc., 1988. P. 235–273.
Arribas O.J. Autotomía caudal en las lagartijas de alta montaña de los Pirineos (Iberolacerta Arribas, 1997) // Butll. Soc. Catalana d’Herpetologia. 2014. V. 21. P. 115–126.
Bateman P.W., Fleming P.A. To cut a long tail short: a review of lizard caudal autotomy studies carried out over the last 20 years // J. Zool. 2009. V. 277. P. 1–14.
Beatty A.E., Mote D.M., Schwartz T.S. Tails of reproduction: Regeneration leads to increased reproductive investment // J. Experimental Zoology Part A: Ecological and Integrative Physiology. 2021. V. 335. № 5. P. 522–528. https://doi.org/10.1002/jez.2472
Bellairs A.d’A., Bryant S.V. Autotomy and regeneration in reptiles. Biology of the reptilia. V. 15. Development B. / Eds Gans C., Billett F. N.Y.: Wiley and Sons, 1985. P. 303–410.
Bowen K.D. Frequency of Tail Breakage of the Northern Watersnake, Nerodia sipedon sipedon // The Canad. Field Naturalist. 2004. V. 118. № 3. P. 435–437.
Chapple D.G., Swain R. Distribution of energy reserves in a viviparous skink: Does tail autotomy involve the loss of lipid stores? // Austral Ecology, 2002. V. 27. № 5. P. 565–572. https://doi.org/10.1046/j.1442-9993.2002.01217.x
Costa H.C., Moura M.R., Feio R.N. A tale of lost tails: pseudoautotomy in the Neotropical snake genus Drymoluber (Serpentes: Colubridae) // Can. J. Zool. 2014. V. 92. P. 811–816.
Crnobrnja-Isalović J., Corović J., Halpern B. Deliberate tail loss in Dolichophis caspius and Natrix tessellata (Serpentes: Colubridae) with a brief review of pseudoautotomy in contemporary snake families // North-Western J. Zoology. 2016. V. 12(2). P. 367–372.
Dial B., Fitzpatrick L. The Energetic Costs of Tail Autotomy to Reproduction in the Lizard Coleonyx-Brevis (sauria, Gekkonidae) // Oecologia. 1981. V. 51. № 3. P. 310–317. https://doi.org/10.1007/BF00540899
Gauthier J.A., Kearney M. Maisano J.A., Rieppel O., Behlke A.B.K. Assembling the squamate tree of life: perspectives from the phenotype and the fossil record // Bull. Peabody Mus. Nat. Hist. 2012. V. 53. № 1. P. 3–308.
Gordeev D.A., Ananjeva N.B., Korost D.V. Autotomy and Regeneration in Squamate Reptiles (Squamata, Reptilia): Defensive Behavior Strategies and Morphological Characteristics (Using Computer Microtomography Methods) // Biology Bulletin. 2020. V. 47. № 4. P. 389–398. https://doi.org/10.1134/S1062359020040068
Grismer J.L., Schulte II, J.A., Alexander A., Wagner Ph., Travers S.L., Buehler M.D., Welton L.J., Brown R.M. The Eurasian invasion: phylogenomic data reveal multiple Southeast Asian origins for Indian Dragon Lizards // BMC Evolutionary Biology. 2016. V. 16(43). 11 p. https://doi.org/10.1186/s12862-016-0611-6
Jaksic F.M., Fuentes E.R. Correlates of tail loss in twelve species of Liolaemus lizards // J. Herpetology. 1980. V. 14. P. 137–141.
Macey J.R., Schulte J.A., Larson A., Ananjeva N.B., Wang Y., Pethiyagoda R., Rastegar-Pouyani N., Papenfuss T.J. Evaluating trans-tethys migration: an example using acrodont lizard phylogenetics // Syst. Biol. 2000. V. 49. P. 233–256.
Manthey S., Manthey U. Mantheyus phuwuanensis (Manthey& Nabhitabhata, 1991) – vom Fang bis zur Nachzucht in Terrarium // Reptilies. Münster. 2005. Bd. 10. № 1. S. 26–31.
Manthey U., Nabhitabhata J. Eine neue Agame, Ptyctolaemus phuwuanensis sp.n. (Sauria: Agamidae), aus Nordost-Thailand // Sauria. 1991. Bd. 13. № 4. S. 3–6.
Pafilis P., Sagonas K., Kapsalas G., Foufopoulos J., Valakos E. Sex does not affect tail autotomy in lacertid lizards // Acta Herpetol. 2017. V. 12(1). P. 19–27.
Pyron R.A., Burbrink F.T., Wiens J.J. A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes // BMC Evol. Biology. 2013. V. 13. № 93. P. 1–53.
Savage J.M., Slowinski J.B. Evolution of coloration, urotomy and coral snake mimicry in the snake genus Scaphiodontophis (Serpentes: Colubridae) // Biol. J. Linnean Society. 1996. V. 57. P. 129–194.
Schulte II, J.A., Vindum J.V., Win H., Thin T., Lwin K.S., Shein A.K. Phylogenetic relationships of the genus Ptyctolaemus (Squamata: Agamidae), with a description of a new species from Chin Hills of Western Myanmar // Proc. Cal. Acad. Sci. 2004. V. 55. № 12. P. 222–247.
Siebenrock F. Das Skelet der Agamidae // Sitzungsberichte der Mathematisch-Naturwissenschaftlichen Classe der Kaiserlichen Akademie der Wissenschaften. 1895. V. 104. P. 1089–1196.
Uetz P., Freed P., Aguilar R., Hošek. J. (eds.) (2021) The Reptile Database, http://www.reptile-database.org/ (accessed on 11 January 2022).
Wagner P., Ihlow F., Hartmann T., Flecks M., Schmitz A., Böhme W. Integrative approach to resolve the Calotes mystaceus Duméril & Bibron, 1837 species complex (Squamata: Agamidae) // Bonn zoological Bulletin. 2021. V. 70. № 1. P. 141–171.
Werner Ye.L. Regeneration frequencies in geckoes of two ecological types (Reptilia: Gekkonidae) // Vie et Milieu (C). 1968. V. 19. P. 199–222.
Zheng Y., Wiens J.J. Combining phylogenomic and supermatrix approaches, and a time-calibrated phylogeny for squamate reptiles (lizards and snakes) based on 52 genes and 4162 species // Mol. Phylogenetics Evol. 2016. V. 94. 537–547.
Zug G.R., Brown H.H.K., Schulte II, J.A., Vindum J.V. Systematics of the garden lizards, Calotes versicolor group (Reptilia, Squamata, Agamidae), in myanmar: central dry zone populations // Proc. Cal. Acad. Sci. 2006. V. 57. № 2. P. 35–68.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


