Известия РАН. Серия биологическая, 2022, № 4, стр. 395-400
Влияние копрофагии на продвижение корма по пищеварительному тракту даурской пищухи (Ochotona dauurica, Lagomorpha, Ochotonidae)
Е. И. Наумова 1, *, Г. К. Жарова 1, Т. Ю. Чистова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: einaumova@gmail.com
Поступила в редакцию 25.01.2022
После доработки 06.02.2022
Принята к публикации 06.02.2022
- EDN: FAHIAP
- DOI: 10.31857/S1026347022040102
Аннотация
Рассмотрено продвижение клетчаткового корма в пищеварительном тракте даурской пищухи Ochotona dauurica путем многократного мечения инертными пластиковыми маркерами. Среднее время задержки корма в пищеварительном тракте, против ожидания, оказалось недолгим – менее 6 ч (как и у мелких полевок с вдвое меньшей массой тела). Отмечены возвраты маркеров в желудок, что может быть следствием копрофагии, а также задержка маркеров в сепараторной системе слепая-ободочная кишки. Остаточный вывод маркеров из пищеварительного тракта растянут до 23 ч из-за повторного попадания маркеров в пищеварительный тракт.
Кинетика пищевых масс в пищеварительном тракте животных-фитофагов служит важным ключом к пониманию специфики сложного пищеварения с участием микробиоты. Результаты, полученные путем однократного мечения корма, не всегда поддаются однозначной интерпретации из-за неравномерности продвижения корма по пищеварительному каналу мелких млекопитающих-фитофагов. У грызунов и зайцеобразных в пищеварительном тракте развиты слепые выросты (преджелудок и слепая кишка), где пища может застаиваться на неопределенное время. Кроме того, у этих млекопитающих в толстом отделе кишечника сформирован сепараторный механизм (Björnhag, 1972; Björnhag, Snipes, 1999), благодаря которому мелкоструктурная часть содержимого может возвращаться из ободочной кишки назад в слепую, нарушая поступательное продвижение корма. Аналогичное действие оказывает также копрофагия, ритмическая, или нерегулярная, благодаря которой некоторая доза маркированного корма вторично попадает в желудок, завышая время задержки в нем маркера.
У большинства грызунов копрофагия носит нерегулярный, спорадический характер, ее интенсивность существенно зависит от качества корма (Cranford, Johnson, 1989), а поедаемые и не поедаемые экскременты не имеют таких явных различий, как например у зайцеобразных. Учитывая возможную задержку корма в преджелудке и слепой кишке, а также работу сепараторного механизма, понятно, что результаты экспериментов, основанные на мониторинге выведения меченого корма, не позволяют оценить динамику движения корма внутри пищеварительного тракта.
На основе результатов недавних исследований копрофагия, распространенная у мелких млекопитающих, представляется важным эволюционным фактором адаптации мелких млекопитающих к бедным кормам. Ритмика копрофагии среди зайцеобразных детально исследована у домашнего кролика (Taylor, 1939; Thacker, Brandt, 1955), и ряда видов диких Leporidae (Пшенников и др., 1988; Hirakawa, 2001). Что касается пищух Ochotonidae, известны лишь несколько публикаций, содержащих данные о копрофагии у Ochotona hyperborea (Haga, 1960; Пшенников и др., 1990), O. rufescens (Matsuzawa et al., 1981), O. curzoniae (Fu, Li, 2022). Примененное нами многократное мечение твердой фракции корма цветными пластиковыми фрагментами позволяет визуализировать движение корма внутри пищеварительного тракта (Наумова и др., 2007; Жарова и др., 2010;). Как специализированные копрофаги, пищухи представляют особый интерес в исследовании этого вопроса.
МАТЕРИАЛЫ И МЕТОДЫ
В эксперименте были использованы 6 взрослых, не размножающихся особей даурских пищух (Ochotona dauurica, Lagomorpha, Ochotonidae) обоих полов (4 самки и 2 самца), добытых в Забайкальском крае; средняя масса тела зверьков составила 114 г. Зверьков содержали индивидуально в стандартных клетках (размер 40 × 30 × 25 см).
В качестве инертного маркера волокнистой фракции корма использовали кусочки тонкой пластиковой пленки разного цвета (в данных опытах – красного, синего, желтого), которые резали на мелкие фрагменты длиной не более 1.5 мм. Небольшую дозу стружек (массой менее 0.001 г), полученных таким образом из кусочка тонкого пластика площадью 1 см2, смешивали с хорошо поедаемой приманкой. В качестве приманки для пищух использовали тертую морковь (0.5 г), перемешанную с фрагментами пластика. После поедания приманки пищух пересаживали в чистые клетки во избежание прилипания маркера к лапкам и экскрементам. Основным кормом служили свежие листья одуванчиков, хорошо поедаемые пищухами (с низким содержанием сырой клетчатки – 13.6%). Перед получением пищухами каждого последующего маркера собирали экскременты.
Опыт длился 29 ч (время с момента поглощения зверьками первого маркера до вскрытия). Первую приманку с маркером для оценки полного периода выведения маркеров пищухи получили за 23–29 ч до вскрытия. На следующий день приманки были съедены в интервалах 9:30–10:30, 14:00–15:00 ч. В конце опыта зверьков умертвили путем декапитации для анализа распределения по пищеварительному тракту поглощенных в разное время маркеров, которые легко идентифицировали по цвету. Для количественной оценки распределения маркеров в желудочно-кишечном тракте содержимое каждого органа размывали на ситах; образцы промытого содержимого высушивали и в каждом образце визуально подсчитывали количество маркеров каждого цвета. Количество всех попавших в пищеварительный тракт маркеров одного цвета (выведенных с экскрементами и оставшихся в полости) принимали за 100%. Рассчитано процентное содержание маркеров в каждом органе и экскрементах. Среднее время задержки корма в пищеварительном тракте (MRT) рассчитано по формуле (Warner, 1981):
где mi – количество маркеров в экскрементах (i – дефекация за время ti после дачи маркера), ti – время экспозиции маркера, n – общее количество дефекаций до полного выведения маркера. MRT рассчитывали отдельно для каждого маркера. Результаты по темпам выведения маркеров с экскрементами (всего 33 образца) обработаны с помощью методов непараметрической статистики (программа Statistica).РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распределение маркеров в ЖКТ. Время поедания приманки с маркерами разными особями не было синхронизировано. Первый маркер, предложенный зверькам в 13 ч, находился в пищеварительном тракте у разных особей от 23 до 29 ч. К этому времени у четырех пищух практически все маркеры были выведены из пищеварительного тракта, но у одной особи в слепой кишке задержалось более 20% поглощенных маркеров, и еще у одного зверька были обнаружены маркеры в желудке (рис. 1в, 1д).
Рис. 1.
Распределение маркеров в пищеварительном тракте даурской пищухи. (а), (б), (в), (г), (д), (е )– отдельные особи. Для рис. 1 и 2: 1 – желудок, 2 – слепая кишка, 3 – ободочная кишка, 3а – проксимальная часть ободочной кишки, 3б – дистальная часть ободочной кишки, 4 – экскременты; разной штриховкой обозначены разные маркеры.

Второй маркер, поглощенный пищухами за 7–11 ч до окончания эксперимента не задержался в желудке, но был обнаружен в небольшом количестве в слепой кишке – от 2 до 18% (рис. 1г, 1д). Третий маркер, съеденный зверьками за 2–4 ч до окончания эксперимента, очень быстро эвакуировался из желудка, в одном случае полностью (рис. 1б). В остальных случаях в желудке осталось от 5 до 21% маркеров. Уже через 2 ч после поступления в пищеварительный тракт наблюдалось активное поступление маркеров в слепую кишку, где сосредоточилось до 45% маркеров.
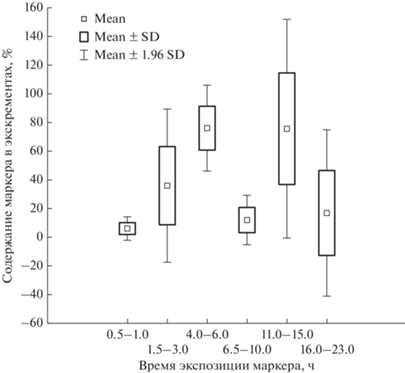
На обобщенном графике (рис. 2) отмеченные индивидуальные различия в распределении маркеров стираются, но во всех случаях зарегистрировано в целом быстрое продвижение корма по пищеварительному тракту. Расчеты по отдельным маркерам показывают, что среднее время задержки корма у даурской пищухи при потреблении зеленой массы растений составляет 5.45 ч (4.92–6.04).
Рис. 2.
Средние значения содержания маркеров в разных органах пищеварительного тракта даурской пищухи.
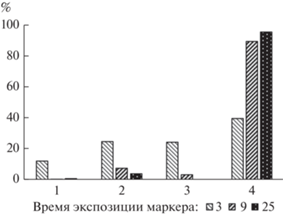
Выведение маркеров с экскрементами. Выведение маркеров продолжалось на протяжении всего опыта. Первое появление маркеров в экскрементах отмечалось уже на протяжении первого часа после поступления маркера (рис. 3). Далее зарегистрировано два пика максимального выведения маркеров – через 4–6 ч, и через 11–15 ч после начала опыта.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Копрофагия у пищух. Максимально полное обобщение сведений о копрофагии у зайцеобразных – поедании специально производимых экскрементов было опубликовано в 2001 г. (Hirakawa, 2001). К этому времени было выяснено, что пищухи, как и зайцы, производят два типа экскрементов, различия между которыми по биохимическому составу и консистенции очень существенны. Leporidae и Ochotonidae различаются также по ритмике формирования экскрементов разного типа: если у зайцев и кроликов цекотрофия происходит только утром, то у пищух выделение цекотрофов может происходить многократно в периоды покоя, причем часть их зверьки не поедают с ануса, а оставляют в стожках запасаемого корма. При этом интенсивность копрофагии, как и у грызунов (Пшенников и др., 1990; Pei et al., 2001), зависит от качества поедаемого корма. Хотя высокая пищевая ценность цекотрофов была раскрыта относительно давно, то лишь в последнее время были обнаружены различия в составе и функциях микробиоты мягких и твердых экскрементов (Fu, Li, 2022).
Среднее время задержки корма в пищеварительном тракте (MRT). Сложное строение слепой и ободочной кишок у пищух, снабженных глубокой спиральной складкой, ячейками слизистой и мускульными кармашками (Наумова и др., 2014) предполагает длительную задержку корма в этих частях кишечника. Против ожиданий, среднее время задержки корма в пищеварительном тракте даурской пищухи составило менее 6 ч, что очень немного для животных с массой тела более 100 г, потребляющих клетчатковые корма. Подобные показатели ранее были получены для некоторых зеленоядных полевок с вдвое меньшей массой тела (Pei et al., 2001; Наумова и др., 2007; Hagen et al., 2018). Если учесть, что относительная масса ферментативного органа у мелко грызущих полевок, достигающая 9% от массы тела (Варшавский и др., 2017), почти вдвое больше, чем у пищух – 4–6% от массы тела (Наумова и др., 2015), а кормовая масса застаивается в слепой кишке до 7 ч, то у полевок условия для ферментации клетчатки кажутся предпочтительнее. Очень быстрое прохождение пищевых частиц по ЖКТ, в среднем, за 4–5 ч (Hirakawa, Okada, 1995) ранее также было выявлено у другого, более крупного представителя зайцеобразных, японского зайца Lepus brachyurus. То есть, у зайцеобразных, облигатных копрофагов, поедающих специально произведенные цекотрофы, отмечена более высокая скорость прохождения корма по пищеварительному тракту, чем у мелких зеленоядных грызунов, факультативных копрофагов.
Эти цифры подтверждают гипотезу о значении копрофагии как способа удлинения времени ферментации растительного корма (путем повторного размещения пищевой массы в слепой кишке). Доказательством возможности интенсивного использования структурных углеводов в качестве нутриента служит и высокая активность ферментов целлюлазного комплекса в слепой и ободочной кишках даурской пищухи (Наумова и др., 2015).
Распределение маркеров в пищеварительном тракте. При однократном мечении корма распределение маркеров по пищеварительному тракту было исследовано у полевки Брандта путем оценки концентрации маркера у животных, умерщвленных через определенные промежутки времени (Pei et al., 2001). Многократное мечение цветными пластиковыми маркерами визуализирует локацию съеденного в разное время корма, конкретизируя пути его продвижения внутри пищеварительного тракта одного и того же животного. В нашем эксперименте было показано, что уже через час после поступления маркера в желудок у даурской пищухи оказывается выведенным до 10% съеденных маркеров. Увеличение количества маркеров в желудке у двух зверьков через 4 ч могло быть результатом повторного заглатывания экскрементов, вывод которых начался уже через 2 ч. Также удалось зафиксировать повторное попадание первого маркера (съеденного около суток назад) в желудок и слепую кишку (рис. 1б, 1д) и второго маркера (с экспозицией 7–10 ч) в слепую и ободочную кишки (рис. 1а, 1б, 1г, 1д). Периоды кормовой активности внутри экспериментальной группы даурских пищух не были синхронизированы, поэтому случаи копрофагии были отмечены не у всех особей. Кроме того, основной корм – листья одуванчиков возможно, содержал недостаточно балласта (13.6% сырой клетчатки) для интенсификации копрофагии.
Выведение маркеров с экскрементами. Перечисленные особенности циркуляции содержимого в пищеварительном тракте мелких млекопитающих на графиках выведения маркированной пищи отражаются в виде пиков концентрации маркера в экскрементах (Pei et al., 2001; Clauss et al., 2007; Hagen et al., 2018). Аналогичные пики были получены при анализе выведения маркеров у даурских пищух (рис. 3). Во временном промежутке от 4 до 6 ч и от 11 до 15 ч с момента введения первого маркера, соответствующему 8–11 ч астрономического времени, была зафиксирована высокая активность копрофагии у пяти пищух. Зарегистрированные в нашем опыте пики и длительное остаточное выведение маркеров могли быть обусловлены копрофагией, а также циркуляцией маркированного содержимого в системе слепая–ободочная кишки.
Список литературы
Варшавский Ал.А., Наумова Е.И., Жарова Г.К., Чистова Т.Ю., Варшавский Ан.А. Взаимосвязь размеров тела и органов пищеварительного тракта у некоторых Myomorpha: изометрия, или аллометрия? // Изв. РАН. Сер. биол. 2017. № 4. С. 534–540.
Жарова Г.К., Чистова Т.Ю., Наумова Е.И. Особенности продвижения корма по пищеварительному тракту тамарисковой песчанки Meriones tamariscinus // Докл. РАН. 2010. Т. 435. № 4. С. 1–4.
Наумова Е.И., Жарова Г.К., Чистова Т.Ю. Исследование продвижения корма по пищеварительному тракту полевок методом многократного введения пластиковых маркеров // Зоол. журн. 2007. Вып. 6. С. 739–750.
Наумова Е.И., Жарова Г.К., Чистова Т.Ю., Формозов Н.А. Структура поверхности эпителия пищеварительного тракта пищух (Ochotona pallasi и O. dauurica, Lagomorpha, Ochotonidae): функциональная и видовая специфика // Изв. РАН. Сер. биол. 2014. № 4. С. 1–8.
Наумова Е.И., Жарова Г.К., Чистова Т.Ю., Варшавский А.А., Формозов Н.А. Редукция растительных волокон в пищеварительном тракте двух видов пищух (Ochotona pallasi и O. dauurica, Lagomorpha, Ochotonidae) // Изв. РАН. Сер. биол. 2015. № 2. С. 163–168.
Пшенников А.Е., Борисов З.З., Васильев И.С. Копрофагия и ее ритмика у зайца-беляка (Lepus timidus) в Центральной Якутии // Зоол. журн. 1988. Т. 67. Вып. 9. С. 1357–1362.
Пшенников А.Е., Алексеев В.Г., Корякин И.И., Гнутов Д.Ю. Копрофагия у северной пищухи (Ochotona hyperborea) в Якутии // Зоол. журн. 1990. Т. 69. Вып. 12. С. 106–114.
Björnhag G. Separation and delay of contents in the rabbit colon // Swed. J. Agric. Res. 1972. № 2. P. 125–136.
Björnhag, G., Snipes, R.L. Colonic separation mechanism in lagomorph and rodent species – a comparison // Zoosystematics and Evolution. 1999. V. 75. P. 275–281.
Clauss M., Besselmann D., Schwarm A., Ortmann S., Hatt J.-M. Demonstrating coprophagy with passage markers? The example of the plains viscacha (Lagostomus maximus) // Comp. Biochem. Physiol. A. 2007. V. 147. P. 453–459.
Cranford J.A., Johnson E.O. Effect of coprophagy and diet quality on two microtine rodents (Microtus pensylvanicus and Microtus pinetorum) // J. Mammalogy. 1989. V. 70. P. 494–502.
Fu H., Li W. Metagenomic Comparisons between soft and hard feces of plateau pikas (Ochotona curzoniae) // Animals. 2022. V. 12. P. 149.
Haga R. Observations on the ecology of the Japanese pika // J. Mammalogy. 1960. V. 41. № 2. P. 200–212.
Hagen K.B., Müller D.W.H., Ortmann S., Kreuzerd M., Clauss M. Digesta kinetics in two arvicoline rodents, the field vole (Microtus agrestis) and the lemming (Lagurus lagurus) // Mammalian Biology. 2018. V. 89. P. 71–78.
Hirakawa H. Coprophagy in leporids and other mammalian herbivores // Mammal Rev. 2001. V. 31. № 1. P. 61–80.
Hirakawa H., Okada A. Hard faeces reingestion and the passage and recycling of large particles in the diet of the Japanese hare Lepus brachyurus // Mammalia. 1995. V. 59. P. 237–247.
Matsuzawa T., Nakata M., Tsushima M. Feeding and excretion in the Afgan pika (Ochotona rufescens rufescens), a new laboratory animal // Laboratory Animals. 1981. № 15. P. 319–322.
Pei Y.-X., Wang D.-H., Hume I.D. Selective digesta retention and coprophagy in Brandt’s vole (Microtus brandti) // J. Comp. Physiol. B. 2001. V. 171. P. 457–464.
Taylor E.L. Does the rabbit chew the cud? (Feces produced at night are swallowed and redigested) // Nature. 1939. V. 143. № 3632. P. 982–983.
Thacker E.G., Brandt C.S. Coprophagy in the rabbit // J. Nutrition. 1955. V. 55. № 3. P. 375–385.
Warner A.C.I. Rate of passage of digesta through the gut of mammals and birds // Nutr. Abstr. Rev. Ser. B. 1981. V. 51. P. 789–820.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая