Известия РАН. Серия биологическая, 2022, № 5, стр. 495-508
Этологические особенности при формировании аппарата движения костистых рыб (на примере радужной форели Oncorhynchus mykisswalbaum)
В. П. Панов 1, *, С. С. Сафонова 1, **, И. В. Байдаров 1
1 ФГБОУ ВО РГАУ-МСХА им. К.А. Тимирязева
127550 Москва, ул. Тимирязевская, 49, Россия
* E-mail: panovval@gmail.com
** E-mail: Sfalij@yandex.ru
Поступила в редакцию 30.01.2021
После доработки 15.06.2021
Принята к публикации 17.06.2021
- EDN: EAJZHV
- DOI: 10.31857/S1026347022040114
Аннотация
В настоящей работе приводятся данные об особенностях структурных адаптационных изменений в соматической мускулатуре радужной форели на различных этапах раннего постнатального онтогенеза. Развитие соматической мышечной системы непосредственно связано с локомоторными поведенческими актами рыб. В предличиночный период происходит подготовка слаборазвитых мышц к поднятию на поверхность воды и наполнению плавательного пузыря воздухом. Личиночный период характеризуется выраженными плавательными движениями, сопровождающими активное экзогенное питание. Мальки приобретают локомоционные свойства, присущие ювенальным особям с хорошо развитой мускулатурой.
Форма тела молоди рыб непосредственно после выхода из икры и относительно короткий период после этого существенно отличается от взрослых особей. Ее трансформация лежит в прогрессивном изменении морфометрических пропорций с увеличением размеров рыб (Snyder et al., 1977; Cooper, 1978a, 1978b; Fuiman, 1979; Панов и др., 2020). Изменения в строении тела рыб связаны сдифференцировкой относительного роста (Fuima, 1983). У большинства видов рыб эмбрионы, близкие к вылуплению, не имеют ротового отверстия, кишечника, ануса, жабр и других органов (Sampaio et al., 2015; Marques et al., 2017; Faustino et al., 2018).
Ряд онтогенетических исследований посвящен внешней и внутренней морфологии молоди рыб (Balart, 1985; Watson, 1987; Potthoff et al., 1988). Способность к поимке живой добычи, особенно при первом трофическом акте, зависит от размеров при вылуплении, остроты зрения, характера плавательных способностей личинок рыб, а также доступности жертвы (Jing et al., 2018).
Другие работы посвящены морфологическому состоянию органов питания и локомоции, которые функционально тесно взаимосвязаны (Kohno et al., 1983; Taki et al., 1987; Omori et al., 1996). Рост и развитие личинок рыб в большой степени обусловлены функционированием их опорно-двигательного аппарата. Его активная составляющая – мышечная система, является основой для совершения и смены поведенческих актов, обеспечивает благополучие популяции рыб на ранних стадиях их развития (Панов, 1997).
У личинок дорадо при вылуплении соматическая мускулатура состоит из монослоя тонких недифференцированных под дермой кожи, лежащих эпаксиально и гипаксиально от горизонтальной миосепты волокон. Под ними наблюдаются большего размера полигональные волокна (Ramirez-Zarzosa, et al., 1995). У костистых рыб миогенезинициируется на более ранних стадиях эмбриогенеза, чем у амниот, таких как птицы и млекопитающие.
Это обусловлено потребностью генерировать пропульсивное плавание у личинок рыб (Johnston et al., 2011). Миогенные предшественники клеток медленных и быстрых мышц пространственно отделяются перед формированием сомитов на стадии гаструляции (Hirsinger et al., 2004).
Рост скелетной поперечнополосатой мускулатуры обусловлен двумя процессами: гипертрофией и гиперплазией. У молоди эти процессы происходят постоянно, а у взрослых особей костистых рыб постепенно затухают и, прежде всего, это касается гиперплазии (Carpene, Veggetti, 1981; Rowlerson et al., 1985; Ramirez-Zarzosa et al., 1998).
Методы определения количественных показателей, таких как диаметры и общая площадь волокон в репрезентативных областях соматической мускулатуры различных возрастных и размерных групп рыб использованы во многих работах (Weatherley et al., 1988; Kiessling et al., 1991; Alami-Durante et al., 1997; Johnston et al., 1998; Valente et al., 1999; Panov et al., 2019).
В период раннего постнатального онтогенеза ручьевой форели и американского гольца выделяется ряд стадий, связанных с изменением морфометрических показателей тела рыб. В это же время у личинок отмечены начало внешнего питания и повышение локомоторной активности (Панов и др., 2020). Эти важные этапы в жизни молоди рыб находятся в соответствии с подготовленностью (созреванием) и морфофункциональным состоянием соматической мышечной системы, которая обеспечивает их успешность.
Целью настоящего исследования является установление особенностей структурных адаптационных изменений в соматической мускулатуре на различных этапах раннего постнатального онтогенеза радужной форели.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись свободные эмбрионы (предличинки), личинки и мальки радужной форели (Oncorhynchus mykiss). Этапы развития рыб устанавливали в соответствии с онтогенетическими взглядами. Расса (1946). Икра на стадии глазка размещалась в один слой в деревянных лотках с сетчатым дном. Лотки находились в емкостях установки замкнутого цикла водообмена (УЗВ). Их полезный объем – 200 л. Установка в своем составе имела блоки механической и биологической очистки, охлаждения и ультрафиолетового обеззараживания воды, аэрации и озонирования. Частичную подмену воды (не более трети объема) производили дважды в неделю. Температура воды при инкубации икры составляла +6°C, увеличиваясь по мере развития рыб до +16°C. Содержание растворенного в воде кислорода поддерживали в пределах 6–9 мг/л.
С момента перехода на смешанное питание и до полной резорбции желточного мешка молодь кормили живыми науплеусами артемии (Artemiasalina) и замороженным циклопом. В дальнейшем рыба потребляла промышленный гранулированный комбикорм Gouessant T-Salmo (протеин – 42%, жир – 24%).
С началом активных локомоций рыб перемещали из лотков в аквариумы. Наблюдения за поведением рыб осуществляли в течение 2 ч в утреннее и вечернее время три раза в неделю и в течение 3 ч в дневное время – два раза в неделю. Для оценки этологических особенностей молоди применяли методы свободного наблюдения и сплошного протоколирования (Попов, Ильченко, 1990).
Длину тела рыб определяли с помощью бинокулярного микроскопа МБС – 2, снабженного окуляром с измерительной шкалой с точностью до 0.1 мм, а массу – поштучно с использованием аналитических электронных весов “Sartorius” (точность до 0.1 мг).
С целью гистологического анализа из каждой возрастной группы рыб отбирали по 3 особи (в одной пробе). За период исследований отобрано 15 проб (7 – на этапе предличинки; 6 – на этапе личинки и 2 – на мальковом). Пробы фиксировали в 10%-ном формалине. После промывки образцов от фиксатора проточной водой осуществляли их проводку через растворы желатина восходящих концентраций (7, 12.5 и 25%), после чего заливали в 25%-ный желатин и после его застывания вырезали блоки. Для уплотнения среды в течение суток блоки выдерживали в 25%-ном формалине. Делали тотальные поперечные срезы тела на уровне начала спинного плавника. Гистологические образцы толщиной 15 мкм получали на замораживающем микротоме с электрическим приводом МЗП-01 Техном, оснащенном охладителем ОМТ 28-02 Е. Окраска образцов осуществляли Суданом III (“Вектон”, Россия) и гематоксилином по Карацци (Абрис+, Россия). Для исследования полученных препаратов использовали световой микроскоп Микромед С-1 с объективами 4/0.10 160/0.17; 10/0.25 160/0.17 и S40/0.65 160/0.17. На них определяли диаметр белых гликолитических(быстрых) и красных окислительных (медленных) мышечных волокон и их плотность (Аппельт, 1959). Красные и белые волокна дифференцировались по среднему диаметру, интенсивности окраски и расположению миофибрилл. Микрофотографии получали c помощью фотоаппарата Sony Cyber-shot и обработаны с использованием программы “MicrosoftPowerPoint”.
Расчет соотношения красной и белой мускулатуры на тотальном поперечном срезе осуществлялся с помощью графической программы ImageJ.
Полученный материал обработан статистически с использованием программного обеспечения Microsoft Office Excel. Рассчитывали такие показатели как среднее абсолютное значение со стандартной ошибкой средней (M ± m), коэффициент вариации (Cv, %). Достоверность различий определял b по t-критерию Стьюдента при p ≤ 0.05 (по Пирсону).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
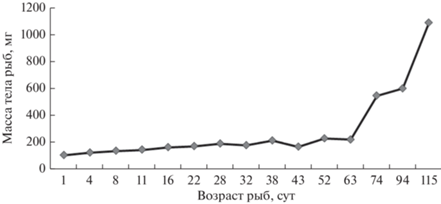
Химический состав воды на протяжении всего экспериментального периода находился в пределах допустимых норм. Рост массы и длины рыб представлены на рис. 1 и 2. Особенность роста массы рыб в раннем постнатальном онтогенезе рыб связана с наличием желточного мешка, его резорбцией и переходом молоди сначала на смешанное, а затем и экзогенное питание. После расходования запасных питательных веществ, на последних этапах личиночного периода и мальков их рост становится более интенсивным (рис. 1).
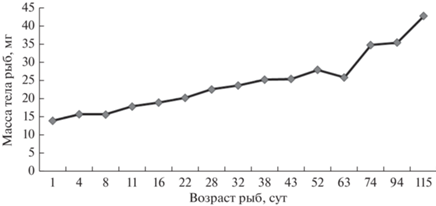
Рост рыб в длину происходит постоянно и постепенно без резких колебаний (рис. 2).
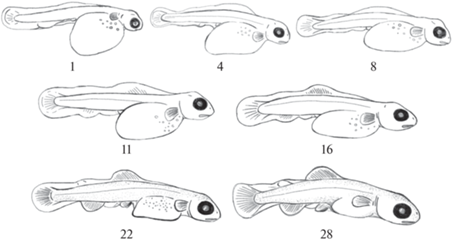
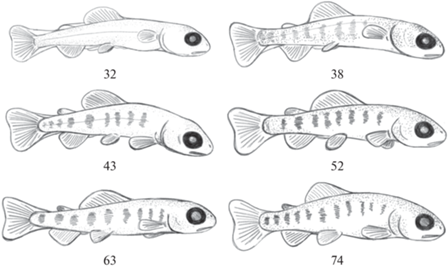
Соматическая мускулатура, составляющая основу аппарата движения, при онтогенетическом развитии выполняет локомоторную функцию и обеспечивает индивидуальное благополучие рыб. Она определяет многие жизненные функции, связанные с развитием респираторного, пищеварительного аппаратов, ухода от хищников и др. Ранний постнатальный онтогенез включает три этапа развития: предличиночный, личиночный и мальковый (рис. 3–5). В каждом из них происходят изменения в структуре мышечной ткани, которые связаны с определенным типом поведения (табл. 1).
Таблица 1.
Поведенческие особенности радужной форели
| Дата отбора проб | Возраст рыб, сутки | Описание |
|---|---|---|
| 14.05.19 | 1 | За несколько дней до начала выклева эмбрионы активно двигались внутри икринок. После выхода из оболочки первые свободные эмбрионы не совершали локомоций, были заметны только колебательные движения грудными плавниками с целью аэрации жаберного аппарата |
| 17.05.19 | 4 | Рыбы, выклюнувшиеся на 4-е – 7-е сутки после первых особей, проявляли большую двигательную активность, чем вышедшие из оболочки самыми первыми и на 2-е – 3-и сутки. Личинки совершают периодические червеобразные движения, хотя в основном лежат на боку |
| 21.05.19 | 8 | Предличинки совершают периодические перемещения по дну лотков рывками. Лежат не только на боку, но и на желточном мешке (на брюшной стороне тела) |
| 24.05.19 | 11 | Объем желточного мешка – 73.2%.Передвижения по дну стали более плавными, предличинки не лежат на боку, а опираются на желточный мешок, поддерживая тело в характерном для рыб положении |
| 29.05.19 | 16 | Объем желточного мешка – 61.9% от исходного. Начинается «роение» - молодь располагается в лотках концентрическими кругами, ориентируясь головами в одном направлении (чаще всего – по часовой стрелке) |
| 04.06.19 | 22 | Объем желточного мешка – 27.2% от исходного. Заметны единичные “свечки”. Продолжается “роение”. Периодически рыбы делают движения вперед и вверх, после чего снова опускаются на дно, сохраняя строение “роя” |
| 10.06.19 | 28 | Объем желточного мешка – 5.3% от исходного. Некоторые особи осуществляют поднятие “на плав”. Поднимаясь к поверхности воды, они заглатывают воздух, чтобы наполнить им плавательный пузырь. Начало кормления (артемия, циклоп, стартовый корм). Рыба на корм реагировала слабо. Корм захватывали только те рыбы, которые поднялись на плав, но не активно. Лежащие на дне особи никак на него не реагировали |
| 14.06.19 | 32 | Начало пигментации спинного плавника. Поднятие на плав стало массовым, повысился и интерес рыб к корму |
| 20.06.19 | 38 | Активное экзогенное питание. Личинки располагаются по всей толще воды и держатся против течения. При кормлении захватывают пищу из толщи воды. На корм с поверхности и со дна не реагируют |
| 25.06.19 | 43 | Продолжается рост рыб. Становится более яркой характерная для молоди лососевых окраска – вертикальные темные полосы на теле. Наблюдаются проявления хищнического поведения – рыбы конкурируют за частицы корма и место, совершая резкие рывки в сторону соперника, пытаясь его укусить |
| 04.07.19 | 52 | Начало каннибализма. Появляются рыбы, у которых изо рта торчат хвосты съеденных ими более мелких особей. При этом чаще всего погибали и агрессоры, и их жертвы, поскольку никто из них не мог высвободиться. Рыбы были распределены по трем размерным группам, каждая группа отсажена в отдельный аквариум |
| 15.07.19 | 63 | Активный каннибанизм. Несмотря на проведенную сортировку, неравномерный рост рыб приводит к возобновлению каннибализма. Рыбы становятся очень агрессивными по отношению друг к другу, заметны повреждения спинных и хвостовых плавников |
| 26.07.19 | 74 | Каннибанизм продолжается. Проведена вторая сортировка. Начало кормления крупкой. Парные и анальный плавники окрашены в оранжевый цвет. На брюшных и анальном плавниках – белый кант. У самых крупных особей появляется чешуя |
| 15.08.19 | 94 | Чешуя присутствует у всех размерных групп. Агрессивное поведение и каннибализм в одноразмерных группах. Появление радужного блеска на чешуе |
| 05.09.19 | 115 | Агрессия уменьшилась, мальки повреждают друг другу только спинные плавники. Рыбы равномерно распределены по всей толще воды в направлении против течения |
Односуточные предличинки обладают большим желточным мешкомовальной формы, плотно прижатой к нему головой, и крупными глазами. В желточном мешке хорошо видны жировые капли. Позади головы находится хорошо выраженный грудной плавник с лепидотрихиями. Относительно небольшое, слаборазвитое тело с окаймляющей плавниковой складкой, в задней части которой наметились лепидотрихии хвостового плавника.
Прогрессивное развитие предличинок заключается в уменьшении объема желточного мешка, который по мере резорбции приобретает несколько уплощенную форму, и обособлении головы. В возрасте 11 сут (71.0 градусо-день с момента начала выклева; объем желточного мешка – 73.2% от исходного) появляются зачатки спинного и анального плавников с лепидотрихиями. Плавниковая складка постепенно редуцируется. У 22-х суточной молоди желточный мешок приобретает угловатую форму, а позади него заметны зачатки брюшных плавников (155.0 градусо-дней; остаток желточного мешка – 27.2%). В конце предличиночного периода, в 28 суточном возрасте желточный мешок практически исчезает (204.5 градусо-дней; остаток – 5.3% от исходного объема), но остаются элементы плавниковой складки в области хвостового стебля и небольшого участка между брюшными и анальным плавником (рис. 3).
В предличиночный период (с 1 по 28 сутки) наблюдается постепенное увеличение диаметров белых мышечных волокон (в 2.4 раза) (P < 0.05). Коэффициент вариации достаточно высокий и, в среднем, составляет 25.6% (пределы колебания 2.3–21.0 мкм). Наиболее интенсивный рост быстрых волокон происходит вначале постнатального онтогенеза с 1 по 4 сут (на 22.7%) и с 16 до 28 сут (на 27.1%) (табл. 2).
Таблица 2.
Характеристика мускулатуры радужной форели в предличиночный период
| Возраст рыб, сутки | Белая мускулатура (n = 150) | Красная мускулатура (n = 30) | Плотность белой мускулатуры (n = 30) | |||
|---|---|---|---|---|---|---|
| диаметр волокон, мкм | CV, % | диаметр волокон, мкм | CV, % | % / 1 мм2 | CV, % | |
| 1 | $\frac{{5.7 \pm 0.12}}{{2.3{\kern 1pt} - {\kern 1pt} 9.2}}$ | 25.6 | $\frac{{1.2 \pm 0.06}}{{0.8{\kern 1pt} - {\kern 1pt} 2.1}}$ | 29.5 | $\frac{{35.5 \pm 1.60}}{{26.0{\kern 1pt} - {\kern 1pt} 57.8}}$ | 24.6 |
| 4 | $\frac{{7.4 \pm 0.20{\kern 1pt} *}}{{2.5{\kern 1pt} - {\kern 1pt} 16.8}}$ | 33.2 | $\frac{{1.3 \pm 0.07}}{{0.8{\kern 1pt} - {\kern 1pt} 2.2}}$ | 29.3 | $\frac{{40.4 \pm 1.73{\kern 1pt} *}}{{29.1{\kern 1pt} - {\kern 1pt} 60.6}}$ | 23.4 |
| 8 | $\frac{{7.8 \pm 0.21{\kern 1pt} *}}{{2.5{\kern 1pt} - {\kern 1pt} 15.5}}$ | 32.3 | $\frac{{1.3 \pm 0.14}}{{0.4{\kern 1pt} - {\kern 1pt} 3.4}}$ | 58.7 | $\frac{{41.7 \pm 0.84{\kern 1pt} *}}{{32.4{\kern 1pt} - {\kern 1pt} 51.2}}$ | 11.0 |
| 11 | $\frac{{8.0 \pm 0.17{\kern 1pt} *}}{{4.2{\kern 1pt} - {\kern 1pt} 12.6}}$ | 26.0 | $\frac{{1.7 \pm 0.11{\kern 1pt} *}}{{0.8{\kern 1pt} - {\kern 1pt} 2.9}}$ | 36.6 | $\frac{{40.8 \pm 1.09{\kern 1pt} *}}{{31.7{\kern 1pt} - {\kern 1pt} 57.5}}$ | 14.6 |
| 16 | $\frac{{10.7 \pm 0.22{\kern 1pt} *}}{{5.0{\kern 1pt} - {\kern 1pt} 18.1}}$ | 25.0 | $\frac{{1.9 \pm 0.14{\kern 1pt} *}}{{0.9{\kern 1pt} - {\kern 1pt} 3.4}}$ | 40.7 | $\frac{{57.5 \pm 1.65{\kern 1pt} *}}{{45.5{\kern 1pt} - {\kern 1pt} 75.9}}$ | 15.8 |
| 22 | $\frac{{11.4 \pm 0.20{\kern 1pt} *}}{{6.3{\kern 1pt} - {\kern 1pt} 16.8}}$ | 21.4 | $\frac{{2.0 \pm 0.11{\kern 1pt} *}}{{1.3{\kern 1pt} - {\kern 1pt} 3.5}}$ | 29.4 | $\frac{{63.6 \pm 2.46{\kern 1pt} *}}{{46.4{\kern 1pt} - {\kern 1pt} 98.5}}$ | 21.2 |
| 28 | $\frac{{13.6 \pm 0.18{\kern 1pt} *}}{{8.4{\kern 1pt} - {\kern 1pt} 21.0}}$ | 15.9 | $\frac{{3.4 \pm 0.16{\kern 1pt} *}}{{1.6{\kern 1pt} - {\kern 1pt} 5.0}}$ | 25.7 | $\frac{{74.6 \pm 2.48{\kern 1pt} *}}{{49.7{\kern 1pt} - {\kern 1pt} 91.2}}$ | 18.2 |
| В среднем за период | 9.2 | 25.6 | 1.8 | 35.7 | 50.6 | 18.4 |
Примечание. * – Разность значений между первыми сутками после выклева и последующими возрастами достоверна при P ≤ 0.05. Здесь и в табл. 3, 4: при расчете плотности белой мускулатуры учитывали только зрелые волокна. Над чертой – абсолютные средние значения и ошибка; под чертой – пределы колебаний.
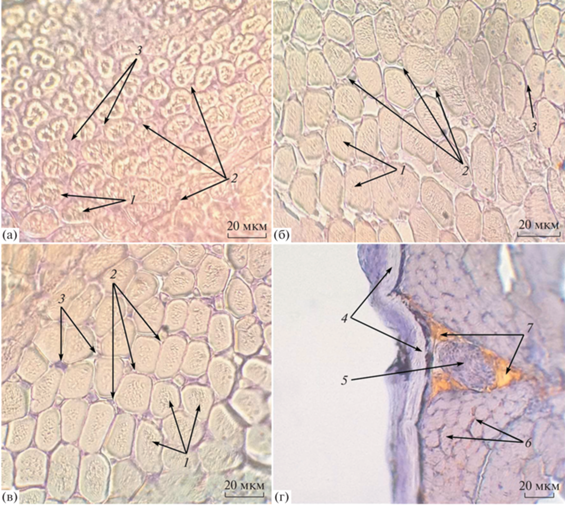
Белые мышечные волокна, угловатые по форме, находятся на достаточно большом расстоянии друг от друга. Наименьшая их плотность (менее 40%) у односуточной молоди. Соединительно-тканные прослойки (эндомизий) широкие, разделяют одно волокно от другого. По мере развития рыб плотность быстрых мышечных волокон повышается и достигает в конце периода 74.5% (P < 0.05). При этом прослойки эндомизия сужаются и волокна сближаются (рис. 6а, 6б).
Рис. 6.
Мускулатура радужной форели. (а): белая мускулатура предличинки (4-е сут после выклева), (б) – белая мускулатура поздней предличинки (28 сут), (в) – белая мускулатура личинки (43 сут), (г) – красная мускулатура малька (94 сут). 1 – зрелые белые волокна; 2 – молодые белые волокна; 3 – эндомизий; 4 – эпидермис; 5 – блуждающий нерв; 6 – зрелые красные волокна; 7 – липоциты. Увеличение: 600×.
Размеры красных мышечных волокон существенно меньше, чем белых (в среднем, в 5.1 раза) (P < 0.05). Медленные волокна по размерам еще более неоднородны (CV = 37.5%), чем быстрые. Среди них встречаются в различные возрастные периоды очень мелкие волокна в 8–10 раз меньше, чем самые крупные. Диаметр медленных волокон с 1 по 28 суток увеличивается в 2.8 раза, особенно интенсивно в последнюю декаду (на 78.9%) (P < 0.05). В целом, у предличинок форели рост белых и красных мышц связан с процессами гипертрофии. Площадь красной мускулатуры мала, поэтому не представляется возможным оценить объективно плотность волокон, ее образующих.
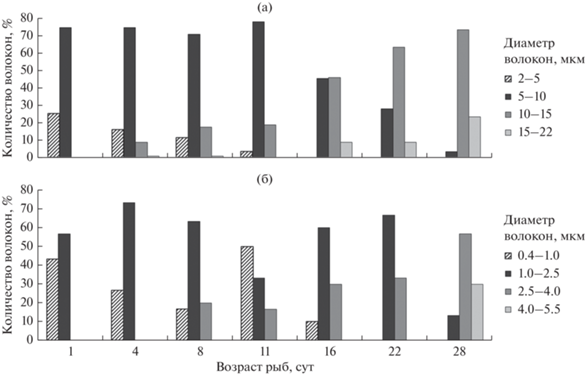
На рис. 7а показано распределение быстрых волокон в соответствии с их диаметрами. Основной группой у предличинок с 1 по 11 сут являются волокна с классовым промежутком 5–10 мкм (70–77%). В дальнейшем с 16 до 28 суточного возраста модальным классом становятся волокна размером 10–15 мкм (45–73%). Появляются также более крупные волокна с диаметром 15–22 мкм (8–23%). Доля самых мелких волокон (2–3 мкм) уменьшается от 25% (1 сут) до 0 (16 сут).
Миогенез быстрых волокон происходит постепенно и в каждой возрастной стадии развития соответствует определенным структурным и морфометрическим изменениям. В первые сутки, когда предличинки лежат неподвижно, быстрые волокна тонкие, их плотность незначительна (35.5%). В процессе метаморфоза происходят хорошо выраженное (4 сут), затем менее заметное (4–11 сут) увеличение диаметров и плотности мышечных волокон, которые используются для кратковременных быстрых движений. При подготовке рыб к более активной локомоции (16–28 сут) интенсивность роста мышечных волокон существенно повышается (роение, свечки и переход на плав). Таким образом, наблюдается характерная гипертрофия быстрых волокон, обеспечивающая молоди быстрые и резкие движения.
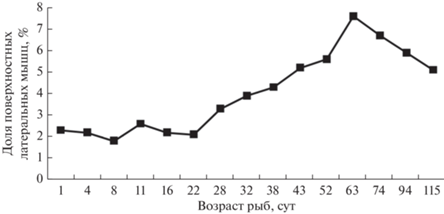
В красных мышцах явной гипертрофии не наблюдается, поскольку в середине предличиночного периода, с 8 до 11 сут, отмечена хорошо выраженная гиперплазия. Количество самых мелких волокон существенно увеличивается (с 16 до 50%), что характерно для начала постнатального развития (44%). В конце этого периода (22 сут) мелкие полностью исчезают и появляются крупные волокна (4.0–5.5 мкм), доля которых составляет ~30% (рис. 7б). Рост медленных мышц можно определить как неравномерный, чередующихся гипертрофии и гиперплазии. В период с 1 до 8 сут при пропульсивных движениях диаметр медленных мышечных волокон фактически не изменяется. Из-за слаборазвитой красной мышцы выполнение основной ее функции продолжительного плавания проблематично. Ее доля от поперечного среза тела в области спинного плавника невелика и в среднем составляет 2.4% (рис. 8). Продолжением предличиночного периода до его окончания является рост красной мышцы за счет гипертрофии волокон. Это связано с процессом формирования красных мышц во время роения и поднятия на плав молоди для продолжительного медленного плавания при невысоких скоростях.
Во время личиночного периода, на поздних стадиях развития молодь приобретают форму, подобную взрослым рыбам. Она имеет хорошо развитые парные и непарные плавники, респираторные органы и ротовой аппарат. Наблюдается полное отсутствие желточного мешка и переход личинок на экзогенное питание. На теле появляется специфическая пигментация, характерная для радужной форели, однако чешуйный покров еще отсутствует. Аппарат движения функционально относительно хорошо развит. У личинок осевая соматическая мускулатура, как и у предличинок, представлена в основном белыми мышцами. На протяжении двух декад (возраст 32–52 сут; 247.5–483.5 градусо-дней с момента выклева) наблюдается постепенное увеличение размеров быстрых волокон (P < 0.05). В последующие 10 сут размеры волокон существенно уменьшаются (на 9.5%) (P < 0.05). Однако личиночный период (74 сут; 815.5 градусо-дней) заканчивается хорошо выраженной гипертрофией белых волокон и их высокой плотностью по сравнению с предыдущими возрастными группами рыб. Плотность волокон повышается до 88% особенно на 74 сутки постнатального развития (в среднем за период 77.8%). Аналогичная динамика роста волокон характерна также для красных мышц личинок. Вариабельность морфометрических показателей мышечной ткани у личинок ниже по сравнению с предличинками (табл. 3).
Таблица 3.
Характеристика мускулатуры радужной форели в предличиночной период
| Возраст рыб, сутки | Белая мускулатура (n = 150) | Красная мускулатура (n = 30) | Плотность белой мускулатуры (n = 30) | |||
|---|---|---|---|---|---|---|
| диаметр волокон, мкм | CV, % | диаметр волокон, мкм | CV, % | %/1 мм2 | CV, % | |
| 32 | $\frac{{15.0 \pm 0.26}}{{7.1{\kern 1pt} - {\kern 1pt} 21.8}}$ | 21.0 | $\frac{{4.4 \pm 0.30}}{{1.7{\kern 1pt} - {\kern 1pt} 7.1}}$ | 37.7 | $\frac{{80.2 \pm 2.22}}{{49.9{\kern 1pt} - {\kern 1pt} 99.8}}$ | 16.6 |
| 38 | $\frac{{15.1 \pm 0.22}}{{8.3{\kern 1pt} - {\kern 1pt} 22.3}}$ | 17.7 | $\frac{{4.8 \pm 0.27}}{{1.7{\kern 1pt} - {\kern 1pt} 7.3}}$ | 30.9 | $\frac{{77.7 \pm 1.75}}{{61.1{\kern 1pt} - {\kern 1pt} 98.8}}$ | 12.3 |
| 43 | $\frac{{15.4 \pm 0.27}}{{4.3{\kern 1pt} - {\kern 1pt} 22.5}}$ | 21.6 | $\frac{{4.6 \pm 0.31}}{{2.5{\kern 1pt} - {\kern 1pt} 8.4}}$ | 36.8 | $\frac{{73.5 \pm 1.43{\kern 1pt} *}}{{63.6{\kern 1pt} - {\kern 1pt} 84.8}}$ | 10.7 |
| 52 | $\frac{{15.8 \pm 0.28{\kern 1pt} *}}{{6.3{\kern 1pt} - {\kern 1pt} 26.9}}$ | 21.5 | $\frac{{6.3 \pm 0.32{\kern 1pt} *}}{{2.1{\kern 1pt} - {\kern 1pt} 9.7}}$ | 27.2 | $\frac{{73.1 \pm 2.10{\kern 1pt} *}}{{55.3{\kern 1pt} - {\kern 1pt} 88.5}}$ | 15.7 |
| 63 | $\frac{{14.3 \pm 0.20{\kern 1pt} *}}{{5.9{\kern 1pt} - {\kern 1pt} 18.9}}$ | 16.8 | $\frac{{4.7 \pm 0.31}}{{2.1{\kern 1pt} - {\kern 1pt} 8.8}}$ | 36.6 | $\frac{{73.9 \pm 1.54{\kern 1pt} *}}{{63.9{\kern 1pt} - {\kern 1pt} 91.2}}$ | 11.4 |
| 74 | $\frac{{17.6 \pm 0.37{\kern 1pt} *}}{{6.2{\kern 1pt} - {\kern 1pt} 28.1}}$ | 25.7 | $\frac{{7.0 \pm 0.52{\kern 1pt} *}}{{2.5{\kern 1pt} - {\kern 1pt} 12.6}}$ | 40.3 | $\frac{{88.3 \pm 1.57{\kern 1pt} *}}{{68.6{\kern 1pt} - {\kern 1pt} 96.1}}$ | 9.7 |
| В среднем за период | 15.5 | 20.7 | 5.3 | 34.9 | 77.8 | 12.7 |
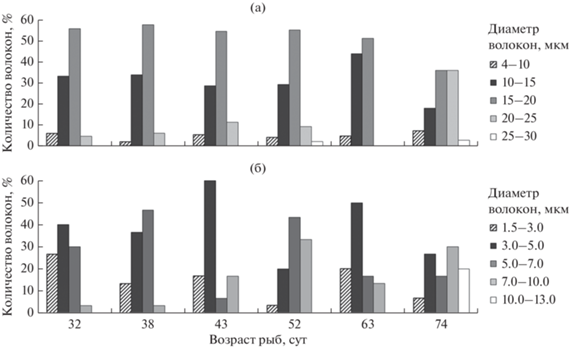
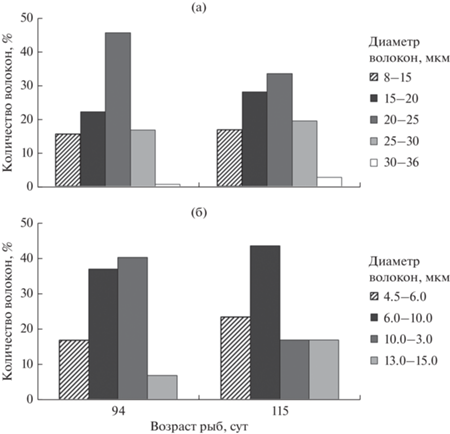
На протяжении большей части личиночного периода (32–63 сут) модальным классом являются волокна с диаметром 15–20 мкм (52–58%), определяющие их средние размерные показатели. В возрасте 63 сут существенно возрастает доля более мелких волокон (10–15 мкм) и их средний диаметр несколько уменьшается. В финальную стадию в белых мышцах молоди увеличивается количество крупных волокон с классовыми промежутками 20–25 мкм (35%) и 25–30% (4%), что приводит к гипертрофии мышечной ткани (рис. 9а).
Для красных мышц характерно чередование гипертрофии и гиперплазии мышечных волокон. Наибольшая доля мелких волокон (1.5–3.0 мкм) отмечено у 32-х суточных рыб (26%). Очередное пополнение мелкими волокнами наблюдается у личинок в возрасте 63 сут. В конце личиночного периода доля этих волокон снижается до 6% и на смену им приходят более крупные 7–10 мкм и 10–13 мкм, доля которых возрастает до 30 и 20% соответственно (рис. 9б).
Вторая половина личиночного периода связана с ростом мышечной системы. Радужная форель является плотоядным по своей природе видом. Ее молодь уже на стадии личинки отличается наклонностью к хищничеству посредством каннибализма. Для этого рыбы совершают резкие рывки в сторону своих сверстников, нанося им не только повреждения спинных и хвостовых плавников, но и практически полностью их заглатывая. В соответствии с подобным поведением, для схватывания жертвы необходима хорошо развитая белая мускулатура с большим количеством сократительных элементов в виде миофибрилл, что обеспечивает увеличение размера волокон. Для постоянных продолжительных локомоций, которыми также обладают личинки форели, красные мышцы играют важную роль. Их рост связан непосредственно с чередующимися процессами гипертрофии и гиперплазии. Доля красных мышц у личинок по сравнению с предличинками увеличивается и в среднем составляет от поперечного среза тела 5.6% (рис. 8). Конечным итогом личиночного периода является повышение роли гипертрофии мышечных волокон.
В мальковый период продолжается увеличение размеров как белых, так и красных волокон (табл. 4). Гипертрофический рост в белых мышцах обусловлен повышением доли быстрых волокон классов 25–30 мкм (20%) и 30–36 мкм (~4%) (рис. 10а). Плотность белых волокон у мальков несколько ниже (79.9–80.4%), чем у старшей возрастной группы личинок (88.3%). В красных мышцах гипертрофия связана с возрастанием роли крупных медленных волокон класса 13–15 мкм (17 мкм) (рис. 10б). Доля красных мышц по сравнению с личинками несколько уменьшается (рис. 8). У мальков снижается уровень агрессивности, появляется чешуйный покров, осуществляется переход на питание искусственными кормами. В аквариумах рыбы равномерно распределяются по всей толще воды против течения. Мальки стараются удержаться в потоке воды, используя продолжительные усилия, и при необходимости осуществляют броски для схватывания корма. Подобному поведению соответствует, по нашему мнению, степень развития обеих мышечных систем молоди.
Таблица 4.
Характеристика мускулатуры радужной форели в мальковый период
| Возраст рыб, сутки | Белая мускулатура (n = 150) | Красная мускулатура (n = 30) | Плотность белой мускулатуры (n = 30) | |||
|---|---|---|---|---|---|---|
| диаметр волокон, мкм | CV, % | диаметр волокон, мкм | CV, % | %/1 мм2 | CV, % | |
| 94 | $\frac{{20.2 \pm 0.38}}{{8.4{\kern 1pt} - {\kern 1pt} 31.9}}$ | 22.9 | $\frac{{9.7 \pm 0.48}}{{5.0{\kern 1pt} - {\kern 1pt} 13.4}}$ | 27.0 | $\frac{{80.4 \pm 2.56}}{{54.6{\kern 1pt} - {\kern 1pt} 98.4}}$ | 17.4 |
| 115 | $\frac{{19.9 \pm 0.45}}{{8.0{\kern 1pt} - {\kern 1pt} 35.7}}$ | 27.7 | $\frac{{9.4 \pm 0.53}}{{4.6{\kern 1pt} - {\kern 1pt} 15.1}}$ | 31.1 | $\frac{{79.9 \pm 2.17}}{{52.9{\kern 1pt} - {\kern 1pt} 98.7}}$ | 14.9 |
| В среднем за период | 20.1 | 25.3 | 9.6 | 29.1 | 80.2 | 16.2 |
Наряду со зрелыми, относительно крупными, в мышцах обоих типов наблюдаются мелкие, вновь образовавшиеся молодые волокна. Молодые волокна имеют округлую форму. На ранних стадиях онтогенеза они имеют темно-синий цвет, т. к. из-за малого размера заметны в основном за счет окрашивания ядер гематоксилином. В белых мышцах это волокна, имеющие диаметр, в среднем. равный 1.6 ± 0.06 мкм, (n = 150) достигают у мальков не более 3 мкм. Они располагаются между крупными быстрыми волокнами. Как правило, каждое молодое окружено тремя и более зрелыми волокнами. Достигая диаметра 3 мкм и более, они приобретают вид зрелых быстрых волокон. Такое сочетание этих структур формирует мозаичную структуру мышечной ткани (рис. 6в). Соотношение зрелых и молодых волокон в период постнатального роста увеличивается в среднем с 1.3 до 2.6. Это свидетельствует о затухании процесса гиперплазии в быстрых мышцах мальков форели. Аналогичные волокна присутствуют в красных мышцах, однако они очень мелкие (<0.1 мкм) и не поддаются точному измерению при помощи светового микроскопа (рис. 6г).
Морфологическим особенностям и функциональному значению соматических мышц различных видов рыб, в том числе и на ранних стадиях онтогенеза, посвящено большое количество исследований (Boddeke et al., 1959; Лобынцев, 1961; Bone, 1966; Лав, 1976; Van Raamsdonk et al., 1982; Akster, 1985; Наследов и др., 1989. Kilarski, 1990; Mascarello et al., 1995; Rowlerson et al., 1995; Панов, Смирнов, 1996).
Наиболее критическими для выживания рыб являются ранние стадии постнатального онтогенеза. Предличиночный период характеризуется подготовкой всей мышечной системы к выполнению тех функций, которые должны быть обеспечены на более поздних этапах развития рыб. В это время мышцы недостаточно готовы в полной мере выполнить возложенные на них функции комплекса быстрых и медленных движений в виде свечек, роения и перехода на постоянное плавание. Раннее развитие структур, связанных с плаванием и питанием являются приоритетным, поскольку не только важны при добычи пищевых объектов, но и для избегания хищников (Osse et al., 1997).
Только, что вылупившиеся предличинки опускаются на дно, лежат и могут делать достаточно резкие движения хвостом при стимуляции. Это связано с тем, что на поздних стадиях эмбрионального развития и у только что вылупившихся предличинок мышечные волокна мало содержат сократительных элементов виде миофибрилл. Однако вскоре их объем увеличивается и волокна заполняются тесно упакованным миофибриллярным материалом (Nag, Nursall, 1972; Proctor et al., 1980; Veggetti et al., 1990; Brooks et al., 1995; Ayala et al., 1999). По этой причине, вероятно, и наблюдается четкая пауза гиперплазии непосредственно после вылупления рыб (Gibson, Johnston, 1995; Galloway et al., 1999a, 1999b; Veggetti et al., 1999).
У радужной форели оптомоторный ответ появляется на 10 сут после выклева, что демонстрируется увеличением чувствительности к низкой освещенности, а также появлением двигательных особенностей в это же самое время (Carvalho et al., 2004). По мнению некоторых исследователей, отмечается тесная связь красных мышц с развитием жабр. Это наталкивает на мысль, что красные волокна выполняют не только локомоторную функцию (EI-Fiky et al., 1987).
В личиночный период рыбы переходят полностью на экзогенное питание. Личинки располагаются по всей толще воды и держатся против течения, активно ему сопротивляясь. Продолжительное плавание у молоди данио рерио не происходит до тех пор, пока молодые красные волокна не приобретают метаболические свойства дефинитивных структур, что происходит в течение 7 суток (Van Raamdonk et al., 1982). Кроме того, красные волокна не становятся различимой популяцией до достижения форелью свободно плавающей стадии (Nag, Nursal, 1972).
Мышечная система обеспечивает необходимые функции жизнедеятельности личинок, в том числе каннибализм, который в этом возрасте (63–74 сут) сильно развит (табл. 1). Охота на соплеменников также требует определенных энергетических затрат, прежде всего, связанных с белыми мышцами.
Характерными поведенческими и морфофункциональными особенностями мальков является тесная связь с последующим периодом развития рыб – ювенальным. Агрессия по отношению к другим особям у мальков уменьшается. Рыбы равномерно распределены по всей толще воды в направлении против течения. Мышечный рост в возрасте 115 сут, по нашим данным, определяется в основном гипертрофией. В дальнейшем, по данным других исследователей, наблюдаются видовые различия по вкладу гиперплазии и гипертрофии в процессы роста рыб (Stickland et al., 1988; Vieira, Johnston, 1992; Johnston, 1994). Гипертрофический рост происходит в различные периоды постнатального онтогенеза, в том числе и на ранних стадиях развития рыб (Nathanailides et al., 1995; Alami-Durante et al., 1997).
Гиперплазия характерна для быстрорастущих рыб, особенно у личинок и ювенальных особей (Weatherley, Gill, 1984; Higgins, 1990).
Процессы роста красной мускулатуры у мальков несколько замедляются, что обусловлено рядом причин: а) разрастанием мышц спинного плавника, которые не учитывались при расчетах; б) ростом тела рыб в высоту, в результате чего увеличивается доля эпаксиальных и гипаксиальных порций быстрых мышц. Аналогичные данные получены и по другим видам рыб. Относительная редукция поверхностных боковых мышц имеет место в связи постнатальным развитием карпа (EI-Fiky et al., 1987) и нототении (Johnston, Camm, 1987).
***
Развитие в раннем постнатальном онтогенезе соматической мышечной системы находится в непосредственной связи с локомоторными поведенческими актами рыб. В предличиночный период при слаборазвитых мышцах происходит подготовка для совершения таких важных актов как “свечки” для захвата воздуха и заполнения плавательного пузыря, роения и поднятия на плав при участии быстрых и медленных мышечных волокон. В личиночный период при установлении хорошо выраженных плавательных движений повышается роль чередующихся процессов гиперплазии и гипертрофии. Мальки, как переходная стадия, приобретают локомоционные свойства, присущие ювенальным особям с хорошо функционально развитыми белыми гипертрофированными мышцами.
Список литературы
Аппельт Г. Введение в методы микроскопического исследования. М.: МЕДГИЗ, 1959. 426 с.
Лав Р.М. Химическая биология рыб. Пищевая пром-сть, 1976. 349с.
Лобынцев К.С. Материалы по экологической гистологии туловищной мускулатуры некоторых костистых рыб // Архив анатомии, гистологии и эмбриологии, 1961. Т. 41. Вып. 11. С. 79–85.
Наследов Г.А., Скоробовичук Н.Ф., Лебединская И.И. Некоторые проявления функциональной адаптации локомоторной (туловищной) мускулатуры // Физиология морских животных, Апатиты, 1989. С. 135.
Панов В.П., Смирнов А.Н. Гистологическое строение осевой мускулатуры ротана (Perсcottusglehni Dyb) // Известия ТСХА, 1996. Вып. 3. С. 191–201.
Панов В.П., Фалий С.С., Байдаров И.В., Есавкин Ю.И., Золотова А.В. Морфогенез структур ручьевой форели (Salmotrutta morphafario) и американского гольца (Salvelinusfontinalis) на ранних стадиях постнатального развития // Известия ТСХА. 2020. Вып. 1. С. 61–75.
Попов С.В., Ильченко О.Г. Методические рекомендации по этологическим наблюдениям за млекопитающими в неволе. М.: Б. и., 1990. 40 с.
Расс Т.С. Ступени онтогенеза костистых рыб (Teleostei) // Зоол. журн. 1946. Т. 25. С. 13–148.
Akster H.A. Morphometry of muscle fibre types in the carp (Cyprinus carpio L.). Relation between structural and contractile characteristics // Cell and Tissue Res. 1985. V. 241. P. 193–201.
Alami-Durante H., Fauconneau B., Rouel M., Escaffre A.M., Bergot P. Growth and multiplication of white skeletal muscle tibres in carp larvae in relation to somatic growth rate // J. Fish Biol. 1997. V. 50. P. 1285–1302.
Ayala M.D., Lopez-Albors O., Gil F., Ramfrez-Zarzosa G, Abelhin E., Moreno F. Red muscle development of gilthead sea bream Sparus aurata (L.): structural and ultrastructural morphometry // Anat. Histol. Embryol. 1999. V. 28. P. 17–21.
Balart E.E. Development of median and paired fin skeleton of Paralichthysolivaceus (Pleuronectiformes: Paralichthyidae) // Japan. J. Ichthyol. 1985. V. 31. P. 398–410.
Boddeke R., Slijpear B.J., van der Stelt Histological characteristics of the body musculature of fishes in connection with their mode of life // Koninklijkened. Acad. Wetenschappen. 1959. Ser. C. V. 62. P. 576–588.
Bone Q. On the function of the two types of myotomal muscle fibre in elasmobranch fish // J. Mar. Biol. Assoc. U.K. 1966. V. 46. P. 321–349.
Brooks S., Vieira V.L.A., Johnston I.A., Macheru P. Muscle development in larvae of a fast-growing tropical freshwater fish, the curimati-pacu // J. Fish Biol. 1995. V. 47. P. 1026–1037.
Carvalho P.S.M., Noltie D.B., Tillitt D.E. Biochemical, histological and behavioral aspects of visual function during early development of rain bowtrout // J. Fish. Biol. 2004. V. 64. P. 833–850.
Carpene E., Veggetti A. Increase in muscle fibres in the lateral is muscle (white portion of Mugilidae) (Pisces, Teleostei) // Experientia. 1981. V. 37. P. 191–193.
Cooper J.E. Eggs and larvae of the logperch, Percinacaprodes (Rafinesque) // Am. Midl. Nut. 1978a. V. 99. P. 257–269.
Cooper J.E. Identification of eggs, larvae, and juveniles of the rainbow smelt, Osmerus mordax, with comparison to larval alewife, Alosa pseudoharengus, and gizzard shad, Dorosomacepedianum // Trans. Am. Fish. Soc. 1978b. V. 107. P. 56–62.
EI-Fiky N., Hinterleitner S., Wieser W. Differentiation of swimming musles and gills, and development of anaerobic powerint helarvae of cyprinid fish (Pisces, Teleostei) // Zoomorphology. 1987. V. 107. P. 126–132.
Van Raamdonk W., Pool C.M., Te Kronnie G. Differentiation of muscle fibre types in (Brachydanio rerio) // Anat. Embriol. 1978. V. 153. P. 137–155.
Faustino F., Makino L.C., Neumann E., Nakaghi L.S.O. Histological description of the larval development of Brycongouldingi Lima, 2004 (Teleostei, Characidae) // International J. Aquactic Biology. 2018. V. 6. P. 75–87. https://doi.org/10.22034/ijab.v6i2.361
Fuiman L.A. Descriptions and comparisons of catostomid fish larvae: northern Atlantic drainage species // Trans. Am. Fish. Soc. 1979. V. 108. P. 560–603.
Fuiman L.A. Growth gradients in fish larvae // J. Fish Biol. 1983. V. 23. P. 117–123.
Galloway T.F., Kjersvik E., Kryvi H. Muscle growth and development in Atlantic cod larvae (Gadus morhua L.) related to different somatic growth rates // J. Exp. Biol. 1999a. V. 202. P. 2111–2120.
Galloway T.F., Kjersvik E., Kryvi H. Muscle growth in yolk-sac larvae of the Atlantic halibut as influenced by temperature in the egg and yolk-sac stage // J. Fish Biol. 1999b. V. 55 (Suppl. A). P. 26–43.
Gibson S., Johnston I.A. Temperature and development in larvae of the turbot Scophthaltnus maximus // Mar. Biol. 1995. V. 124. P. 17–25.
Higgins PJ. The histochemistry of muscle in juvenile atlantic salmon, Salmo salar L. // J. Fish Biol. 1990. V. 37. P. 521–529.
Hirsinger E., Stellabotte F., Devoto S.H., Westerfield M. Hedgehog signaling is required for commitment but not initial induction of slow muscle precursors // Dev. Biol. 2004. V. 275. P. 142–157.
Jing Hu, Yibing Liu, Zhenhua Ma, Jian G. Manuel feeding and development of warm water marine fish larvae in early life // 2018. Chapter10. P. 275–296.
Johnston I.A., Camm J.P. Muscle structure and differentiation in pelagic and demersal stages of the Antarctic teleost Notothenianeglecta // Mar. Biol., 1987. V. 94. P. 183–190.
Johnston I.A. Development and plasticity of fish muscle with growth // Bas. Appl. Myol. 1994. V. 4. P. 353–368.
Johnston I.A., Cole N.J., Abercromby M., Vieira V.L.A. Embryonic temperature modulates muscle growth characteristics in larval and juvenile herring // J. Exp. Biol. 1998. V. 201. P. 623–646.
Johnston I.A., Bower N.I., Macqueen D.J. Review. Growth and the regulation of myotomal muscle mass in teleost fish // J. Exp. Biol. 2011. V. 214. P. 1617–1628.
Kiessling A., Storebakken T., Asgard T., Kiessling K.-H. Changes in the structure and function of the epaxial muscle of rainbow trout (Oncorhynchus mykiss) in relation to ration and age. I. Growth dynamics // Aquaculture. 1991. V. 93. P. 335–356.
Kilarski W. Histochemical characterization of myotomal muscle in the roach, Rutilusrutilus (L.) // J. Fish Biol. 1990. V. 36. P. 353–362.
Kohno H., Taki Y., Ogasawara Y., Shirojo Y., Taketomi M., Inoue M. Development of swimming and feeding functions in larval Pagrus major // Japan. J. Ichthyol. 1983. V. 30. P. 47–60.
Mascarello F., Rowlerson A., Radaelli G., Scapolo P.A., Veggetti A. Differentiation and growth of muscle in the fish Sparus aurata (L.): I. Myosin expression and organization of fiber types in the lateral muscle from hatching to adult // J. Muscle Res. Cell. Mot. 1995. V. 16. P. 213–222.
Marques C., Faustino F., Bertolucci B., Paes M.C.F., Silva R.C., Nakaghi L.S.O. Embryonic development in Zungarojahu // Zygote. 2017. V. 25. P. 1–15. https://doi.org/10.1017/S0967199416000277
Nag A.C., Nursall J.R. Histogenesis of white and red muscle fibres of trunk muscles of a fish, Salmo gairdneri // Cytobios. 1972. V. 6. P. 227–246.
Nathanailides C., Lopez-Albors O., Stickland N.C. Influence of prehatch temperature on the development of muscle cellularity in posthatch Atlanticsalmon (Salmo salar) // Can. J. Fish Aquut. Sci. 1995. V. 52. P. 675–680.
Omori M., Sugawara Y., Honda H. Morphogenesis in hatchery-reared larvae of the black rockfish, Sebastes schlegeli, and its relationship to the development of swimming and feeding functions // Ichthyol. Res. 1996. V. 43. P. 267–282.
Osse J.W.M., van den Boogaart J.G.M., van Snik G.M.J.,van der Sluys L.Priorities during early growth of fish larvae // Aquaculture. 1997. V. 155. P. 249–258.
Panov V.P., Safonova S.S., Orlov A.M., Artemenkov D.V.Histostructure of the locomotor apparatus in the three deep-water species of lanternfishes (Myctophidae): Myctophum punctatum, Notoscopeluskroyeri, and Lampanyctusmacdonaldi // J. Ichthyology. 2019. V. 59. P. 928–937).
Potthoff T., Kelley S., Collis L.A. Osteological development of the red snapper, Lutjanus campechanus (Lutjanidae) // Bull. Mar. Sci. 1988. V. 43. P. 1–40.
Proctor C., Mosse P.R.L., Hudson R.C.L. A histochemical and ultrastructural study of the development of the propulsive musculature of the brown trout, Salmo trutta L., in relation to its swimming behavior // J. Fish Biol. 1980. V. 16. P. 309–329.
Ramirez-Zarzosa G., GiP F., Latorre R., Ortega A., Garcia-Alcarfiz A., Abellfin E., Vfizquez J.M., Lopez-Albors O., Arencibia A., Moreno E. The larval developmen to flateralmusculatureingiltheadseabream Sparusaurataandseabass Dicentrarchuslabrax // Cell Tissue Res. 1995. V. 280. P. 217–224.
Ramirez-Zarzos G., Gil F., Vazquez J.M., Arencibia A., Latorre R., Lopez-Albors O., Ortega A., Moreno F. The post-larval development of lateral musculature in gilthead sea bream Sparus aurata (L.) and sea bass Dicentrarchuslabran (L.) // Anat. Histol. Embryol. 1998. V. 27. P. 21–29.
Rowlerson A., Scapolo P.A., Mascarello F., Carpene E., Veggetti A. Comparative study in myosins present in the lateral muscle in some fish; species variations in myosin isoforms and their distribution in red, pink and white muscle // J. Muscle Res. Cell. Mot. 1985. V. 6. P. 601–640.
Rowlerson A., Mascarello F., Radaelli G., Veggetti A. Differentiation and growth of muscle in the fish Sparus aurata (L): 11. Hyperplastic and hypertrophic growth of lateral muscle from hatching to adult // J. Muscle Res. Cell. Mot. 1995. V. 16. P. 223–236.
Sampaio K.H., Prado P.S., Sato Y., Bazzoli N., Rizzo E. Comparative morphology of the oocyte surface and early development in four Characiformes from the São Francisco River // J. Morph. 2015. V. 276. P. 1258–1272. https://doi.org/10.1002/jmor.20416
Snyder D.E., Snyder M.B.M., Douglas S.C. Identification of goldenshiner, Notemigonuscrysoleucas, spotfinshiner, Notropisspilopterus, and fathead minnow, Pimephalespromelas, larvae // J. Fish. Res. Bd. Can. 1977. V. 34. P. 1397–1409.
Stickland N.C., White R.N., Mescall P.E., Crook A.R., Thorpe J.E. The effect of temperature on myogenesis in embryonic development of the Atlanticsalmon (Salraosalar L.) // Anat. Embryol. 1988. V. 178. P. 253–257.
Taki Y., Kohno H., Hara S. Morphological aspects of the development of swimming and feeding functions in the milkfish chanoschanos // Jap. J. Ichthyol. 1987. V. 34. P. 198–208.
Valente L.M.P., Rocha E., Gomes E.F.S., Silva M.W., Olivereira M.H., Monteiro R.A.F., Fauconneau B. Growth dynamics of white and red muscle fibres in fast- and slowgrowing strains of rainbow trout // J. Fish Biol. 1999. V. 55. P. 675–691.
Van Raamsdonk W., van’t Veer L., Veeken K., Heyting C., Pool C.W. Differentiation of muscle fibre types in the teleost brachydaniorerio, the zebrafish posthatching development // Anat. Embryol. 1982. V. 164. P. 1–62.
Veggetti A., Mascarello F., Scapolo P.A., Rowlerson A. Hyperplastic and hypertrophic growth of lateral muscle in Dicentrarchuslabrax (L.). An ultrastructural and morphometric study // Anat. Embryol. 1990. V. 182 P. 1–10.
Veggetti A., Rowlerson A., Radaelli G., Arrighi S., Domeneghini C. Posthatching development of the gut and lateral muscle in the sole, Soleasolea (L) // J. Fish Biol. 1999. V. 55 (Suppl. A). P. 44–65.
Viera V.L.A., Johnston I.A. Influence of temperature on muscle-fibre development in larvae of the herring Clupea harengus // Mar. Biol. 1992. V. 112. P. 333–41.
Watson W. Larval development of the endemic Hawaiian blenniid, Enchelyurusbrunneolus (Pisces: Blenniidae: Omobranchini) // Bull. Mar. Sci. 1987. V. 41. P. 856–888.
Weatherley A.H., Gil, H.S. Growth dynamics of white myotomal muscle fibres in the bluntnose minnow, Pimephalesnotutus Ratinesque, and comparison with rainbow trout, Salmo guirdneri Richardson // J. Fish Biol. 1984. V. 25. P. 13–24.
Weatherley A.H., Gill H.S., Lobo A.F. Recruitment and maximal diameter of axial muscle fibres in teleosts and their relationship to somatic growth and ultimate size // J. Fish Biol. 1988. V. 33. P. 851–859.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая