Известия РАН. Серия биологическая, 2022, № 5, стр. 509-521
Гигантские клетки кортикальной глии в центральной нервной системе насекомых
А. А. Панов *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: tortrix@yandex.ru
Поступила в редакцию 06.12.2021
После доработки 23.02.2022
Принята к публикации 11.03.2022
- EDN: OAYGPN
- DOI: 10.31857/S1026347022050171
Аннотация
Клетки кортикальной глии расположены в слое тел нейронов мозга и ганглиев нервной цепочки. Существует, по крайней мере, два размерных класса кортикальной глии: мелкоклеточная и “гигантская”, имеющая большие, по-видимому, полиплоидные ядра. В результате обследования головного мозга у насекомых 152 видов из 13 отрядов насекомых с неполным и полным превращением установлено, что большинству исследованных насекомых свойственна мелкоклеточная кортикальная глия. Гигантская кортикальная глия состоит из предположительно полиплоидных клеток. Она характерна для чешуекрылых и ручейников, а также встречается у некоторых видов клопов, перепончатокрылых и жуков. Особый тип глии с политенными хромосомами в ядрах найден у исследованных двукрылых из надсемейства Muscoidea.
Глия является системой клеточных элементов внутри нервной системы, которая обеспечивает структурную стабильность и функционирование нервных клеток. Как и у других животных, глиальная система насекомых включает клетки, различающиеся морфологией, топографией и функциональными задачами. В современной литературе принято подразделение глиальных клеток насекомых на четыре основных типа: перинейриум, субперинейральная глия, кортикальная глия и нейропилярная глия, подразделяющаяся на обкладочную и астроцитоподобную глию. Кроме того, выделяют класс глиальных клеток, сопровождающих нервные волокна в корешках нервов (Edwards, Meinertzhagen, 2010; Freeman, 2015). Иногда при классификации клеток глии учитываются и более второстепенные характеристики, и тогда число выделяемых типов глиальных клеток может возрастать в несколько раз, например до 14 в первом грудном ганглии табачного бражника Manduca sexta (Cantera, 1993).
Кортикальная глия, о которой пойдет речь в данной статье, представляет собой собрание глиальных клеток, приуроченное к слою тел нейронов мозга и туловищных ганглиев. Ей приписываются две основные функции: формирование опорного остова, в который заключены тела нейронов, и выполнение ряда метаболических функций (Freeman, 2015). Это особенно очевидно в случае крупных тел мотонейронов, у которых формируется “трофоспонгий”, система впячиваний плазматической мембраны тел нейронов, в которые входят тонкие отростки клеток кортикальной глии (Wigglesworth, 1959).
Только для дрозофилы разработаны молекулярно-генетические методы селективного выявления клеток кортикальной глии (Awasaki et al., 2008). Для других насекомых эти методы неприменимы, и при обычных гистологических методах окраски отчетливо выявляются только ядра клеток и какая-то часть околоядерной цитоплазмы. Поэтому топографические и морфологические характеристики клеток кортикальной глии дают преимущественно на основе их ядер.
Известно существование, по крайней мере, двух размерных типов клеток кортикальной глии. Клетки с небольшими округлыми или овальными ядрами поперечником в несколько микронов были найдены, например, у Periplaneta americana (Scharrer, 1939) и Drosophila melanogaster (Hartenstein et al., 2008). С другой стороны, у ряда насекомых были обнаружены “гигантские” клетки с большими полиморфными ядрами, которые, судя по их положению, могли быть отнесены к кортикальной глии. Среди насекомых с неполным превращением такие клетки были обнаружены у клопа Rhodnius prolixus (Wigglesworth, 1959), а среди представителей Holometabola – у медоносной пчелы (Weyer, 1931; Risler, 1954), двух видов жуков (De Lerma, 1949), комнатной мухи (Grandori et al., 1951) и нескольких видов чешуекрылых (Schrader, 1938; Панов, 1963; Nordlander, Edwards, 1969; Cantera, 1993). При этом для некоторых видов были указаны размеры ядер гигантских клеток: до 90 мкм у Hydrous piceus (De Lerma, 1949), 60 × 15 мкм у клопа-родниуса, но только 35 мкм у Oncopeltus fasciatus и до 30 мкм у комнатной мухи (Grandori et al., 1951).
Тем не менее, данные работы не позволяют достаточно объективно оценить степень распространения данного явления в классе насекомых. Поэтому цель работы – поиск гигантских кортикальных клеток у возможного более широкого круга насекомых и выявление их особенностей у разных представителей класса. Учитывая данные предыдущих исследований, мы определили условную размерную границу между “мелкими” и “гигантскими” ядрами клеток кортикальной глии на уровне ~30 мкм. Обследование проводили в надглоточном и подглоточном ганглиях за исключением зрительных долей, в которых система глиальных клеток построена особым образом и рассматривается отдельно от таковой “центрального” мозга (Nordlander, Edwards, 1969; Tix et al., 1997).
МАТЕРИАЛЫ И МЕТОДЫ
Исследованы серии срезов головного мозга 152 видов из 13 отрядов насекомых с неполным и полным превращением из коллекции препаратов автора (табл. 1). Насекомые были собраны в течение длительного срока экспедиционных и лабораторных работ автором и сотрудниками-энтомологами ИПЭЭ РАН. Надрезанные насекомые были зафиксированы в жидкости Буэна, вычлененные надглоточные ганглии залиты в парапласт, а серии срезов толщиной 7–10 мкм окрашены железным гематоксилином Гейденгайна (Ромейс, 1953), после которого хорошо видны ядра глиальных клеток. Именно по их положению и была проведена идентификация различных типов глиальных клеток.
Таблица 1.
Список исследованных видов
| Отряд | Семейство | Вид |
|---|---|---|
| Ephemeroptera | Heptageniidae | Ecdyonurus submontanus L. |
| Palingeniidae | Palingenia fuliginosa G. | |
| Ephemerellidae | Ephemerella ignita P. | |
| Blattodea | Blattidae | Periplaneta americana L. |
| Blaberidae | Nauphoeta cinerea Oliv. | |
| Orthoptera | Tettigoniidae | Tettigonia viridissima L. Sepiana sepium Jers. |
| Gryllidae | Acheta domesticus L. | |
| Phasmatodea | Phasmatidae | Extatosoma tiaratum Mac. Medauroidea extradentata Br. |
| Heteropterygidae | Sungaria inexpectata Z. | |
| Lonchodidae | Carausius morosus S. | |
| Dermaptera | Forficulidae | Forficula auricularia L. Anechura japonica De Borman |
| Labiduridae | Labidura riparia Pall. | |
| Homoptera | Cicadidae | Cicada orni L. Lyristes plebejus Scopoli Melampsalta musiva Germar |
| Heteroptera | Notonectidae | Notonecta glauca L. |
| Nepidae | Nepa cinerea L. | |
| Naucoridae | Ilyocoris cimicoides L. | |
| Reduviidae | Rhodnius prolixus Stål. Triatoma infestans Klug. Triatoma maculata Erichson |
|
| Coreidae | Coreus marginatus L. Enoplops scapha Fabr. |
|
| Rhopalidae | Corizus hyoszyami L | |
| Pentatomidae | Dolycoris baccarum L. Palomena prasina L. Perillus bioculatus Fabr. |
|
| Scutelleridae | Eurygaster integriceps Put. | |
| Pyrrhocoridae | Dysdercus koenigii Fabr. Dysdercus volkeri Schmidt Pyrrhocoris apterus L. |
|
| Stenocephalidae | Dicranocephalus agilis Scop. | |
| Neuroptera | Chrysopidae | Chrysopa perla L. |
| Coleoptera | Carabidae | Carabus nemoralis Müll. |
| Hydrophilidae | Hydrophilus piceus L. Hydrobius fuscipes L. Sphaeridium scarabaeoides L. |
|
| Silphidae | Nicrophorus vespilloides Hbst. | |
| Tenebrionidae | Tenebrio molitor L. | |
| Cerambycidae | Morimus funereus Mulsant | |
| Coleoptera | Geotrupidae | Geotrupes stercorarius L. Geotrupes puncticollis Malinovsky |
| Passalidae | sp. indet. | |
| Trogidae | Trox eximius Fald. | |
| Lucanidae | Lucanus cervus L. Lucanus ibericus Motsch. Prismognathus angularis C.O. Waterhouse |
|
| Glaphyridae | Amphicoma vulpes Fabr. | |
| Scarabaeidae-Aphodiinae | Aphodius fossor L. Aphodius rufipes L. Aphodius rectus Motsch. |
|
| Scarabaeidae-Scarabaeinae | Gymnopleurus mopsus Pall. Copris lunaris L. Caccobius schreberi L. Oniticellus fulvus Gz. Onthophagus speculifer Solsky Scarabaeus carinatus Gebler |
|
| Scarabaeidae-Melolonthinae | Serica brunnea L. Miltotrogus aequinoctialis Hbst. Amphimallon volgensis Fischer Hoplia parvula Krynicki Melolontha hippocastani Fabr. Polyphylla fullo L. Anoxia pilosa Fabr. |
|
| Scarabaeidae-Rutelinae | Phyllopertha horticola L. Adoretus nigrifrons Stev. Anisoplia agricola Poda. |
|
| Scarabaeidae-Dynastinae | Oryctes nasicornis L. Pentodon algerinum bispinifrons Reitter |
|
| Scarabaeidae-Cetoniinae | Trichius fasciatus L Cetonia aurata L. Protaetia metallica Herbst Oxythyrea funesta Poda. Tropinota hirta Poda. |
|
| Hymenoptera | Diprionidae | Neodiprion sertifer Geoffr. |
| Crabronidae | Bembix sp. | |
| Sphecidae | Ammophila sp. | |
| Chrysididae | Chrysis ignita L. | |
| Vespidae | Vespa crabro L. | |
| Apidae | Apis mellifera L. Xylocopa sp. |
|
| Formicidae | Formica rufa L. | |
| Trichoptera | Limnephilidae | Limnephilus rhombicus L. Limnephilus flavicornis Fabr. Glyphotaelius pellucidus Retz. |
| Phryganeidae | Phryganea grandis L. | |
| Lepidoptera | Yponomeutidae | Yponomeuta padella L. |
| Nymphalidae | Aglias io L. Apatura ilia Den. et Schiff. |
|
| Lasiocampidae | Malacosoma neustria L. | |
| Bobycidae | Bombyx mori L. | |
| Saturniidae | Saturnia pavonia L. Antheraea pernyi Guér. Hyalophora cecropia L. |
|
| Sphingidae | Laothoe populi L. | |
| Notodontidae | Cerura vinula L. | |
| Noctuidae | Agrotis segetum Den. et Schiff. Agrotis exclamationis L. |
|
| Erebidae | Spilosoma lubricipedia L. Hyphantria cunea Drury Lymantria dispar L. |
|
| Diptera | Tipulidae | Tipula peliostigma Schummel Tipula truncorum Meig. Nephrotoma tenuipes Riedel |
| Pediciidae | Pedicia rivosa L. | |
| Limoniidae | Limonia quadrimaculata L. Epiphragma ocellare L. |
|
| Ptychopteridae | Ptychoptera contaminate L. | |
| Anisopodidae | Sylvicola fenestralis Scopoli Sylvicola punctatus Fabr. |
|
| Bibionidae | Bibio marci L. | |
| Bombyliidae | Hemipenthes maura L. | |
| Asilidae | Dasypogon diadema Fabr. Stenopogon sabaudus Fabr. |
|
| Therevidae | Thereva nobilitata Fabr. | |
| Rhagionidae | Rhagio tringarius L. | |
| Stratiomyidae | Sargus cuprarius L. | |
| Xylomyidae | Xylomyia czekanovskii Pleske | |
| Tabanidae | Haematopota pluvialis L. | |
| Xylophagidae | Coenomyia ferruginea Scop. | |
| Dolichopodidae | Dolichopus brevipennis Meig. | |
| Empididae | Empis tesselata Fabr. Empis stercorea L. |
|
| Syrphidae | Epistrophe nitidicollis Meig. Eristalis sp. |
|
| Conopidae | Sicus abdominalis Kröber | |
| Lauxaniidae | Minettia longipennis Fabr. | |
| Dryomyzidae | Dryomyza anilis Fall. | |
| Diptera | Sciomysidae | Sepedon sphegea Fabr. Ilione rossica Mayer |
| Sepsidae | Nemopoda nitidula Fall. | |
| Psilidae | Psila fimetaria L. | |
| Glossinidae | Glossina morsitans Westw. Glossina pallidipes Austen |
|
| Fanniidae | Fannia scalaris Fabr. | |
| Muscidae | Hydrotaea ignava Harris Potamia littoralis R.-D. Muscina prolapsa Harris Muscina stabulans Fall. Muscina levida Harris Musca domestica L. |
|
| Scatophagidae | Scatophaga stercoraria L. | |
| Calliphoridae | Calliphora vomitoria L. Calliphora vicina R.-D. Calliphora uralensis Vill. Lucilia sericata Meig. Phormia regina Meig. |
|
| Sarcophagidae | Sarcophaga sp. | |
| Tachinidae | Tachina fera L. |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У исследованных поденок, тараканов, прямокрылых, палочников, уховерток и цикад (табл. 1) в слое тел нейронов головного мозга кортикальная глия была представлена только мелкими угловатыми клетками с округлыми или эллипсоидными ядрами, содержавшими хроматин в виде интенсивно окрашивавшихся зерен. Поперечник ядер был сопоставим с диаметром ядер соседних нейронов или был даже меньше него (рис. 1а, табл. 2). При использованном способе окраски препаратов цитоплазму либо вообще не выявляли, либо она была видна в виде тонких темно-окрашенных тяжиков, отходящих от околоядерной области и идущих между телами нейронов. Таким образом, клетки кортикальной глии видов насекомых указанных групп были подобны таковым, описанным ранее у американского таракана (Scharrer, 1939).
Рис. 1.
Клетки кортикальной глии в головном мозге насекомых. (а) – Acheta domesticus, (б) – Rhodnius prolixus; (в) – Triatoma maculatа; (г) – Triatoma infestans; (д) – Coreus marginatus; (е) – Chrysopa perla. CG – ядра кортикальной глии, GCG – “гигантские” ядра кортикальной глии, GCGc – цитоплазма “гигантских” клеток кортикальной глии, KC – клетки Кеньона грибовидных тел, TR – ядро трахеобласта: для рис. 1–3. Масштаб (рис. 1–3) – 10 мкм.
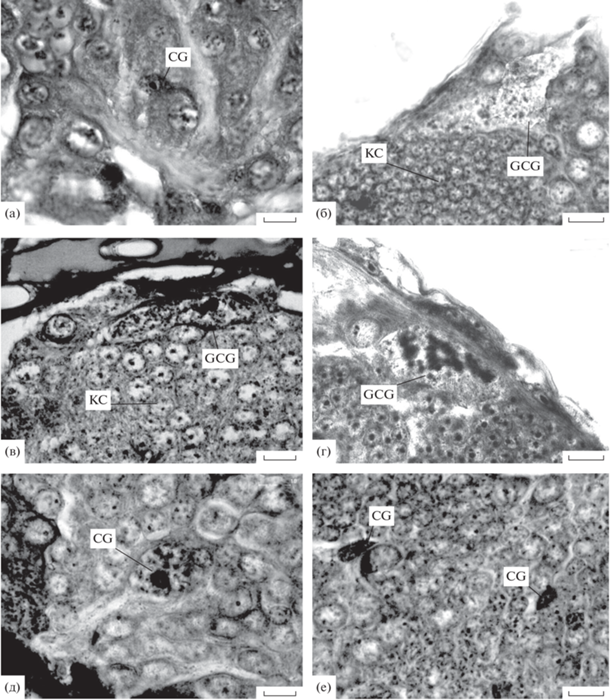
Таблица 2.
Максимальный размер сечений ядер кортикальной глии (виды насекомых с “гигантскими” ядрами кортикальной глии выделены жирным шрифтом)
| Вид насекомого | Размер в мкм, округлено до 1 мкм |
|---|---|
| Acheta domesticus | 8 |
| Rhodnius prolixus | 53 |
| Triatoma infestans | 40 |
| T. maculata | 54 |
| Geotrupes stercorarius | 16 |
| Protaetia metallica | 15 |
| Trox eximius | 10 |
| Amphimallon volgensis | 12 |
| Anoxia pilosa | 18 |
| Phyllopertha horticola | 23 |
| Passalidae | 40 |
| Polyphylla fullo | 30 |
| Apis mellifera | 65 |
| Lymantria dispar | 72 |
| Limnephilus flavicornis | 49 |
| Muscina stabulans | 27 |
| Hydrotaea ignava | 28 |
| Lucilia sericata | 9 |
| Sarcophaga sp. | 16 |
| Limonia quadrimaculata | 14 |
Поскольку у клопа R. prolixus было отмечено существование гигантской кортикальной глии, представители отряда Heteroptera были исследованы подробнее. Всего в нашем распоряжении были срезы надглоточного ганглия клопов 17 видов из 10 семейств (табл. 1). Из этого состава только у 3 видов семейства Reduviidae в слое тел нейронов мозга были найдены гигантские глиальные ядра. Во-первых, они были найдены у R. prolixus, что подтверждает их существование в центральной нервной системе (цнс) этого клопа (Wigglesworth, 1959). Однако в их мозге, по-видимому, меньше, чем в исследованном Уигглсуорсом туловищном синганглии. Так, они были обнаружены только в дорсальном протоцеребруме, где их ядро, заполненное зернистым хроматином, окружало в виде шапочки собрание клеток Кеньона грибовидного тела (рис. 1б). Во-вторых, характерные гигантские ядра, были также найдены в мозге Triatoma infestans и Triatoma maculata. Помимо ядер, отделявших клетки Кеньона от соседних нейронов, в клеточном слое мозга обоих видов Triatoma имелись и другие гигантские ядра. Распределение и структура хроматина внутри гигантских ядер у указанных видов оказалось различным. У родниуса хроматиновые зерна были более мелкими (рис. 1б), а у видов Triatoma хроматин был собран в глыбки, более мелкие у T. maculata (рис. 1в) и более крупные у T. infestans (рис. 1г).
У клопов 14 других исследованных видов, представлявших 8 семейств, гигантские ядра в кортикальном слое головного мозга обнаружены не были. Только у 3 видов (Dicranocephalus agilis из сем. Stenocephalidae и Enoplops scapha и Coreus marginatus – оба из сем. Coreidae) размер некоторых ядер клеток кортикальной глии был несколько увеличенным, но не превосходил условную границу, разделяющую “мелкие” и “гигантские” клетки кортикальной глии (рис. 1д).
В крайне таксономически разнообразном отряде сетчатокрылых был обследован только мозг имаго Chrysopa perla. В клеточной коре среди тел нейронов были обнаружены только угловатые ядра с зернистым хроматином, сопоставимые по величине с ядрами соседних нейронов (рис. 1е).
У жуков размеры ядер клеток кортикальной глии оказались очень разными. Так, было подтверждено существование у большого водолюба “гигантских” ядер кортикальной глии, впервые описанных де Лермой (De Lerma, 1949). Однако у Hydrobius fuscipes и Sphaeridium scarabaeoides из того же семейства водолюбов, равно как и у Nicrophorus vespilloides из семейства Silphidae клетки кортикальной глии были мелкими. Также небольшими размерами характеризовались клетки кортикальной глии у изученных представителей жужелиц, чернотелок и усачей.
Чтобы выяснить, имеется ли связь размера клеток кортикальной глии с таксономическим положением вида, были исследованы надглоточные ганглии жуков 34 видов из 5 семейств надсемейства Scarabaeoidea (табл. 1). В целом, за некоторыми исключениями, “низшие” скарабеоиды имеют клетки кортикальной глии малого размера (рис. 2а). Исключениями являются представители Passalidae (табл. 2) и Glaphyridae. У неопределенного представителя пассалид из южного Вьетнама среди тел нейронов клеточной коры встречались крупные ядра глиальных клеток, сечения которых достигали в длину ~40 мкм (рис. 2б). У Amphicoma vulpes сечения ядер кортикальных глиальных клеток существенно различались по величине: среди тел нейронов можно было увидеть как мелкие ядра, так и ядра с поперечником, равным приблизительно трем диаметрам соседних нейронов.
Рис. 2.
Клетки кортикальной глии в головном мозге насекомых (продолжение). (а) – Geotrupes stercorarius; (б) – не определенный жук из сем. Passalidae; (в) – Amphimallon volgensis; (г) – Polyphylla fullo; (д) – Apis mellifera; (е) – Lymantria dispar.
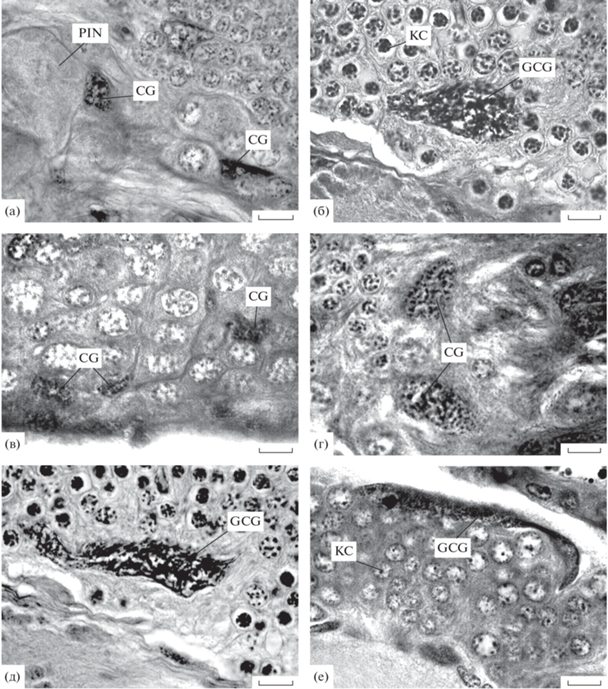
Среди представителей сем. Scarabaeidae исследованные виды п/сем. Aphodiinae и Scarabaeinae характеризуются мелкими клетками кортикальной глии. Также и у значительной части растительноядных скарабеид кортикальные клетки были мелкими (Serica brunnea, Miltotrogus aequinoctialis, Amphimallon volgensis, Hoplia parvula, Adoretus nigrifrons, Pentodon algerinum bispinifrons, Trichius fasciatus, Oxythyrea funesta, Tropinota hirta) (рис. 2в), а у меньшей части (Melolontha hippocastani, Polyphylla fullo, Anoxia pilosa, Phylopertha horticola, Anisoplia agricola, Pentodon algerinum bispinifrons, Cetonia aurata, Protaetia metallica) – средними по величине Наиболее крупные ядра были найдены у P. fullo и A. pilosa (рис. 2г, табл. 2). Однако ни в одном случае не были обнаружены “настоящие” гигантские клетки, которые будут далее описаны у чешуекрылых.
Для исследованных перепончатокрылых, в основном, характерными оказались мелкие клетки кортикальной глии. Исключение представляет лишь медоносная пчела, у которой в клеточной коре мозга некоторых экземпляров были обнаружены более крупные глиальные ядра (рис. 2д).
У единственного обследованного представителя скорпионниц, Panorpa communis, кортикальная глия оказалась мелкоклеточной.
Чешуекрылые – отряд насекомых, у представителей которого, как уже отмечалось, наличие гигантских полиморфных ядер в слое тел нейронов мозга и туловищных ганглиев было продемонстрировано наиболее убедительно. Чтобы проверить предположения о гигантизме клеток кортикальной глии как о черте, характерной по крайней мере для высших чешуекрылых в целом, в настоящей работе были исследованы срезы головного мозга чешуекрылых 15 видов из 9 семейств (табл. 1). У всех экземпляров были встречены типичные для чешуекрылых гигантские ядра клеток кортикальной глии. Как и у ранее исследованных видов, они частично располагались под слоем субперинейральной глии, а частично – в глубине клеточной коры. Хроматин имел зернистую структуру и равномерно заполнял ядро, либо был собран в его середине. Имелись крупные ядрышки, но их, по-видимому, в ядрах было немного, поскольку они встречались не во всех сечениях ядер (рис. 2е).
Ближайшими родственниками чешуекрылых являются ручейники, которые вместе с ними образуют надотряд Amphiesmenoptera (Kiriakoff, 1948). Поэтому в связи с широким распространением у чешуекрылых гигантизма клеток кортикальной глии было интересно узнать характеристики кортикальной глии и у ручейников. В нашем распоряжении было три вида ручейников (табл. 1). У всех них в слое тел нейронов были обнаружены гигантские ядра, которые как бы отграничивали клеточную кору от оболочки мозга или внедрялись между телами нейронов, ничем не отличаясь по форме и структуре от гигантских ядер кортикальной глии чешуекрылых (рис. 3а, табл. 2).
Рис. 3.
Клетки кортикальной глии в головном мозге насекомых (продолжение). (а) – Limnephilus flavicornis; (б) – Hydrotaea ignava; (в) – Muscina stabulans; (г, д) – Muscina levida; (е) – Limonia quadrimaculata.
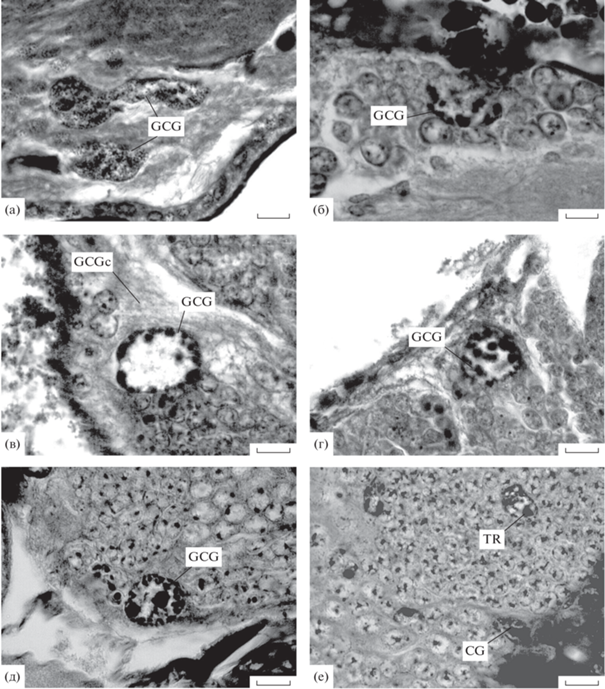
Для двукрылых в настоящее время известны два размерных типа клеток кортикальной глии: Drosophila-тип, характеризующийся малой величиной клеток и Musca-тип с крупными (“гигантскими”) глиальными клетками (Grandori et al., 1951). Мы также нашли в головном мозге комнатной мухи крупные округлые ядра с хроматиновыми глыбками, часто прилегающим к ядерной оболочке, и большим ядрышком. Эти ядра располагались в толще клеточной коры и около перинейриума. Вокруг них имелся слой волокнистой цитоплазмы, либо ядра были вплотную окружены телами соседних нейронов.
Помимо комнатной мухи, такие же ядра клеток кортикальной глии были нами найдены только у других представителей сем. Muscidae (табл. 1) (рис. 3б), а также у Fannia scalaris (Fanniidae) и Scatophaga stercoraria (Scatophagidae), т.е. у представителей семейств, входящих в надсемейство Muscoidea.
Наиболее подробно структура и расположение гигантских ядер кортикальной глии были изучены у трех видов Muscina. Как и у комнатной мухи, ядра встречались как на периферии слоя клеточной коры, так и внутри нее. У периферических ядер хорошо прослеживалась окружавшая их цитоплазма (рис. 3в). Ранее была отмечена пространственная связь гигантских ядер с вторичными нейробластами грибовидных тел (Панов, 2020).
У личинки 3-го возраста ядра кортикальной глии имели очень крупные ядрышки (рис. 3д), а средний поперечник ядер равнялся ~20 мкм. У предкуколок и куколок размер ядер увеличивался, а у имаго мог достигать почти 30 мкм. На всех стадиях развития ядра были округлыми и содержали одно ядрышко, размер которого был максимальным у личинок и уменьшался у куколок и имаго. На экваториальных сечениях ядер хроматин имел вид интенсивно окрашивавшихся, четко очерченных крупных глыбок, которые прилегали к оболочке ядра (рис. 3в). На тангенциальных срезах ядер, проходящих через их “горбушки”, было видно, что эти глыбки хроматина представляют собой фрагменты четковидных структур – политенных хромосом, (рис. 3г). У всех трех видов Muscina ни у личинок, ни в ходе метаморфоза не было найдено делений ядер клеток кортикальной глии.
У всех остальных 40 видов, относящихся к 27 семействам длинноусых и короткоусых двукрылых (табл. 1), кортикальная глия была мелкоклеточной (рис. 3е), а гигантские ядра кортикальной глии обнаружены не были.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование головного мозга 152 видов, представляющих 13 наиболее многочисленных по видовому составу отрядов класса насекомых, показало, что основным размерным типом кортикальной глии является мелкоклеточная глия, морфологические, функциональные и молекулярно-генетические характеристики которой исследованы в последние годы у дрозофилы (Hartenstein, 2011). В туловищном синганглии дрозофилы в эмбриональное время клетки кортикальной глии, 6–8 на нейромер, образуются в результате делений четырех нейроглиобластов (Altenhain, 2015). Такое же число клеток кортикальной глии сохраняется у поздних эмбрионов и новорожденных личинок, но потом клетки начинают митотически делиться, и их число существенно возрастает. У домового сверчка Acheta domesticus, также имеющего мелкоклеточную кортикальную глию, в нимфальное время ее клетки митотически делятся, как и клетки нейропилярной глии, в ритме линек. При этом пик митотической активности приходится на конец третьей – начало четвертой четверти межлиночного периода (Панов, 1962), когда у насекомых достигает пика титр линочного гормона.
Как показало настоящее исследование широкого круга насекомых, “гигантизм” кортикальной глии – явление, достаточно редко встречающееся либо у отдельных видов, либо характерное для систематических групп различного ранга. При этом можно выделить два типа гигантизма. Первый тип, который характеризуется очень большими ядрами сложной формы, заполненными многочисленными мелкими зернами хроматина, наиболее полно представлен у чешуекрылых. Впервые такие гигантские ядра были описаны у мельничной огневки (Schrader, 1938), однако автор посчитал их ядрами трахеолярных клеток. Позже у китайского дубового шелкопряда Antheraea pernyi в клеточном слое туловищных ганглиев и мозга были найдены гигантские ядра двух категорий, различавшихся по структуре. Одни из них, действительно, были ядрами трахеолярных клеток, тогда как другие – ядрами гигантских кортикальных глиальных клеток (Панов, 1963).
У эмбрионов дубового шелкопряда в момент образования нейрилеммы непосредственно под ней, а также среди тел нейронов, были обнаружены немногочисленные эллипсовидные ядра, которые на более поздних этапах эмбриогенеза начинали отличаться от ядер нервных клеток неправильными очертаниями и равномерным распределением в ядре зерен хроматина. Ни у эмбрионов, ни у гусениц не встречались деления этих ядер. Вместе с тем, они интенсивно росли, становясь у взрослых гусениц самыми крупными клеточными ядрами как в мозге, так и в туловищных ганглиях.
Удалось установить лишь один период деления гигантских глиальных клеток, приходившийся на первые дни куколочного развития. В это время в поверхностном слое ганглиев в довольно большом числе встречались фигуры огромных митозов на стадии метафазы (Панов, 1963).
Существование гигантских клеток кортикальной глии у чешуекрылых было затем подтверждено при изучении постэмбрионального развития нервной системы у бабочки-монарха Danaus plexippus plexippus. У него также было найдено, что гигантские кортикальные глиальные клетки растут, не делясь, в течение личиночного периода развития, но вступают в митоз в начале метаморфоза (Nordlander, Edwards, 1969). При этом, как у китайского дубового шелкопряда, так и у бабочки-монарха были встречены гигантские митозы только в метафазе. Поэтому дальнейшая судьба вступивших в митоз гигантских кортикальных глиальных клеток осталась неизвестной.
В переднегрудном ганглии табачного бражника были также обнаружены гигантские клетки кортикальной глии, которые в период метаморфоза вступали в митоз, причем наблюдались даже мультиполярные митозы. Одновременное увеличение числа гигантских ядер, сопровождавшееся уменьшением их размеров, позволило предположить, что кариокинез завершается формированием дочерних ядер (Cantera, 1993).
Существует большая литература по проблеме связи размеров ядер со степенью их плоидности, которая содержит свидетельства как наличия такой связи, так и ее отсутствия (Бродский, Урываева, 1981). В современных обзорах говорится о существовании такой связи (Edgar, Orr-Weaver, 2001). Большие размеры ядер гигантской кортикальной глии и обилие хроматинового материала в них позволили предположить их полиплоидную природу (Johansson, 1957; Панов, 1963; Nordlander, Edwards, 1969). Это предположение было подтверждено Нордлендер и Эдвардсом, наблюдавшими в личиночное время многократные циклы включения H3-тимидина в гигантские ядра кортикальной глии бабочки-монарха без их последующих делений.
Случаи инструментально доказанной полиплоидности клеток глии цнс насекомых единичны. Так, относительно недавно было обнаружено, что клетки субперинейральной глии D. melanogaster, входящей в состав гематоэнцефалического барьера, являются полиплоидными, и увеличение размера клеток субперинейральной глии в результате полиплоидизации необходимо для поддержания в целостности межклеточных соединений, образующих гематоэнцефалический барьер. (Unhavaithaya, Orr-Weaver, 2012). В цнс имаго дрозофилы было обнаружено увеличение числа клеток с содержанием ДНК от 4С до более чем 16С по мере старения насекомого. При идентификации типа клеток в препаратах диссоциированной центральной нервной системы с помощью молекулярных маркеров было обнаружено, что за 2 нед. имагинальной жизни 6–7% глиальных клеток в целом начинают содержать более 2С ДНК (Nandakumar et al., 2020).
Деления полиплоидных клеток были найдены в кишечнике личинок двукрылых. Фокс с сотр. (Fox et al., 2010) обнаружили митотические деления октоплоидных клеток в задней кишке метаморфизирующей личинки дрозофилы, и на этом основании они сделали вывод, что вступление клеток в эндоцикл не является необратимым и не исключает возможности их последующего размножения с помощью митоза. По-видимому, это справедливо и для предположительно высокополиплоидных клеток кортикальной глии чешуекрылых, описанных в данной работе.
Вторым, особым видом полиплоидии является политения. В этом случае возникающие в ходе повторяющихся эндоциклов хромонемы не расходятся, а остаются тесно связанными, в результате чего формируются гигантские политенные хромосомы (Stormo, Fox, 2017). Политенными являются клетки ряда внутренних органов некоторых видов двукрылых и других насекомых (Бродский, Урываева, 1981).
На гистологических срезах политенные хромосомы обычно выглядят как крупные интенсивно окрашенные глыбки хроматина, плотно прилегающие к ядерной оболочке. Только на поверхностных сечениях ядер бывает видно, что эти глыбки объединены в четковидные цепочки – политенные хромосомы. До сих пор имелось только одно свидетельство присутствия политенных клеток в нервной системе насекомых. У Drosophila virilis политенные ядра были найдены в давленых препаратах туловищного синганглия личинки, однако их принадлежность к какому-либо определенному типу клеток установлена не была (Makino, 1938). Фактически политенные хромосомы у глиальных клеток комнатной мухи было впервые описаны Грандори с соавт. (Grandori et al., 1951), однако как таковые они квалифицированы не были. В высшей степени вероятное их присутствие в ядрах клеток кортикальной глии у нескольких видов мускоидных двукрылых – третий случай обнаружения политенных клеток в центральной нервной системе насекомых.
У насекомых большинство органов, содержащих клетки с политенными хромосомами, являются “личиночными”, дегенерирующими в ходе метаморфоза. Исключение составляют только мальпигиевы сосуды и трофоциты яичников (Бродский, Урываева, 1981). К таким переживающим метаморфоз структурам с политенными хромсомами относятся, очевидно, и клетки кортикальной глии, описанные у мускоидных двукрылых в настоящей работе. При этом ни в одном случае у них не было отмечено митозов в ходе постэмбрионального развития. Невозможность или большая редкость вхождения клеток с политенными хромосомами в митотический цикл объясняется особенностями структуры политенных хромосом и ошибками при редупликации генома в клетках этого типа (Edgar, Orr-Weaver, 2001)
Проведенная работа лишь обрисовывает общую картину распространения в кортикальной глии насекомых гигантизма клеток и, вероятнее всего, лежащей в ее основе их полиплоидности. Остается неизвестным, почему в отдельных группах насекомых разного таксономического ранга (от подсемейственного и до надотрядного) происходит переход от пролиферации исходных клеточных элементов к значительному росту клеток кортикальной глии без их умножения. Обычно считается, что при полиплоидизации, ведущей к росту клеток и увеличению их синтетических потенций, происходит экономия времени и средств по сравнению с ростом за счет пролиферации (Бродский, Урываева, 1981). По сравнению с митотическими циклами, сопровождающимися разрушением ядерной оболочки, формированием веретена, цитокинезом, восстановлением ядерной оболочки и проч., при эндорепликации сохраняются структура и специфическое функционирование полиплоидизирующихся клеток. Так, необходимостью непрерывного специфического функционировнния объясняется, например, полиплоидизация у дрозофилы клеток субперинейральной глии, формирующей гематоэнцефалический барьер (Unhavaithava, Orr-Weaver, 2012).
Что же касается кортикальной глии, то функциональные и морфогенетические причины случаев ее гигантизма и предполагаемой полиплоидной природы остаются неизвестными. Интересно отметить, что нейропилярная глия всегда бывает мелкоядерной. Остается неясным, связан ли гигантизм кортикальной глии с общей тенденцией морфогенетических процессов в нервной системе насекомых той или иной группы. О возможности существования такой связи говорят лишь единичные находки. Например, при исследовании состава мозговых нейросекреторных клеток были выделены 2 группы насекомых. У насекомых первой группы число нейросекреторных клеток росло в течение постэмбрионального развития за счет деятельности нейробластов. У насекомых второй группы медиальные нейросекреторные клетки головного мозга были относительно малочисленны, и их число, в основном, стабилизировалось уже к началу постэмбриогенеза. Интересно отметить, что у исследованных насекомых первой группы нейросекреторные клетки оставались диплоидными, а у имаго одного из насекомых второй группы они оказались тетраплоидными (Панов, Маршак, 1968). Именно насекомые с гигантскими клетками кортикальной глии входят в состав насекомых со стабильным составом медиальных нейросекреторных клеток головного мозга.
Список литературы
Бродский В.Я., Урываева И.В. Клеточная полиплоидия. Пролиферация и дифференцировка. М.: Наука, 1981. 259 с.
Панов А.А. Характер размножения клеток в центральной нервной системе нимфы домового сверчка (Gryllus domesticus L., Orthoptera) // ДАН СССР. 1962. Т. 143. № 2. С. 471–474.
Панов А.А. Происхождение и судьба нейробластов, нейронов и клеток нейроглии в центральной нервной системе китайского дубового шелкопряда Antheraea pernyi Guér. (Lepidoptera, Attacidae) // Энтомол. Обозр. 1963. Т. 42. Вып. 2. С. 337–350
Панов А.А., Маршак Т.Л. Онтогенез медиальных нейросекреторных клеток насекомых и количество ДНК в их ядрах // ДАН СССР. 1968. Т. 183. № 5. С. 1193–1196.
Панов А.А. Десятки на смену четырем: два поколения нейральных прогениторов в развивающихся грибовидных телах Muscina prolapsa Harris (Diptera, Muscidae) // Зоол. журн. 2020 Т. 99. № 8. С. 911–918.
Ромейс Б. Микроскопическая техника. М.: Изд-во иностр. лит., 1953. 718 с. (Romeis B. Mikroskopische Technik. München: Leibnitz-Verlag [R. Oldenbourg-Verlag]. 1948. 695 s.)
Altenhein B. Glial cell progenitors in the Drosophila embryo // Glia. 2015. V. 63. P. 1291–1302.
Awasaki T., Lai S.-L., Ito K., Lee T. Organization and postembryonic development of glial cells in the adult central brain of Drosophila // J. Neurosci. 2008. V. 28. Issue 51. P. 13742–13753.
Cantera R. Glial cells in adult and developing prothoracic ganglion of the hawk moth Manduca sexta // Cell Tiss. Res. 1993. V. 272. P. 93–108.
De Lerma B. Sulla presenza di cellule giganti nel cerebron e nella massa gangliare sottoesofagea dei Coleotteri // Italian J. Zool. 1949. V. 16. Issue 4–6. P. 169–177.
Edgar B.A., Orr-Weaver T.L. Endoreplication cell cycles: more for less // Cell. 2001. V. 195. 297–306.
Edwards T.N., Meinertzhagen I.A. The functional organisation of glia in the adult brain of Drosophila and other insects // Prog. Neurobiol. 2010. V. 90. Issue 4. P. 471–497.
Fox D.T., Gall J.G., Spradling A.C. Error-prone polyploid mitosis during normal Drosophila development // Gen. Dev. 2010. V. 24. P. 2294–2302.
Freeman M.C. Drosophila central nervous system glia // Cold Spring Harbor Perspect Biol. 2015. V. 7: a020552
Grandori R., Grandori L., Caré E. Sulla presenza cli cellule giganti nel sistema nervoso centrale di Musca domestica L. // Boll. Zool. Agr. Bach. 1951. V. 17. P. 93–99.
Hartenstein V. Structure and development of glia in Drosophila // Glia. 2011. V. 59. Issue 9. P. 1237–1252
Hartenstein V., Spindler S., Pereanu W., Fung S. The development of the Drosophila larval brain / Brain development in Drosophila melanogaster (G.M. Technau, ed.). Chapt.1. N.Y.: Springer Science, 2008. P. 1–31.
Johansson A.S. The nervous system of the milkweed bug, Oncopeltus fasciatus (Dallas) (Heteroptera, Lygaeidae) // Transact. Amer. Entomol. Soc. 1957. V. 83. № 3. P. 119–183.
Kiriakoff S.G. A classification of the Lepidoptera and related groups with some remarks on taxonomy // Biologisch Jaarbock. 1948. V. 15. P. 118–143.
Makino S. A morphological study of the nucleus in various kinds of somatic cells of Drosophila virilis // Cytologia. 1938 V. 9. P. 272–282.
Nandakumar S., Grushko O., Buttitta L.A. Polyploidy in the adult Drosophila brain // eLife. 2020.V. 9. e 54385
Nordlander R., Edwards J.S. Postembryonic brain development in the monarch butterfly, Danaus plexippus plexippus L. I. Cellular events during brain morphogenesis // Wilhelm Roux’ Arch. Entwickl. Mech. Org. 1969. Bd. 162. H. 3. S. 197–217.
Ris1er H. Die somatische Polyploidie in der Entwicklung der Honigbiene (Apis mellifica) // Z. Zellforsch. 1954. V. 41. H. 1. S. 1–78.
Scharrer B. Differentiation between the neuroglia and connective tissue sheath in the cockroach Periplaneta americana // J. Comp. Neurol. 1939. V. 70. Iss. 1. P. 77–88.
Schrader K. Untersuchungen über die Normalentwicklung des Gehirns und Gehirntransplantationen bei der Mehlmotte Ephestia kühniella Zeller nebst einigen Bemerkungen über das Corpus allatum // Biol. Zbl. 1938. Bd. 58. S. 52–90.
Stormo B.M., Fox D.T. Polyteny: still a giant player in chromosome research // Chromosome Res. 2017. V. 25. Issue 3–4. P. 201–214.
Tix S., Eule E., Fischbach K.F., Benzer S. Glia in the chiasms and medulla of the Drosophila melanogaster optic lobes // Cell Tissue Research. 1997. V. 289. Issue 3. P. 397–409.
Unhavaithaya Y., Orr-Weaver T.L. Polyploidization of glia in neural development links tissue growth to blood–brain barrier integrity // Gen. Dev. 2012. V. 26. P. 31–36.
Weyer F. Cytologische Untersuchungen am Gehirn alternder Bienen und die Frage nach der Alterstod // Z. Zellforsch. 1931. Bd. 14. S. 1–54.
Wigglesworth V.B. The histology of the nervous system of an insect, Rhodnius prolixus (Hemiptera). II. The Central Ganglia // Quart. J. Micr. Sci. 1959. V. 100. Issue 2. P. 299–313.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


