Известия РАН. Серия биологическая, 2022, № 5, стр. 451-469
Наноматериалы для направленного изменения параметров электрохимических биосенсоров и биотопливных элементов
Ю. В. Плеханова 1, *, А. Н. Решетилов 1
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, ФГБУН “ФИЦ ПНЦБИ РАН”
142290 Московская обл., Пущино, проспект Науки, 5, Россия
* E-mail: plekhanova@ibpm.pushchino.ru
Поступила в редакцию 02.04.2021
После доработки 10.06.2021
Принята к публикации 10.06.2021
- EDN: BDSPKK
- DOI: 10.31857/S1026347022040126
Аннотация
Представлены обобщения последних достижений в области создания биосенсоров (БС) и биотопливных элементов (БТЭ) при использовании наноматериалов (НМ). НМ рассматриваются как элементы, способные изменять характеристики биораспознавания за счет взаимодействия с биоматериалом. Основные эффекты НМ обусловлены их способностью увеличивать электропроводность и эффективную поверхность биорецепторной части. Суммированы представления, полученные отечественными и зарубежными учеными, о возможных механизмах действия НМ. Рассмотрены перспективы применения НМ при создании БС и БТЭ.
В последнее десятилетие появилось огромное количество данных, связанных с использованием наноматериалов (НМ) в различных областях человеческой деятельности, в том числе и при создании биосенсоров (БС) и биотопливных элементов (БТЭ). Задача рассмотреть все описанные типы НМ и привести в единую систему их взаимодействия с биоматериалами (БМ) достаточно сложна, тем не менее в настоящее время общие закономерности уже стали проявляться, поскольку в основном определен тип БМ, используемый в БС и БТЭ.
Показано, что применение НМ в биоэлектрохимических системах приводит к уменьшению сопротивления электродов, т.е. к облегчению передачи заряда от биорецептора к электроду, росту амплитуды полезного сигнала, увеличению полезной площади электрода и т.п. (Kumar et al., 2018; Kucherenko et al., 2019; Hwang et al., 2020). Использование НМ ведет к созданию электродов, содержащих мембраны с определенными размерами и формой пор, необходимой механической гибкостью, прочностью, улучшенными адгезионными свойствами, гидрофильностью/гидрофобностью, наличием определенных функциональных групп на их поверхности (Plachá, Jampilek, 2019; Arora, Attri, 2020). НМ позволяют реализовать общую тенденцию, которая определяется словами “макро-микро-нано” (Решетилов и др., 2020), подразумевая создание новых БС и БТЭ все более малого размера. Один из первых примеров движения в данном направлении можно найти в работе Карубе (Sasaki, Karube, 1999). В ней была показана возможность создавать миниатюрные, по меркам того времени, системы множественного БТЭ, содержащего 25 одиночных элементов и имеющего размер 40 × 50 мм2. Настоящее время характеризуется продолжением разработок по снижению размеров БС и БТЭ. Описано формирование функциональных наноэлементов (использовали золотые проволоки с наночастицами (НЧ) золота), на основе которых создаются контактные линзы (Falk et al., 2013), вживляемые в организм крыс (Andoralov et al., 2013); БТЭ на основе многостенных углеродных нанотрубок (МУНТ), которые вживляются в кролика (El Ichi-Ribault et al., 2018) или в форме татуировки наносятся на кожу человека (Escalona-Villalpando et al., 2019). Рассматривая процесс “макро-микро-нано” отметим, что высокоактуальным в настоящее время является разработка медицинских систем, получивших название point-of-care technologies (POCT), которые можно определить как анализирующие устройства, расположенные рядом или на поверхности организма пациента (Gonzalez-Solino, Lorenzo, 2018; Sun et al., 2021). Для указанной цели широко используются НМ, значительно расширяющие аналитические возможности исследователей и практикующих врачей.
Целью данного обзора является представление данных, описывающих влияние различных типов НМ на свойства биораспознающих элементов электрохимических БС и БТЭ; оценка интегральной возможности изменения биоэлектрохимических параметров и характеристик биораспознающих элементов, обусловленных присутствием НМ.
НАНОМАТЕРИАЛЫ: ТИПЫ. ПРИМЕНЕНИЕ. СВОЙСТВА
По определению, к НМ относят объекты, размер которых заключен в диапазоне 1.0–100 нм (Miernicki et al., 2019; Sheikhzadeh et al., 2020). Обладая уникальными свойствами, отличающимися от аналогичных свойств материалов микро- и макроразмеров, они находят все новые области применения. Постоянно происходит развитие методов их получения, а также изменения их свойств с помощью различных (химических, механических и др.) воздействий. Выяснено, что свойства НМ зависят от их природы, размера и формы, метода их получения.
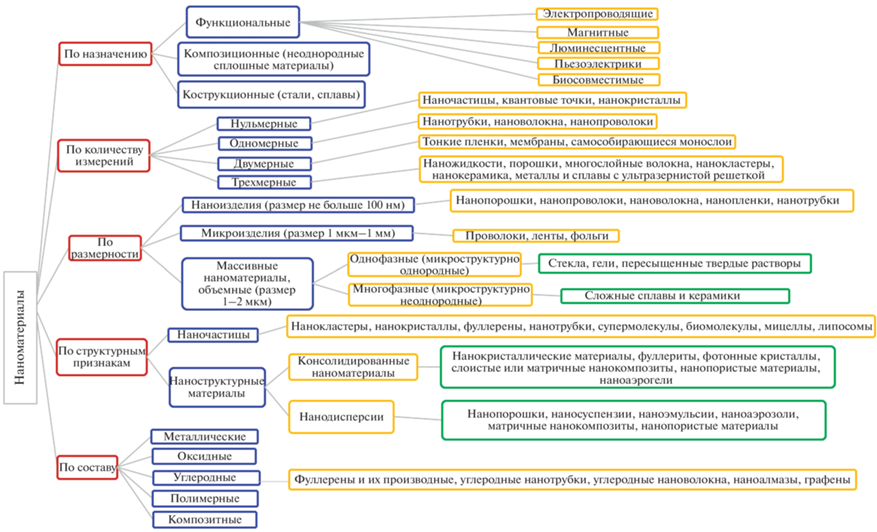
На рис. 1 представлен вариант возможной классификации НМ, в которой учитывается зависимость от размера частиц, геометрическая и физическая размерность, морфология, химический состав. В работе (Saleh, 2020) представлен обзор существующих в настоящее время наноматериалов и описаны их свойства. Применительно к БС и БТЭ наиболее часто используют классификацию, основанную на химическом составе НМ; при этом выделяют как однокомпонентные НМ, так и нанокомпозиты, имеющие в своем составе дополнительные включения.
В табл. 1 представлены некоторые примеры применения различных типов НМ при создании БС. Как видно из табл. 1, основные области применения таких модифицированных биосенсоров – это медицина, охрана окружающей среды и биотехнология. При этом зачастую для модификации электрода в составе БС используют не один НМ, а несколько одновременно – НЧ нескольких металлов или их оксидов, или НЧ металлов и углеродные НМ, что приводит к изменению аналитических характеристик биоэлектрохимических устройств. В табл. 2 приведены некоторые примеры применения НМ в ферментных и микробных биотопливных элементах, при этом указывается на какую характеристику больше всего повлияло применение НМ.
Таблица 1.
Примеры практического применения электрохимических биосенсоров, модифицированных наноматериалами
| Область применения | Тип наноматериала | Анализируемое соединение | Биокатализатор | Стабильность | Пределы определения | Ссылка |
|---|---|---|---|---|---|---|
| Медицина | КТ CdTe | МикроРНК мутации гена 1 рака молочной железы | Нуклеаза | Уменьшение сигнала на 4.8% в течение 30 дней | 1.2 мкМ в образцах сыворотки | Yang et al., 2019 |
| КТ антимонена | Определение H2O2 у больных с диагностированным раком CA-125 | Каталаза | Электрохимически стабилен до 30 циклов | 4.4 мкМ | Fatima et al., 2020 | |
| ОУНТ/НЧ Au в качестве метки антител | Хорионический гонадотропин человека | Антитела | – | 5 пг/мл | Viet et al., 2019 | |
| МУНТ/НЧ Cu | L-молочная кислота | Лактатоксидаза | Сохранение 60% активности от первоначальной через 140 дней | 0.25 мкМ | Dagar, Pundir, 2017 | |
| Графен/НЧ Pt | Глюкоза в крови и в поте | Глюкозооксидаза | – | 300 нМ | Yoon et al., 2020 | |
| НЧ оксида графена | L-лизин в образцах сыворотки | L-лизиноксидаза | Снижение сигнала на 35% при непрерывном использовании в течение 230 раз | 0.01 мкМ | Nohwal et al., 2020 | |
| НЧ Pt | Бактерии Salmonella | Антитела | – | 13 КОЕ/мл | Wang et al., 2020 | |
| НЧ ZnO, Ag | Ксантин | Ксантиноксидаза | Сохранение 77% активности от первоначальной через 20 дней хранения | 0.07 мкМ | Sahyar et al., 2019 | |
| НЧ ZnO/CuO | С-реактивный белок | Антитела | – | 16 пг/мл | Cao et al., 2020 | |
| Наностержни ZnO | Глюкоза | Глюкозооксидаза | – | 10 мкМ | Bagyalakshmi et al., 2020 | |
| Нанокластеры платиновой сажи/анатаз | Холестерин в крови | Холестериноксидаза | 96.4% активности от первоначальной через 30 дней | 960 нМ | Lee et al., 2021 | |
| Охрана окружающей среды | ОУНТ | Пестицид метилпаратион в образцах фруктов | Ацетилхолинэстераза | Снижение сигнала на 7% после хранения в течение 33 дней | 3.75 × 10–11 М | Kumar, Sundramoorthy, 2019 |
| МУНТ | Фенольные соединения | Лакказа | 77% от первоначальной активности через 10 циклов и 86% через 30 дней | 0.002 мкМ | Othman, Wollenberger, 2020 | |
| Графен/НЧ Au и Cu2O | Фосфаты в продуктах питания | Пируватоксидаза | 87.8% от первоначальной активности через 9 дней | 0.4 нМ | He, Liu, 2020 | |
| Восстановленный оксид графена и хитозан | Метилпаратион в образцах овощей | Гемоглобин | 92.5% от первоначальной активности через 21 дней | 79.77 нМ | Kaur et al., 2020 | |
| НЧ Au | As (III) | Alcaligenis faecalis | 15 циклов | 6.61 мкмоль | Núñez et al., 2020 | |
| НЧ Au | Полифенолы в прополисе | Лакказа | 85% от первоначальной активности через месяц | 1 мкМ | Mohtar et al., 2019 | |
| Золотые наностержни/ мезопористые НЧ SiO2 | Фосфорорганические пестициды | Ацетилхолинэстераза | 98% от первоначальной активности через 30 дней | 1.3 нМ | Cui et al., 2019 | |
| Биотехнология | НЧ ZnO/МУНТ/ полианилин | L-аминокислоты во фруктовых соках | L-аминокислотная оксидаза | 70% от первоначальной активности через 120 дней | 0.35 мкМ | Lata et al., 2013б |
| МУНТ | Этиловый спирт | Gluconacetobacter sucrofermentas | – | 0.015 мМ | Plekhanova et al., 2019 | |
| НЧ Au | Метанол в яблочном соке | Methylobacterium organophilium | 69% от первоначальной активности через 60 дней | 0.047 мМ | Wen et al., 2014 | |
| НЧ ZnO/МУНТ | Теофиллин в фармацевтических препаратах | Цитохром с | В течение 5 дней сигнал не изменялся | 0.0012 мкМ | Kilele et al., 2020 |
Примечание. ОУНТ – одностенные углеродные нанотрубки, остальные обозначения в тексте для табл. 1, 2.
Таблица 2.
Применение НМ в ферментных и микробных биотопливных элементах
| НМ | Роль НЧ | Биоматериал/ топливо | Медиатор | Плотность тока | Время жизни | Мощность | Ссылка |
|---|---|---|---|---|---|---|---|
| НЧ Ag/оксид графена | Стабильность биоматериала; механическая прочность электрода; перенос электронов в системе | Глюкозооксидаза/ глюкоза | Ферритин | 5.7 мА/см2 | 45 дней | – | Perveen et al., 2018 |
| УНТ/НЧ Ag | Препятствие денатурации фермента; перенос электронов в системе; устойчивость биоматериала к высокой концентрации H2O2 | Глюкозооксидаза/ глюкоза | Без медиатора | 0.160 ± 0.0026 мкА/см2 | 5 недель | 1.46 ± 0.07 мВт/см2 | Christwardana et al., 2018 |
| Восстановленный оксид графена/ Fe3O4 | Перенос электронов в системе; высокая удельная поверхность и пористость электрода | Глюкозооксидаза/ глюкоза | Ферритин | 32.9 мА/см2 | 45 дней | – | Shakeel et al., 2019 |
| МУНТ | Перенос электронов в системе | Лактатоксидаза/ лактат в поте | Диметилферроцен | 96 мкА | – | 13.6 мкВт | Escalona- Villalpando et al., 2019 |
| НЧ Au | Перенос электронов в системе | Алкогольдегидрогеназа/глицерин | Прямой перенос электронов | 510 мА/см2 | – | 130 мкВт/см2 | Ratautas et al., 2017 |
| МУНТ | Обеспечение долгосрочной стабильности биоматериала; окисление NADH | Глюкозодегидрогеназа и кофактор NADP/глюкоза | Без медиатора | 1300 мА/см2 | 1 год | – | Tahar et al., 2019 |
| МУНТ | Перенос электронов в системе; увеличение чувствительности БС; снижение общего сопротивления биоэлектрода | Gluconacetobactersucrofermentas ВКПМ B-11267/ глюкоза | 2,6-дихлорофенолиндофенол | - | – | 2 мкВт/см2 | Тарасов и др., 2021 |
| Магнитные НЧ Fe3O4 | Облегчение образования биопленок и переноса электронов | Synechococcus sp./ азокраситель Mordant Orange 1 | Феррицианид калия | 14.04 ± 5.5 А/м3 | 216 ч | 4.9 ± 0.5 Вт/м3 | Sarma et al., 2018 |
| Биогенные НЧ Au и МУНТ | Увеличение количества бактерий на электроде; увеличение генерируемой электроэнергии; уменьшение времени запуска БТЭ | Микробное сообщество активного ила/ глюкоза | Феррицианид в катодном отделении | 700 мА/ м2 | – | 178.34 ± 4.79 мВт/см2 | Wu et al., 2018 |
| НЧ титана | Перенос электронов в системе; способствуют прикреплению микробов на электроде | Shewanella oneidensisMR-1 и Klebsiella pneumoniae L17/глюкоза | Без медиатора | – | 3 недели | 97.6 мВт/см2 | Kim et al., 2019 |
Применение НМ в электрохимических БС и БТЭ связано с их уникальными свойствами (Khan et al., 2019; Asha, Narain, 2020). Для БС и БТЭ прежде всего это высокое соотношение между площадью поверхности НЧ и их объемом. Большая удельная поверхность приводит к значительной адсорбции биологических объектов на поверхности НМ. Особенности адсорбции определяются размерным эффектом; кристаллической структурой поверхности НЧ; наличием дефектов на поверхности НЧ; возможностью получения трехмерных композиций, позволяющих создавать особую среду вокруг клеток или ферментов, сохраняющих их каталитическую активность в течение длительного времени (Perveen et al., 2018; Kim et al., 2019; Shakeel et al., 2019; Tahar et al., 2019).
НМ проявляют высокую каталитическую активность в химических реакциях из-за большого количества координационно ненасыщенных атомов, расположенных на поверхности, краях и углах НЧ, по сравнению с общим числом атомов (Navalón, García, 2016). Адсорбция НЧ на поверхности электрода приводит к стабилизации НЧ, выступает в качестве каркаса для иммобилизации биокатализатора и позволяет использовать каталитическую активность НЧ для усиления сигнала БС (Zhou et al., 2021), в качестве замены ферментной метки в иммуносенсорах (Tao et al., 2020) или одного из ферментов в каскадных реакциях при окислении или восстановлении одного из реагентов в ферментных БС (Smutok et al., 2021).
Электрические свойства НМ, что важно для электрохимических устройств, связаны с квантово-размерным эффектом и эффектом квантового ограничения. Известно, что некоторые металлы (например, медь) при получении наноформ теряют проводимость, тогда как изоляционные материалы (например, диоксид кремния) наоборот становятся проводящими (Shi et al., 2015). Для нанопроволок и нанотрубок характерно, что при уменьшении диаметра ниже 20 нм из-за увеличения поверхностного рассеяния электронов и фононов, увеличения площади поверхности и очень высокой плотности электронных состояний, проводимость резко возрастает по сравнению с объемными материалами. Таким образом, уменьшение структур до наноразмеров приводит к снижению удельного сопротивления и увеличению проводимости, что в свою очередь ведет к возрастанию сигналов БС и БТЭ, модифицированных НМ (Тарасов и др., 2020), позволяя в некоторых случаях отказываться от медиаторов – искусственных акцепторов электронов (Christwardana et al., 2018; Tahar et al., 2019).
Растворы, содержащие НЧ, относятся к дисперсионным системам, где на границе раздела “частица-дисперсионная среда” возникает двойной электрический слой (ДЭС). Частью ДЭС является дзета-потенциал, определяющий степень и характер взаимодействия между частицами дисперсной системы. Исследование дзета-потенциала позволяет изучать поверхностные свойств НЧ и предсказывать возможные механизмы взаимодействия НЧ с мембраной клеток и микроорганизмов (Zhang et al., 2007; Forest, Pourchez, 2017). Например, НЧ серебра, имея отрицательный дзета-потенциал, значительно хуже подавляют пролиферацию клеток, чем НЧ меди, обладающие положительным дзета-потенциалом (Казанцев, 2018). Следует отметить, что исследований по зависимости между свойствами наночастиц, их биологической активностью как анодного/катодного материалов БС и БТЭ и значением дзета-потенциала было выполнено относительно немного.
Свойства НМ влияют на основные характеристики БС и БТЭ. Для БС – это такие аналитические параметры как минимальная определяемая концентрация анализируемого соединения, пределы определения, амплитуда сигнала, чувствительность анализа; для БТЭ – генерируемый потенциал, мощность, и для биоэлектрохимических систем в целом важным параметром является сохранение долговременной стабильности БМ. Рассматривая конкретные НМ, авторы данного обзора обращали внимание именно на эти характеристики модифицированных устройств.
Углеродные наноматериалы. Углеродные нанотрубки. К одним из наиболее часто применяемых НМ относят углеродные нанотрубки (УНТ). В 1991 г. японский ученый С. Иджима синтезировал полые молекулы углерода и определил их кристаллическую структуру. Эти молекулы назвали углеродными нанотрубками (Iijima, 1991). Обычно углеродные НМ, такие как фуллерен, УНТ, графен (Гр) и их производные, нерастворимы в воде из-за наличия гидрофобной поверхности, в результате чего возникает тенденция к агломерации из-за большой площади поверхности (Алиев и др., 2011). При их модификации, например, неорганическими НЧ золота (Duc Chinh et al., 2019), платины (Kang et al., 2008), серебра (Chen et al., 2012), меди (Lata et al., 2013а), оксида меди (Di Tocco et al., 2018), квантовыми точками (Reza Jamei et al., 2020) создаются новые гибридные конструкции с улучшенной растворимостью и стабильностью.
В работе (Plekhanova et al., 2019) использовали МУНТ, модифицированные хитозаном, в составе микробных биосенсоров. Было показано, что в комбинации с хитозаном УНТ не влияют на структурную целостность и дыхательную активность микробных клеток Gluconobacter oxydans. В то же время происходит уменьшение импеданса рабочего электрода более, чем на порядок, увеличивается чувствительность биосенсора к субстратам. Модификация измерительного электрода БС, содержащего филогенетически близкие к бактериям G. oxydans клетки Gluconoacetobacter sucrofermentas ВКПМ B-11267 с помощью МУНТ также приводило к росту тока в 8–10 раз и к дополнительному снижению общего сопротивления электрода в ~10 раз (Тарасов и др., 2020).
Углеродные нановолокна. Углерод может существовать в форме трубчатых микроструктур, называемых нитями или волокнами. Первые наблюдения углеродных нановолокон (НВ) диаметром 50 нм с помощью электронной микроскопии были выполнены в начале 1950-х гг советскими учеными Радушкевичем и Лукьяновичем (1952). Благодаря своим свойствам НВ широко используются при разработке БС и БТЭ (Yadav et al., 2020; Zhou et al., 2020). Исследование, посвященное применению углеродного высокодисперсного материала в сочетании с иммобилизованными клетками G. oxydans при их сорбционном контакте с углеродными волокнами, представлено в работе (Решетилов и др., 2017). Исследования показали, что электрическая проводимость в значительной степени зависит от технологии изготовления и химического состава – НВ, не содержащие азот и имеющие пониженное содержание кислорода, оказались наиболее эффективными элементами электродов; максимальная развиваемая удельная мощность составляла 5 мкВт/см2.
Графен и графеноподобные НМ. Большое внимание исследователи уделяют использованию в БС Гр (Peña-Bahamonde et al., 2018), представляющего двумерную форму углерода и впервые полученного в 2004 г. группой ученых Манчестерского университета и Института проблем технологии микроэлектроники в Черноголовке под руководством А. Гейма и К. Новосёлова (Novoselov et al., 2004). Гр обладает высокой электропроводностью, удовлетворительными механическими и оптическими свойствами, относительно низкой себестоимостью, высокой биосовместимостью (Bai et al., 2020). Применение Гр сопряжено с повышением электрической мощности БТЭ (Bin Mohd Yusoff, 2015). Вопрос об использовании Гр в ферментных и микробных БТЭ, анализ свойств Гр как конкурента углеродных и металлических НМ представлен в обзорном материале (Filip, Tkac, 2014).
В обзорах (Alexander et al., 2020; Arshad et al., 2019) рассматривают, как гидрофобный графен с помощью сурфактантов можно переводить и стабилизировать в растворенном состоянии, получая графеновые наножидкости, сочетающие свойства и графена, и того растворителя, который применяется как базовый.
Перспективными НМ, по сути, близкими к Гр, являются наноуглеродные графеноподобные материалы. К ним относится терморасширенный графит (ТРГ). При производстве ТРГ исходный кристаллический графит подвергают окислению, а затем высокоскоростному нагреву со скоростью 400–600°С/с, в результате чего графитовые частицы расщепляются практически до графеновых слоев (Горшенев и др., 2008). В работе (Reshetilov et al., 2015) показано, что применение ТРГ в сочетании с мембранными фракциями (МФ) бактериальных клеток обеспечивает безмедиаторный перенос заряда. Этот эффект обусловлен специфической формой НЧ ТРГ и его взаимодействием с белками МФ. Эффект наблюдали только при окислении этилового спирта, но не глюкозы. Это свидетельствует о том, что при взаимодействии “ТРГ – белки МФ” обеспечивается не только облегченный перенос заряда, но и специальные условия для возникновения своеобразной субстратной специфичности (Решетилов и др., 2016).
Высокоориентированный пиролитический графит (ВОПГ) представляет собой одну из модификаций графита, имеющую слоистую структуру. Материал получается в результате одноосного давления на пироуглерод, прошедший отжиг при высокой температуре (до 3300 К). Структура ВОПГ может быть описана как чередование графеновых плоскостей (Banerjee et al., 2005). Такая модификация графита также используется как материал электродов для биосенсорных применений (Mahe et al., 2014; Tehrani et al., 2016).
Наночастицы на основе металлов и их соединений. Наночастицы металлов, их оксидов и сульфидов широко используются в составе БС и БТЭ. Для их получения обычно используют процесс восстановления солей металлов различными реакционными агентами (Korobeinyk, et al., 2019; Delbecq et al., 2019). В последнее время для получения металлических НЧ все большее значение приобретают методы биологического синтеза. Такой синтез основан на способности некоторых микроорганизмов создавать различные типы НЧ из материалов-предшественников (Singh et al., 2016; Patil, Kim, 2018). Таким образом открывается перспектива как в области биоремедиации (очистки окружающей среды от загрязняющих соединений, являющимися материалами-предшественниками), так и в области получения НЧ с высокой биосовместимостью. Например, известно биохимическое получение НЧ оксида меди (Waris et al., 2020), железа (Sadhasivam et al., 2020), оксида титана (Jha et al., 2009), золота (Italiano et al., 2018), теллура (Castro et al., 2020), серебра (Nazari, Jookar Kashi, 2020).
При получении НЧ с помощью биологического синтеза возможно встраивание определенных участков генома в используемый микроорганизм для создания нужных НЧ (Pasula, Lim, 2017; Furubayashi et al., 2020). Кроме того, контролируя pH, температуру, время воздействия и концентрацию исходного раствора солей металла, использование дополнительных химических соединений для увеличения поглощения нужных металлов, можно регулировать скорость образования, размер и морфологию НЧ (Gericke, Pinches, 2006; Li et al., 2011).
Наиболее часто при создании БС и БТЭ используют НЧ золота (Hua et al., 2021), серебра (Yu et al., 2020), платины (Hossain, Slaughter, 2020), палладия (Guler, Dilmac, 2019), меди (Qing et al., 2019). Из НЧ оксидов металлов наибольшее применение нашли диоксид титана (Shetti et al., 2019а), оксид железа (Chong et al., 2019), оксид церия (Vennila et al., 2018), оксид цинка (Shetti et al., 2019б).
Для обеспечения эффективного переноса электронов от ферментов к электроду часто используют одновременную модификацию полимера для иммобилизации БМ металлическими НЧ и углеродными НМ. Например, композит НЧ диоксида титана с УНТ, функционализированными амином и последующей иммобилизацией глюкозооксидазы, обладает высокой каталитической активностью по отношению к окислению глюкозы (Tasviri et al., 2011); при этом определение глюкозы проводят в отсутствии медиаторов. В работе (Chen et al., 2015) показано, что при использовании смеси, состоящей из гидрофилизированного Гр, который через карбоксильные группы связывали с НЧ золота, скорость переноса электронов в системе увеличивалась, а максимальная мощность устройства достигала значения ~2 мВт/см2. В работе (Bollella et al., 2018) применили миниатюрную топливную ячейку на ферментной основе; в качестве базовых использовали электроды, полученные матричной печатью, модифицированные НЧ золота и Гр. Основой анода являлась целлобиозодегидрогеназа, основой катода – лакказа. В 100 мкМ растворе глюкозы максимальная плотность энергии составляла ~1.6 мкВт/см2 при напряжении холостого хода 0.6 В.
Применение НМ нередко позволяет решать несколько сопряженных задач – повышения кажущейся каталитической активности электродов (используется терминология “кажущейся”, поскольку активность возрастает не за счет изменения свойств БМ, а возрастает за счет изменения структуры электрода), увеличения времени жизни, эффективного способа иммобилизации. Для БТЭ до сих пор существенной проблемой является низкий энергетический выход и малое время жизни. В работе (Kizling et al., 2020) авторы предлагают конструкцию БТЭ, содержащую каскад ферментов в анодном отделении с целью повысить энергетический выход. Применение НЧ золота для иммобилизации БМ значительно увеличило скорость катализа. Энергетический выход при окислении сахарозы достигал 0.8 мВт/см2, что являлось высоким по сравнению с БТЭ с обычным катодом и анодом.
Число новых синтезированных НМ постоянно растет. Сравнительно недавно был синтезирован НМ, который революционизировал многие отрасли науки и техники. Этот высокопроводящий материал с гидрофильной природой, названный максеном (MXene), был открыт в 2011 г. (Naguib et al., 2011). НМ представляет собой двумерные карбиды, нитриды и карбонитриды переходных металлов. Материал перспективен для создания энергетических устройств, особенно гибких электронных устройств, в том числе и БС (Kshetri et al., 2021; Venkateshalu, Grace, 2020). Одна из описанных структур максена, имеющая формулу Ti3C2Tx, позволяла включать в его состав молекулы УНТ, металлы Ag, Cu, Au/Ag, проводящие полимеры (Sarycheva, Gogotsi, 2020). Применение максена в качестве элемента сенсора привело к высокочувствительной детекции пероксида водорода с нижним пределом обнаружения порядка 400 нМ (Lorencova et al., 2017, 2018). Включение максена Ti3C2Tx с НЧ платины в состав биосенсора на основе глутаматоксидазы позволило получить высокую чувствительность БС к глутамату (1.59 нА/(мкМ/л)) с нижним пределом обнаружения, равным 0.45 мкМ/л. При этом сигнал биосенсора через 28 дней составлял 70% от первоначального уровня сигнала (Liu et al., 2021).
Наночастицы неметаллов. Одним из наиболее перспективных неметаллических НМ является кремний. Применение кремниевых наноструктур в биосенсорах интенсивно развивается (Ji et al., 2018). Это связано, во-первых, с их нетоксичностью: кремниевые НМ легко биоразлагаются и выводятся из организма (Zhong et al., 2015; Chiappini et al., 2015). Во-вторых, такие НЧ обладают настраиваемыми физическими, химическими, оптическими и механическими свойствами (Prabha et al., 2021). В-третьих, НЧ оксида кремния представляют собой сферические везикулы, которые состоят из оболочки из оксида кремния и канюльного ядра, в которое может захватываться большое количество молекул, таких как оксид железа, молекулы органических и неорганических красителей, лекарства. Следовательно, НЧ оксида кремния могут содержать десятки тысяч молекул красителя, что дает значительно более высокий сигнал при использовании их в БС (Wen, 2015). Чаще всего НЧ оксида кремния используют в оптических БС для увеличения чувствительности анализа (Cheng, Guan, 2017). Но известны примеры применения таких НЧ в электрохимических устройствах. Биосенсор, в котором НЧ оксида кремния, функционализированные специфическими поликлональными антителами, использовали для обнаружения Escherichia coli в минимальной концентрации 103 КОЕ/мл, представлен в работе (Mathelié-Guinlet et al., 2019). Основное направление использования кремниевых НМ – биосенсоры на основе кремниевых нанопроволок (КНП) (Namdari et al., 2016; Puppo et al., 2017). КНП представляют собой класс одномерных НМ, которые были описаны в 2001 г. группой Либера (Cui et al., 2001). Это устройства работают как полевые транзисторы, но благодаря увеличению отношения площади поверхности к объему, они обеспечивают улучшенную аналитическую чувствительность по сравнению с устройствами на планарных полевых транзисторах (Noor, Krull, 2014), например в работе (Duan et al., 2012) была показана возможность обнаружения адсорбции и десорбции белка in situ в режиме реального времени без дополнительных меток и с чувствительностью в фемтомолярном диапазоне, а также проводить регистрацию анализируемого соединения на уровне одиночных молекул (Ivanov et al., 2012). Новое поколение биосенсоров на основе наноструктур кремния, начиная от электрохимических датчиков с КНП, полевого транзистора и пористого кремния и заканчивая оптическими датчиками на основе пористого кремния, люминесцентных кремниевых квантовых точек КНП представлено в обзоре (Lenardi et al., 2021).
Полимерные наноматериалы. Для сопряжения биологического материала с электродом создаются различные композитные материалы и смеси на основе полимеров. Проводящие полимеры обеспечивают основу для иммобилизации биокатализатора на электроде, одновременно увеличивая проводимость и чувствительность устройства, при чем эти свойства зависят от общей длины цепи полимера, его структуры и состава. Проводящие полимеры могут быть дополнительно модифицированы путем введения различных функциональных групп для связывания белковых молекул. В ряде случаев возможен электрохимический синтез полимера непосредственно на рабочем электроде БС или БТЭ с одновременным захватом биологического материала (Kumar et al., 2020).
Для модификации БС и БТЭ наиболее часто используются такие проводящие полимеры как наноструктурированные полипиррол (Jain et al., 2017), полианилин (Kazemi et al., 2020), политиофен (Ihalainen et al., 2016) и их производные (Rawat, Ghosh, 2020). Следует отметить, что зачастую первые применения проводящих полимеров связаны не с БС и БТЭ. Например, такой высокопроводящий полимер как поли (3,4-этилендиокситиофен) полистиролсульфонат (ПЭДОТ:ПСС), обладающий высокой механической гибкостью, растяжимостью и оптической прозрачностью начал применятся в термоэлектрических генераторах; в качестве антистатического агента при производстве фотопленок; как электролит в полимерных электролитических конденсаторах; для изготовления фотоэлектрических элементов, дисплеев и транзисторов и т.п. (Fan et al., 2019). Это производное политиофена было синтезировано во второй половине 1980-х годов учеными из Германии (Jonas et al., 1988) и только спустя десять лет начали появляться первые работы по применению этого полимера в биосенсорах (Groenendaal et al., 2000).
Одно из направлений связано с развитием гиперразветвленных полимеров наноразмеров – дендримеров (Golshan et al., 2020; Rabiee et al., 2020). Это монодисперсные трехмерные сверхразветвленные наноразмерные полимерные архитектуры с очень высокой плотностью поверхностных функциональных групп (Евтюгин, Стойкова, 2015). Они содержат периферийные группы –NH2, –COOH, –OH, –СНО, с помощью которых их можно конъюгировать с БМ, при этом разветвленная структура оказывает стабилизирующее действие на трехмерную структуру белков и нуклеиновых кислот. Дендримеры синтезируются серией повторяющихся шагов. Идея повторяющегося роста с ветвлением впервые была высказана Фогтлем (Vogtle et al., 1978). Термин “дендример” ввел Д. А. Томалиа на первой международной конференции по полимерам, проходившей в Японии в августе 1984 г. (Tomalia et al., 1984) и подробно описал синтез дендримера поли(амидоамина) (Tomalia et al., 1985). Использование дендримеров предоставляет возможность изучения переноса заряда (выявления роли структурных и стерических факторов) в поверхностном слое электрода. Иммобилизация фермента уреазы на самоорганизованных дендримерах из МУНТ с полиамидоамином (Dervisevic et al., 2018) позволила создать БС с широким линейным диапазоном обнаружения мочевины 1–20 мМ, низким пределом обнаружения 0.4 мМ и высокой чувствительностью ~7 нА/мМ; время анализа составляло 3 с.
Квантовые точки. Квантовые точки (КТ) представляют собой полупроводниковые нанокристаллы с размером порядка 2–10 нм, состоящие из атомов, созданных на основе неорганических полупроводниковых материалов Si, InP, CdSe и т.д., покрытые монослоем стабилизатора из органических молекул (Олейников, 2010; Aladesuyi, Oluwafemi, 2020). Квантовые точки были впервые получены в 1981г. Алексеем Екимовым для сульфида кадмия в стеклянной матрице (Екимов, Онущенко, 1981), а затем, в 1985 г., Луисом Брюсом в коллоидных растворах (Brus, 1984). Основное преимущество КТ заключается в возможности высокоточного контроля над их размерами, а, следовательно, и над их электрическими характеристиками (Walther et al., 2020), что делает их перспективными при создании БС (Azizi et al., 2020; Fatima et al., 2020) и БТЭ (Talooki et al., 2020). В работе (Wu et al., 2017) использовали КТ для иммобилизации на аноде НАД+ – зависимых алкогольдегидрогеназы, альдегиддегидрогеназы и формиатдегидрогеназы, а на катоде – лакказы; КТ обеспечивали высокую электропроводность между ферментами и базовым стеклоуглеродным электродом. При восстановлении кислорода наблюдали эффект прямого переноса заряда. Указанная конструкция развивала максимальную мощность ~69 мкВт/см2 при потенциале холостого хода в 0.7 В. Биосенсор на основе КТ нитрида бора был применен для анализа сердечного тропонина-I (одна из субъединиц сердечных тропониновых комплексов, являющихся биохимическим маркером острого инфаркта миокарда) в плазме крови (Yola, Atar, 2018). Применение КТ позволило добиться нижнего предела обнаружения в 0.0005 нг/мл (концентрация тропонина I в крови у человека со здоровым сердцем не превышает 0.026 нг/мл), что дало возможность проводить раннюю диагностику инфаркта миокарда с высокой точностью.
ИЗМЕНЕНИЕ СВОЙСТВ НАНОМАТЕРИАЛОВ И МЕХАНИЗМ ИХ ДЕЙСТВИЯ
Как видно из приведенных выше данных, для применения в биоэлектрохимических устройствах НМ модифицируют, создавая композиции с измененными свойствами. Следует отметить, что есть множество работ, показывающих токсическое воздействие НМ на живые объекты (Mohanta et al., 2019; Wu et al., 2019; Caixeta et al., 2020; Yin et al., 2020). Некоторые НМ благодаря своей физической природе способны индуцировать активные формы кислорода (Long et al., 2007; Kang, 2008). Другие НМ способны проникать через тканевые барьеры внутрь клеток и взаимодействовать с внутриклеточными компонентами (Kaura et al., 2008). Известен также эффект нарушения мембранных структур за счет влияния НМ на их проницаемость (Hong et al., 2004). С помощью функционализации токсичность НМ можно изменять. Например, в процессе окисления УНТ на концах трубок образуются карбоксильные группы, что делает их гидрофильными и, следовательно, растворимыми в водных растворителях при наблюдаемом снижении токсичности НМ (Mallakpour, Soltanian, 2016). Функционализация небольшими молекулами (“обертывание” полимерами) может изменять электрохимические свойства НМ (Zhao, Stoddart, 2009), улучшать его механические свойства (Zhang, Huang, 2016). При химической функционализации УНТ появляется возможность образования связей с БМ (Verma et al., 2013; Christwardana et al., 2017). Модификация, например, хитозаном, позволяет снизить токсичность УНТ и увеличить их растворимость в воде (Negm et al., 2020).
Металлические НЧ применяют для функционализации УНТ, либо УНТ используют для фунционализации НЧ металлов с целью дальнейшей иммобилизации на таких структурах БМ (Lahcen et al., 2020). Например, иммобилизацию пероксидазы хрена с помощью 3-аминопропилтриэтоксилана на композитах Fe3O4/УНТ применили для эффективной деградации фенола в сточных водах (Zhang, Cai, 2018). В работе (Asghary et al., 2019) для решения проблемы токсичности УНТ микроорганизмы связывали с ними через НЧ золота (использовали сообщество бактерий из бытовых сточных вод).
Несомненно, что применение НМ становится более эффективным при понимании механизма их действия. В главном, интегральном, моменте эффекты НМ основаны на снижении электрического сопротивления – увеличении проводимости рецепторного материала; под рецепторным материалом подразумевается сложная композиция, включающая БМ, НЧ, полимерные компоненты, медиаторы, проводящий электролит, расположенные на поверхности рабочего электрода.
Молекулярная детализация сути процесса переноса заряда может быть различна, однако в итоге все определяется взаимным расположением активного центра фермента (выделенного или находящегося в составе микробной клетки), расстоянием до ближайшей точки на НМ, позволяющей передавать/принимать заряды (обеспечивать прохождение тока), геометрией расположения частиц НМ, присутствием проводящего электролита. Так, например, в работе (Арляпов и др., 2020) предполагается, что перенос заряда может происходить по двум механизмам – по сетке, образуемой НМ, если медиатор отсутствует, либо по прыжковому механизму – смешанному пути по структурам “медиатор – НМ”. НМ служит переносчиком, обеспечивающим ускоренный перенос заряда. В случае, если расстояние между ковалентно-связанными медиаторами большое, то скорость прыжковой составляющей переноса электронов может снижаться. За счет внедрения УНТ в структуру редокс-активного полимера эффективное расстояние между молекулами медиаторов уменьшается; УНТ играют роль мостиков, по которым электроны переносятся по редокс-активному полимеру на электрод. Детальный анализ возможных механизмов переноса заряда в системе, использующей НМ, представлен в работе (Adachi et al., 2020).
* * *
Таким образом, можно отметить, что применение НМ позволяет значительно увеличить точность и чувствительность анализа, а во многих случаях увеличить скорость получения результатов. Также применение НМ приводит к уменьшению объема образцов, необходимых для проведения анализа, т.к. появляется возможность получения сигнала, связанного с одной молекулой, с одной клеткой. Развитие гибких и биосовместимых материалов на основе НМ позволяет разрабатывать носимые и имплантируемые устройства. При этом точность и воспроизводимость таких устройств уже не просто не сопоставима, а значительно превышает традиционные методы анализа. Кроме того, применение НМ позволяет значительно уменьшить величину измеряющего устройства, дает возможность проводить измерения в сложных матрицах с минимальной пробоподготовкой, на месте сбора образца.
Можно предположить, что следующее поколение биосенсоров будет использовать новые биорецепторы во взаимосвязи с новыми классами НМ еще более интенсивно, чем в настоящее время. Основное направление развития БС и БТЭ связано с оптимизацией стратегии связывания биоматериалов с поверхностью преобразователя, представленного НМ, с интеграцией массива биосенсоров на одной платформе для одновременного анализа различных анализируемых соединений. Для такого развития требуется одновременное участие в исследованиях специалистов различных областей знаний – биологов, химиков, врачей, инженеров, специалистов микроэлектронного профиля, что должно приводить к интегрированным междициплинарным исследовательским программам.
Финансирование. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта (20-13-50157).
Acknowledgments. The reported study was funded by RFBR, project number 20-13-50157.
Список литературы
Алиев А.Д., Бойнович Л.Б., Буховец В.Л., Емельяненко А.М., Горбунов А.М., Городецкий А.Е., Пашинин А.С. Супергидрофобные покрытия на основе нанотрубок нитрида бора: механизм супергидрофобности и самовосстановление высокогидрофобных свойств // Российские нанотехнологии. 2011. Т. 6. № 11–12. С. 57–64.
Арляпов В.А., Харькова А.С., Абрамова Т.Н., Кузнецова Л.С., Илюхина А.С., Зайцев М.Г., Решетилов А.Н. Гибридный редокс-активный полимер на основе бычьего сывороточного альбумина, ферроцена, карбоксилированных углеродных нанотрубок и глюкозооксидазы // Журн. аналит. химии. 2020. Т. 75(9). С. 820–833.
Горшенев В.Н., Илюшин А.С., Колесов В.В., Фионов А.С., Петрова Н.Г. Композиционные материалы на основе терморасширенного графита // Перспективные материалы. 2008. Т. 6. № 2. С. 351–355.
Евтюгин Г.А., Стойкова Е.Е. Электрохимические биосенсоры на основе дендримеров // Журн. аналит. химии. 2015. Т. 70. № 5. С. 451–469.
Екимов А.И., Онущенко А.А. Квантовый размерный эффект в трехмерных микрокристаллах полупроводников // Письма в журн. эксперим. и теорет. физики. 1981. Т. 34. С. 363–366.
Казанцев С.О., Фоменко А.Н., Кондратова А.Н. Электрокинетические свойства биметаллических наночастиц с различным соотношением металлов // Химия и химическая технология в XXI веке: материалы XIX Международной научно-практической конференции студентов и молодых ученых имени профессора Л.П. Кулёва, г. Томск, Изд-во ТПУ, 2018. С. 77–78.
Олейников В.А. Квантовые точки в биологии и медицине // Природа. 2010. № 3. С. 22–28.
Радушкевич Л.В., Лукьянович В.М. О структуре углерода, образующегося при термическом разложении окиси углерода на железном контакте // Журн. физ. химии.1952. № 26. С. 88–95.
Решетилов А.Н., Китова А.Е., Мачулин A.В., Тарасов С.Е., Гуторов М.А., Алферов С.В., Колесов В.В., Готовцев П.М., Василов Р.Г. Биосенсор на основе клеток Gluconobacter и терморасширенного графита // Сенсорные системы. 2016. Т. 30. № 4. С. 351–354.
Решетилов А.Н., Плеханова Ю.В., Тарасов С.Е., Быков А.Г., Гуторов М.А., Алферов С.В., Тенчурин Т.Х., Чвалун С.Н., Орехов А.C., Шепелев А.Д. Готовцев П.М., Василов Р.Г. Оценка свойств биоэлектродов на основе углеродных высокодисперсных материалов, содержащих модельные микроорганизмы Gluconobacter // Российские нанотехнологии. 2017. Т. 12. № 1–2. С. 83–89.
Решетилов А.Н., Готовцев П.М., Сандраморти А.К., Василов Р.Г. Биосенсоры – движение от макро- к микро- и наноразмерам // Российские нанотехнологии. 2020. Т. 15. № 1. С. 14–21.
Тарасов С.Е., Плеханова Ю.В., Быков А.Е., Кленова Н.А., Решетилов А.Н. Стимулирующие эффекты мультистенных углеродных нанотрубок на иммобилизованные бактериальные клетки Gluconacetobacter sucrofermentas ВКПМ B-11267 // Российские нанотехнологии. 2020. Т. 15. № 1. С. 86–89.
Тарасов С.Е., Плеханова Ю.В., Быков А.Г., Казаков А.С., Вишневская М.В., Парунова Ю.М., Готовцев П.М., Решетилов А.Н. Перспективы использования Gluconacetobacter sucrofermentas ВКПМ B-11267 в биотопливных элементах // Приклад. биохимия и микробиол. 2021. Т. 57. № 2. С. 187–195.
Adachi T., Kitazumi Y., Shirai O., Kano K. Direct electron transfer-type bioelectrocatalysis of redox enzymes at nanostructured electrodes // Catalysts. 2020. V. 10(2). P.236.
Aladesuyi O.A., Oluwafemi O.S. Synthesis strategies and application of ternary quantum dots - in cancer therapy // Nano-Struct. Nano-Objects. 2020. V. 24. e.100568.
Alexander K., Sheshrao Gajghate S., Shankar Katarkar A., Majumder A., Bhaumik S. Role of nanomaterials and surfactants for the preparation of graphene nanofluid: a review // Mater. Today: Proc. 2020. V. 44(1). P. 1136–1143.
Andoralov V., Falk M., Suyatin D.B., Granmo M., Sotres J., Ludwig R., Popov V.O., Schouenborg J., Blum Z., Shleev S. Biofuel cell based on microscale nanostructured electrodes with inductive coupling to rat brain neurons // Sci. Rep. 2013.V. 3(1). 3270. https://doi.org/10.1038/srep03270
Arora B., Attri P. Carbon Nanotubes (CNTs): a potential nanomaterial for water purification // J. Compos. Sci. 2020. V. 4(3). P. 135.
Arshad A., Jabbal M., Yan Y., Reay D. A review on graphene based nanofluids: preparation, characterization and applications // J. Mol. Liq. 2019. V. 279. P. 444–484.
Asghary M., Raoof J.B., Rahimnejad M., Ojani R. Usage of gold nanoparticles/multi-walled carbon nanotubes-modified CPE as a nano-bioanode for enhanced power and current generation in microbial fuel cell // J. Iran. Chem. Soc. 2019. V. 16. P. 1677–1685. https://doi.org/10.1007/s13738-019-01645-y
Asha A.B., Narain R. Nanomaterials properties / Ed. Narain R. Polymer Science and Nanotechnology. Fundamentals and Applications, Elsevier Inc. 2020. P. 343–359. https://doi.org/10.1016/b978-0-12-816806-6.00015-7
Azizi S., Gholivand M.-B., Amiri M., Manouchehri I. DNA biosensor based on surface modification of ITO by physical vapor deposition of gold and carbon quantum dots modified with neutral red as an electrochemical redox probe // Microchem. J. 2020. V. 159. e.105523.
Bagyalakshmi S., Sivakami A., Balamurugan K.S. A ZnO nanorods based enzymatic glucose biosensor by immobilization of glucose oxidase on a chitosan film // Obes. Med. 2020. V. 18. e.100229.
Bai Y., Xu T., Zhang X. Graphene-based biosensors for detection of biomarkers // Micromachines (Basel). 2020. V. 11(1). e.60.
Banerjee S., Sardar M., Gayathri N., Tyagi A.K., Raj B. Conductivity landscape of highly oriented pyrolytic graphite surfaces containing ribbons and edges // Phys. Rev. B. 2005. V. 72(7). e.075418.
Bin Mohd Yusoff A.R. Applications of Graphene and Its Derivative in Enzymatic Biofuel Cells / Ed. A. Rashid Bin Mohd Yusoff: Wiley-VCH Verlag GmbH & Co, 2015. P. 371–378.
Bollella P., Fusco G., Stevar D., Gorton L., Ludwig R., Ma S., Boer H., Koivula A., Tortolini C., Favero G., Antiochia R., Mazzei F. A Glucose/oxygen enzymatic fuel cell based on gold nanoparticles modified graphene screen-printed electrode. proof-of-concept in human saliva // Sens. Actuators, B. 2018. V. 256. P. 921–930.
Brus L.E. Electron–electron and electron-hole interactions in small semiconductor crystallites: The size dependence of the lowest excited electronic state // J. Chem. Phys. 1984. V. 80(9). P. 4403–4409.
Caixeta M.B., Araújo P.S., Gonçalves B.B., Silva L.D., Grano-Maldonado M.I., Rocha T.L. Toxicity of engineered nanomaterials to aquatic and land snails: a scientometric and systematic review // Chemosphere. 2020. V. 260. e.127654.
Cao L., Kiely J., Piano M., Luxton R. Nanoparticle-based 3D membrane for impedimetric biosensor applications // Bioelectrochemistry. 2020. V. 136. e.107593.
Castro L., Li, J., González F., Muñoz J.A., Blázquez M.L. Green synthesis of tellurium nanoparticles by tellurate and tellurite reduction using Aeromonas hydrophila under different aeration conditions // Hydrometallurgy. 2020. V. 196. e.105415.
Chen L., Xie H., Li J. Electrochemical glucose biosensor based on silver nanoparticles/multiwalled carbon nanotubes modified electrode // J. Solid State Electrochem. 2012. V. 16(10). P. 3323–3329.
Chen Y., Gai P., Zhang J., Zhu J.-J. Design of an enzymatic biofuel cell with large power output // J. Mater. Chem. A. 2015. V. 3(21). P. 11511–11516.
Cheng X., Guan B. Optical biosensing and bioimaging with porous silicon and silicon quantum dots (invited review) // Prog. Electromag. Res. 2017. V. 160. P. 103–121. https://doi.org/10.2528/pier17120504
Chiappini C., De Rosa E., Martinez J.O., Liu X., Steele J., Stevens M.M., Tasciotti E. Biodegradable silicon nanoneedles delivering nucleic acids intracellularly induce localized in vivo neovascularization // Nat. Mater. 2015. V. 14(5). P. 532–539. https://doi.org/10.1038/nmat4249
Chong S.F., Razak K.A., Nor N.M., Ridhuan N.S., Zakaria N.D. Electrochemical Glucose Detection using Screen-Printed Carbon Electrode Modified Silica-Encapsulated Iron Oxide Nanoparticles // Materials Today: Proceedings. 2019. V. 17. P. 1189–1196https://doi.org/10.1016/j.matpr.2019.06.562
Christwardana M., Chung Y., Kwon Y. A new biocatalyst employing pyrenecarboxaldehyde as an anodic catalyst for enhancing the performance and stability of an enzymatic biofuel cell // NPG Asia Materials. 2017. V. 9(6). e386.
Christwardana M., Kim D.-H., Chung Y., Kwon Y. A hybrid biocatalyst consisting of silver nanoparticle and naphthalenethiol self-assembled monolayer prepared for anchoring glucose oxidase and its use for an enzymatic biofuel cell // Appl. Surf. Sci. 2018. V. 429. P. 180–186.
Cui H.-F., Zhang T.-T., Lv Q.-Y., Song X., Zhai X.-J., Wang G.-G. An acetylcholinesterase biosensor based on doping Au nanorod@SiO2 nanoparticles into TiO2-chitosan hydrogel for detection of organophosphate pesticides // Biosens. Bioelectron. 2019. V. 141. e.111452.
Cui Y., Wei Q., Park H., Lieber C.M. Nanowire nanosensors for highly sensitive and selective detection of biological and chemical species // Science. 2001. V. 293(5533). P. 1289–1292. https://doi.org/10.1126/science.1062711
Dagar K., Pundir C.S. An improved amperometric L-lactate biosensor based on covalent immobilization of microbial lactate oxidase onto carboxylated multiwalled carbon nanotubes/copper nanoparticles/polyaniline modified pencil graphite electrode // Enzyme Microb. Technol. 2017. V. 96. P. 177–186.
Delbecq F., Delfosse P., Laboureix G., Paré C., Kawai T. Study of a gelated Deep Eutectic solvent metal salt solution as template for the production of size-controlled small noble metal nanoparticles // Colloids Surf., A: Physicochem. Eng. Asp. 2019. V. 567. P. 55–62.
Dervisevic M., Dervisevic E., Şenel M. Design of amperometric urea biosensor based on self-assembled monolayer of cystamine/PAMAM-grafted MWCNT/Urease // Sens. Actuators, B: Chem. 2018. V. 254. P. 93–101.
Di Tocco A., Robledo S.N., Osuna Y., Sandoval-Cortez J., Granero A.M., Vettorazzi N.R., Martinez J.L, Segura E.P., Ilina A., Zon M.A., Arevalo F.J., Fernández H. Development of an electrochemical biosensor for the determination of triglycerides in serum samples based on a lipase/magnetite-chitosan/copper oxide nanoparticles/multiwalled carbon nanotubes/pectin composite // Talanta. 2018. V. 190. P. 30–37.
Duan X., Li Y., Rajan N.K., Routenberg D.A., Modis Y., Reed M.A. Quantification of the affinities and kinetics of protein interactions using silicon nanowire biosensors // Nature Nanotech. 2012. V. 7. P. 401–407.
Duc Chinh V., Speranza G., Migliaresi C., Van Chuc N., Minh Tan V., Phuong N.-T. Synthesis of gold nanoparticles decorated with multiwalled carbon nanotubes (Au-MWCNTs) via cysteaminium chloride functionalization // Sci. Rep. 2019. V. 9(1). P. 5667.
El Ichi-Ribault S., Alcaraz J.-P., Boucher F., Boutaud B., Dalmolin R., Boutonnat J., Cinquin P., Zebda A., Martin D.K. Remote wireless control of an enzymatic biofuel cell implanted in a rabbit for 2 months // Electrochim. Acta. 2018. V. 269. P. 360–366.
Escalona-Villalpando R.A., Ortiz-Ortega E., Bocanegra-Ugalde J.P., Minteer S.D., Arriaga L.G., Ledesma-García J. A complete tattoo-based wireless biofuel cell using lactate directly from sweat as fuel // J. Phys. Conf. Ser. 2019.V. 1407. e.012028.
Falk M., Andoralov V., Silow M., Toscano M.D., Shleev S. Miniature biofuel cell as a potential power source for glucose-sensing contact lenses // Anal. Chem. 2013. V. 85(13). P. 6342–6348.
Fan X., Nie W., Tsai H., Wang N., Huang H., Cheng Y., Wen R., Ma L., Yan F., Xia Y. PEDOT: PSS for flexible and stretchable electronics: modifications, strategies, and applications // Adv. Sci. 2019. e.1900813.
Fatima B., Hussain D., Bashir S., Hussain H.T., Aslam R., Nawaz R., Rashid H.N, Bashir N., Majeed S., Ashiq M.N., Najam-ul-Haq M. Catalase immobilized Antimonene quantum dots used as an electrochemical biosensor for quantitative determination of H2O2 from CA-125 diagnosed ovarian cancer samples // Mater. Sci. Eng., C. 2020. e.111296.
Filip J., Tkac J. Is graphene worth using in biofuel cells? // Electrochim. Acta. 2014. V. 136. P. 340–354.
Forest V., Pourchez J. Preferential binding of positive nanoparticles on cell membranes is due to electrostatic interactions: A too simplistic explanation that does not take into account the nanoparticle protein corona // Mater. Sci. Eng. C. 2017. V. 70. P. 889–896. https://doi.org/10.1016/j.msec.2016.09.016
Furubayashi M., Wallace A.K., González L.M., Jahnke J.P., Hanrahan B.M., Payne A.L., Stratis-Cullum D.N., Gray M.T., Liu H., Rhoads M.K., Voigt C.A. Genetic tuning of iron oxide nanoparticle size, shape, and surface properties in Magnetospirillum magneticum // Adv. Funct. Mater. 2020. e.2004813.
Gericke M., Pinches A. Biological synthesis of metal nanoparticles // Hydrometallurgy. 2006. V. 83. № 1–4. P. 132–140.
Golshan M., Rostami-Tapeh-Esmail E., Salami-Kalajahi M., Roghani-Mamaqani H. A review on synthesis, photophysical properties, and applications of dendrimers with perylene core // Eur. Polym. J. 2020. V. 137. e.109933.
Gonzalez-Solino C., Lorenzo M. Enzymatic fuel cells: towards self-powered implantable and wearable diagnostics // Biosensors. 2018. V. 8(1). P. 11.
Groenendaal L., Jonas F., Freitag D., Pielartzik H., Reynolds J.R. Poly(3,4-ethylenedioxythiophene) and its derivatives: past, present, and future // Adv. Mater. 2000. V. 12(7). P. 481–494.
Guler M., Dilmac Y. Palladium nanoparticles decorated (3-aminopropyl)triethoxysilane functionalized reduced graphene oxide for electrochemical determination of glucose and hydrogen peroxide // J. Electroanal. Chem. 2019. V. 834. P. 49–55. https://doi.org/10.1016/j.jelechem.2018.12.052
He B., Liu H. Electrochemical biosensor based on pyruvate oxidase immobilized AuNRs@Cu2O-NDs as electroactive probes loaded poly (diallyldimethylammonium chloride) functionalized graphene for the detection of phosphate // Sens. Actuator B-Chem. 2020. V. 304. e.27303.
Hong S., Bielinska A.U., Mecke A., Keszler B., Beals J.L., Shi X., Balogh L., Orr B.J., Baker J.B., Banaszak M.M. Interaction of poly(amidoamine) dendrimers with supported lipid bilayers and cells: hole formation and the relation to transport // Bioconjug. Chem. 2004. V. 15. № 4. P. 774–782.
Hossain M.F., Slaughter G. PtNPs decorated chemically derived graphene and carbon nanotubes for sensitive and selective glucose biosensing // J. Electroanal. Chem. 2020. V. 861. e.113990. https: doi.org/https://doi.org/10.1016/j.jelechem.2020.113990
Hua Z., Yu T., Liu D., Xianyu Y. Recent advances in gold nanoparticles-based biosensors for food safety detection // Biosens. Bioelectron. 2021. V. 179. e.13076.
Hwang H.S., Jeong J.W., Kim Y.A., Chang M. Carbon nanomaterials as versatile platforms for biosensing applications // Micromachines. 2020. V. 11(9). 814.
Ihalainen P., Pesonen M., Sund P., Viitala T., Määttänen A., Sarfraz, J., Wilén C.-E., Österbacka R., Peltonen J. Printed biotin-functionalised polythiophene films as biorecognition layers in the development of paper-based biosensors // Appl. Surf. Sci. 2016. V. 364. P. 477–483.
Iijima S. Helical microtubules of graphitic carbon // Nature. 1991. V. 354(6348). P. 56–58.
Italiano F., Agostiano A., Belviso B.D., Caliandro R., Carrozzini B., Comparelli R., Melillo M.T., Mesto E., Tempesta G., Trotta M. Interaction between the photosynthetic anoxygenic microorganism Rhodobacter sphaeroides and soluble gold compounds. From toxicity to gold nanoparticle synthesis // Colloids Surf., B. 2018. V. 172. P. 362–371.
Ivanov Y.D., Pleshakova T.O., Kozlov A.F., Malsagova K.A., Krohin N.V., Shumyantseva V.V., Shumov I.D., Popov V.P., Archakov A.I., Naumova O.V., Fomin B.I., Nasimov D.A., Aseev A.L. SOI nanowire for the high-sensitive detection of HBsAg and α-fetoprotein // Lab on a Chip: Miniaturisation for Chemistry and Biology. 2012. V. 12(23). P. 5104–5111.
Jain R., Jadon N., Pawaiya A. Polypyrrole based next generation electrochemical sensors and biosensors: a review // TrAC. 2017. V. 97. P. 363–373. https: doi.org/https://doi.org/10.1016/j.trac.2017.10.009
Jha A.K., Prasad K., Kulkarni A.R. Synthesis of TiO2 nanoparticles using microorganisms // Colloids Surf., B. 2009. V. 71(2). P. 226–229.
Ji X., Wang H., Song B., Chu B., He Y. Silicon nanomaterials for biosensing and bioimaging analysis // Front. Chem. 2018. V. 6. 38.
Jonas F., Heywang G., Schmidtberg W., Heinze J., Dietrich M. (Bayer AG), European Patent, 339–340, 1988.
Kang S.J. Titanium dioxide nanoparticles trigger p53-mediated damage response in peripheral blood lymphocytes // Environ. Mol. Mutagen. 2008. V. 49. № 5. P. 399–405.
Kang X., Mai Z., Zou X., Cai P., Mo J. Glucose biosensors based on platinum nanoparticles-deposited carbon nanotubes in sol–gel chitosan/silica hybrid // Talanta. 2008. V. 74(4). P. 879–886.
Kaur R., Rana S., Lalit K., Singh P., Kaur K. Electrochemical detection of methyl parathion via a novel biosensor tailored on highly biocompatible electrochemically reduced graphene oxide-chitosan-hemoglobin coatings // Biosens. Bioelectron. 2020. V. 167. e.112486.
Kaura I.P., Bhanarib R., Bhanarib S., Kakkara V. Potential of solid lipid nanoparticles in brain targeting // J. Controlled Release. 2008. V. 127. № 2. P. 97–109.
Kazemi F., Naghib S.M., Mohammadpour Z. Multifunctional micro-/nanoscaled structures based on polyaniline: an overview of modern emerging devices // Mater. Today Chem. 2020. V. 16. e.100249.
Khan I., Saeed K., Khan I. Nanoparticles: properties, applications and toxicities // Arab. J. Chem. 2019. V. 12. P. 908–931.
Kilele J.C., Chokkareddy R., Rono N., Redhi G.G. A novel electrochemical sensor for selective determination of theophylline in pharmaceutical formulations // J. Taiwan Inst. Chem. Eng. 2020. V. 111. P. 228–238.
Kim C., Kim J.R., Heo J. Enhancement of bioelectricity generation by a microbial fuel cell using Ti nanoparticle modified carbon electrode // J. Chem. Technol. Biotechnol. 2019. V. 94. P. 1622–1627.
Kizling M., Dzwonek M., Nowak A., Tymecki Ł., Stolarczyk K., Więckowska A., Bilewicz R. Multi-substrate biofuel cell utilizing glucose, fructose and sucrose as the anode fuels // Nanomaterials. 2020. V. 10(8). e.1534.
Korobeinyk A.V., Whitby R.D.L., Mikhalovsky S.V., Inglezakis V.J. In situ production of high purity noble metal nanoparticles on fumed silica and catalytic activity towards 2-nitrophenol reduction // J. Phys. Chem. Solids. 2019. V. 127. P. 28–34.
Kshetri T., Tran D.T., Le H.T., Nguyen D.C., Hoa V.H., Kim N.H., Lee J.H. Recent Advances in MXene-based nanocomposites for electrochemical energy storage applications // Prog. Mater. Sci. 2021. V. 117. e.100733.
Kucherenko I., Soldatkin A., Kucherenko D., Soldatkina O., Dzyadevych S.V. Advances in nanomaterial application in enzyme-based electrochemical biosensors: a review // Nanoscale Advances. 2019. V. 1. e.4560.
Kumar A., Sharma S., Pandey L.M., Chandra P. Nanoengineered material based biosensing electrodes for enzymatic biofuel cells applications // Materials Science for Energy Technologies. 2018. V. 1(1). P. 38–48.
Kumar H., Kumari N., Sharma R. Nanocomposites (conducting polymer and nanoparticles) based electrochemical biosensor for the detection of environment pollutant: its issues and challenges // Environ. Impact Assess Rev. 2020. V. 85. e.106438. https:doi.oeg/10.1016/j.eiar.2020.106438
Kumar T.H.V., Sundramoorthy A.K. Electrochemical biosensor for methyl parathion based on single-walled carbon nanotube/glutaraldehyde crosslinked acetylcholinesterase-wrapped bovine serum albumin nanocomposites // Anal. Chim. Acta. 2019. V. 1074. P. 131–141.
Lahcen A.A., Rauf S., Beduk T., Durmus C., Aljedaibi A., Timur, S., Alshreef H.N., Amine A., Wolfbeis O.S., Salama K.N. Electrochemical sensors and biosensors using laser-derived graphene: a comprehensive review // Biosens. Bioelectron. 2020. V. 168. e.112565.
Lata S., Batra B., Kumar P., Pundir C.S. Construction of an amperometric d-amino acid biosensor based on d-amino acid oxidase/carboxylated mutliwalled carbon nanotube/copper nanoparticles/polyalinine modified gold electrode // Anal. Biochem. 2013a. V. 437(1). P. 1–9.
Lata S., Batra B., Singala N., Pundir C.S. Construction of amperometric l-amino acid biosensor based on l-amino acid oxidase immobilized onto ZnONPs/c-MWCNT/PANI/AuE // Sens. Actuator B-Chem. 2013б. V. 188. P. 1080–1088.
Lee M.-K., Lee Y.J., Kang J.Y., Lee S.H. Strong enzyme immobilization associated by anatase TiO2 sputtered on platinum black nanoclusters to improve sensitivity and long-term stability of electrochemical cholesterol sensor // Sens. Actuator B-Chem. 2021. V. 334. e.129617.
Lenardi A.A., Faro M.J.L., Irrere A. Biosensing platforms based on silicon nanostructures: A critical review // Anal. Chim. Acta. 2021. V. 1160. 338393.
Li X., Xu H., Chen Z.-S., Chen G. Biosynthesis of nanoparticles by microorganisms and their applications // J. Nanomater. 2011. V. 2011. P. 1–16.
Liu J., Fan Y., Chen G., Liu Y. Highly sensitive glutamate biosensor based on platinum nanoparticles decorated MXene-Ti3C2Tx for l-glutamate determination in foodstuffs // Food Sci. Technol. 2021. V. 148. e.111748.
Long T.C., Tajuba J., Sama P., Saleh N., Swartz C., Parker J., Hester S., Lowry G.V., Veronesi B. Nanosize titanium dioxide stimulates reactive oxygen species in brain microglia and damages neurons in vitro // Environ. Health. Perspect. 2007. V. 115(11). P. 1631–1637.
Lorencova L., Bertok T., Dosekova E., Holazova A., Paprckova D., Vikartovska A., Sasinkova V., Filip J., Kasak P., Jerigova M., Velic D., Mahmoud K.A., Tkac J. Electrochemical performance of Ti3C2Tx MXene in aqueous media: towards ultrasensitive H2O2 sensing // Electrochim. Acta. 2017. V. 235. P. 471–479.
Lorencova L., Bertok T., Filip J., Jerigova M., Velic D., Kasak P., Mahmoud K.A., Tkac J. Highly stable Ti3C2Tx (MXene)/Pt nanoparticles-modified glassy carbon electrode for H2O2 and small molecules sensing applications // Sens. Actuators, B. 2018. V. 263. P. 360–368.
Mahe L.S.A., Green S.J., Winlove C.P., Jenkins A.T.A. Pyrene-wired antibodies on highly oriented pyrolytic graphite as a label-free impedance biosensor for the sepsis biomarker procalcitonin // J. Solid State Electrochem. 2014. V. 18(12). P. 3245–3249.
Mallakpour S., Soltanian S. Surface functionalization of carbon nanotubes: fabrication and applications // RSC Advances. 2016. V. 6(111). P. 109916–109935.
Mathelié-Guinlet M., Cohen-Bouhacina T., Gammoudi I., Martin A., Béven L., Delville M.-H., Grauby-Heywang C. Silica nanoparticles-assisted electrochemical biosensor for the rapid, sensitive and specific detection of Escherichia coli // Sens. Actuators B Chem. 2019. V. 292. P. 314–320.
Miernicki M., Hofmann T., Eisenberger I., von der Kammer F., Praetorius A. Legal and practical challenges in classifying nanomaterials according to regulatory definitions // Nat. Nanotechnol. 2019. V. 14. P. 208–216.
Mohanta D., Patnaik S., Sood S., Das N. Carbon nanotubes: evaluation of toxicity at biointerfaces // J. Pharm. Anal. 2019. V. 9. P. 293–300.
Mohtar L., Aranda P., Messina G.A., Nazareno M.A., Pereira S.V., Raba J., Bertolino F.A. Amperometric biosensor based on laccase immobilized onto a nanostructured screen-printed electrode for determination of polyphenols in propolis // Microchem. J. 2019. V.144. P. 13–18.
Naguib M., Kurtoglu M., Presser V., Lu J., Niu J., Heon M., Hultman Y., Barsoum M.W. Two-dimensional nanocrystals produced by exfoliation of Ti3AlC2 // Adv. Mater. 2011. V. 23(37). P. 4248–4253.
Namdari P., Daraee H., Eatemadi A. Recent advances in silicon nanowire biosensors: synthesis methods, properties, and applications // Nanoscale Res. Lett. 2016. V. 11(1). e.406. https://doi.org/10.1186/s11671-016-1618-z
Navalón S., García H. Nanoparticles for catalysis // Nanomaterials. 2016. V. 6(7). e.123. https://doi.org/10.3390/nano6070123
Nazari N., Jookar Kashi F. A novel microbial synthesis of silver nanoparticles: its bioactivity, Ag/Ca-Alg beads as an effective catalyst for decolorization disperse blue 183 from textile industry effluent // Sep. Purif. Technol. 2020. e.118117.
Negm N.A., Abubshait H.A., Abubshait S.A., Abou Kana M.T.H., Mohamed E.A., Betiha M.M. Performance of chitosan polymer as platform during sensors fabrication and sensing applications // Int. J. Biol. Macromol. 2020. V. 165. P. 402–435.
Nohwal B., Chaudhary R., Pundir C.S. Amperometric L-lysine determination biosensor amplified with L-Lysine oxidase nanoparticles and graphene oxide nanoparticles // Process Biochem. 2020. V. 97. P. 57–63.
Noor M.O., Krull U.J. Silicon nanowires as field-effect transducers for biosensor development: a review // Anal. Chim. Acta. 2014. V. 825. P. 1–25.
Novoselov K.S., Geim A.K., Morozov S.V., Jiang D., Zhang Y., Dubonos S.V., Grigorieva I.V., Firsov A.A. Electric field effect in atomically thin carbon films // Science. 2004. V. 306. P. 666–669.
Núñez C., Triviño J.J., Arancibia V. A electrochemical biosensor for As(III) detection based on the catalytic activity of Alcaligenes faecalis immobilized on a gold nanoparticle–modified screen–printed carbon electrode // Talanta. 2020. e.121702.
Othman A.M., Wollenberger U. Amperometric biosensor based on coupling aminated laccase to functionalized carbon nanotubes for phenolics detection // Int. J. Biol. Macromol. 2020. V. 153. P. 855–864.
Pasula R.R., Lim S. Engineering nanoparticle synthesis using microbial factories // Engineering Biology. 2017. V. 1(1). P. 12–17.
Patil M.P., Kim G.-D. Marine microorganisms for synthesis of metallic nanoparticles and their biomedical applications // Colloids Surf. B. 2018. V. 172. P. 487–495.
Peña-Bahamonde J., Nguyen H.N., Fanourakis S.K., Rodrigues D.F. Recent advances in graphene-based biosensor technology with applications in life sciences // J. Nanobiotechnology. 2018. V. 16(1). e. 75.
Perveen R., Inamuddin, Nasar A., Beenish, Asiri A.M. Synthesis and characterization of a novel electron conducting biocomposite as biofuel cell anode // Int. J. Biol. Macromol. 2018. V. 106. P. 755–762.
Plachá D., Jampilek J. Graphenic materials for biomedical applications // Nanomaterials (Basel). 2019. V. 9(12). e.1758.
Plekhanova Y., Tarasov S., Bykov A., Prisyazhnaya N., Kolesov V., Sigaev V., Signore M.A., Reshetilov A. Multiwalled carbon nanotubes and the electrocatalytic activity of Gluconobacter oxydans as the basis of a biosensor // Biosensors. 2019. V. 9(4). e.137.
Prabha S., Durgalakshmi D., Rajendran S., Lichtfouse E. Plant-derived silica nanoparticles and composites for biosensors, bioimaging, drug delivery and supercapacitors: a review // Environ. Chem. Lett. 2021. V. 19. P. 1667–1691.
Puppo F., Carrara S., De Micheli G. Silicon nanowires for biosensing / reference module in chemistry, molecular sciences and chemical engineering. isevier Inc, 2017. P. 499–510. https://doi.org/10.1016/b978-0-12-409547-2.13479-1
Qing Z., Bai A., Xing S., Zou Z., He X., Wang K., Yang R. Progress in biosensor based on DNA-templated copper nanoparticles // Biosens. Bioelectron. 2019. V. 137. P. 96–109. https://doi.org/10.1016/j.bios.2019.05.014
Rabiee N., Ahmadvand S., Ahmadi S., Fatahi Y., Dinarvand R., Bagherzadeh M., Rabiee M., Tahriri M., Tayebi L., Hamblin M.R. Carbosilane dendrimers: grug and gene delivery applications // J. Drug Deliv. Sci. Technol. 2020. V. 59. e.101879.
Ratautas D., Tetianec L., Marcinkevičienė L., Meškys R., Kulys J. Bioanode with alcohol dehydrogenase undergoing a direct electron transfer on functionalized gold nanoparticles for an application in biofuel cells for glycerol conversion // Biosens. Bioelectron. V. 2017. V. 98. P. 215–221.
Rawat N.K., Ghosh R. Conducting polymer–based nanobiosensors / Eds. Han B., Nguyen T.A., Singh P.K., Tomer V.K., Farmani A. Nanosensors for Smart Cities, Elsevier Inc, 2020. P. 129–142. https:doi.org/https://doi.org/10.1016/b978-0-12-819870-4.00008-6
Reshetilov A.N., Kitova A.E., Kolesov V.V., Yaropolov A.I. Mediator-free bioelectrocatalytic oxidation of ethanol on an electrode from thermally expanded graphite modified by Gluconobacter oxydans membrane fractions // Electroanalysis. 2015. V. 27. № 6. P. 1443–1448.
Reza Jamei H., Rezaei B., Asghar Ensafi A. Ultra-sensitive and selective electrochemical biosensor with aptamer recognition surface based on polymer quantum dots and C60/MWCNTs-polyethylenimine nanocomposites for analysis of thrombin protein // Bioelectrochemistry. 2020. V. 138. e.107701.
Sadhasivam S., Vinayagam V., Balasubramaniyan M. Recent advancement in biogenic synthesis of iron nanoparticles // J. Mol. Struct. 2020. V. 1217.e. 128372.
Sahyar B.Y., Kaplan M., Ozsoz M., Celik E., Otles S. Electrochemical xanthine detection by enzymatic method based on Ag doped ZnO nanoparticles by using polypyrrole // Bioelectrochemistry. 2019. V. 130. e.107327.
Saleh T.A. Nanomaterials: Classification, properties, and environmental toxicities // Environ. Technol. Innov. 2020. V. 20. e.101067.
Sarma M.K., Quadir M.G.A., Bhaduri R., Kaushik S., Goswami P. Composite polymer coated magnetic nanoparticles based anode enhances dye degradation and power production in microbial fuel cells // Biosens. Bioelectron. 2018. V. 119. P. 94–102.
Sarycheva A., Gogotsi Y. Raman spectroscopy analysis of structure and surface chemistry of Ti3C2Tx MXene // Chem. Mater. 2020. V. 32. P. 3480–3488.
Sasaki S., Karube I. The development of microfabricated biocatalytic fuel cells // Trends Biotechnol. 1999. V. 17(2). P. 50–52.
Shakeel N., Ahamed M.I., Ahmed A., Inamuddin, Rahman M.M., Asiri A.M. Functionalized magnetic nanoparticle-reduced graphene oxide nanocomposite for enzymatic biofuel cell applications // Int. J. Hydrog. Energy. 2019. V. 44(52). P. 28294–28304.
Sheikhzadeh E., Beni V., Zourob M. Nanomaterial application in bio/sensors for the detection of infectious diseases // Talanta. 2020. e.122026.
Shetti N.P., Bukkitgar S.D., Reddy K.R., Reddy C.V., Aminabhavi T.M. Nanostructured titanium oxide hybrids-based electrochemical biosensors for healthcare applications // Colloids Surf. B. 2019a. V. 178. P. 385–394.
Shetti N.P., Bukkitgar S.D., Reddy K.R., Reddy C.V., Aminabhavi T.M. ZnO-based nanostructured electrodes for electrochemical sensors and biosensors in biomedical applications // Biosens. Bioelectron. 2019б. V. 141. e.111417.
Shi D., Guo Z., Bedford N. Nanomaterials and Devices. Elsevier Inc, 2015. 347 p. https://doi.org/10.1016/C2012-0-03204-8
Singh P., Kim Y.-J., Zhang D., Yang D.-C. Biological synthesis of nanoparticles from plants and microorganisms // Trends Biotechnol. 2016. V. 34(7). P. 588–599.
Smutok O., Kavetskyy T., Prokopiv T., Serkiz R., Wojnarowska-Nowak R., Šauša O., Novák I., Berek D., Melman A., Gonchar M. New micro/nanocomposite with peroxidase-like activity in construction of oxidases-based amperometric biosensors for ethanol and glucose analysis // Anal. Chim. Acta. 2021. V. 1143. P. 201–209. https://doi.org/10.1016/j.aca.2020.11.052
Sun M., Xin T., Ran Z., Pei X., Ma C., Liu J., Cao M., Bai J., Zhou M. A Bendable biofuel cell-based fully integrated biomedical nanodevice for point-of-care diagnosis of scurvy // ACS Sens. 2021. V. 6(1). P. 275–284.
Tahar A.B., Szymczyk A., Tingry S., Vadgama P., Zelsmanne M., Tsujumura S., Cinquin P., Martin D., Zebda A. One-year stability of glucose dehydrogenase confined in a 3D carbon nanotube electrode with coated poly-methylene green: application as bioanode for a glucose biofuel cell // J. Electroanal. Chem. 2019. V. 847. e.113069.
Talooki E.F., Ghorbani M., Rahimnejad M., Lashkenari M.S. Evaluation of a visible light-responsive polyaniline nanofiber˗cadmium sulfide quantum dots photocathode for simultaneous hexavalent chromium reduction and electricity generation in photo-microbial fuel cell // J. Electroanal. Chem. 2020. V. 873. e.114469.
Tao X., Wang X., Liu B., Liu J. Conjugation of antibodies and aptamers on nanozymes for developing biosensors // Biosens. Bioelectron. 2020. V. 168. e.112537.https://doi.org/10.1016/j.bios.2020.112537
Tasviri M., Rafiee-Pour H.-A., Ghourchian H., Gholami M.R. Amine functionalized TiO2–carbon nanotube composite: synthesis, characterization and application to glucose biosensing // Appl. Nanosci. 2011. V. 1(4). P. 189–195.
Tehrani Z., Thomas D.J., Guy O.J. Electrochemical biofunctionalization of highly oriented pyrolytic graphite for immunosensor applications. // J. Surface Science and Nanotechnology. 2016. V. 14. P. 193–197.
Tomalia D.A., Baker H., Dewald J., Hall M., Kallos G., Martin S., Roeck J., Ryder J, Smith P. A new class of polymers: starburst-dendritic macromolecules // Polym. J. 1985. V. 17. P. 117–132.
Tomalia D.A., Dewald J.R., Hall M.R., Martin S.J., Smith P.B. Preprints of the 1st SPSJ International Polymer Conference, Society of Polymer Science Japan, Kyoto, 1984. P. 65.
Venkateshalu S., Grace A.N. MXenes – A new class of 2D layered materials: Synthesis, properties, applications as supercapacitor electrode and beyond // Appl. Mater. Today. 2020. V. 18. 100509.
Vennila R., Hasina Banu A., Kamaraj P., Devikala S., Arthanareeswari M., Arockia selvi J., Pushpamalini T., Buela J.G., Priya D., Sivasankari R. A novel glucose sensor using green synthesized Ag Doped CeO2 nanoparticles // Materials Today: Proceedings. 2018. V. 5(2). P. 8683–8690.
Verma M.L., Naebe M., Barrow C.J., Puri M. Enzyme immobilisation on amino-functionalised multi-walled carbon nanotubes: structural and biocatalytic characterisation // PLoS ONE. 2013. V. 8(9). e.73642.
Viet N.X., Hoan N.X., Takamura Y. Development of highly sensitive electrochemical immunosensor based on single-walled carbon nanotube modified screen-printed carbon electrode // Mater. Chem. Phys. 2019. V. 227. P. 123–129.
Vogtle F., Buhleier E.W., Wehner W. Cascade and nonskid-chain-like syntheses of molecular cavity topologies // Synthesis. 1978. V. 2. P. 155–158.
Walther B.K., Dinu C.Z., Guldi D.M., Sergeyev V.G., Creager S.E., Cooke J.P., Guiseppi-Elie A. Nanobiosensing with graphene and carbon quantum dots: recent advances // Mater. Today. 2020. V. 39. P. 23–46.
Wang L., Hao L., Qi W., Huo X., Xue L., Liu Y., … Lin J. A sensitive Salmonella biosensor using platinum nanoparticle loaded manganese dioxide nanoflowers and thin-film pressure detector // Sens. Actuator B-Chem. 2020. V. 321. e.128616.
Waris A., Din M., Ali A., Ali M., Afridi S., Baset A., Ullah Khan A. A Comprehensive review of green synthesis of copper oxide nanoparticles and their diverse biomedical applications // Inorg. Chem. Commun. 2020. V. 123. e.108369.
Wen G., Wen X., Shuang S., Choi M.M.F. Whole-cell biosensor for determination of methanol // Sens. Actuator B-Chem. 2014. V. 201. P. 586–591.
Wen H.-W. Applications of nanotechnology in developing biosensors for food safety / Eds. Cheung P.C.K., Mehta B.M. Handbook of Food Chemistry, Springer-Verlag Berlin Heidelberg, 2015. P. 1103–1136.
Wu D., Ma Y., Cao Y., Zhang T. Mitochondrial toxicity of nanomaterials // Sci. Total Environ. 2019. e.134994.
Wu G., Gao Y., Zhao D., Ling P., Gao F. Methanol/oxygen enzymatic biofuel cell using laccase and NAD+-dependent dehydrogenase cascades as biocatalysts on Carbon Nanodots Electrodes // ACS Appl. Mater. Interfaces. 2017. V. 9(46). P. 40978–40986.
Wu X., Xiong X., Owens G., Brunetti G., Zhou J., Yong X., Xie X., Zhang L., Wei P., Jia H. Anode modification by biogenic gold nanoparticles for the improved performance of microbial fuel cells and microbial community shift // Bioresour. Technol. 2018. V. 270, P. 11–19.
Yadav D., Amini F., Ehrmann A. Recent advances in carbon nanofibers and their applications – a review // Eur. Polym. J. 2020. e.109963.
Yang B., Zhang S., Fang X., Kong J. Double signal amplification strategy for ultrasensitive electrochemical biosensor based on nuclease and quantum dot-DNA nanocomposites in the detection of breast cancer 1 gene mutation // Biosens. Bioelectron. 2019. V. 142. e.111544.
Yin J., Dong Z., Liu Y., Wang H., Li A., Zhuo Z., Feng W., Fan W. Toxicity of reduced graphene oxide modified by metals in microalgae: Effect of the surface properties of algal cells and nanomaterials // Carbon. 2020. V. 169. P. 182–192.
Yola M.L., Atar N. Development of candiac troponin-I biosensor based on boron nitride quantum dots Including molecularly imprinted Polymer // Biosens. Bioelectron. 2018. V. 126. P. 418–424. https://doi.org/10.1016/j.bios.2018.11.016
Yoon H., Nah J., Kim H., Ko S., Sharifuzzaman M., Barman S.C., Xuan X., Kim J., Park J.Y. A chemically modified laser-induced porous graphene based flexible and ultrasensitive electrochemical biosensor for sweat glucose detection // Sens. Actuator B-Chem. 2020. V. 311. e.127866.
Yu C.-X., Xiong F., Liu L.-L. Electrochemical biosensors with silver nanoparticles as signal labels // Int. J. Electrochem. Sci. 2020. V. 15. P. 3869–3890. https://doi.org/10.20964/2020.05.53
Zhang C., Cai X. Immobilization of horseradish peroxidase on Fe3O4/nanotubes composites for biocatalysis-degradation of phenol // Compos. Interfaces. 2018. V. 26(5). P. 379–396.
Zhang Y., Huang S. Significant improvements in the mechanical properties of chitosan functionalized carbon nanotubes/epoxy composites // RSC Advances. 2016. V. 6(31). P. 26210–26215.
Zhang Y., Yang M., Portney N.G., Cui D., Budak G., Ozbay E., Ozkan M., Ozkan C.S. Zeta potential: a surface electrical characteristic to probe the interaction of nanoparticles with normal and cancer human breast epithelial cells // Biomed. Microdevices. 2007. V. 10(2). P. 321–328.
Zhao Y.-L., Stoddart J.F. Noncovalent functionalization of single-walled carbon nanotubes // Acc. Chem. Res. 2009. V. 42(8). P. 1161–1171.
Zhong Y., Sun X., Wang S., Peng F., Bao F., Su Y., Li Y., Lee S.-T., He Y. Facile, large-quantity synthesis of stable, tunable-color silicon nanoparticles and their application for long-term cellular imaging // ACS Nano. 2015. V. 9(6). P. 5958–5967. https://doi.org/10.1021/acsnano.5b00683
Zhou C., Zou H., Sun C., Li Y. Recent advances in biosensors for antibiotic detection: Selectivity and signal amplification with nanomaterials // Food Chem. 2021. V. 361(1). e.130109. https://doi.org/10.1016/j.foodchem.2021.130109
Zhou X., Wang Y., Gong C., Liu B., Wei G. Production, structural design, functional control, and broad applications of carbon nanofiber-based nanomaterials: A comprehensive review // Chem. Eng. J. 2020. V. 402. e.126189.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая