Известия РАН. Серия биологическая, 2022, № 5, стр. 482-488
Фенотипическая изменчивость и наследование нетипичной формы anterior lobe M1 копытных леммингов (Dicrostonyx, Rodentia, Arvicolinae)
М. И. Чепраков *
Институт экологии растений и животных УрО РАН
620144 Екатеринбург, Россия
* E-mail: Cheprakov@ipae.uran.ru
Поступила в редакцию 28.07.2021
После доработки 20.01.2022
Принята к публикации 25.03.2022
- EDN: NFINYK
- DOI: 10.31857/S1026347022050055
Аннотация
В работе изложено описание отклонений от типичной формы anterior lobe M1 (консервативный элемент жвательной поверхности) у копытных леммингов (Dicrostonyx) и выяснение характера их наследования на материале из лабораторных колоний. Фенотипы нетипичной формы отличаются по степени сложности. Особи, имеющие нетипичную форму anterior lobe, являются рецессивными гомозиготами. Какой фенотип реализует рецессивная гомозигота зависит от различных факторов, таких как номер выводка или частота самцов в семье. Вероятно, эти факторы могут взаимодействовать в своем влиянии на частоту проявления рецессивных гомозигот. Полиморфизм изучаемого признака обладает существенным эволюционным потенциалом и открывает новое направление эволюционных преобразований жевательной поверхности коренных зубов в подсемействе Arvicolinae.
Anterior lobe (передняя непарная петля) M1 (первого верхнего моляра) является консервативным элементом жевательной поверхности не только у копытных леммингов Dicrostonyx (Gloger, 1841), но и во всем подсемействе Arvicolinae (Агаджанян, 2009). В этой группе основная изменчивость жевательной поверхности верхних моляров сосредоточена в задней их части, нижних моляров – в передней (Бородин, 2009). Это связывают с жевательными движениями, происходящими, в основном, в передне-заднем направлении (Громов, Поляков, 1977). Недавно было показано, что в выборках из лабораторных колоний копытных леммингов может встречаться нетипичная форма anterior lobe M1 (Markova, Smirnov, 2018). У грызунов мутантные гены, вызывающие изменения фенотипов моляров в то числе M1, приводят преимущественно к появлению таких атавистических признаков, как дополнительные зубы (Marangoni et al., 2015). Особое значение имеют такие новые мутации, которые способствуют появлению ранее неизвестных фенотипических структур зубов (Hulsey et al., 2020). Именно такая мутация лежит в основе той фенотипической изменчивости, которая представлена в настоящей работе.
Целью настоящей работы является: выявление и описание фенотипической изменчивости отклонений от типичной формы anterior lobe M1Dicrostonyx и выяснение характера наследования этой нетипичной формы anterior lobe M1 на материале из лабораторных колоний.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на леммингах, содержащихся при свободном доступе к воде и корму, комнатной температуре (17 ± 2.0°C) и естественном, сезонном изменении фотопериода (Екатеринбург, 56°48′ с.ш.). При рождении детенышей индивидуально метили, в 25–30 дней отсаживали их от родителей, а в 1.5–2 мес. формировали пары. В качестве корма большую часть года давали морковь, яблоки, зерна овса в шелухе и ивовые прутья. Летом кормили травяной смесью, овсом и ивой.
В исследовании использовали выборки черепов из четырех лабораторных колоний. Время содержания колоний составляло 1–1.5 года. Были получены потомки до четвертого поколения включительно.
Основатели первой колонии были пойманы на стационаре “Еркута”, недалеко от устья р. Паютаяха, юго-запад п-ова Ямал (68°13′ с.ш., 69°09′ в.д.) в начале августа 2004 г. Популяция копытных леммингов находилась на низкой стадии цикла численности. Оценки численности и плотности, сделанные автором при отлове основателей лабораторной колонии, составляли 3 ± 2 экз. на 100 лов.-сут и 0.3 ± 0.2 экз./га. Основателями стали 1 самец, 4 самки, черепов – 57 шт.
Основатели второй и третьей колоний были пойманы на стационаре “Хадыта” в бассейне р. Хадытаяха, юг п-ова Ямал (66°59′ с.ш., 69°33′ в.д.). Летом 1984 г. около двух десятков леммингов было завезено в виварий. Из них основателями колонии стали 6 самцов и 7 самок. В этом году была низкая стадия популяционного цикла – 0.2 экз./га (Балахонов и др., 1997), черепов – 101 шт.
Летом 1985 г. копытные лемминги были завезены с пиковой стадии популяционного цикла – 5 экз./га (Балахонов и др., 1997). Основателями стали 6 самцов и 6 самок, черепов – 103 шт.
Летом 1984 г. из заповедника на о-ве Врангеля привезли копытных леммингов, из которых была сформирована четвертая лабораторная колония. Популяция леммингов находилась на низкой стадии цикла численности – около 6 экз. на 100 лов.-сут (Денисенко, 1986). Основателями стали 8 самцов и 12 самок, черепов – 167 шт.
Первые три выборки относятся к виду Dicrostonyx torquatus (Pallas, 1778), четвертая к Dicrostonyx groenlandicus (Trail, 1823) (Abramson, Lissovsky, 2012). Материалы хранятся в Музее ИЭРиЖ УрО РАН, г. Екатеринбург.
Выявленный признак обозначен как нетипичная форма (atypical form) anterior lobe M1, а фенотип, маркированный этим признаком, обозначен как af. Фенотип типичной формы anterior lobe M1Dicrostonyx обозначен как TF.
Фенотип TF представлен двумя вариантами морфотипа (рис. 1, 1А и 1В). Для них характерно наличие выпуклой передней поверхности anterior lobe M1. Варианты отличаются степенью выпуклости передней поверхности этой передней доли: у 1А она более выпуклая, чем у – 1 В. Рис. 1 составлен из цифровых фотографий зубов отдельных особей.
Рис. 1.
Морфотипическая изменчивость anterior lobe (выделено прямоугольником) M1 у копытных леммингов. 1A и 1B – варианты типичной формы anterior lobe. 2.1A–2.4B – варианты нетипичной формы anterior lobe.
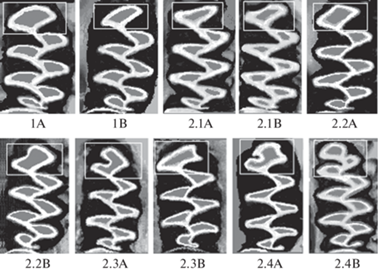
Фенотип af представлен четырьмя морфотипами (рис. 1, 2.1A–2.4B). Первый морфотип af имеет прямую (2.1A) или вогнутую (2.1B) переднюю поверхность передней доли M1. Во втором морфотипе af передняя доля M1 имеет форму ромба (2.2A) или ромба с прогибом (2.2B). В третьем морфотипе af на передней доле M1 присутствует один входящий угол: дополнительный буккальный входящий угол (BRA0, 2.3A) либо дополнительный лингвальный входящий угол (LRA0, 2.3B). В четвертом морфотипе af на передней доле M1 присутствуют как буккальный, так и лингвальный дополнительные входящие углы. Эти углы могут быть слабо выражены (2.4A) или полностью выражены (2.4B). В последнем варианте anterior lobe M1 представлена в виде трех петель.
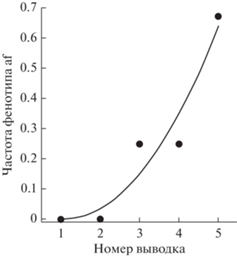
Рис. 2.
Зависимость частоты фенотипа atypical form anterior lobe M1 (af) от номера выводка в семье № 9.
Всего выявлено 64 зуба у 37 особей, имеющих фенотип af. В колонии “Еркута-04” выявлено 34 зуба у 19 особей (из них две пойманы в природе), в колонии “Хадыта-85” – 14 зубов у 9 особей (из них одна поймана в природе), в колонии “Хадыта-84” – 11 зубов у 6 особей, в колонии “о-в Врангеля-84” – 5 зубов у 3 особей.
Для сравнения выборок из разных колоний между собой разные варианты фенотипа af объединяли в две категории сложности. В первую категорию вошли варианты морфотипов 2.1A–2.2B, во вторую – 2.3A–2.4B.
Для выяснения характера наследования отклонений от типичной формы anterior lobe M1 проводили посемейный анализ расщеплений в разных вариантах скрещивания.
При статистической обработке данных использовали пакет программ Stat Soft STATISTICA for Windows 6.0: статистика χ2, точный критерий Фишера – Fisher exact test (Fisher exact), ранговая корреляция Спирмена – Rs. Интегральную гомогенность независимых таблиц сопряженности в целом для нескольких выборок проверяли с помощью процедуры объединения P-значений по Фишеру (Fisher combination test – FCT, Животовский, 1991).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Фенотип af anterior lobe M1 имеет преимущественно двухстороннее проявление, так как в 27 (73%) случаев он встречается на обеих сторонах челюсти (справа и слева). Он обнаружен в 4 (11%) случаях только с левой стороны и в 6 (16%) случаях только с правой стороны.
Наиболее редкими являются варианты четвертого морфотипа af: 2.4A и 2.4B. Они представлены по одному экземпляру, что в сумме составляет 3%. Потом идут варианты первого морфотипа af: 2.1A и 2.1B, которые в сумме составляют 7 экз. или 11%. Вариант 2.2A второго морфотипа af: (23 экз., 36%) преобладает над вариантом 2.2B (4 экз., 6.5%). Абсолютное преобладание у варианта 2.3A третьего морфотипа af: (27 экз., 42%) над вариантом 2.3B (1 экз., 1.5%).
Частота особей с фенотипом af самая высокая (33%) в колонии “Еркута-04” по сравнению с другими колониями: “Хадыта-85” (9%), “Хадыта-84” (6%), “о-ов Врангеля-84” (2%) (P < 0.001 для Fisher exact). В колонии “Хадыта-85” она выше, чем в колонии “о-ов Врангеля-84” (P < 0.02 для Fisher exact).
Сравнение выборок зубов фенотипа af из колоний по категориям сложности показало, что морфотипы наиболее сложной второй (2.3A–2.4B) категории преобладают в колонии “Хадыта-85” (86%, N = 14, P < 0.005 для Fisher exact) по сравнению с колониями “Еркута-04” (35%, N = 34) и “Хадыта-84” (27%, N = 11). Последние две колонии между собой не отличаются по этому показателю (P = 0.46 для Fisher exact). Выборка из колонии “о‑ов Врангеля-84” (60%, N = 5) не отличается от выборок из всех других колоний (P > 0.24 для Fisher exact) в том числе из-за своей малой величины. Так как колония “Хадыта-85” единственная из всех происходит от животных с пиковой стадии популяционного цикла, есть основание заключить, что высокая плотность популяции может приводить к повышению частоты сложных морфотипов фенотипа af anterior lobe M1 Dicrostonyx, то есть к усилению выраженности этого признака.
В 15 выводках из всех семей, где в потомстве наблюдали расщепление по форме anterior lobe M1 у самцов и самок, для каждого выводка была протестирована однородность расщепления у обоих полов. Для выводка минимальное значение P = 0.17 (Fisher exact). FCT по всем выводкам дает P = 0.97.
В 10 семьях, в потомстве которых наблюдали расщепление у обоих полов, была протестирована его однородность. Для семьи минимальное значение P = 0.11 (Fisher exact). FCT по всем семьям дает P = 0.53.
Расщепления у самцов и самок в разных вариантах скрещивания однородны. Минимальное значение P = 0.12 (Fisher exact). FCT по вариантам скрещивания дает P = 0.29. Так как расщепления по самцам и самкам однородны, дальнейший анализ проводился по обоим полам.
В 11 семьях наблюдали расщепление по форме anterior lobe M1 в разном числе выводков: в 5 семьях – в одном, в 3 семьях – в двух, в 2 семьях – в трех и в 1 семье – в пяти выводках. В трех семьях с одним выводком расщепления не было. Была проанализирована однородность расщепления в разных выводках одной семьи. Минимальное значение P = 0.11 (Fisher exact) при сравнении между собой двух выводков одной семьи. FCT по всем выводкам дает P = 0.90. Однако в семье № 9 с 5 выводками была обнаружена положительная связь номера (очередности) выводка с частотой фенотипа atypical form anterior lobe M1 (рис. 2). Ранговая корреляция Спирмена для этой связи равна 0.94, P < 0.02. В дальнейшем данные по выводкам в пределах семьи были объедены и расщепление анализировали в 14 семьях.
Результаты посемейных расщеплений по форме anterior lobe M1 в разных вариантах скрещивания приведены в табл. 1. Характер генетической детерминации изменчивости формы anterior lobe M1 оказался относительно простым.
Таблица 1.
Расщепление по признаку atypical form anterior lobe M1 в потомстве родителей разных фенотипов
| № семьи | Фенотип родителей | Фенотип потомков | ||
|---|---|---|---|---|
| typical form | atypical form | всего | ||
| 1 | Typical form × typical form | 2 | 1 | 3 |
| 2 | 8 | 3 | 11 | |
| 3 | 6 | 2 | 8 | |
| 4 | Typical form × atypical form | 3 | 3 | 6 |
| 5 | 2 | 2 | 4 | |
| 6 | 2 | 2 | 4 | |
| 7 | 2 | 1 | 3 | |
| 8 | 7 | 3 | 10 | |
| 9 | 14 | 4 | 18 | |
| 10 | 10 | 2 | 12 | |
| 11 | 2 | 0 | 2 | |
| 12 | 2 | 0 | 2 | |
| 13 | 2 | 0 | 2 | |
| 14 | Atypical form × atypical form | 1 | 2 | 3 |
Гипотеза генетической детерминации предполагает, что различия в форме anterior lobe M1 у копытных леммингов (Dicrostonyx) определяются моногенно. Особи с типичной формой anterior lobe M1 – это гетерозиготы или доминантные гомозиготы с фенотипом ТF. Особи, имеющие нетипичную форму anterior lobe M1, являются рецессивными гомозиготами с фенотипом af. Какой фенотип (af или ТF) реализует рецессивная гомозигота может зависеть от различных факторов.
Анализ расщеплений. При скрещивании родителей с фенотипом TF в семьях № 1–3 выщепляются особи с фенотипом af (табл. 1). Расщепления в разных семьях однородны. FCT по всем семьям дает P = 0.93. Суммарно по всем трем семьям наблюдаемое соотношение фенотипа af к фенотипу TF составляет 6 : 16 и согласуется с отношением моногенного расщепления 1 : 3 (χ2 = 0.06, df = 1, P = 0.80). Следовательно, особи с фенотипом af – рецессивные гомозиготы, которые показывают полное проявление.
В скрещиваниях, где один родитель имеет фенотип TF, а у другого родителя представлен фенотип af в семьях № 4–10, выщепляются потомки с фенотипом af. В семьях № 11–13 потомков с фенотип af нет. Однако у самца (фенотип TF) из семьи № 11 в семье № 5 с другой самкой выщепляются потомки с фенотипом af. У самца (фенотип TF) из семьи № 12 в семье № 6 с другой самкой также выщепляются потомки с фенотипом af. Значит, оба этих самца являются гетерозиготами. В семье № 13 самец с фенотипом TF может быть как гетерозиготой, так и доминантной гомозиготой, поэтому эта семья была исключена из анализа. Расщепления в разных семьях однородны. Минимальное значение P = 0.18 (Fisher exact) при сравнении между собой двух семей. FCT по всем выводкам дает P = 0.93. Несмотря на это удалось выявить фактор, влияние которого на частоту потомков с фенотипом af в семьях этого варианта скрещивания статистически значимо (Rs = –0.92, P < 0.001, рис. 3). На графике видно, что при частоте самцов среди потомков в семье от 0 до 0.25 включительно частота потомков с фенотипом af в семьях соответствует теоретически ожидаемой и равной 0.5. При повышении частоты самцов среди потомков больше 0.25 частота потомков с фенотипом af монотонно убывает.
Рис. 3.
Зависимость частоты фенотипа atypical form (af) anterior lobe M1 в семье от частоты самцов в семье в скрещиваниях TF × af.
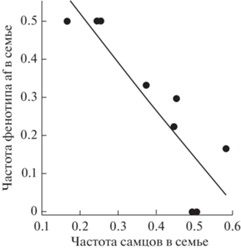
Разделение семей на две группы: первая с частотой самцов в семье до 0.4 (семьи № 4–7) и вторая с частотой самцов в семье равной или более 0.4 (семьи № 8–12) позволило выяснилось, что наблюдаемое расщепление на фенотипы af и TF в первой группе (8 : 9) согласуется с теоретически ожидаемым 1 : 1 (χ2 = 0.06, df = 1, P > 0.80). Во второй группе отличие наблюдаемого расщепления на фенотипы af и TF (9 : 35) от теоретически ожидаемого 1 : 1 статистически высоко значимо (χ2 = 15.4, df = 1, P < 0.0001), т.е. наблюдаем неполное проявление (0.41%) рецессивных гомозигот. Соотношения фенотипов в первой и второй группах отличаются друг от друга P < 0.042. (Fisher exact). Однако суммарное по 9 семьям в этом варианте скрещивания наблюдаемое расщепление (17 : 44) также отличается от ожидаемого 1 : 1 статистически значимо (χ2 = 12.0, df = 1, P < 0.001) с проявлением 56%.
Таким образом, особи с фенотипом af в семьях № 4–12 – рецессивные гомозиготы, а особи с фенотипом TF – гетерозиготы. Рецессивные гомозиготы показывают полное проявление в семьях, когда частота самцов в семье меньше 0.4, и показывают неполное проявление, когда частота самцов равна или выше 0.4. Одним из механизмов, влияющих на проявление рецессивных гомозигот, является положительная связь частоты фенотипа af с номером выводка, показанная на примере семьи № 9. В роли другого механизма выступает отрицательная связь частоты фенотипа af с частотой самцов в семье. Вероятно, что факторы: номер выводка и частота самцов в семье могут взаимодействовать в своем влиянии на проявление гомозигот.
В семье 14, где оба родителя имеют фенотип af, выщепился потомок с фенотипом TF (табл. 1). Это может быть результатом обратной геновариации либо результатом действия другого гена, влияющего на форму anterior lobe M1, которое проявилось под влиянием генов-модификаторов у данной особи.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что у копытных леммингов встречаются самки трех кариотипов X0X0, X*X0 и X*Y. X0 – хромосома дикого типа, X* – мутантная хромосома, которая при сочетании в геноме с Y хромосомой приводит к развитию организма женского пола (Gileva, 1987; Fredga, 1988, 1994, Kozielska et al., 2010). Только в потомстве самок X*X0 и X*Y встречаются самки с кариотипом X*Y в пропорции 0.33 и 0.50 (теоретически) и 0.41 и 0.55 (фактически). Для самок X*X0 и X*Y характерна пониженная частота самцов в потомстве: теоретически – 0.25 и 0.33, фактически – 0.27 и 0.29 (Gileva, 1987, Kozielska et al., 2010). Самки X*Y встречаются во всех пяти хромосомных расах, выделяемых по количеству A хромосом у копытных леммингов. Число хромосом (2n) колеблется между расами от 28 до 48 (Fedorov et al., 1999; Fredga et al., 1999). Зависимость частоты фенотипа atypical form anterior lobe M1 в семье от частоты самцов в ней позволяет предполагать, что полное проявление рецессивных гомозигот с фенотипом af происходит в потомстве тех семей, в родительской паре которых самки имеют мутантную X* хромосому. Соответственно, в скрещиваниях, где один родитель является гетерозиготой с фенотипом TF, а у другого родителя представлен фенотип af, полное проявление рецессивных гомозигот может определяться, в том числе наличием генов-модификаторов, расположенных в мутантной X* хромосоме. Различная степень проявления мутантного аллеля в гомозиготном состоянии в разных вариантах скрещиваний была показана для признаков окраски меха (Belyaev et al., 1981). В нашем случае удалось выявить факторы, оказывающие влияние на дефицит особей с фенотипом af среди потомков в одном из вариантов скрещивания.
Так как изменчивость жевательной поверхности верхних моляров копытных леммингов сосредоточена в задней их части (Агаджанян, 2009, Бородин, 2009, Маркова, 2013), изученная фенотипическая изменчивость anterior lobe M1 открывает совершенно новое направление изменчивости не только у представителей этого рода, но и во всем подсемействе Arvicolinae. Мутации, которые способствуют появлению ранее не известных фенотипических структур зубов, имеют принципиальное значение для эволюции таксонов. (Hulsey et al., 2020).
Как показано в настоящей работе, atypical form anterior lobe M1 распространена в популяциях из различных регионов и встречаются на разных фазах популяционного цикла. По данным других авторов, в выборках нулевого-четвертого поколений из лабораторных колоний копытных леммингов с Полярного Урала (66°47′ с.ш., 65°49′ в.д.) и из Якутии, окр. Текси (71°06′ с.ш., 129°18′ в.д.) частота особей с фенотипом af (только морфотип 2.3A) составила ~3% и 1% (Markova., Smirnov, 2018). Все это позволяет говорить о полиморфизме anterior lobe первого верхнего моляра (M1) у леммингов рода Dicrostonyx.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе описано очень редкое, ранее неизвестное явление – полиморфизм anterior lobe первого верхнего моляра (M1) у леммингов рода Dicrostonyx. Полиморфизм этого признака находится в стадии становления, обладает существенным эволюционным потенциалом и открывает новое направление эволюционных преобразований жевательной поверхности коренных зубов в подсемействе Arvicolinae.
По нашим данным высокая плотность популяции может приводить к повышению частоты сложных морфотипов фенотипа af anterior lobe M1 Dicrostonyx, т.е. к усилению выраженности этого признака.
В скрещиваниях TF × af полное проявление рецессивных гомозигот видимо определяется, в том числе наличием генов-модификаторов, расположенных в мутантной X* хромосоме.
Представляет особый интерес оценка частоты встречаемости полиморфизма anterior lobe первого верхнего моляра у леммингов рода Dicrostonyx в природных популяциях различных регионов.
Благодарности. Автор благодарит анонимных рецензентов за важные замечания.
Финансирование. Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН 122021000094-3.
Список литературы
Агаджанян А.К. Мелкие млекопитающие плиоцен–плейстоцена Русской равнины. М.: Наука, 2009. 676 с.
Балахонов В.С., Данилов А.Н., Лобанова Н.А., Чибиряк М.В. Изучение динамики численности мелких млекопитающих на юге Ямала // Материалы по истории и современному состоянию фауны севера Западной Сибири. Челябинск, 1997. С. 43–59.
Бородин А.В. Определитель зубов полевок Урала и Западной Сибири (поздний плейстоцен–современность). Екатеринбург: УрО РАН, 2009. 100 с.
Громов И.М., Поляков И.Я. Фауна СССР. Млекопитающие. Т. 3. Вып. 8. Л.: Наука, 1977. 502 с.
Денисенко А.М. Годовая динамика численности леммингов (Lemmus sibiricus и Dicrostonyx vinogradovi) на острове Врангеля // Животный мир острова Врангеля. Владивосток: ДВНЦ АН СССР, 1986. С. 109–113.
Животовский Л.А. Популяционная биометрия. М.: Наука, 1991. С. 132–135.
Маркова Е.А. Оценка сложности щечных зубов полевок (Arvicolinae, Rodentia): ранжированный морфотипический подход // Зоол. журн. 2013. Т. 92. № 8. С. 968–980.
Abramson N.I., Lissovsky A.A. Subfamily Arvicolinae // The mammals of Russia: a taxonomic and geographic reference / Eds Pavlinov I.Y., Lissovsky A.A. M.: KMK Sci. Press, 2012. P. 220–276.
Belyaev D.K., Ruvinsky A.O., Trut L.N. Inherited activation-inactivation of the star gene in foxes: its bearing on the problem of domestication // J. Hered. 1981. V. 72. № 4. P. 267–274.
Fedorov V.B., Fredga K., Jarrell G.H. Mitochondrial DNA variation and the evolutionary history of chromosome races of collared lemmings (Dicrostonyx) in the Eurasian Arctic // J. Evol. Biol. 1999. V. 12. № 1. P. 134–145.
Fredga K. Aberrant chromosomal sex-determining mechanism in mammals, with special reference to species with XY females // Phil. Trans. R. Soc. Lond. 1988. B 322. P. 83–95.
Fredga K. Bizarre mammalian sex-determinating mechanisms // The differences between sexes / Eds Short R.V. and Balaban E. Cambridge Univ. Press. 1994. P. 419–431.
Fredga K., Fedorov V., Jarrell G., Jonsson L. Genetic Diversity Arctic Lemmings // Ambio. 1999. V. 28. № 3. P. 261–269.
Gileva E.A. Meiotic drive in the sex chromosome system of the varying lemming, Dicrostonyx torquatus Pall. (Rodentia, Microtinae) // Heredity. 1987. V. 59. № 3. P. 383–389.
Hulsey C.D., Cohen K.E., Johanson Z., Karagic N., Meyer A., Miller C.T., Sadier A., Summers A.P., Fraser G.J. Grand challenges in comparative tooth biology // Integrative and comparative biology. 2020. V. 60. № 3. P. 563–580. https://doi.org/10.1093/icb/icaa038
Kozielska M., Weissing F.J., Beukeboom L.W., Pen I. Segregation distortion and the evolution of sex-determining mechanisms // Heredity. 2010. V. 104. № 1. P. 100–112. https://doi.org/10.1038/hdy.2009.104
Marangoni P., Charles C., Tafforeau P., Laugel-Haushalter V., Joo A., Bloch-Zupan A., Klein O.D., Viriot L. Phenotypic and evolutionary implications of modulating the ERK-MAPK cascade using the dentition as a model // Scientific reports. 2015. V. 5. № 1. P. 1–12. https://doi.org/10.1038/srep11658
Markova E., Smirnov N. Phenotypic diversity arising from a limited number of founders: A study of dental variation in laboratory colonies of collared lemmings, Dicrostonyx (Rodentia: Arvicolinae) // Biol. J. Linn. Soc. 2018. V. 125. P. 777–793. https://doi.org/10.1093/biolinnean/bly172
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


