Известия РАН. Серия биологическая, 2022, № 5, стр. 530-537
Стимуляция заживления ожоговых РАН у крыс наносекундным импульсно-периодическим микроволновым излучением
А. А. Гостюхина 1, 3, 2, *, А. В. Самойлова 1, 4, 3, М. А. Большаков 1, 3, В. М. Мочалова 3, К. В. Зайцев 2, О. П. Кутенков 1, В. В. Ростов 1
1 ФГУН Институт сильноточной электроники СО РАН
634055 Томск, пр. Академический, 2/3, Россия
2 Томский НИИКиФ ФФГБУ ФНКЦ МРиК ФМБА России
634009 г. Томск, ул. Р. Люксембург, д. 1, Россия
3 ФГАОУВО “Национальный исследовательский Томский государственный университет”
634050 Томск, пр. Ленина, 36, Россия
4 ГБОУВПО “Сибирский государственный медицинский университет” Министерства здравоохранения Российской Федерации
634050 Томск, Московский тракт, 2, Россия
* E-mail: antariks-tomsk2015@yandex.ru
Поступила в редакцию 20.04.2021
После доработки 18.05.2021
Принята к публикации 05.09.2021
- EDN: AXDLLJ
- DOI: 10.31857/S1026347022050080
Аннотация
Изучено влияние наносекундного импульсно-периодического микроволнового излучения (ИПМИ, 10 ГГц, длительность импульсов 100 нс, частота повторения импульсов 8 Гц, пиковые плотности потока мощности (пППМ) 140 и 1500 Вт/см2) на регенерацию ожоговых ран у крыс в динамике. Установлено, что после 4-кратного локального облучения ран с интенсивностями 140 и 1500 Вт/см2 при частоте повторения импульсов 8 Гц с 1 по 14 день заживление ран в контрольной и облученных группах значимо не отличалось. Статистически значимое ускорение заживления ожоговых ран выявлялось с 19 суток. При этом с 12-ого дня наблюдалось частичное отделение сформировавшегося струпа. Эпителизация облученных ран наблюдалась с 24 по 28 сут. Эффективность воздействия ИПМИ с пППМ 140 Вт/см2 оказалась выше в сравнении с облучением пППМ 1500 Вт/см2.
Эффективное восстановление кожных покровов у человека, поврежденных в результате различных термических травм, является актуальной медико-биологической проблемой (Алексеев, Бобровников, 2012; Алексеев и др., 2016). Несмотря на значительное количество работ, посвященных лечению таких повреждений посредством хирургических, фармакологических и других методов, а также стимуляции регенерации ран с использованием различных физических факторов (Мельникова и др., 2010; Еремин и др., 2012; Звягинцева и др., 2014; Стручков и др., 2015; Самаева, Пак, 2017), из-за их недостаточной эффективности или сложности используемых процедур вопросы успешной терапии сохраняют свою актуальность. Одним из перспективных и оригинальных методов восстановления ожоговых повреждений может быть использование низкоинтенсивных электромагнитных факторов. Определенный интерес представляют данные о ранозаживляющем действии импульсных радиочастотных излучений (Гапеев, Чемерис, 2007; Athanasiou et al., 2007; Strauch et al., 2009; Гапеев, 2012), в частности, наносекундного импульсно-периодического микроволнового излучения (ИПМИ), которое при определенных параметрах воздействия способно стимулировать репаративную регенерацию полнослойной кожной раны у лабораторных мышей (Князева и др., 2011). Возможным механизмом стимуляции заживления ран под влиянием воздействия такого излучения, как полагают Страуч с соавт., является активация Са2+-кальмодулинзависимой продукции окиси азота (Strauch et al., 2009). По некоторым данным, положительные эффекты ранозаживления с использованием крайне высокочастотного воздействия объясняются понижением интенсивности воспалительных процессов за счет усиления микроциркуляции в раневом очаге и прилежащих тканях (Лушников и др., 2002, 2003; Князева и др., 2011; Гапеев, 2012). Есть данные, что воздействие импульсным радиочастотным излучением используется в косметической хирургии для ускорения заживления ран и снятия болевых ощущений в постоперационный период (Strauch et al., 2009). Известно, что помимо болевых ощущений, причиной отрицательных исходов в хирургии и терапии глубоких ожогов кожи является протекающий воспалительный процесс в ране (Полутова и др., 2011). Предполагается, что перечень возможных вариантов действия исследуемого наносекундного ИПМИ, может быть расширен, в том числе, и за счет непосредственного активирующего влияния на клетки, участвующие в процессе регенерации ран (лимфоциты, фибробласты, стволовые клетки) (Князева и др., 2011). Таким образом, стимуляция заживления термических ожогов с помощью электромагнитных факторов, в том числе, наносекундного ИПМИ, представляется актуальной как с теоретической точки зрения в плане выяснения молекулярно-клеточных и физиологических механизмов ранозаживляющего действия, так и с практической. Для изучения стимулирующих эффектов наносекундных импульсных микроволн при заживлении термических травм удобным для исследования модельным объектом представляются лабораторные крысы, геном которых на 90% имеет сходство с геномом человека (Chen et al., 2011). По этой причине возможные механизмы стимулирующего влияния, выявленные на лабораторных крысах, можно будет экстраполировать на процессы регенерации ожогов кожи у человека.
Цель настоящей работы – изучить возможности стимулирования регенерации кожных ожоговых ран у лабораторных крыс с помощью наносекундного импульсно-периодического микроволнового излучения.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование выполнено на 30 половозрелых крысах–самках породы “Wistar” массой 230–250 г. Животных содержали в стандартных условиях вивария при естественном световом режиме и на стандартном рационе со свободным доступом к воде и пище. Все процедуры с животными выполняли в одно и то же время (с 9:00 до 11:00). Исследование проводили в соответствии с этическими нормами работы с лабораторными животными (ETS № 123, 2007) и санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник (Правила лабораторной практики в Российской Федерации). На проведение исследования получено разрешение Комиссии по биоэтике Биологического института НИ ТГУ (протокол № 15 от 14.06.2019 г.).
Экспериментальные животные случайным образом были разделены на три группы по 10 особей в каждой:
1. Контрольная группа (n = 10) – крысы, которых после моделирования термического ожога содержали в стандартных условиях вивария и не подвергали воздействию ИПМИ;
2. Опытная группа № 1 (n = 10) – крысы, которых после моделирования термического ожога подвергали однократно в течение 4-х дней локальному воздействию наносекундным ИПМИ с пППМ 140 Вт/см2 и с частотой повторения импульсов 8 Гц.
2. Опытная группа № 2 (n = 10) – крысы, которых после моделирования термического ожога подвергали однократно в течение 4-х дней локальному воздействию наносекундным ИПМИ с пППМ 1500 Вт/см2 и с частотой повторения импульсов 8 Гц.
Выбор режимов воздействия (длительность, пППМ, частота повторения) основан на результатах предыдущего исследования, как наиболее эффективно влияющих на скорость репаративной регенерации полнослойных кожных ран (Князева и др., 2011).
Моделирование термических ожогов. За сутки до моделирования ожога на дорсальной поверхности тела крысы осуществляли депиляцию участка кожи путем выбривания электрической ветеринарной машиной. Бритье и моделирование ожога проводили под СО2 наркозом. Термическая рана создавалась прикладыванием без усилия на 30 с, разогретого до 100°С металлического стержня диаметром 2 см к поверхности кожи в межлопаточной области. Площадь повреждения в контрольной и опытных группах составляла, в среднем, 340 ± 18 мм2, что соответствовало 8–9% от площади поверхности тела.
В течение всего эксперимента крыс по две особи содержали в специальных клетках, разделенных между собой прозрачной перегородкой для исключения контакта животных друг с другом и взаимного влияния на процесс заживления ожоговой раны. Наблюдение за процессом заживления ран после 4х-кратного облучения осуществляли в динамике у контрольных и опытных крыс вплоть до образования коллоидного рубца. Динамику заживления термических ожогов оценивали с помощью электронного штангенциркуля по уменьшению площади участка поврежденной кожи (Князева и др., 2011; Александрова, 2014; Имашева, 2014), что было фиксировано фотокамерой Sony-DSC-F717 (Япония) с последующим анализом фотографий (пакет программ Imageanalyzer). Полученные результаты измерения площади поверхности ожоговой раны облученных животных сравнивали с аналогичными показателями в контрольной группе крыс.
Облучение термических ожогов. Через 5 ч после формирования ожога ежедневно в течение 4-х последующих дней лабораторные крыс подвергали однократному воздействию наносекундным ИПМИ (4000 импульсов за сеанс/день) с интенсивностями 140 и 1500 Вт/см2 при частоте повторения импульсов 8 Гц. Для локального воздействия на термическую рану и устранения возможности облучения всего организма остальную часть тела животных укрывали радиопоглощающим материалом. Продолжительность однократного облучения с указанными параметрами воздействия составляла 8 мин. В качестве источника наносекундного ИПМИ использовали импульсный лабораторный генератор на основе магнетрона МИ-505 (изделие серийного производства ОАО “Тантал”, Россия, несущая частота 10 ГГц, выходная пиковая мощность 180 кВт, длительность импульсов на половинном уровне мощности 100 нс). Использованные пиковые интенсивности (140 и 1500 Вт/см2) фиксировались по стандартной методике на основе антенных измерений и калориметрических калибровок (Klimov et al., 2008). Во время воздействий животных в специальных пластиковых контейнерах диаметром 10 см и длиной 30 см помещали на расстоянии 20 см от рупора антенны генератора, в зоне сформировавшейся волны ИПМИ. При радиочастотном электромагнитном воздействии возможен нагрев тканей и, соответственно, повышение температуры облучаемой ткани. Поэтому во время воздействия с помощью волоконно-оптического термометра МТ-4МО-1 (Россия) осуществляли температурный контроль. При использованных интенсивностях ИПМИ температура нагрева тканей в области раны не превышала 0.03–0.05° градуса при 140 Вт/см2 и 0.13° – при 1500 Вт/см2.
Анализ гематологический показателей. Для оценки состояния воспалительного процесса ожоговых ран в ходе эксперимента каждые 5–7 дней проводили гематологический анализ крови крыс (содержание гемоглобина, количество эритроцитов, тромбоцитов, лейкоцитов и их субпопуляций) с помощью ветеринарного гематологического анализатора PCE-90 Vet (“HighТechnology”, США). Забор крови осуществляли под СО2-наркозом через разрез десны в сухую чистую пробирку Microvette (tri-Kallium-EDTA, Germany).
Статистический анализ данных. Расчет площади поверхности тела у крыс проводили по формуле К. Миех (K. Meeh), в модификации Д.А. Гилпин (D.A. Gilpin) (Gilpin, 1996; Ковальчук, 2015): [S = k × W2/3], где S – площадь поверхности тела, см2; W – масса тела животного, кг; k – константа Михаэлиса. Площадь раны рассчитывали по методу точечного счета, путем измерения минимального и максимального диаметра раны и нахождения их полусуммы (Автандилов, 1990). Статистическую обработку полученных результатов проводили с использованием возможностей программы Statistica 8.0 for Windows. Полученные результаты представлялись в виде среднего арифметического значения и стандартной ошибки среднего арифметического (M ± m) для всех групп экспериментальных животных в динамике. Значимость различий величин между контрольными и облученными показателями определяли с помощью непараметрического U-критерия Манна–Уитни. Критический уровень значимости различий р при проверке статистических гипотез принимался равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В проведенных экспериментах у всех подопытных крыс в результате использованного термического воздействия формировался ожог III степени, характеризовавшийся поражением всей толщи кожи. Кожа на месте ожоговой раны была плотная и неподвижная. Ожоговые травмы представляли собой овальные раны, с красно-коричневым оттенком, по краям которых отмечалась зона гиперемии. У этих животных в течение первых часов после формирования ожога наблюдалась вялость, нарушение координации движения, отказ от еды и питья.
У крыс контрольной группы, не подвергавшиеся воздействию ИПМИ, заживление ожогов представляло собой монотонное уменьшение площади поверхности ран с 1 по 30 день исследования. При этом наблюдалось длительное сохранение струпа, который отпадал, начиная с 16 дня после нанесения термической травмы. По истечению 24–28 сут у животных в группах регистрировали частичную или полную эпителизацию раны.
У облученных крыс после 4-кратного локального воздействия на ожоговые раны ИПМИ с интенсивностью 140 Вт/см2 на начальных этапах динамика ранозаживления значимо не отличалась от контрольной группы (рис. 1). Но с 19 сут эксперимента у облученных животных регистрировали статистически значимое уменьшение площади раны относительно контрольной группы с полным заживлением всех ожогов к 28 суткам эксперимента. Кроме того, у облученных крыс, начиная с 12 дня, после нанесения ожога, наблюдалось частичное отделение сформировавшегося струпа. К 24 сут отмечалась эпителизация облученных ран с полным ее завершением у всех животных на 28 день исследования (рис. 2).
Рис. 1.
Динамика уменьшения поверхности ожоговых ран у крыс, облученных наносекундным ИПМИ с частотой повторения импульсов 8 Гц и интенсивностями 140 и 1500 Вт/см2 и. Примечание: * – различия статистически значимы по отношению к показателям облучённых животных наносекундным ИПМИ с пППМ 140 Вт/см2 (р ≤ 0.05); ** – с пППМ 1500 Вт/см2 (р ≤ 0.05).
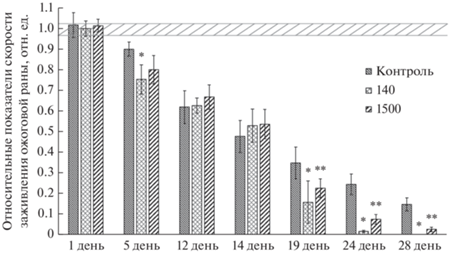
Рис. 2.
Фотографии процесса заживления кожной ожоговой раны у контрольных и облученных крыс на 5, 19 и 24 сут эксперимента.
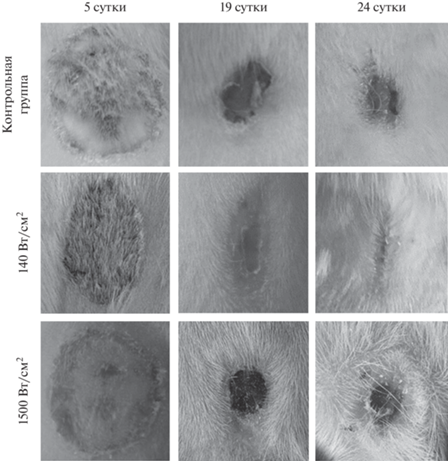
У крыс, облученных наносекундным ИПМИ с большей интенсивностью 1500 Вт/см2, с 1-ого и 14 день исследования площадь раны не отличалась от таковой в контрольной группе (рис. 1). Статистически значимое уменьшение раневой площади наблюдали с 19 дня после нанесения ожога с окончательным заживлением к 30 суткам исследования. На 19-й день после нанесения ожога на фоне ускоренного уменьшения площади раневой поверхности сформировавшийся струп отпадал. При сравнении результатов ранозаживления у обеих облученных групп выяснилось, что воздействие с меньшей интенсивностью (пППМ 140 Вт/см2) способствует более эффективному уменьшению площади раневой поверхности (рис. 2). Таким образом, полученные результатов указывают на то, что ИПМИ с использованными параметрами ускоряет процессы ранозаживления.
Из литературных данных известно, что при ожоге, который занимал более 10% поверхности тела, наблюдаются значительные изменения в составе крови, она заметно сгущается, нарушается обмен веществ (Шнякина и др., 2017). Любая травма, в том числе и термическая, сопровождается развитием интоксикации в организме, поскольку, кров, в первую очередь, подвергается действию токсических веществ, возникших в очаге поражения. Известно, что процесс ранозаживления сопровождается физиологическими сдвигами показателей циркулирующей крови в организме человека и животных (Мамонтова, 2006; Ажикова, Журавлева, 2016). С учетом этого, было проведено измерение гематологических показателей крови крыс, анализ которого показал, что во все исследуемые сроки эксперимента как в контрольной, так и в опытных группах отсутствовали статистически значимые изменения количества форменных элементов крови относительно физиологической нормы (табл. 1). При этом наблюдалась тенденция к увеличению количества гранулоцитов, которые способствуют стимуляции регенерации тканей в месте ранения, обеспечивают защиту от инфекции и участвуют в поддержании кровотока и трофики поврежденных тканей.
Таблица 1.
Содержание форменных элементов в крови крыс на 1, 5, 12 и 19 день после моделирования термического ожога
| Лейкоциты (×109/л) | Гранулоциты (×109/л) | Эритроциты (×1012/л) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| 1 сутки | 9.8 ± 2.1 | 10.6 ± 1.3 | 8.8 ± 0.4 | 3.6 ± 0.6 | 4.1 ± 0.8 | 3.6 ± 0.1 | 8.3 ± 0.2 | 8.3 ± 0.5 | 8.9 ± 0.2 |
| 5 сутки | 7.7 ± 1.0 | 9.3 ± 1.7 | 10.8 ± 0.8 | 2.5 ± 0.4 | 4.2 ± 0.1 | 4.5 ± 0.4 | 7.8 ± 0.5 | 8.6 ± 0.2 | 8.4 ± 0.2 |
| 12 сутки | 7.7 ± 0.7 | 10.2 ± 0.5 | 8.4 ± 1.3 | 2.9 ± 0.5 | 4.1 ± 0.2 | 3.6 ± 0.7 | 7.8 ± 0.2 | 8.6 ± 0.2 | 8.0 ± 0.3 |
| 19 сутки | 9.8 ± 1.1 | 10.7 ± 1.1 | 9.8 ± 2.1 | 2.7 ± 0.4 | 3.9 ± 0.7 | 3.6 ± 0.5 | 9.3 ± 0.3 | 8.8 ± 0.3 | 7.9 ± 0.3 |
Примечание. Полученные результаты представлены в виде среднего арифметического значения и стандартной ошибки среднего арифметического (M ± m); 1 (n = 10) – показатели контрольной группы, 2 (n = 10) – показатели крыс, облученных в течение 4 дней наносекундным ИПМИ с пППМ 140 Вт/см2 и с частотой повторения импульсов 8 Гц; 3 (n = 10) – показатели крыс, облученных в течение 4 дней наносекундным ИПМИ с пППМ 1500 Вт/см2 и с частотой повторения импульсов 8 Гц.
Возможной причиной отсутствия статистически значимых изменений состава крови у животных контрольной группы является относительно небольшая (8–9%) площадь ожоговой поверхности и, соответственно, меньшее количество токсических веществ, возникших в очаге поражения для развития полноценного воспалительного процесса. Применительно к облученным животным можно допустить, что воздействие ИПМИ на ожоговые раны уже в первые часы после нанесения травмы оказывает стимулирующее действие на восстановительные процессы в ране и вызывает снижение воспалительной реакции.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТАОВ
Как следует из полученных результатов, воздействие ИПМИ на ожоговые раны способствует ускорению их регенерации. При этом можно отметить ряд обстоятельств, выявившихся в результате проведенного исследования.
Считается (Алексеев, Бобровников, 2012; Алексеев и др., 2016; Самаева, Пак, 2017), что скорость деления клеток строго лимитирована поэтому, за счет усиления пролиферации невозможно ускорить сроки заживления ожоговых ран. Тем не менее, создание определенных оптимальных условий для ускорения процесса регенерации, по-видимому, в принципе возможно посредством определенных корригирующих воздействий. Примером подобного, как было показано (Бессонов и др., 2000; Лушников и др., 2003), может служить способность низкоинтенсивного электромагнитного излучения крайне высокой частоты (КВЧ) оказывать противовоспалительное действие, а также модифицировать иммунный статус организма, повышать его адаптационные возможности, улучшать микроциркуляцию в поврежденных тканях, тем самым активировать репаративную регенерацию. Не исключено, что аналогичной возможностью по отношению к ранозаживлению, в том числе травм термической природы, обладает воздействие наносекундным ИПМИ, использованное в настоящей работе.
Менее интенсивное воздействие оказывает более выраженное ранозаживляющее действие. Ранее работами Эди (Adey, 1993), было показано существование определенных “частотных энергетических окон”. В соответствии с этим наибольшее биологическое действие оказывает радиочастотное излучение с частотами повторения импульсов в пределах 6–16 Гц и вполне конкретной, оптимальной интенсивности. При больших или меньших интенсивностях эффект существенно снижается или полностью исчезает. По-видимому, пППМ 140 Вт/см2, которая применялась в данной работе при частоте повторения импульсов 8 Гц, могла быть наиболее близка к оптимальному режиму воздействия, поэтому наблюдаемый эффект был более выражен. В соответствии с моделью Эйди (Adey, 1993), биологическому действию электромагнитных излучений подвержены процессы, опосредованные ионами Ca2+. Подтверждением этому могут быть результаты (Pilla, 2008; Strauch, 2009) продемонстрировавшие, что воздействие электромагнитным излучением способно усиливать кальций-кальмодулиновое связывание в клетки. Это активирует NO-синтетазу и способствует усилению продукции оксида азота, который обеспечивает расширение капилляров и, соответственно, усиление микроциркуляции крови (Князева и др., 2011). Ранее было показано, что воздействие ИПМИ на митохондрии печени мышей изменяет содержание активных форм кислорода (АФК) (Большаков и др., 2012). Поэтому нельзя исключать возможности того, что облучение ран ИПМИ, помимо АФК, может аналогично продуцировать NO (Стручков и др., 2015), что ускоряет процесс регенерации эпидермиса и способствует более выраженному проявлению отторжения струпа.
Полученные экспериментальные результаты по стимулирующему эффекту заживления ожоговых ран у крыс в результате воздействия наносекундным ИПМИ можно с высокой степенью экстраполировать на ожоги человека. Вполне вероятно, что термические раны различной природы у людей не превышающие 10% всего кожного покрова можно будет восстанавливать в короткие сроки с положительным результатом. Более того, отторжение струпа в месте ожоговой раны предполагает восстановление кожи без посттравматических рубцов. Поэтому в результате необременительной серии процедур неинвазивного воздействия ИПМИ пациенты не будут подвергаться риску неблагоприятных последствий, поскольку ИПМИ низких интенсивностей не превышают гигиенических уровней безопасности воздействия на организм (СанПиН 2.2.4/2.1.8.055-96, 1996). Более того, с учетом возможности снижения болевых ощущений в месте раны (Pilla, 2008), метод может найти широкое применение в медицине.
* * *
Ускорение заживления ожоговых ран посредством наносекундных микроволновых импульсов, наблюдавшееся в проведенной экспериментальной работе, может стать основой новой перспективной технологии в косметологической и терапевтической практике. Для успешного использования такого подхода потребуются специальные клинические исследования для уточнения параметров воздействующего фактора (пППМ, частота повторения импульсов, количество импульсов и сеансов повторного облучения), а также проработка технических требований, необходимых для производства физиотерапевтического оборудования.
Список литературы
Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1990. 384 с.
Ажикова А.К., Журавлева Г.Ф. Исследование гематологических показателей крыс в норме и в условиях термического воздействия // Современные проблемы науки и образования. 2016. № 2. С. 284.
Александрова А.В. Заживление ожоговой раны при лечении синтетическим ингибитором матричных металлопротеиназдоксициклином // Вестн. Харьковского нац. мед. ун-та. 2014. С. 4.
Алексеев А.А., Бобровников А.Э. Современные технологии местного консервативного лечения пострадавших от ожогов // Анналы хирургии. 2012. № 2. С. 32–38.
Алексеев А.А., Бобровников А.Э., Малютина Н.Б. Экстренная и неотложная медицинская помощь после ожоговой травмы // Мед. алфавит. 2016. Т. 2. № 15(278). С. 6–12.
Бессонов А.Е., Чемерис Н.К., Гапеев А.Б. Репаративная регенерация тканей под воздействием электромагнитных волн миллиметрового, инфракрасного и части видимого диапазонов, генерируемых терапевтическим аппаратом “Минитаг” НИР НЦИМ “ЛИДО” // Физ.-хим. основы информ. медицины. ИБК РАН. Пущино, 2000. С. 18.
Большаков М.А., Жаркова Л.П., Иванов В.В., Керея А.В., Князева И.Р., Кутенков О.П., Ростов В.В. Оценка активности ферментов антиоксидантной защиты митохондрий печени мышей после воздействия наносекундного импульсно-периодического микроволнового излучения // Вест. Томского государ. уни-та. Биология. 2012. № 3(19). С. 122–136.
Гапеев А.Б., Чемерис Н.К. Механизмы биологического действия электромагнитного излучения крайне высоких частот на уровне организма. // Биомед. радиоэлектроника. 2007. № 8–9. С. 30–46.
Гапеев А.Б. Механизмы противовоспалительного и противоопухолевого действия низкоинтенсивного электромагнитного излучения крайне высоких частот // Миллиметровые волны в биологии и медицине. 2012. № 3. С. 3.
Еремин Н.В, Мнихович М.В., Мигляс В.Г., Тернов М.М. Морфология кожной раны под влиянием низкоинтенсивного гелий-неонового лазерного излучения // Клин. и эксперим. морфология. 2012. № 1. С. 38–43.
Звягинцева Т.В., Миронченко С.И., Гринь И.В. Ранозаживляющее действие мази метилурацила, содержащей наночастицы серебра, при термическом ожоге крыс // Актуальные проблемы транспортной медицины. 2014. Т. 2. № 2. С. 27–30.
Имашева А.К. Особенности регенеративных процессов кожи при термических ожогах у животных // Науч. журн. “Успехи современного естествознания”. 2014. № 7. С. 27–29.
Князева И.Р., Медведев М.А., Жаркова Л.П., Гостюхина А.А., Кутенков О.П., Ростов В.В., Большаков М.А. Действие наносекундного импульсно-периодического микроволнового излучения на процессы регенерации // Бюллетень сибирской медицины. 2011. № 6. С. 109–113.
Ковальчук В.И. Состояние прооксидантно-антиоксидантного баланса при термическом ожоге кожи в эксперименте и клинике // Журнал Гродненского государственного медицинского университета. 2015. № 1. С. 73–78.
Лушников К.В., Гапеев А.Б., Чемерис Н.К. Влияние электромагнитного излучения крайне высоких частот на иммунную систему и системная регуляция гомеостаза. // Радиационная биология. Радиоэкология. 2002. Т. 42. № 5. С. 533–545.
Лушников К.В., Гапеев А.Б., Шумилина Ю.В. Снижение интенсивности клеточного иммунного ответа и неспецифического воспаления при действии электромагнитного излучения крайне высоких частот // Биофизика. 2003. Т. 38. № 5. С. 918–925.
Мамонтова Е.В. Влияние ALPHA-токоферола на степень перекисного гемолиза белых мышей в норме и при иммобилизационном стрессе // Современные проблемы науки и образования. 2006. № 3. С. 27–28.
Мельникова В.И., Извольская М.С., Воронова С.Н., Шарипова М.М., Рукин Е.М., Захарова Л.А. Репаративная регенерация тканей кожи крысы под действием излучения лампы полого катода с линейчатым спектром марганца и меди // Цитология. 2010. Т. 52. № 3. С. 204–210.
Полутова Н.В., Чеснокова Н.П., Островский Н.В., Невважай Т.А. О патогенетической взаимосвязи нарушений метаболического статуса, клеточного состава и реологических свойств крови при поверхностной термической травме, их диагностическое и прогностическое значение // Саратовский научно-медицинский журн. 2011. Т. 7. № 4. С. 795–800.
Самаева Е.В., Пак И.В. Современные подходы в лечении ожоговых ран // Вестник Кыргызско-Российского Славянского университета. 2017. Т. 17. № 10. С. 200–203.
Стручков А.А., Перетягин С.П., Вазина И.Р. Значение местного применения активных форм кислорода для стимуляции процессов репарации в ожоговой ране // Биорадикалы и антиоксиданты. 2015. Т. 2. № 2. С. 52–60.
Шнякина Т.Н., Безина Н.М., Щербаков Н.П. Гематологические и клинические исследования при лечении экспериментальной ожоговой раны у собак // Вестник Алтайского государственного аграрного университета. 2017. № 4(150). С. 127–131.
Adey W.R. Biological effects of electromagnetic fields // J. Cell Biochem. 1993. V. 51. № 4. P. 410–416.
Athanasiou A., Karkambounas S., Batistatou A. The effect of pulsed electromagnetic fields on secondary skin wound healing: an experimental study // Bioelectromagnetics. 2007. V. 28. P. 362–368.
Chen C.H., Panizzon M.S., Eyler L.T. Genetic influences on cortical regionalization in the human brain // Neuron. 2011. V. 72. Issue 4. P. 537–544.
Euro guide on the accommodation and care of animals used for experimental and other scientific purposes. FELASA: 2007. 17 p.
Gilpin D.A. Calculation of a new Meeh constant and experimental determination of burn size // Burns. 1996. V. 22. № 8. P. 607–611.
Klimov A.I., Kovalchuk O.V., Rostov V.V. Measurement of Parameters of X-Band High-Power Microwave Superradiative Pulses // IEEE Transactions on Plasma Science. 2008. V. 36. № 6. P. 1–4.
Pilla A. Proposed electrochemical mechanism of EMF modulation of tissue repair // The bioelectromagnetic society 30th annual meeting abstract collection, San Diego, California. 2008. P. 147.
Strauch B., Herman C., Dabb R. et al. Evidence-based use of pulsed electromagnetic field therapy in clinical plastic surgery // Aesthet. Surg. J. 2009. № 29(2). P. 135–143.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


