Известия РАН. Серия биологическая, 2022, № 5, стр. 522-529
Флуориметрический метод оценки активности целлюлаз в пищеварительном тракте мелких травоядных млекопитающих
А. А. Варшавский 1, *, Е. И. Наумова 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: ulvhare@sev-in.ru
Поступила в редакцию 27.12.2021
После доработки 17.02.2022
Принята к публикации 18.03.2022
- EDN: GIQGQU
- DOI: 10.31857/S1026347022050201
Аннотация
Флуориметрический метод определения целлобиогидролазной активности (ЦА), используемый в работе с чистыми культурами, модифицирован для исследования содержимого пищеварительного тракта мелких млекопитающих, обитающих в естественных условиях. Проанализировано влияние разных способов консервации на активность ЦА в пробах химуса, взятых в полевых условиях. Оптимальным консервантом был признан 86%-ный глицерин. Построена математическая модель зависимости результатов измерения ЦА от концентрации химуса в пробе. Модель подтвердила влияние концентрации химуса на результаты измерения в диапазоне 5–15 г/л. Выяснено, что оптимальная концентрация химуса равна 10 г/л, т.е., для пробы требуется навеска 0.2 г химуса, консервированного в 1 мл 86%-ного глицерина, что легко выполнимо в полевых условиях.
Разработка доступных методов оценки активности целлюлолитичеких симбионтов травоядных млекопитающих очень важна для понимания роли структурных углеводов в их питании. В физиологических исследованиях для этой цели обычно используют показатели переваримости сырой клетчатки, кислого (ADF) и нейтрального (NDF) детергентов волокон, полученные на экспериментальных млекопитающих (Goering, Van Soest, 1970; Sakaguchi et al., 1987, 1992). Эти данные могут зависеть от многих факторов и отражают толерантность подопытных животных к предлагаемому рациону.
На биохимическом уровне используется ряд методов определения активности ферментов целлюлазного комплекса – вискозиметрические, фотометрические, флуориметрические и др. (Синицын и др., 1990; Sharma et al., 2016). Эти методы предполагают исследование чистых ферментов, как правило, из чистых же культур выделенных микроорганизмов. Гораздо реже используют метод оценки переваримости целлюлозы in vivo (Лактионов, 2012), выполняемый на фистулированных животных. Исследование активности целлюлаз у сельскохозяйственных животных базируется на фотометрических методах (Давлетова и др., 1986). Перечисленные подходы по разным причинам неприемлемы для исследования естественного фона активности целлюлаз у обитающих в природе животных. Кроме того, опубликованные результаты часто несопоставимы в силу использования разных единиц измерений.
С биохимической точки зрения целлюлазные системы в широком понимании определяются как системы, включающие ферменты, способные расщеплять 1,4-β-глюкозидные связи в полимерных формах целлюлозы, а также ферменты иной специфичности или некаталитические белки, способные действовать на поверхности целлюлозы, т. е., содержащие целлюлозосвязывающий домен (Рабинович, Мельник, 2000). Однако в рамках данной работы удобнее рассматривать целлюлазы как молекулярную машину, включающую два типа ферментов – экзоглюканазы, в первую очередь целлобиогидролазы, разлагающие упорядоченные формы целлюлозы, и эндоглюканазы, гидролизующие глюкановые цепочки клетчатковых фибрилл (Tokuda et al., 2005). Образующиеся в результате олигосахариды далее разлагаются до глюкозы при помощи β-глюкозидазы.
За основу для разработки методики, позволяющей оценить целлюлазную активность в пробах из диких животных, был принят флуориметрический метод с 4-метилумбеллиферил-β-D-целлобиозидом (МУФ-Ц) в качестве субстрата (Синицын и др., 1990). Этот метод регистрирует целлобиогидролазную активность (ЦА), обладает высокой чувствительностью и работает при нейтральном pH (Coleman et al., 2007), характерном для локусов ферментации целлюлозы у млекопитающих.
Для разработки доступного в применении метода сбора материала и оценки целлюлазной активности у млекопитающих, живущих в естественных, а не экспериментальных условиях, прежде всего необходимо было решить следующие важные задачи по сбору, хранению и обработке материала: 1) выбрать оптимальный способ консервации и экстракции целлюлаз содержимого пищеварительного тракта (химуса). При отборе проб химуса в полевых условиях возникает задача их консервации для транспортировки в лабораторию и хранения до проведения измерений. Консервант должен не только сохранять пробы, но и экстрагировать ферменты целлюлазного комплекса; 2) разработать способ освобождения субстрата от гуминовых веществ и пищевых частиц, которыми богат желудочно-кишечный тракт; 3) найти оптимальную концентрацию химуса во флуориметрической пробе для получения воспроизводимых результатов. Скорость ферментативной реакции при избытке субстрата зависит от концентрации в реакционной смеси фермента, в данном случае содержащегося в химусе. Для выбора оптимальной концентрации было необходимо исследовать ее влияние на ЦА при экстракции буфером и 86%-ным глицерином; 4) составить протокол методики флуориметрического исследования ЦА в гетерогенном субстрате.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Модельным объектом был выбран домашний кролик Oryctolagus cuniculus, типичный представитель специализированных растительноядных млекопитающих с кишечным типом ферментации. Объем основного локуса ферментации кролика – слепой кишки – достаточен для отбора нескольких повторностей проб химуса (всего исследовано 44 образца). Это позволяет учесть неравномерность распределения целлюлазных комплексов по объему химуса и изучить активность при разных условиях отбора и хранения образцов. В работе использовались два взрослых кролика – лабораторный и фермерский, содержавшиеся на разных кормах, обеспечивших априори разную целлюлазную активность, что важно для оценки работы метода в разных диапазонах ЦА. Лабораторного кролика в течение 3 суток перед опытом кормили сеном. Фермерский кролик все время содержался на смешанном корме (комбикорм, сено, пищевые отходы). Разные диапазоны активности образцов были необходимы для контроля чувствительности метода. Эвтаназия проводилась методом декапитации.
Отбор проб. Все пробы отбирали из слепой кишки в пластиковые пробирки типа “эппендорф” объемом 1.5 или 2 мл. Для экстракции целлюлаз в пробирки наливали 86%-ный глицерин или же фосфатный буфер рН 6.8–7.0 в количестве 1 или 1.5 мл в зависимости от объема пробирки. Пустые (для заморозки) или залитые экстрагентом пробирки взвешивали перед отбором проб с точностью 0.005 г. Химус отбирали шпателем или обрезанным инсулиновым шприцом в зависимости от густоты. Экстрагируемые пробы перемешивали. Пробирки с химусом вновь взвешивали, определяя таким образом массу пробы. Пробы экстрагировали при температуре 4°С, заморозку проводили при –18°C. Минимальное время экстракции или заморозки составляло 21 сут.
Основы метода измерения. Для регистрации ЦА в исследуемых образцах использован 4-метилумбеллиферил-β-D-целлобиозид (МУФ-Ц), состоящий из способного к флуоресценции 4-метилумбеллиферата (МУФ) и присоединенного к нему остатка целлобиозы. Содержащийся в образце фермент целлобиогидролаза при взаимодействии с реактивом отщепляет целлобиозид в том же молярном соотношении, что и при гидролизе целлюлозы. При этом высвобождается МУФ, флуоресценцию которого можно зарегистрировать, и, сравнив с флуоресценцией раствора МУФ известной концентрации, выяснить количество вещества (v) МУФ, образующегося в ходе реакции. Активность фермента рассчитывается как отношение v продукта реакции к ее длительности.
Сравнение эффективности консервантов химуса. Было проведено сравнение способов консервации в фосфатном буфере, глицерине и замораживания.
Из опыта работы по исследованию эндоглюканазной активности мелких млекопитающих (Варшавский и др., 2003, 2004) известно, что 86%-ный раствор глицерина в дистиллированной воде успешно консервирует пробы химуса при 4°С, сохраняя их даже при аварийном повышении температуры до 25°С. При этом 86%-ный глицерин экстрагировал эндоглюканазы, входящие в целлюлазный комплекс. Сделано предположение о возможности применения 86%-ного глицерина в качестве консерванта и одновременно экстрагента для проб химуса, используемых при исследовании целлобиогидролазной активности. Для проверки этого предположения был поставлен первый эксперимент (разведочный), при этом во избежание замутнения реакционной смеси использовали низкую концентрацию химуса. Как дополнительный вариант консервации проверяли также заморозку проб химуса. Из слепой кишки лабораторного кролика было отобрано 14 проб содержимого. По 3 пробы химуса экстрагировали в 86% глицерине и в фосфатном буфере, 3 пробы заморозили. Оставшиеся 5 проб использовали для контроля гашения флуоресценции. Размороженный химус и жидкую фракцию из глицеринового и буферного экстрактов растворяли в фосфатном буфере так, чтобы конечная концентрация химуса в реакционных пробирках составляла 0.005 г/мл (5 г/л). Измерения проводились на спектрофлуориметре МРF-4. Были также проверены результаты эффективности экстракции ферментов на большей выборке (второй эксперимент). Из слепой кишки фермерского кролика было отобрано 30 проб содержимого. По 10 проб химуса экстрагировали в 86% глицерине и в фосфатном буфере, остальные 10 проб заморозили. Концентрации химуса в реакционной смеси варьировали от 5 до 11 г/л. Измерения проводили на спектрофлуориметре “Флуорат-02-Панорама”.
Разработка способа освобождения субстрата от гуминовых веществ и пищевых частиц. Для коррекции подготовки экстрагента использовались 30 проб химуса. Были испытаны разные режимы центрифугирования проб химуса перед измерением ЦА: от 2000 до 5000 об/мин с визуальным контролем осаждения.
Исследование влияния концентрации химуса на ЦА (третий эксперимент). Из слепой кишки фермерского кролика было отобрано 20 проб химуса. По 10 проб экстрагировали в 86% глицерине и в фосфатном буфере. После центрифугирования из каждой пробы отбирали по 3 повторности супернатанта, растворяли их в фосфатном буфере так, чтобы конечная концентрация химуса в реакционных кюветах составляла 5, 10 и 15 г/л. Измерения проводили на спектрофлуориметре “Флуорат-02-Панорама”. По результатам измерения была построена математическая модель.
Анализ данных и построение математической модели. Весь анализ данных проводили в среде R (R Core Team, 2020), для построения графиков применяли пакет ggplot (Wickham et al., 2020), расширенный собственными функциями, для создания и анализа моделей – пакет lme4 (Bates et al., 2020). Разведочный анализ данных проводили согласно протоколу Жюра (Zuur et al., 2010). В первых двух экспериментах использовали только графический анализ, как в предварительных.
Данные, полученные в третьем эксперименте, представляют собой иерархическую структуру: 10 проб экстрагировалось глицерином, столько же – буфером, из каждой пробирки проводилось по 3 измерения разных концентраций. Такая структура данных и предполагаемая линейная зависимость ЦА от концентрации химуса соответствует линейной модели со смешанными эффектами (LMM), где пробирки являются случайным эффектом.
Использование LMM как метода анализа в третьем эксперименте диктуется не только структурой данных, но и тем, что такие модели позволяют наилучшим образом учесть взаимодействие различных эффектов, а также допускают нарушения критериев применимости классических методов статистики.
В модели ЦА как функции от ковариат мы предполагали, что ЦА распределена нормально. Фиксированными переменными являются концентрация химуса (интервальная) и экстрагент (фактор с двумя уровнями). Возможны взаимодействия между фиксированными эффектами, т.е., экстрагент × концентрация химуса. Чтобы учесть зависимость измерений из одной пробирки, в модель ввели пробирки как случайный эффект.
Следует учесть и вложенность факторов: экстрагент → пробирки → концентрация химуса. Обычно в линейных моделях вложенные фиксированные эффекты рассматривают просто как взаимодействующие.
Таким образом, формула максимальной модели (все эффекты и их взаимодействия) будет такой:
где: $cbh{{a}_{{ij}}}$ – ЦА j-го измерения из i-й пробирки; $i \in [1,20];$ $j \in [1,3];$ $\alpha $ – константа (оно же intercept); ${{\beta }_{n}}$ – угловые коэффициенты (slopes); ${\text{extragen}}{{{\text{t}}}_{{ij}}}$ – экстрагент; ${\text{con}}{{{\text{c}}}_{{ij}}}$ – концентрация химуса; ${\text{sampl}}{{{\text{e}}}_{i}}$ – пробирка (случайный эффект); ${{\varepsilon }_{{ij}}}$ – случайная ошибка (остатки модели, “шум”); $cbh{{a}_{{ij}}} \sim N(\mu ,{{\sigma }^{2}});$ ${\text{sampl}}{{{\text{e}}}_{i}} \sim N(0,\sigma _{{{\text{sample}}}}^{2});$ ${{\varepsilon }_{{ij}}} \sim N(0,{{\sigma }^{2}}).$
Для диагностики и оптимизации модели применяли сравнение по критерию Акаике с корректировкой для малых выборок (AICc), тест отношения правдоподобия LRT, метод Кенварда–Роджера и параметрический бутстреп, а также графический анализ. Валидацию моделей проводили методом построения графиков их остатков относительно предсказанных значений и относительно каждого предиктора. Помимо вышеперечисленных пакетов R для этого использовали пакеты MuMIn (Bartoń, 2020), pbkrtest (Halekoh, Højsgaard, 2014), performance (Lüdecke et al., 2020), и jtools (Long, 2020). Расчет доверительных и предсказательных интервалов проводили методом параметрического бутстрепа с помощью пакета ciTools (Haman, Avery, 2020). Коэффициенты детерминации ${{R}^{2}}$ для смешанных моделей рассчитывали по методу Накагавы с расширением Джонсона (Nakagawa, Schielzeth, 2013; Johnson, 2014) с помощью пакета performance.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
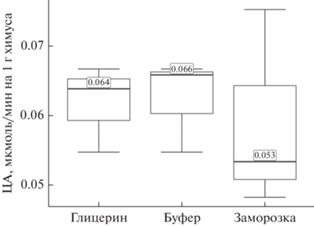
Экстракция целлюлаз из содержимого ЖКТ. В первом эксперименте результаты измерений активности целлюлаз, экстрагированных 86%-ным глицерином, по медиане практически не отличаются от экстрагированных буфером (рис. 1). ЦА замороженного химуса примерно на 20% меньше, чем в экстрагированных пробах. По сравнению с экстрактами в пробах замороженного химуса отмечается больший разброс результатов измерений, что вызвано взвесью частиц химуса в реакционных пробирках. Таким образом, подтверждается эффективность 86%-ного глицерина в качестве экстрагента и консерванта проб.
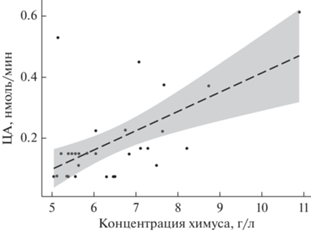
Рис. 1.
ЦА симбионтов слепой кишки домашнего кролика, нормированная на 1 г химуса по результатам первого эксперимента.
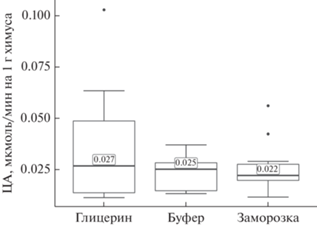
Результаты второго эксперимента подтверждают выводы, сделанные по итогам первого. Медианы измерений активности целлюлаз, экстрагированных различными способами, различаются слабо (рис. 2). Уменьшение ЦА в замороженных образцах практически не выражено. Тем не менее, в дальнейшем от заморозки как способа консервации проб решено было отказаться, поскольку в полевых условиях она доступна не всегда. Результаты измерений ЦА во втором эксперименте примерно вдвое меньше, чем в первом, что ожидаемо связано со смешанным рационом фермерского кролика.
Рис. 2.
ЦА симбионтов слепой кишки домашнего кролика, нормированная на 1г химуса по результатам второго эксперимента.
Очистка субстрата. Для освобождения субстрата от гуминовых веществ и пищевых частиц после испытания разных режимов центрифугирования выбрана оптимальная скорость 5000 об./мин, достаточная для осаждения нерастворимой фракции и в то же время не вызывающая разрушения макромолекул целлюлаз. Четкое разделение фракций происходило за 10 мин. В результате центрифугирования разброс значений ЦА (интерквартильный размах, примерный аналог “трех сигм”) во втором и третьем экспериментах был относительно невелик, что мы связываем с отсутствием взвеси в реакционной кювете.
Влияние концентрации химуса на ЦА (третий эксперимент). Графический анализ результатов второго эксперимента (рис. 3) показал предположительно линейную зависимость ЦА от концентрации химуса в реакционной кювете. Ни графический, ни статистический анализы не подтвердили влияние экстрагента на результаты измерения ЦА. Отсутствие статистически значимого влияния экстрагента согласуется с результатами первого и второго опытов, таким образом, 86%-ный глицерин был признан оптимальным экстрагентом и консервантом проб. Влияние концентрации химуса в реакционной смеси на регистрируемую ЦА подтверждается всеми вариантами модели. В результате анализа итоговая модель зависимости ЦА от концентрации химуса в пробе приобрела следующий вид:
где: $cbh{{a}_{{ij}}}$ – ЦА j-го измерения из i-й пробирки; $i \in [1,19];$ $j \in [1,3];$ ${\text{con}}{{{\text{c}}}_{{ij}}}$ – концентрация химуса; ${{a}_{i}} \sim N\left( {0,0.058} \right)$ – случайная константа для пробы; ${{b}_{{ij}}} \sim N\left( {0,0.009} \right)$ – случайный угол наклона для пробы; ${{{{\varepsilon }}}_{{ij}}} \sim N\left( {0,0.032} \right)$ – случайная ошибка (остатки модели, “шум”).
Количество наблюдений (пробирок) в модели N = 19, число измерений равно 57. Одну пробирку исключили в ходе разведочного анализа как экстремум. Валидация модели не выявила значимых нарушений. Основные параметры модели представлены в табл. 1. В настоящее время для оценки достоверности эффектов смешанных моделей не рекомендуется использовать p-значения, более надежными считаются доверительные интервалы. Влияние эффекта признается достоверным, если доверительный интервал не пересекает нуля (концентрация в табл. 1).
Таблица 1.
Фиксированные эффекты итоговой модели
| Коэффициент | Оценка | Стандартная ошибка | 2.5% | 97.5% |
|---|---|---|---|---|
| Константа | –0.024 | 0.017 | –0.058 | 0.010 |
| Концентрация | 0.021 | 0.002 | 0.017 | 0.026 |
Коэффициент детерминации ${{R}^{2}}$ в смешанных (многоуровневых) моделях представлен двумя типами – предельным и условным. Предельный $R_{{{\text{marginal}}}}^{2}$ показывает долю дисперсии, объясненную только фиксированными эффектами, без учета случайных. Условный $R_{{{\text{conditional}}}}^{2}$ показывает долю дисперсии, объясненную как фиксированными, так и случайными эффектами. В данном случае и предельный (0.622) и условный (0.92) коэффициенты детерминации весьма высоки, т.е., модель объясняет 92% дисперсии, из которых 62% объясняется влиянием концентрации химуса в реакционной кювете.
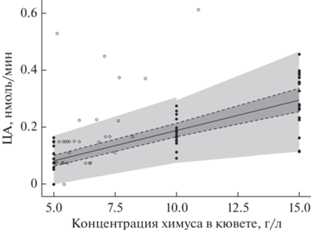
Графическое представление модели показано на рис. 4. Для проверки качества модели на графике показаны также результаты из второго эксперимента (те же пробы, но случайные концентрации). 23 точки из 29 (79%) попали в 95% интервал ожидания модели.
Рис. 4.
График итоговой модели с 95% доверительным интервалом (темно-серый) и 95% интервалом ожидания (светло-серый). Незалитые точки отображают измерения из второго эксперимента.
Методика флуориметрического измерения целлобиогидролазной активности в содержимом ЖКТ млекопитающих. В результате проведенных исследований в исходную методику флуориметрического определения ЦА (Синицын и др., 1990) были внесены существенные изменения и для работы с химусом составлен следующий протокол:
1) Фосфатный буфер рН 6.8–7.0 (0.15 моль/л) готовится смешиванием 0.15-молярных растворов 12‑водного Na2HPO4 и KH2PO4 в пропорции ≈1 : 1. M(Na2HPO4 · 12H2O) = 358 г/моль; M(KH2PO4) = = 136 г/моль; соответственно для получения 500 мл раствора надо растворить 0.15 × 0.5 × 358 = 26.85 г Na2HPO4 · 12H2O и 0.15 × 0.5 × 142 = 10.65 г KH2PO4.
2) Запасной раствор МУФ концентрацией 10–7 моль/мл готовится разведением 2 мг МУФ в 113.6 мл фосфатного буфера рН 6.8–7.0.
3) Запасной раствор МУФ-Ц концентрацией 10–6 моль/мл готовится разведением 5 мг МУФ-Ц в 0.193 (0.2) мл диметилсульфоксида (ДМСО), затем доливают 9.478 (9.5) мл буфера (концентрация ДМСО в итоге ≈2%). Конечная концентрация МУФ в калибровочных пробах 10–9 моль/мл, МУФ-Ц в рабочих пробах 10–7 моль/мл (запас на 2 порядка).
На спектрофлуориметре МРF-4 (Hitachi, Япония):
4) Калибровка. В мерную кювету вносят 0.2 мл глицеринового экстракта пробы химуса, доливают буфер до 2 мл и добавляют 20 мкл раствора МУФ. Снимают показания прибора при следующих длинах волн ($\lambda $): ${{\lambda }_{{{\text{возбуждения}}}}}$ = 368 нм и ${{\lambda }_{{{\text{флуоресценции}}}}}$ = 446 нм. В случае слишком больших или малых значений меняют усиление прибора и/или концентрацию МУФ. Рассчитывают коэффициент:
где: C – концентрация МУФ (в мкмоль/мл), D – показания прибора.
5) Измерение. В мерную кювету вносят 0.2 мл раствора МУФ-Ц, доливают 1.6 мл буфера и вносят ≈0.2 мл экстракта пробы химуса (в зависимости от желаемой его концентрации). Перемешивают. Снимают показания прибора (точка t = 0). Реакционную смесь переливают в чистую пробирку и инкубируют при 38–42°С в течение 1 ч, снимая показания прибора каждые 15 мин. Активность фермента (в мкмоль/мин) рассчитывают по формуле:
где: ${{D}_{t}}$ – показания прибора в момент времени t, ${{D}_{0}}$ – показания прибора в момент времени 0, V – объем реакционной смеси в мл, t – время реакции в минутах.
Выбирают максимальную At, и в дальнейших измерениях используют это время инкубации.
На спектрофлуориметре “Флуорат-02-Панорама” (Россия):
6) Калибровка. Глицериновый экстракт пробы химуса центрифугируют 5–15 мин при 5000 об./мин. В мерную кювету вносят 0.2 мл супернатанта, доливают буфер до 2 мл и измеряют сигнал фонового раствора (Ф) согласно инструкции к прибору при следующих длинах волн ($\lambda $): ${{\lambda }_{{{\text{возбуждения}}}}}$ = 368 нм и ${{\lambda }_{{{\text{флуоресценции}}}}}$ = 446 нм. В случае слишком больших или малых значений меняют усиление прибора (F1). Затем градуируют спектрофлуориметр при том же усилении согласно инструкции, доливая в кювету МУФ в диапазоне концентраций 10–4 – 2 × × 10–2 мкмоль/мл. Объем запасного раствора МУФ (VМУФ), который необходимо долить в кювету для получения конечной концентрации CМУФ в растворе, рассчитывается по формуле:
Достаточно 3 точек калибровки.
7) Действия аналогичны первому варианту, но, поскольку в данном случае спектрофлуориметр показывает непосредственно концентрацию (С), формула расчета активности другая:
где: ${{C}_{t}}$ – концентрация образовавшегося МУФ в момент времени t (в мкмоль/мл), ${{C}_{0}}$ – концентрация образовавшегося МУФ в момент времени 0 (в мкмоль/мл), V – объем реакционной смеси в мл, t – время реакции в минутах.
Возможно инкубировать реакционную смесь непосредственно в измерительных кюветах, без переливания. Оптимальное время по результатам ≈100 измерений равно 15 мин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные испытания активности целлюлаз, проявляющейся в разных экспериментальных условиях, позволили выделить оптимальные позиции для сбора и дальнейшей обработки материала. А именно, оптимальной средой для консервации и экстракции целлюлазного комплекса оказался 86%-ный глицерин. При идентичных с чистым буфером значениях ЦА (рис. 1, 2) глицерин обеспечивает консервацию образцов, в то время как взвесь содержимого пищеварительного тракта в нейтральном буфере представляет собой хорошую питательную среду для различных микроорганизмов. Кроме того, экстракция целлюлаз глицерином позволяет использовать одни и те же пробы для измерения как эндоглюканазной, так и целлобиогидролазной активности. От заморозки образцов окончательно отказались. Помимо очевидных технических трудностей при организации заморозки в полевых условиях и транспортировке замороженных проб, наблюдается тенденция к снижению в них ЦА (рис. 1, 2), что может быть вызвано частичной инактивацией ферментов воздействием низких температур.
По сравнению с лабораторным кроликом, питавшимся сеном, ЦА в слепой кишке фермерского кролика, содержавшегося на смешанном рационе, снижена примерно вдвое (рис. 1, 2): сказываются различия в составе корма. Гидролиз целлюлозы – энергозатратный процесс, и, при наличии в рационе легкоусвояемых нутриентов, синтез целлюлаз, предположительно, снижается.
Взвесь частиц химуса в реакционной смеси представляет серьезную проблему при измерениях, непредсказуемо пересекая световые потоки спектрофлуориметра. В первом опыте концентрация химуса в реакционной кювете была выбрана равной 5 г/л, в первую очередь, с целью минимизировать помутнение реакционной смеси. Центрифугирование позволило увеличить эту концентрацию примерно вдвое без видимого помутнения, и во втором опыте мы использовали случайные значения из диапазона 5–11 г/л. Тем не менее, полного осаждения частиц химуса не происходит, и при концентрации 15 г/л разброс показаний прибора растет (рис. 4). Исходя как из фактических данных, так и из предсказаний модели, оптимальной для дальнейшего применения методики можно считать концентрацию 10 г/л (0.01 г/мл) химуса в кювете, что примерно соответствует 0.2 г химуса в полевой пробе объемом 2 мл. При отборе проб химуса следует учитывать, что целлюлазный комплекс фиксирован на твердом субстрате – частицах содержимого пищеварительного тракта, поэтому минимально допустимый объем пробы зависит от гомогенности химуса. Предлагаемая методика оптимизирована для использования проб мелкодисперсного химуса от животных с высокой степенью измельчения корма зубами и малого объема проб, т. е., в первую очередь мелких млекопитающих-фитофагов.
Скорость ферментативной реакции при избытке субстрата зависит в т. ч. и от концентрации фермента, сначала увеличиваясь прямо пропорционально, затем выходя на плато при насыщении (Sattler et al., 1989). График зависимости абсолютной ЦА (скорости реакции) от концентрации химуса во втором эксперименте показал близкую к линейной корреляцию (рис. 3). Построенная математическая модель позволила проанализировать влияние экстрагента, концентрации химуса в реакционной смеси и случайного разброса (фактор пробы) на результаты измерения ЦА. Что касается экстрагента, модель подтверждает выводы предыдущих двух опытов – целлюлазы экстрагируются 86%-ным глицерином в достаточной степени, чтобы различий с буферным раствором практически не наблюдалось. Наблюдаемая на рис. 4 близкая к линейной корреляция ЦА и концентрации химуса показывает, что в условиях эксперимента насыщение реакционной смеси ферментом не достигается. Следовательно, для повышения чувствительности метода можно повысить концентрацию химуса и, соответственно, целлобиогидролаз в кювете, где проходит реакция, до 10 г/л.
В нескольких пробирках отмечалось сильное влияние случайного эффекта. Это отражает неравномерное распределение макромолекул целлюлазного комплекса по слепой кишке. Для компенсации разброса данных можно порекомендовать отбор большего количества проб из одного отдела пищеварительного тракта животного размером с кролика или же перемешивать химус в слепой кишке мелких грызунов. Высокие коэффициенты детерминации $R_{{{\text{marginal}}}}^{2}$ и $R_{{{\text{conditional}}}}^{2}$ показывают хорошее соответствие модели экспериментальным данным. В то же время около 30% дисперсии полученных результатов модель не объясняет. Можно предположить, что это опять-таки связано с неравномерностью распределения целлюлаз в химусе. Кроме того, дополнительную вариативность создает неполное осаждение частиц химуса при центрифугировании, что ограничивает возможность увеличения чувствительности метода путем повышения концентрации фермента в измерительной кювете.
По предварительным данным, целлюлазная активность достаточно устойчива и сохраняется в ЖКТ длительное время в широком диапазоне температуры окружающей среды. Но этот вопрос требует дополнительного специального исследования.
С учетом отмеченных ограничений разработанная методика достаточно удобна при изучении целлюлазной активности в пищеварительном тракте диких животных-фитофагов, так как позволяет отбирать пробы в полевых условиях. При этом одни и те же пробы можно использовать при измерении как эндоглюканазной, так и целлобиогидролазной активности.
Таким образом, на основании проведенного анализа можно рекомендовать разработанную схему сбора и обработки материала для широкого скрининга ЦА у фитофагов со смешанной и кишечной ферментацией. Накопление подобных данных позволит точнее оценивать актуальную и потенциальную возможности фитофагов, использовать лигноцеллюлозные корма в качестве нутриента. Поскольку именно структурные углеводы служат основным ограничителем кормового диапазона у фитофагов, знание особенностей их пищеварения может быть полезным в экологических прогнозах.
Благодарности. Авторы благодарят М.Л. Рабиновича, принимавшего непосредственное участие в разработке методики.
Этические нормы. Это исследование было проведено в соответствии с этикой и благополучием животных. Все исследования выполняли в соответствии с Законом о ветеринарной и медицинской деятельности и Национальным законом о защите животных.
Список литературы
Варшавский А.А., Наумова Е.И., Тихонов И.А. Особенности функционирования целлюлолитических симбионтов в преджелудке и слепой кишке серых полевок (Microtus arvalis и M. rossiaemeridionalis) // Зоол. журн. 2004. Т. 83. № 11. С. 1299–1304.
Варшавский А.А., Пузаченко А.Ю., Наумова Е.И., Костина Н.В. Ферментативная активность микрофлоры пищеварительного тракта обыкновенного слепыша Spalax microphtalmus (Spalacidea, Rodentia) // ДАН. 2003. Т. 392. № 4. С. 564–567.
Давлетова Л.В., Капралова Л.Т., Термелева А.Г. Морфофункциональное изучение органов пищеварения копытных. М.: Наука, 1986. 58 с.
Лактионов К.С. Исследование целлюлозолитической активности цекальных бактерий у кроликов методом in vivo // Вестник Орел ГАУ. 2012. № 1(34). С. 122–123.
Рабинович М.Л., Мельник М.С. Прогресс в изучении целлюлолитических ферментов и механизм биодеградации высокоупорядоченных форм целлюлозы // Успехи биол. химии. 2000. Т. 40. С. 205–266.
Синицын А.П., Черноглазов В.М., Гусаков А.В. Методы изучения и свойства целлюлолитических ферментов // Итоги науки и техники, сер. “Биотехнология”. М.: ВИНИТИ, 1990. 152 с.
Bartoń K. MuMIn: Multi-Model Inference, 2020. https://CRAN.R-project.org/package=MuMIn.
Bates D., Maechler M., Bolker B., Walker S. lme4: Linear Mixed-Effects Models using Eigen and S4, 2020. https://github.com/lme4/lme4/.
Coleman D.J., Studler M.J., Naleway J.J. A long-wavelength fluorescent substrate for continuous fluorometric determination of cellulase activity: resorufin-β-D-cellobioside // Anal. biochem. 2007. V. 371. № 2. P. 146–153.
Goering H.K., Van Soest P.J. Forage Fiber Analysis (Apparatus, Reagents, Procedures and Some Application) // Agric. Handbook. 1970. № 379.
Halekoh U., Højsgaard S. A Kenward-Roger Approximation and Parametric Bootstrap Methods for Tests in Linear Mixed Models – The R Package pbkrtest // Journal of Statistical Software. 2014. V. 59. № 9. P. 1–30.
Haman J., Avery M. ciTools: Confidence or Prediction Intervals, Quantiles, and Probabilities for Statistical Models, 2020. https://github.com/jthaman/ciTools.
Johnson P.C.D. Extension of Nakagawa & Schielzeth’s $R_{{GLMM}}^{2}$ to random slopes models // Methods in Ecol. and Evol. 2014. V. 5. № 9. P. 944–946.
Long J.A. jtools: Analysis and Presentation of Social Scientific Data, 2020. https://jtools.jacob-long.com
Lüdecke D., Makowski D., Waggoner P., Patil I., Ben-Shachar M.S. performance: Assessment of Regression Models Performance, 2020. https://easystats.github.io/performance/.
Nakagawa S., Schielzeth H. A general and simple method for obtaining ${{R}^{2}}$ from generalized linear mixed-effects models // Methods in Ecol. and Evol. 2013. V. 4. № 2. P. 133–142.
R Core Team. R: A Language and Environment for Statistical Computing. Vienna, Austria: R Foundation for Statistical Computing, 2020.
https://www.R-project.org/.
Sakaguchi E., Itoh H., Uchida S., Horigome T. Comparison of fibre digestion and digesta retention time between rabbits, guinea-pigs, rats and hamsters // British J. Nutrition. 1987. V. 58. № 1. P. 149–158.
Sakaguchi E., Kaizu K., Nakamichi M. Fibre digestion and digesta retention from different physical forms of the feed in the rabbit // Comp. Biochem. and Physiol. Part A: Physiology. 1992. V. 102. № 3. P. 559–563.
Sattler W., Esterbauer H., Glatter O., Steiner W. The effect of enzyme concentration on the rate of the hydrolysis of cellulose // Biotech. and bioengin. 1989. V. 33. № 10. P. 1221–1234.
Sharma A., Tewari R., Rana S.S., Soni R., Soni S.K. Cellulases: classification, methods of determination and industrial applications // Applied Biochem. and Biotech. 2016. V. 179. № 8. P. 1346–1380.
Tokuda G., Lo N., Watanabe H. Marked variations in patterns of cellulase activity against crystalline- vs. carboxymethyl-cellulose in the digestive systems of diverse, wood-feeding termites // Physiol. Entomol. 2005. V. 30. № 4. P. 372–380.
Wickham H., Chang W., Henry L., Pedersen T.L., Takahashi K., Wilke C., Woo K., Yutani H., Dunnington D. ggplot2: Create Elegant Data Visualisations Using the Grammar of Graphics, 2020.
https://CRAN.R-project.org/package=ggplot2.
Zuur A.F., Ieno E.N., Elphick C.S. A protocol for data exploration to avoid common statistical problems // Methods in Ecol. and Evol. 2010. V. 1. № 1. P. 3–14.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая