Известия РАН. Серия биологическая, 2022, № 6, стр. 642-648
Выявление матриксных металлопротеиназ в сердце преждевременно рожденных крыс
В. В. Иванова 1, *, И. В. Мильто 1, 2, О. Н. Серебрякова 1, И. В. Суходоло 1
1 ФГБОУ ВО СибГМУ Минздрава России
634050 Томск, Московский тракт, 2, Россия
2 ФГБУН СБН Центр ФМБА России
636013 Северск-13, а/я № 130, Россия
* E-mail: ivvera92@rambler.ru
Поступила в редакцию 13.07.2021
После доработки 14.03.2022
Принята к публикации 08.06.2022
- EDN: LUSWAB
- DOI: 10.31857/S1026347022060075
Аннотация
Изучено влияние преждевременного рождения на экспрессию матриксных металлопротеиназ (ММР2 и ММР9) в стенке левого желудочка сердца крыс в раннем постнатальном периоде онтогенеза (до 21 сут). В эксперименте иммуногистохимически исследованы фрагменты сердца преждевременно рожденных (срок гестации – 21 и 21.5 сут) и доношенных (срок гестации – 22 сут) крыс Вистар на 7 и 21 сут постнатального периода онтогенеза. Преждевременное рождение не оказывает эффекта на паттерн иммуногистохимического окрашивания MMP2 в стенке левого желудочка крыс, тогда как содержание MMP9 снижается на 7 сут и увеличивается на 21 сут постнатального периода онтогенеза, по сравнению с таковой доношенных крыс.
Преждевременное рождение у человека (ранее 37 полных недель беременности) является глобальной проблемой. Ежегодно свыше 15 млн детей рождаются до срока, из них 85% – на 32–36 неделе беременности (Blencowe et al., 2012). Преждевременные роды могут быть вызваны соматической патологией матери, индуцированы ятрогенно или же являются спонтанными (Walani, 2020).
В настоящее время не вызывает сомнения наличие связи преждевременного рождения с измененным фенотипом сердца и повышенным риском развития сердечно-сосудистых заболеваний во взрослом возрасте (Lewandowski et al., 2020). У преждевременно рожденных детей в возрасте 13 и 25 лет показан меньший размер желудочков (Goss et al., 2020), в возрасте 25 лет продемонстрировано снижение ударного и конечного диастолического объемов обоих желудочков, в сравнении с таковыми у доношенных сверстников (Lapidaire et al., 2021). В возрасте 18–40 лет у детей, рожденных ранее 37 недель беременности, показано снижение миокардиального резерва (Huckstep et al., 2018), а также более значимая связь между систолическим артериальным давлением и массовым индексом левого желудочка, чем у доношенных сверстников (Mohamed et al., 2021). У детей, рожденных ранее 37 недель беременности, в возрасте 30–34 лет продемонстрирован более высокий риск развития ишемической болезни сердца (Crump et al., 2019). Рождение ранее 32 недель беременности является риском раннего развития гипертонической болезни и сердечной недостаточности (Carr et al., 2017).
Установление начальных структурно-функциональных изменений в сердце преждевременно рожденных детей необходимо для понимания механизма развития у них сердечно-сосудистых заболеваний во взрослом возрасте. Основной массив клинических данных получен с помощью методов функциональной диагностики, таких как МРТ, ЭКГ, УЗИ (Crump et al., 2019; Goss et al., 2020; Lewandowski et al., 2020; Mohamed et al., 2021), и не позволяет детально охарактеризовать гистологические и цитологические особенности миокарда преждевременно рожденных детей. Таким образом, актуальным для изучения влияния преждевременного рождения на строение и функционирование миокарда является проведение экспериментальных исследований.
Ремоделирование межклеточного матрикса играет важную роль в регуляции пролиферации, дифференцировки, миграции и гибели клеток как в норме, так и при патологии (Silva et al., 2021). Преждевременное рождение ассоциировано с развитием окислительного стресса (Falsaperla et al., 2020), одним из эффектов которого является активация матриксных металлопротеиназ (Siwik, Colucci, 2004). Патогенетическая роль матриксных металлопротеиназ в ремоделировании сердца в результате преждевременного рождения не изучена. Цель данного исследования заключается в установлении влияния преждевременного рождения на экспрессию матриксных металлопротеиназ в сердце крыс в раннем постнатальном периоде онтогенеза.
МАТЕРИАЛЫ И МЕТОДЫ
В эксперименте использовали крыс Вистар обоего пола, из которых были сформированы 3 группы: контрольная группа (доношенные животные, продолжительность беременности 22 сут, 10 особей), 1 группа (недоношенные крысы, продолжительность беременности 21.5 сут, 10 особей) и 2 группа (недоношенные крысы, продолжительность беременности 21 сут, 10 особей). Для получения потомства, к самкам крыс Вистар (3 мес, 180 ± 20 г) в стадии проэструса полового цикла на ночь подсаживали самцов крыс линии Вистар (2 мес, 180 ± 20 г). Утром следующего дня анализировали влагалищные мазки самок крыс и считали первым днем беременности день обнаружения у самок во влагалищном мазке сперматозоидов. Индукцию преждевременных родов на 21 и 21.5 сут беременности осуществляли подкожным введением крысам мифепристона (1 мл, 10 мг/кг массы тела, “Sigma-Aldrich”, США) на 20 и 20.5 сут беременности соответственно (Dudley et al., 1996). Выведение потомства из эксперимента осуществляли на 7 и 21 сут постнатального периода онтогенеза асфиксией CO2. Крыс содержали в стандартных условиях вивария. Протокол исследования одобрен решением ЛЭК ФГБОУ ВО СибГМУ Минздрава России № 8475/1 от 30.11.2020.
Животных и их сердца взвешивали на лабораторных весах (“HL-100", Япония) для подсчета относительной массы сердца по формуле: [масса сердца (г)/масса крысы (г)] × 100%. Сердца крыс фиксировали 12–24 ч в забуференном (pH 7.4) формалине (“БиоВитрум”, Россия), промывали в проточной воде, обезвоживали в Isoprep (“БиоВитрум”) и пропитывали парафиновой смесью HISTOMIX (“БиоВитрум”). Приготовленные на автоматическом микротоме HM355S (“Thermo Fisher Scientific”, Китай) срезы толщиной 5 мкм использовали для иммуногистохимического анализа.
На полученных срезах выявляли матриксные металлопротеиназы 2 и 9, используя в качестве первичных антител NCL-MMP2-507 и NCL-MMP9-439 (“Novocastra”, Германия) в разведении 1 : 500. Проводили высокотемпературную демаскировку антигенов в цитратном буфере (0.01 М; рН 6.0). Для минимизации неспецифического окрашивания срезы инкубировали в течение 10 мин с “Peroxidase Block” (“Abcam”, Великобритания), а затем в течение 10 мин с “Protein Block” (“Abcam”). Срезы инкубировали с первичными антителами в течение 45 мин при температуре 25°С. Иммуногистохимическую реакцию визуализировали c помощью. системы детекции “Mouse and Rabbit Specific HRP/DAB IHC Detection Kit – Micro-polymer” (“Abcam”), после чего срезы докрашивали гематоксилином Джилла. Постановку отрицательного контроля антител осуществляли нанесением на срезы вместо первичных антител раствора для разведения антител “Ab Diluent” (“Abcam”). Реакцию оценивали в стенке левого желудочка сердца экспериментальных животных.
Исследование и фотосъемку микропрепаратов проводили c помощью светового микроскопа Axioscope 40 (“Zeiss”, Германия) и цифровой камеры CanonG5 (“Canon”, Китай).
На фотографиях, полученных с гистологических препаратов, с помощью программы ImageJ 1.48 (“NIH”, США) измеряли толщину стенки левого желудочка крыс.
Статистический анализ проведен c помощью SPSS 16.0 (“IBM”, США) с использованием критериев Шапиро–Уилка и Манна–Уитни. Данные представлены в виде медианы и квартилей – Ме(Q1; Q3). Различия между показателями считали достоверными при уровне значимости p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Получение преждевременно рожденного потомства. Инъекция мифепристона беременным крысам является надежным способом индукции преждевременных родов. Введение мифепристона на 20 и 20.5 сут беременности крысам приводит к началу родов через 18–24 ч. Полученное преждевременно рожденное потомство является жизнеспособным. Отмечали гибель отдельных особей на 1–3 сут постнатального периода онтогенеза среди крыс 2-ой группы. Стоит отметить, что крысы, рожденные на 36 ч ранее срока, являются нежизнеспособными.
В ходе постнатального периода онтогенеза отмечается увеличение массы крыс всех исследуемых групп. Масса крыс 1-ой и 2-ой групп на 7 и 21 сут постнатального периода онтогенеза меньше, чем масса крыс контрольной группы (табл. 1). На 21 сут постнатального периода онтогенеза минимальные значения массы тела отмечены у крыс 2-ой группы.
Таблица 1.
Морфометрические показатели преждевременно рожденных крыс и их сердца, Me(Q1;Q3)
| Экспериментальная группа | Срок постнатального периода онтогенеза, сут | |
|---|---|---|
| 7 | 21 | |
| Масса крыс, г | ||
| контрольная группа | 15.2 (14.7; 16.3) | 43.7 (41.4; 47.1)а |
| группа 1 | 13.7 (12.4; 14.6)б | 44.3 (40.7; 49.3)а |
| группа 2 | 12.1 (11.3; 13.3)б | 37.5 (35.5; 40.2)а, б, в |
| Относительная масса сердца, % | ||
| контрольная группа | 0.73 (0.67; 0.75) | 0.73 (0.68; 0.77) |
| группа 1 | 0.73 (0.69; 0.81) | 0.75 (0.67; 0.81) |
| группа 2 | 0.74 (0.68; 0.80) | 0.80 (0.75; 0.85)б |
| Толщина стенки левого желудочка сердца, мкм | ||
| контрольная группа | 719.2 (682.9; 811.4) | 1140.4 (975.6; 1250.3)а |
| группа 1 | 743.3 (695.1; 811.4) | 832.1 (748.4; 917.3)а, б |
| группа 2 | 693.7 (655.6; 786.8) | 871.8 (855.6; 943.7)а, б |
Характеристика сердца преждевременно рожденных крыс. Значения относительной массы сердца и толщины стенки левого желудочка экспериментальных животных отражены в табл. 1. На 7 сут постнатального периода онтогенеза не наблюдается отличия относительной массы сердца и толщины стенки левого желудочка крыс контрольной, 1-ой и 2-ой групп. Относительная масса сердца крыс 2-ой группы превышает соответствующий показатель крыс контрольной и 1-ой групп на 21 сутки постнатального периода онтогенеза. Толщина стенки левого желудочка крыс контрольной, 1-ой и 2-ой групп возрастает в ходе постнатального периода онтогенеза. На 21 сут постнатального периода онтогенеза толщина стенки левого желудочка крыс контрольной группы превышает соответствующий показатель сердца крыс 1-ой и 2-ой групп.
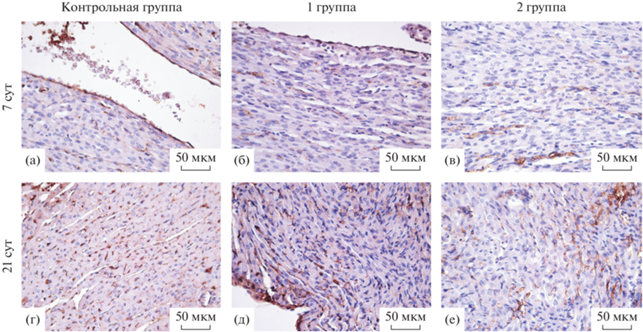
Выявление MMP2 в стенке левого желудочка преждевременно рожденных крыс. У крыс контрольной, 1-ой и 2-ой групп в стенке левого желудочка в наблюдаемые сроки определяется схожий паттерн MMP2-позитивного окрашивания. Иммунопозитивное окрашивание характерно для эндотелиоцитов эндокарда, фибробластов миокарда, мезотелиоцитов эпикарда и эндотелиоцитов кровеносных сосудов сердца крыс. На 7 сут постнатального периода онтогенеза MMP2-позитивное окрашивание характеризуется умеренной интенсивностью и наиболее выражено в субэпикардиальных участках стенки левого желудочка крыс (рис. 1). На 21 сут постнатального периода онтогенеза в стенке левого желудочка крыс определяется диффузное MMP2-позитивное окрашивание высокой интенсивности (рис. 1). У крыс 2-ой группы на 21 сут постнатального периода онтогенеза определяется более выраженная MMP2-позитивная реакция периваскулярной стромы, чем у крыс контрольной и 1-ой групп.
Рис. 1.
Фрагмент стенки левого желудочка крысы контрольной группы – срок гестации 22 сут (а, г), 1-ой группы – срок гестации 21.5 сут (б, д), 2-ой группы – срок гестации 21 сут (в, е) на 7 и 21 сут постнатального периода онтогенеза. Иммуногистохимическая реакция на MMP2 с докраской гематоксилином Джилла. MMP2-позитивное окрашивание умеренной (а, б, в) и высокой (г, д, е) интенсивности.
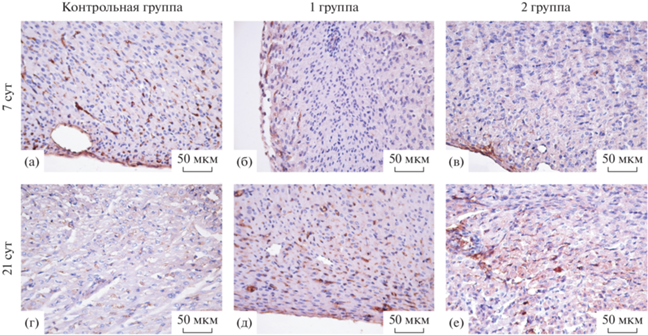
Выявление MMP9 в стенке левого желудочка преждевременно рожденных крыс. MMP9-позитивное окрашивание определяется в стенке левого желудочка крыс всех исследуемых групп на 7 и 21 сут постнатального периода онтогенеза. Количество MMP9-позитивных структур в стенке левого желудочка возрастает в ходе онтогенеза у крыс контрольной, 1-ой и 2-ой групп. Иммунопозитивными являются эндотелиоциты эндокарда, фибробласты миокарда, мезотелиоциты эпикарда и эндотелиоциты кровеносных сосудов сердца крыс. На 7 и 21 сут постнатального периода онтогенеза MMP9-позитивное окрашивание определяется в эндокарде, субэндокардиальных и субэпикардиальных участках миокарда левого желудочка крыс (рис. 2). Количество иммунопозитивных структур, а также степень интенсивности иммунного окрашивания на 7 сут постнатального периода онтогенеза представляется большей в стенке левого желудочка крыс контрольной группы, по сравнению с таковыми животных 1-ой и 2-ой групп. На 21 сут постнатального периода онтогенеза количество MMP9-позитивных структур, а также степень интенсивности иммунного окрашивания в стенке левого желудочка крыс контрольной группы визуально меньшие, чем у животных 1-ой и 2-ой групп.
Рис. 2.
Фрагмент стенки левого желудочка крысы контрольной группы – срок гестации 22 сут (а, г), 1-ой группы – срок гестации 21.5 сут (б, д), 2-ой группы – срок гестации 21 сут (в, е) на 7 и 21 сут постнатального периода онтогенеза. Иммуногистохимическая реакция на MMP9 с докраской гематоксилином Джилла. MMP9-позитивное окрашивание умеренной (б, в, г) и высокой (а, д, е) интенсивности.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В раннем постнатальном периоде онтогенеза возрастающая гемодинамическая нагрузка индуцирует структурные преобразования в сердце, затрагивающие как клетки, так и межклеточное вещество. Ремоделирование межклеточного вещества в ходе постнатального кардиоморфогенеза является нормальным процессом, заключающимся в сбалансированных процессах деградации и синтеза его компонентов. В ходе постнатального периода онтогенеза в сердце показано снижение экспрессии фибронектина, гиалуроновой кислоты и протеогликанов и накопление коллагенов (I и III типов) и ламинина (Silva et al., 2021). Накопление коллагенов в межклеточном веществе миокарда способствует увеличению степени упорядоченности миофибрилл в цитоплазме кардиомиоцитов, а также ассоциировано с угнетением активности клеточного цикла кардиомиоцитов (Yahalom-Ronen et al., 2015).
Мишенями MMP2 и MMP9 являются компоненты межклеточного матрикса (коллагены I и IV типов, ламинин), цитокины и хемокины (DeCoux et al., 2014). Результаты экспериментальных исследований свидетельствуют о множественных, подчас противоположных эффектах матриксных металлопротеиназ в сердце, реализуемых различными механизмами. MMP2 и MMP9, разрушая компоненты межклеточного вещества, влияют на его архитектонику. Кроме того, продукты деградации компонентов межклеточного вещества – матрикины – являются биологически активными молекулами. В частности, матрикины, образующиеся в результате частичного протеолиза MMP2 и MMP9 коллагена I типа, регулируют электрическую активность и клеточную гибель кардиомиоцитов, пролиферацию и миграцию миофибробластов, модулируют ангиогенез, являются мощными активаторами нейтрофильных гранулоцитов, служат хемоаттрактантами макрофагов и тучных клеток, а также способны модулировать экспрессию и активность самих матриксных металлопротеиназ (Maquart et al., 2004). Стоит отметить, что содержание матриксных металлопротеиназ в раннем постнатальном периоде онтогенеза в норме изучена недостаточно (Kandasamy et al., 2010).
Преждевременное рождение крыс ассоциировано с меньшей массой тела в раннем постнатальном периоде онтогенеза. Меньшая масса преждевременно рожденных животных, вероятно, является причиной более низких абсолютных морфометрических показателей сердца, таких как толщина стенки левого желудочка. Для выявления закономерностей, не связанных с размерами животных, предпочтительно анализировать относительные морфометрические показатели сердца.
Нами продемонстрировано, что у преждевременно рожденных крыс наблюдается увеличение относительной массы сердца уже в раннем постнатальном периоде онтогенеза. Одним из возможных механизмов ремоделирования сердца является изменение активности матриксных металлопротеиназ, которое может наблюдаться с первых дней постнатального периода онтогенеза и приводить к ранним структурным изменениям стенки сердца (Tong et al., 2011).
Показано, что преждевременное рождение ассоциировано с окислительным стрессом (Falsaperla et al., 2020). Активные формы кислорода и азота индуцируют транскрипцию генов матриксных металлопротеиназ, а также непосредственно активируют проферменты (Siwik, Colucci, 2004; Bavineni et al., 2019). Известно, что у детей, рожденных на 33–36 неделе беременности активность MMP2 и MMP9 в ходе 1 мес. постнатального периода онтогенеза выше, чем у детей, рожденных в срок (Schulz et al., 2004). Увеличение активности MMP2 и MMP9 в плазме крови продемонстрировано в раннем постнатальном периоде онтогенеза у детей с врожденными дефектами межжелудочковой перегородки. Активность матриксных металлопротеиназ положительно коррелирует со степенью тяжести заболевания (Cheng et al., 2013). Какое влияние оказывает преждевременное рождение на содержание матриксных металлопротеиназ в сердце в раннем постнатальном периоде онтогенеза не изучено.
Деградация компонентов межклеточного вещества матриксными металлопротеиназами в раннем постнатальном периоде онтогенеза наблюдается при увеличении размеров и изменении формы кардиомиоцитов, а также при установлении клеточных контактов между ними. Показано, что гипертрофия кардиомиоцитов сопровождается активацией ММР2 (Verzola et al., 2006). Нами продемонстрирован высокий уровень экспрессии ММР2 в стенке левого желудочка как доношенных, так и преждевременно рожденных крыс в период, соответствующий активному гипертрофическому росту миокарда (7 и 21 сут постнатального периода онтогенеза).
Ангиогенез, активно протекающий в сердце крыс в раннем постнатальном периоде онтогенеза, индуцируется ММР9 и сопровождается повышением активности ММР2 (Bellafiore et al., 2013). Экспрессия MMP2 и MMP9 в эндотелиоцитах развивающихся кровеносных сосудов в субэпикардиальных участках миокарда свидетельствует об их участии в ангиогенезе.
Интересным представляется тот факт, что экспрессия ММР9 в сердце преждевременно рожденных крыс на 21 сут постнатального периода онтогенеза превышает таковую у контрольных животных. Известно, что MMP9 играет ключевую роль в дезадаптивном ремоделировании сердца в условиях патологии (DeCoux et al., 2014; DeLeon-Pennell et al., 2017). В экспериментах in vivo продемонстрировано, что угнетение экспрессии или активности MMP9 приводит к снижению воспалительной реакции и степени ремоделирования сердца (Turner, Porter, 2012).
* * *
Таким образом, преждевременное рождение у крыс не оказывает влияния на содержание MMP2 в стенке левого желудочка в исследуемые сроки, тогда как содержание MMP9 снижается на 7 сут и увеличивается на 21 сут постнатального периода онтогенеза, по сравнению с таковым у доношенных крыс. Стоит отметить, что иммуногистохимическое исследование не позволяет дифференцировать латентную и активную формы матриксных металлопротеиназ. Кроме того, требуется дальнейшее исследование, целью которого будет анализ экспрессии и активности ингибиторов матриксных металлопротеиназ в сердце преждевременно рожденных животных.
Финансирование. Работа выполнена при финансовой поддержке Программы стратегического академического лидерства “Приоритет – 2030”.
Список литературы
Bavineni M., Wassenaar T.M., Agnihotri K., Ussery D.W., Lüscher T.F., Mehta J.L. Mechanisms linking preterm birth to onset of cardiovascular disease later in adulthood // Eur. Heart J. 2019. V. 40. P. 1107–1112.
Bellafiore M., Battaglia G., Bianco A., Farina F., Palma A., Paoli A. The involvement of MMP-2 and MMP-9 in heart exercise-related angiogenesis // J. Transl. Med. 2013. V. 11. 283. https://doi.org/10.1186/1479-5876-11-283
Blencowe H., Cousens S., Oestergaard M.Z., Chou D., Moller A.B., Narwal R., Adler A., Vera Garcia C., Rohde S., Say L., Lawn J.E. National, regional, and worldwide estimates of preterm birth rates in the year 2010 with time trends since 1990 for selected countries: a systematic analysis and implications // Lancet. 2012. V. 379. P. 2162–2172.
Carr H., Cnattingius S., Granath F., Ludvigsson J.F., Edstedt Bonamy A.K. Preterm Birth and Risk of Heart Failure Up to Early Adulthood // J. Am. Coll. Cardiol. 2017. V. 69. P. 2634–2642.
Cheng K.S., Liao Y.C., Chen M.Y., Kuan T.C., Hong Y.H., Ko L., Hsieh W.Y., Wu C.L., Chen M.R., Lin C.S. Circulating matrix metalloproteinase-2 and -9 enzyme activities in the children with ventricular septal defect // Int. J. Biol. Sci. 2013. V. 9. P. 557–563.
Crump C., Howell E.A., Stroustrup A., McLaughlin M.A., Sundquist J., Sundquist K. Association of Preterm Birth With Risk of Ischemic Heart Disease in Adulthood // JAMA Pediatr. 2019. V. 173. P. 736–743.
DeCoux A., Lindsey M.L., Villarreal F., Garcia R.A., Schulz R. Myocardial matrix metalloproteinase-2: inside out and upside down // J. Mol. Cell Cardiol. 2014. V. 77. P. 64–72.
DeLeon-Pennell K.Y., Meschiari C.A., Jung M., Lindsey M.L. Matrix Metalloproteinases in Myocardial Infarction and Heart Failure // Prog. Mol. Biol. Transl. Sci. 2017. V. 147. P. 75–100.
Dudley D.J., Branch D.W., Edwin S.S., Mitchell M.D. Induction of preterm birth in mice by RU486 // Biol. Reprod. 1996. V. 55. P. 992–995.
Falsaperla R., Lombardo F., Filosco F., Romano C., Saporito M., Puglisi F., Piro E., Ruggieri M., Pavone P. Oxidative Stress in Preterm Infants: Overview of Current Evidence and Future Prospects // Pharmaceuticals (Basel, Switzerland). 2020. V. 13. 145. https://doi.org/10.3390/ph13070145
Goss K.N., Haraldsdottir K., Beshish A.G., Barton G.P., Watson A.M., Palta M., Chesler N.C., Francois C.J., Wieben O., Eldridge M.W. Association Between Preterm Birth and Arrested Cardiac Growth in Adolescents and Young Adults // JAMA Cardiol. 2020. V. 5. P. 910–919.
Huckstep O.J., Williamson W., Telles F., Burchert H., Bertagnolli M., Herdman C., Arnold L., Smillie R., Mohamed A., Boardman H., McCormick K., Neubauer S., Leeson P., Lewandowski A.J. Physiological Stress Elicits Impaired Left Ventricular Function in Preterm-Born Adults // J. Am. Coll. Cardiol. 2018. V. 71. P. 1347–1356.
Kandasamy A.D., Chow A.K., Ali M.A., Schulz R. Matrix metalloproteinase-2 and myocardial oxidative stress injury: beyond the matrix // Cardiovasc. Res. 2010. V. 85. P. 413–423.
Lapidaire W., Clark C., Fewtrell M.S., Lucas A., Leeson P., Lewandowski A.J. The Preterm Heart-Brain Axis in Young Adulthood: The Impact of Birth History and Modifiable Risk Factors // J. Clin. Med. 2021. V. 10(6). 1285. https://doi.org/10.3390/jcm10061285
Lewandowski A.J., Levy P.T., Bates M.L., McNamara P.J., Nuyt A.M., Goss K.N. Impact of the Vulnerable Preterm Heart and Circulation on Adult Cardiovascular Disease Risk // Hypertension. 2020. V. 76. P. 1028–1037.
Maquart F.X., Pasco S., Ramont L., Hornebeck W., Monboisse J.C. An introduction to matrikines: extracellular matrix-derived peptides which regulate cell activity. Implication in tumor invasion // Crit. Rev. Oncol. Hematol. 2004. V. 49. P. 199–202.
Mohamed A., Marciniak M., Williamson W., Huckstep O.J., Lapidaire W., McCance A., Neubauer S., Leeson P., Lewandowski A.J. Association of Systolic Blood Pressure Elevation With Disproportionate Left Ventricular Remodeling in Very Preterm-Born Young Adults: The Preterm Heart and Elevated Blood Pressure // JAMA Cardiol. 2021. V. 6. P. 821–829.
Schulz C.G., Sawicki G., Lemke R.P., Roeten B.M., Schulz R., Cheung P.Y. MMP-2 and MMP-9 and their tissue inhibitors in the plasma of preterm and term neonates // Pediatr. Res. 2004. V. 55. P. 794–801.
Silva A.C., Pereira C., Fonseca A.C.R.G., Pinto-do-Ó P., Nascimento D.S. Bearing My Heart: The Role of Extracellular Matrix on Cardiac Development, Homeostasis, and Injury Response // Front. Cell Dev. Biol. 2021. V. 8. 621644. https://doi.org/10.3389/fcell.2020.621644
Siwik D.A., Colucci W.S. Regulation of matrix metalloproteinases by cytokines and reactive oxygen/nitrogen species in the myocardium // Heart Fail. Rev. 2004. V. 9. P. 43–51.
Turner N.A., Porter K.E. Regulation of myocardial matrix metalloproteinase expression and activity by cardiac fibroblasts // IUBMB Life. 2012. V. 64. P. 143–150.
Tong W., Xue Q., Li Y., Zhang L. Maternal hypoxia alters matrix metalloproteinase expression patterns and causes cardiac remodeling in fetal and neonatal rats // Am. J. Physiol. Heart Circ. Physiol. 2011. V. 301. H2113–H2121. https://doi.org/10.1152/ajpheart.00356.2011
Verzola R.M.M., Mesquita R.A., Peviani S., Ramos O.H.P., Moriscot A.S., Perez S.E.A., Selistre-de-Araújo H.S. Early remodeling of rat cardiac muscle induced by swimming training // Braz. J. Med. Biol. Res. 2006. V. 39. P. 621–627.
Walani S.R. Global burden of preterm birth // Int. J. Gynaecol. Obstet. 2020. V. 150. P. 31–33.
Yahalom-Ronen Y., Rajchman D., Sarig R., Geiger B., Tzahor E. Reduced matrix rigidity promotes neonatal cardiomyocyte dedifferentiation, proliferation and clonal expansion // Elife. 2015. V. 4. e07455. https://doi.org/10.7554/eLife.07455
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


