Известия РАН. Серия биологическая, 2022, № 6, стр. 649-660
Разнообразие и динамика сообществ гетертрофных жгутиконосцев в литорали крупного равнинного водохранилища
Н. Г. Косолапова 1, *, Е. В. Кузнецова 1, Д. Б. Косолапов 1, 2
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, пос. Борок, 109, Россия
2 Череповецкий государственный университет
162600 Вологодская обл., Череповец, просп. Луначарского, 5, Россия
* E-mail: kng@ibiw.ru
Поступила в редакцию 02.02.2021
После доработки 29.04.2021
Принята к публикации 30.04.2021
- EDN: CKFKKE
- DOI: 10.31857/S1026347022050110
Аннотация
В течение 4-х лет в весенне-летний период изучали видовой состав и структуру сообществ планктонных гетеротрофных жгутиконосцев (нанофлагеллят, ГНФ) разнотипных прибрежных мелководий Рыбинского водохранилища (Верхняя Волга), в том числе, испытывающих влияние жизнедеятельности колониальных птиц. Идентифицированы 105 видов и форм ГНФ из 13 крупных таксонов и группы неопределенного систематического положения. На всех исследованных участках наибольшим числом видом были представлены таксоны Choanoflagellida и Chrysomonadida. В прибрежных мелководьях, испытывающих влияние колониальных поселений птиц, встречалось меньше видов ГНФ, чем на участках вне зон этого влияния. Общими для всех участков литорали были 35 видов, из них 3 вида (Bodo designis, Paraphysomonas imperforata и Spumella sp. 1) имели высокую частоту встречаемости (≥50%). Однако основу разнообразия ГНФ составляли виды, частота встречаемости которых была ≤20%, и которые занимали более половины списка видов во всех биотопах.
Понимание структурно-функциональной организации экосистемы во многом основано на знаниях о взаимодействии видов в ее трофических сетях, в процессе которых осуществляются круговороты веществ и энергии (Pomeroy, 1974). C появлением концепции “микробной петли” или “микробной трофической сети” (Azam et al., 1983; Sherr, Sherr, 1988), исследования межмикробных взаимодействий лежат в основе понимания структуры и функций всей трофической сети, поскольку микроорганизмы играют ведущие роли в минерализации органических веществ, круговоротах биогенных элементов, формировании биомассы и продуктивности водных экосистем. Гетеротрофные жгутиконосцы (нанофлагелляты, ГНФ) являются постоянными компонентами микробной трофической сети, главными потребителями пикопланктона и важными пищевыми объектами для инфузорий и многоклеточного зоопланктона (Laybourn-Parry, Parry 2000; Weisse, 2002; Auer et al., 2004).
Исследования ГНФ Рыбинского водохранилища (Верхняя Волга) имеют многолетнюю историю, однако, в основном, они ограничивались глубоководной частью водоема и редко затрагивали прибрежно-мелководные участки (Жуков, 1989, 2001; Косолапова, 2018). Вместе с тем литоральная зона занимает значительную часть акватории водохранилища, служит местом нереста рыб и гнездования птиц, отличается резкими колебаниями физико-химических условий и своеобразием биологических сообществ (Рыбинское водохранилище…, 1972). Находясь на границе водной и наземной сред, прибрежные мелководья водохранилищ характеризуются открытостью и по сравнению с мелководьями озер обладают специфическими чертами, обусловленными, в первую очередь, нестабильностью уровневого режима (Буторин, 1984). Сезонная и межгодовая динамика численности и биомассы ГНФ на разнотипных участках литорали Рыбинского водохранилища описана нами ранее (Румянцева и др., 2013, 2015, 2016).
Цель настоящей работы – изучить динамику разнообразия и структуры сообщества ГНФ в прибрежных мелководьях Рыбинского водохранилища, в том числе испытывающих влияние колониальных поселений птиц.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в 2009–2011 и 2013 гг. на прибрежно-мелководных участках Рыбинского водохранилища вблизи поселений колониальных птиц: в защищенной зарастающей литорали среди гнездовий птиц сем. Чайковых (Laridae) и сем. Крачковых (Sternidae) (ст. Ч) и в открытой литорали около колонии серой цапли (Ardea cinerea L.) (ст. Ц). Одновременно отбор проб воды производили на фоновых участках, расположенных на расстоянии 200–500 м от соответствующих птичьих колоний (ст. ФЧ и ФЦ), где гидрологические параметры были примерно такими же, как на станциях Ч и Ц. Сроки и периодичность отбора проб были выбраны в связи с особенностями биологии птиц, в первую очередь, с учетом сроков их гнездования. С середины мая до середины июля, в период максимальной орнитогенной нагрузки, когда вылуплялись и активно выкармливались птенцы, отбор проб производили еженедельно. До и после этого периода периодичность отбора составляла 1 раз в две недели.
Определение видового состава бесцветных жгутиконосцев проводили с помощью фазово-контрастной микроскопии в нефиксированных пробах с использованием микроскопа AxioScope Al (“Carl Zeiss”, Германия). Пробы воды просматривали в течение недели для более полного изучения видового состава жгутиконосцев (Методика изучения …, 1975; Vørs, 1992). Для идентификации жгутиконосцев использовали известные руководства (Ветрова, 1980; Жуков, 1993; Lee, Patterson, 2000; Lee, 2015).
Анализ полученных данных проводили, используя принятые в гидробиологии показатели: число видов (S), частота встречаемости (Р, %), альфа-разнообразие, т.е. среднее число видов в пробе. Бета-разнообразие (β) сообществ гетеротрофных нанофлагеллят рассчитывали по формуле Р. Уиттекера:
β = (S/α) – 1, где S – общее число видов, α – среднее количество видов в сообществах (Уиттекер, 1980).
В местах отбора проб измеряли температуру воды, концентрацию растворенного кислорода и биохимическое потребление кислорода (БПК5). Условия обитания литоральных микробных сообществ описаны нами ранее (Румянцева и др., 2015).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
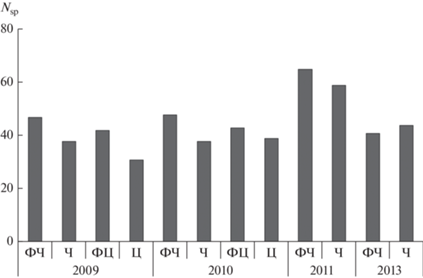
За весь период исследований в литорали Рыбинского водохранилища идентифицировано 105 видов и форм гетеротрофных жгутиконосцев, относящихся к 13 крупным таксонам и группе неопределенного систематического положения. Основу разнообразия на всех исследованных биотопах составляли представители Choanoflagellida (22 вида) и Chrysomonadida (16 видов) (табл. 1). Остальные таксономические группы содержали в своем составе от 1 до 14 видов. Максимальное число видов зарегистрировано на ст. ФЧ (81), минимальное – на ст. Ц (48 видов). Общими для всех исследованных сообществ были 35 видов, что составляет 33% общего количества определенных видов, из которых 3 вида (Bodo designis, Paraphysomonas imperforata и Spumella sp.1) имели высокую частоту встречаемости (Р ≥ 50%). Наибольшее число постоянных видов (7) обнаружено на ст. Ч, а наименьшее – на ст. Ц (3 вида). На фоновых участках зарегистрировано 6 (ст. ФЧ) и 5 (ст. ФЦ) постоянных видов. Некоторые виды имели высокую частоту встречаемости только на одном из исследованных участках: это Paraphysomonas vestita на ст. ФЧ, Codosiga botritis на ст. Ч и Ancyromonas sigmoides на ст. ФЦ. На ст. Ц таких видов не обнаружено. Некоторые виды ГНФ были приурочены лишь к одному биотопу. Наибольшее число таких специфических видов (по 11) зарегистрировано в закрытой литорали (ст. ФЧ и Ч), наименьшее (1 вид) – на ст. Ц, на ст. ФЦ таких видов было 6. Межгодовые исследования фауны ГНФ показали, что наибольшее число видов обнаружено в 2011 г. на ст. ФЧ (65 видов), а наименьшее (31 вид) – в 2009 г. на ст. Ц (рис. 1). Причем на фоновых участках количество видов было больше, чем на участках, заселенных птицами. Исключение составил 2013 г., когда число видов на ст. Ч было выше, чем на ст. ФЧ.
Таблица 1.
Видовой состав и частота встречаемости ГНФ на разных участках прибрежных мелководий Рыбинского водохранилища
| Вид | 2009–2011, 2013 гг. | 2009–2010 гг. | ||
|---|---|---|---|---|
| ФЧ | Ч | ФЦ | Ц | |
| Mastigamoebidae Goldschmidt, 1907 | ||||
| Mastigomaeba limax Moroff, 1904 | – | 2 | – | – |
| Choanomonada Kent, 1880 | ||||
| Aulomonas purdyi Lackey, 1942 | – | – | 5 | – |
| Codosiga botritis Kent,1880 | 43 | 53 | 32 | 27 |
| Codonosiga sp. | – | – | 5 | – |
| Codonosigopsis robini Senn, 1900 | – | 7 | – | – |
| Desmarella irregularis Stokes, 1888 | – | 2 | – | – |
| Diplosiga socialis Frenzel, 1892 | – | – | 5 | – |
| Kentrosiga setifera Schiller, 1953 | 2 | – | – | – |
| Lаgenoeca globulosa France 1897 | 2 | – | 5 | – |
| L. ruttneri Bourrelly, 1952 | 4 | 2 | – | – |
| Monosiga ovata Kent, 1880 | 45 | 33 | 41 | 36 |
| Monosiga sp. | – | 5 | 5 | 5 |
| Protospongia haeckeli Kent, 1880 | 7 | 5 | – | – |
| Salpingoeca amphoridium Clark, 1868 | 2 | – | – | 5 |
| S. convallaria Stein, 1878 | – | – | 5 | – |
| S. globulosa Zhukov, 1978 | 4 | – | – | – |
| S. gracilis Clark, 1868 | 7 | 7 | – | – |
| S. minor Dangeard, 1910 | 24 | 28 | 18 | 5 |
| S. minuta Kent, 1880 | 20 | 9 | 5 | – |
| S. oblonga Stein, 1878 | 2 | – | – | – |
| S. pixidium Kent, 1880 | 4 | 2 | – | – |
| S. urnula Skuja, 1948 | 7 | 5 | – | 5 |
| S. vagenicola Stein, 1878 | – | 2 | – | – |
| Bicosoecida Grassè and Deflandre, 1952 | ||||
| Bicosoeca crystallina (Lackey) Skuja, 1956 | 4 | – | – | – |
| B. conica Lemmerman, 1914 | 4 | 5 | 5 | 5 |
| B. cylindrica (Lackey) Bourrelly, 1951 | 4 | 2 | – | – |
| B. exilis Penard, 1921 | 20 | 5 | 9 | 5 |
| B. fotti Bourrelly, 1951 | – | – | 5 | – |
| B. lacustris Skuja, 1948 | 27 | 16 | 14 | 9 |
| B. ovata Lemmerman, 1914 | – | 2 | – | – |
| B. planctonica Kisselew, 1931 | 9 | – | – | – |
| Cafeteria roenbergensis Fenchel and Patterson, 1990 | 4 | 5 | – | – |
| Cyathobodo sp. | 2 | – | – | – |
| Pseudodendromonas vlkii (Vlk, 1938) Bourrelly, 1953 | – | 2 | – | – |
| Chrysophyceae Pascher, 1914 | ||||
| Anthophisa vegetans (O.F.M.) Stein, 1878 | 7 | 23 | – | – |
| Cladomonas fruticulosa Stein, 1878 | – | 5 | – | – |
| Dendromonas cryptostilus Skuja, 1948 | – | 2 | – | – |
| Paraphisomonas imperforata Lucas, 1967 | 51 | 60 | 68 | 55 |
| P. vestita (Stokes) De Saedeleer, 1929 | 53 | 40 | 23 | 9 |
| Siphomonas fritschii Pringcheim, 1946 | 16 | 5 | 5 | 14 |
| Stokesiella longipes (Stokes, 1888) Lemmermann, 1910 | 4 | 2 | – | – |
| Spumella coronifera Skuja, 1948 | 9 | 5 | – | 5 |
| Spumella cylindrica Skuja, 1956 | 11 | 14 | 18 | 9 |
| S. neglecta Skuja, 1956 | 2 | – | – | – |
| S. major Skuja, 1956 | 4 | 7 | – | 5 |
| S. (Monas) sochiabilis (Meyer, 1897) | 4 | 12 | – | – |
| Spumella vivipara | 27 | 26 | 23 | 14 |
| Spumella sp. 1 | 69 | 74 | 50 | 55 |
| Spumella sp. 2 | 31 | 37 | 41 | 14 |
| Spumella sp. 3 | 42 | 30 | 18 | 41 |
| Histionidae Flavin and Nerad, 1993 | ||||
| Reclinomonas americana Flavin and Nerad, 1993 | 22 | 14 | – | – |
| Euglenida Bütschli, 1884, emend. Simpson, 1997 | ||||
| Entosiphon sulcatum (Duj.) Stein, 1878 | 16 | 16 | 9 | 5 |
| Petalomonas angusta (Klebs) Lemmerman, 1910 | – | 2 | – | – |
| P. minuta Hollande, 1942 | 2 | 7 | 5 | 9 |
| P. steini Klebs, 1893 | 7 | 9 | 9 | 5 |
| P.pusilla Skuja, 1948 | 50 | 52 | 32 | 23 |
| Petalomonas sp. | 4 | – | – | – |
| Pseudoperanema fusiforme (Larsen, 1987) Larsen and Patterson, 1990 | 9 | 7 | – | – |
| Ploeotia discoides Larsen and Patterson, 1990 | 33 | 12 | 9 | – |
| Kinetoplastea Honigberg, 1963 | ||||
| Bodo curvifilus Griessmann, 1913 | 4 | 7 | 23 | 23 |
| B. designis Skuja, 1948 | 73 | 70 | 73 | 64 |
| B. edax Klebs, 1893 | 2 | 5 | – | – |
| B. globosus Stein, 1878 | – | 2 | – | – |
| B. minimus Klebs, 1893 | 13 | 14 | 9 | 9 |
| B. repens Klebs, 1893 | 4 | 2 | 9 | 14 |
| B. rostratus (Kent) Klebs, 1893 | 2 | 9 | 5 | 5 |
| B. saltans Ehrenberg, 1832 | 31 | 26 | 32 | 27 |
| B. saliens Larsen et Patterson, 1990 | 4 | 7 | 9 | 5 |
| B. spora Skuja, 1956 | 4 | 5 | 5 | – |
| Rhynchomonas nasuta (Stokes, 1888) Klebs, 1892 | 31 | 53 | 55 | 36 |
| Parabodo nitrophilus Skuja, 1948 | – | – | 9 | – |
| Phyllomitus apiculatus Skuja, 1948 | 44 | 44 | – | 23 |
| Cryptophyceae Pascher, 1913 | ||||
| Goniomonas truncata (Fresenius) Stein, 1887 | 62 | 60 | 41 | 32 |
| Cercomonadida (Poche, 1913), emend. Vickerman, 1983, emend. Mylnikov, 1986 | ||||
| Allantion tachyploon Sandon, 1924 | 18 | 12 | – | – |
| Cercomonas amoibinus Mylnikov, 1985 | 2 | – | – | – |
| C. crassicauda Dujardin, 1841 | 13 | 9 | 5 | 5 |
| C. granulifera Hollande, 1942 | 7 | 9 | 5 | – |
| C. levis Skuja, 1939 | 2 | – | – | – |
| C. longicauda Dujardin, 1841 | 27 | 19 | 9 | 9 |
| C. minimus Mylnikov, 1992 | 2 | – | – | 14 |
| Сercomonas sp.1 | 7 | 7 | 5 | 9 |
| Сercomonas sp.2 | 4 | 2 | – | – |
| Heteromita minima (Hollande, 1942), Mylnikov, 2000 | 20 | 19 | 23 | 9 |
| H. reniformis (Zhukov, 1978) Mylnikov et Karpov, 2004 | 33 | 30 | 18 | 5 |
| Helkesimastix faccicola Woodcock et Lapage, 1914 | – | 2 | – | – |
| Protaspis gemmifera Larsen and Patterson, 1990 | 13 | 19 | – | 5 |
| P. simplex Vørs, 1992 | 18 | 21 | 9 | – |
| Silicofilosea Adl et al., 2005 | ||||
| Thaumatomonas lauterborni De Saedeleer, 1931 | 2 | – | 5 | 5 |
| Dictyochophyceae Silva, 1980 | ||||
| Actinomonasmirabilis Kent, 1880 | 7 | 5 | 5 | 5 |
| Pteridomonas pulex Penard, 1890 | 4 | 12 | – | – |
| Colpodellida Cavalier-Smith, 1993, emend. Adl et al., 2005 | ||||
| Colpodella angusta (Duj.) Simpson et Patterson, 1996 | 4 | 2 | 23 | 5 |
| Spongomonadida (Hibberd, 1983), emend. Karpov, 1990 | ||||
| Spongomonas uvella Stein, 1878 | 4 | – | 9 | – |
| Protista incertae sedis | ||||
| Ancyromonas contorta (Klebs) Lemmermann, 1910 | 13 | 2 | – | 5 |
| A. sigmoides Kent, 1880 | 49 | 42 | 50 | 36 |
| Amastigomonas debriney De Saedeleer, 1931 | 2 | 2 | 9 | – |
| A. caudata Zhukov, 1975 | 2 | – | – | – |
| Aulacomonas hyalina Skuja, 1956 | 7 | 2 | 9 | 5 |
| Colponema loxodes Stein, 1878 | 13 | 9 | – | – |
| Metromonas sp. | – | – | – | 5 |
| Katablepharis sp. | 24 | 12 | 18 | 23 |
| Всего видов: 105 | 81 | 77 | 53 | 48 |
Рис. 1.
Число видов ГНФ (Nsp) в защищенной зарастающей литорали Рыбинского водохранилища на заселенном чайками и крачками (ст. Ч) и фоновом (ст. ФЧ) участках и в открытой литорали вблизи колониальных поселений цапель (ст. Ц) и на фоновом участке (ст. ФЦ) в 2009, 2010, 2011 и 2013 гг.
Наибольшим видовым разнообразием в сообществе ГНФ защищенной литорали во все годы наблюдений характеризовались хризофитовые. Больше всего представителей этой группы обнаружено на станциях Ч и ФЧ в 2011 г.: 14 и 13 видов соответственно. В представленности других эколого-таксономических групп в закрытой литорали наблюдались некоторые различия. Так, в составе сообщества ГНФ в 2009 г. на ст. ФЧ преобладали три группы: хоанофлагелляты, кинетопластиды и церкомонадиды, а на ст. Ч только кинетопластиды (рис. 2а). В 2010 г. в этих биотопах содоминирующей группой были кинетопластиды, а в 2011 – хоанофлагелляты. В 2013 г. на станциях ФЧ и Ч часто встречались церкомонады, а на ст. ФЧ еще и эвгленовые.
Рис. 2.
Таксономическая структура сообществ ГНФ на станциях Ч и ФЧ (а) и станциях Ц и ФЦ (б) в разные годы проведения исследований.
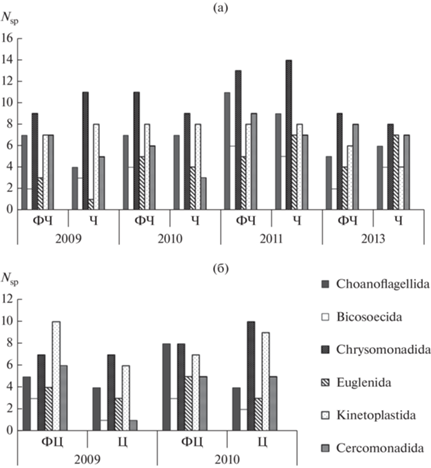
В открытой литорали в 2009 г. на ст. ФЦ по числу видов доминировали кинетопластиды, а на ст. Ц – хризомонадиды (рис. 2б). В 2010 г. на ст. ФЦ наибольшим разнообразием отличались хоанофлагелляты и хризофитовые, а на ст. Ц – хризофитовые и кинетопдастиды. Меньше всего за весь период исследований как в закрытой, так в открытой литорали встречалось представителей бикозоецид.
Число видов ГНФ в литорали водохранилища испытывало резкие сезонные колебания. Амплитуды сезонных изменений этого показателя обычно имели сходный характер на всех исследованных биотопах. Как правило, за пиком числа видов шел его резкий спад (рис. 3). На ст. ФЧ в 2009 г. обнаруживалось от 1 до 21 вида ГНФ (в среднем за сезон 9.6 видов), максимальные значения регистрировались в конце мая, в конце июня и в первой декаде августа. На ст. Ч число видов изменялось в пределах 2–22, а в среднем, за сезон составило 9.4. Здесь наблюдался только один ярко выраженный пик числа видов (в конце июня) (рис. 3а). Минимальное количество видов на обоих биотопах было в конце августа. В 2010 г. на станциях ФЧ и Ч число видов ГНФ изменялось от 5 до 19 (в среднем, за сезон 9.9) и от 4 до 16 (в среднем, 7.7) соответственно. Увеличение числа видов ГНФ на ст. Ч отмечалось в конце мая и в середине августа, а на ст. ФЧ – в середине июня. Меньше всего ГНФ на этих участках закрытой литорали регистрировалось в начале (ст. Ч) и в конце июня (ст. ФЧ) (рис. 3б).
Рис. 3.
Число видов ГНФ в 2009 (а, в), 2010 (б, г), 2011 (д) и 2013 (е) гг. на разных участках литорали водохранилища: 1 – ст. ФЧ, 2 – ст. Ч, 3 –ст. ФЦ, 4 – ст. Ц.
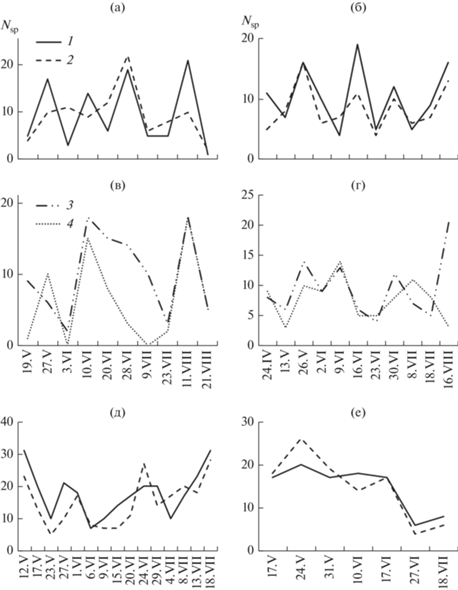
На станциях ФЦ и Ц открытой литорали в 2009 г. среднее за сезон число видов ГНФ составляло 10 и 6 соответственно. Максимум видов ГНФ регистрировался на фоновой станции в первой декаде июня, а также на обоих участках в начале августа. Меньше всего видов было в начале июня, а на ст. Ц еще и в начале июля (рис. 3в). В 2010 г. в среднем за сезон обнаруживалось 8 (на ст. Ц) и 10 (на ст. ФЦ) видов ГНФ. Наибольшее число видов на ст. ФЦ регистрировалось в середине августа, а на ст. Ц – в начале июня. Меньше всего видов ГНФ на ст. ФЦ было в начале третьей декады июня, а на ст. Ц в середине мая и августа (рис. 3г).
В 2011 и 2013 гг. в закрытой литорали отмечаются наиболее высокий уровень альфа-разнообразия: на станциях ФЧ и Ч, в среднем, за сезон обнаруживалось 17 и 15 видов соответственно. Число видов ГНФ было максимальным в середине мая и в середине августа, а минимальным – в начале июня (рис. 3д). В 2013 г. наблюдались отличия в сезонной динамике числа видов, а именно: увеличение числа видов в конце мая и дальнейшее их постепенное снижение (рис. 3е).
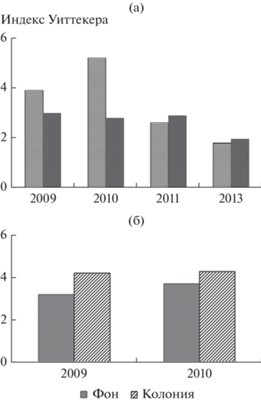
Для понимания видового разнообразия сообществ ГНФ участков литорали проведен анализ их бета-разнообразия. Считается, что чем меньше общих видов в сообществах, тем этот показатель выше (Уиттекер, 1980). Бета-разнообразие сообществ ГНФ фоновых участков было сравнительно высоким в 2009 и 2010 гг. и низким – в 2011 и 2013 гг. (рис. 4а). В биотопах, заселенных птицами, сообщества ГНФ отличалось большим постоянством. Бета-разнообразие сообщества на ст. Ц было выше, чем на ст. ФЦ, что свидетельствует о меньшей гетерогенности сообщества на участке вблизи колонии цапель (рис 4б).
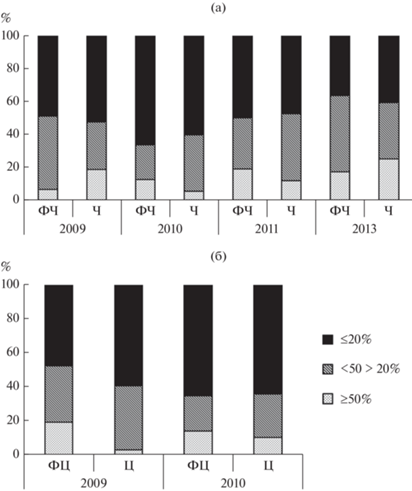
Анализ распределения видов ГНФ по частоте встречаемости показал, что постоянные виды (Р ≥ 50%) составляли меньшую часть (3–22%) общего числа видов во всех литоральных биотопах (рис. 5). Основу разнообразия сообществ ГНФ определяли редкие виды (Р ≤ 20%), на долю которых приходилось более половины видов. В 2013 г. в закрытой литорали, особенно вблизи колонии чаек, наблюдалось снижение доли редких видов и увеличение доли постоянных видов.
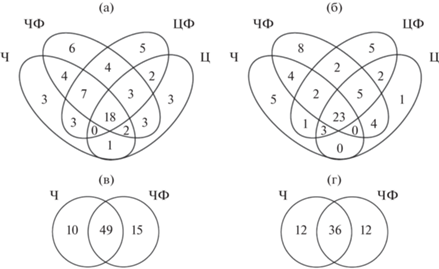
Для определения сходства сообществ ГНФ разных участков литорали водохранилища использовали диаграммы Венна. В 2009 г. общими для всех четырех биотопов были 18 видов, что составляло 28% общего числа видов, в 2010 г. сходство сообществ было выше: общими были 35% видов (рис 6а и 6б). В 2009 г. сообщества ГНФ фоновых участков были более сходными (65%) по сравнению с сообществами участков, заселенных птицами (43%). В 2010 г., сходство сообществ между ст. Ц и ФЦ составляло 69%, а между ст. Ч и ФЧ – 51%. В 2011 и 2013 гг. сходство между сообществами фоновых и заселенными птицами участков оказалось равным 66% и 60% общего числа видов соответственно (рис.6в, г). В 2009 и 2010 гг. сходство сообществ было выше на фоновых (65 и 43% соответственно), чем заселенных птицами участках (58 и 52% соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сообщества ГНФ разных водных местообитаний при некоторой степени структурной общности, которую определяют эврибионтные виды, имеют существенные отличия. Пока до конца не выяснено, какие факторы являются определяющими при формировании тех или иных типов сообществ ГНФ, какие изменения их структурной организации происходят при изменении условий окружающей среды. Известно, что для каждого пресного водоема характерен определенный комплекс видов ГНФ, отражающий его тип, уровень трофии, степень и характер загрязнения и др. Богаче всего фауна ГНФ мезосапробных водоемов. В олигосапробных водоемах доминируют прикрепленные одноклеточные формы: фильтраторы или седиментаторы (роды Salpingoeca, Bicosoecida). Мезосапробные водоемы характеризуются массовым развитием неприкрепленных жгутиконосцев, питающихся путем активной охоты (бодониды, бесцветные эвгленовые), однако максимальной плотности здесь достигают прикрепленные колониальные организмы (род Codonosiga). В полисапробных водах доминируют неприкрепленные формы (Золотарев, 1987).
Большинство ГНФ из отрядов Chrysomonadida и Kinetoplastida является эврибионтными и повсеместно распространено в пресных водоемах (Mathes, Arndt, 1994; Arndt et al., 2000; Auer, Arndt, 2001; Weitere, Arndt, 2003; Косолапова, 2005). Содоминантами могут быть хоанофлагелляты, бикозоециды, эвглениды и катаблефариды. В литорали Рыбинского водохранилища лидирующей группой в сообществе ГНФ были воротничковые жгутиконосцы (хоанофлагелляты), тогда как эвглениды не достигали значительного развития. С другой стороны, нами обнаружено значительное разнообразие церкомонад и бикозоецид, которые, однако, в сообществах исследованных биотопов в большинстве случаев были редкими представителями.
При эвтрофировании водоемов могут исчезать некоторые виды ГНФ. Вероятно, этим можно объяснить меньшее число видов ГНФ на участках литорали Рыбинского водохранилища, испытывающих влияние колониальных поселений птиц. Ранее в результате исследования малой реки, впадающей в Рыбинское водохранилище, было установлено, что на ее участках, испытывающих антропогенное (сточные воды сырзавода) и зоогенное (жизнедеятельность бобров) влияние, видовое богатство ГНФ было ниже, чем на быстротекущих и медленнотекущих, зарастающих макрофитами участках (Косолапова, 2002). В работах А.В. Крылова с соавт. (Крылов и др., 2012) было также показано уменьшение видового богатства и числа доминирующих видов зоопланктона в местах колониальных поселений птиц, вызванное поступлением больших количеств органических веществ и соединений биогенных элементов в результате жизнедеятельности птиц. По нашим данным, в литорали Рыбинского водохранилища значения БПК5, отражающие содержание в воде легкоокисляемых органических веществ, в местах колониальных поселений птиц были, в среднем, в 3 раза выше, чем на фоновых участках.
В литорали по сравнению с пелагиалью Рыбинского водохранилища, нами было обнаружено большее число видов ГНФ. Исследования, проведенные в глубоководной части водохранилища в 2007–2009 гг., выявили 73 вида и формы ГНФ из 12 крупных таксонов и группы неопределенного систематического положения (Косолапова, 2018). Основу разнообразия пелагиальных сообществ составляли представители Kinetoplastida, Cercomonadida, Chrysomonadida и Choanomonada. В прибрежно-мелководной зоне обнаружено 39 видов, которые не встречались в глубоководной части водохранилища, и только 6 видов, идентифицированных в пелагиали, не были отмечены в литорали.
Доминирующий комплекс сообществ ГНФ в литорали водохранилища состоял из 19 видов. Это Codonosiga botritis, Monosiga ovata, Bicosieca lacustris, Anthophisa vegetans, Spumella sp. 1, S. sp. 2, S. sp. 3, Paraphisomonas imperforata, P. vestita, B. designis, Bodo saltans, Rhynchomonas nasuta, Phyllomitus apiculatus, Petalomonas pusilla, Goniomonas truncata, A. sigmoides, Reclinomonas americana, Protaspis simplex и Heteromita reniformis. Большинство этих видов обладает широкой экологической валентностью, и населяет разнотипные водоемы с большим диапазоном варьирования экологических факторов.
Интересно отметить, что некоторые виды ГНФ постоянно встречались только в прибрежных мелководьях, не испытывающих влияние жизнедеятельности колониальных птиц, – это M. ovata, B. lacustris, B. saltans и H. reniformis. На участках, заселенных птицами, только два вида флагеллят (A. vegetans и P. simplex) имели высокую частоту встречаемости. B. designis постоянно регистрировался во всех литоральных биотопах все четыре года исследований.
Десять видов, обнаруженных в прибрежных мелководьях водохранилища (Actinomonas mirabilis, Ancyromonas sigmoides, Amastigomonas debriney, B. designis, B. saltans, Bodo saliens, Cafeteria roenbergensis, P. pusilla, Petalomonas minuta и Rh.s nasuta) входят в число 20 наиболее часто встречающихся в мировой фауне ГНФ (Patterson, Lee, 2000).
Большую часть сообщества ГНФ литорали водохранилища составляли редкие виды (Р ≤ 20%), которые, как правило, и определяли различия видового состава между биотопами. Эта закономерность наблюдается в большинстве водоемов и водотоков (Косолапова, 2002, 2005).
Характер сезонных колебаний числа видов ГНФ на разных участках прибрежных мелководий водохранилища имел свои особенности, причем влияние на него колониальных поселений птиц проявлялось слабо. Практически на всех участках наблюдалось 4 основных пика числа видов ГНФ: в конце мая, в середине июня, в конце июня и в середине августа. Исключением был 2013 г., когда в защищенной литорали регистрировался один пик в конце мая, и в дальнейшем происходило постепенное снижение числа видов. Вероятно, это связано с тем, что в 2013 г. наблюдались резкие колебания уровня воды водохранилища. В этот год в защищенной литорали птицы не смогли сформировать гнездовую колонию высокой плотности, как в предыдущие годы, поэтому их влияние на ГНФ было менее выражено.
Важными факторами, определяющими развитие ГНФ в пресных водоемах, являются уровень количество, активность и структура сообщества их основных пищевых объектов – бактерий, а также их основных консументов: инфузорий и многоклеточного зоопланктона (Arndt et al., 2000; Auer, Arndt, 2001). В водохранилищах, особенно в их литоральной зоне, на структурно-функциональную организацию сообществ гидробионтов решающее влияние оказывает уровневый режим, регулируемый человеком. Взаимодействие всех этих и других факторов объясняет высокую вариабельность численности, биомассы (Румянцева и др., 2016), а также числа видов ГНФ в литорали Рыбинского водохранилища в течение вегетационного сезона (с мая до обмеления и пересыхания прибрежно-мелководных участков в августе). При этом состав таксонов высокого ранга, особенно доминирующих, оставался сравнительно постоянным.
* * *
Таким образом, в литорали Рыбинского водохранилища идентифицировано 105 видов и форм ГНФ из 13 крупных таксонов и группы неопределенного систематического положения. Фауна ГНФ в литоральной зоне водохранилища представлена большим числом видов, чем в пелагиали. По видовому богатству доминировали хоанофлагелляты и хризофитовые. В прибрежных мелководьях, заселенных колониальными птицами, число видов ГНФ было обычно ниже, чем в фоновых биотопах. Большинство часто встречающихся в литорали водохранилища видов относится к эврибионтам. В литорали водохранилища обнаружено 10 видов, входящих в состав 20 наиболее часто встречающихся видов в мировой фауне ГНФ. Основу разнообразия литоральных сообществ ГНФ составляли редкие виды, которые чаще всего и определяли различие между биотопами.
Финансирование. Работа выполнена в рамках государственного задания (№ темы АААА-А18-118012690098-5).
Список литературы
Буторин Н.В. Значение мелководий в биологической продуктивности водохранилищ / Н.В. Буторин, С.М. Успенский // Биологические ресурсы водохранилищ. М.: Наука, 1984. С. 23–41.
Ветрова З.И. Бесцветные эвгленовые водоросли Украины // Киев: Наукова Думка, 1980. 184 с.
Жуков Б.Ф. Бесцветные жгутиконосцы в планктоне некоторых волжских водохранилищ // Биол. внутр. вод: Информ. бюл. Л., 1989. № 83. С. 28–31.
Жуков Б.Ф. Атлас пресноводных гетеротрофных жгутиконосцев (биология, экология и систематика). Рыбинск: Ин-т биологии внутр. вод, 1993. 160 с.
Жуков Б.Ф. Гетеротрофные жгутиконосцы // Экологические проблемы Верхней Волги: Коллективная монография. Ярославль: Изд-во ЯГТУ, 2001. С. 117–120.
Золотарев В.А. Простейшие водоемов различной сапробности. // Фауна и биология пресноводных организмов. Л.: Наука, 1987. С. 108–119.
Косолапова Н.Г. Фауна гетеротрофных жгутиконосцев малой реки Латка // Биол. внутр. вод. 2002. № 4. С. 14–18.
Косолапова Н.Г. Сообщества планктонных гетеротрофных жгутиконосцев в малых водных объектов Автореф. дис. канд. биол. наук. Борок, 2005. 24 с.
Косолапова Н.Г. Гетеротрофные жгутиконосцы в планктоне водохранилища // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI в. / ред. В.И. Лазарева. М.: РАН, 2018. С. 208–2012.
Крылов А.В., Кулаков Д.В., Чалова И.В., Папченков В.Г. Зоопланктон пресных водоемов в условиях влияния гидрофильных птиц // Ижевск: Издатель Пермяков С.А., 2012. 204 с.
Методика изучения биогеоценозов внутренних водоемов. М.: Наука, 1975. 240 с.
Румянцева Е.В., Косолапов Д.Б., Косолапова Н.Г., Кулаков Д.В. Динамика планктонных микроорганизмов и вирусов в литорали Рыбинского водохранилища: влияние колониальных поселений птиц // Биол. внутр. вод. 2013. № 4. С. 21–29
Румянцева Е.В., Косолапов Д.Б., Косолапова Н.Г., Леванова Ю.В. Бактериопланктон Рыбинского водохранилища в зоне колониальных поселений птиц сем. Чайковых (Laridae) // Биол. внутр. вод. 2015. № 2. С. 39–49
Румянцева Е.В., Косолапова Н.Г., Косолапов Д.Б. Взаимоотношения бактериопланктона, гетеротрофных нанофлагеллят и вириопланктона в литорали крупного равнинного водохранилища: влияние колониальных птиц // Микробиология. 2016. Т. 85. № 5. С. 588–597
Рыбинское водохранилище и его жизнь. Л.: Изд-во “Наука”, 1972. 364 с.
Уиттекер P. Сообщества и экосистемы. М.: Изд-во Прогресс, 1980. 328 с.
Arndt H., Dietriech D., Auer B., Cleven E.-J., Grafenhan T., Wietere M., Mylnikov A. Functional diversity of heterotrophic flagellates in aquatic ecosystems // The flagellates: Unity, diversity and evolution. (Eds: Leadbeater B.S.C.; Green J.C.). London and N.Y.: Taylor and Francis, 2000. P. 240–268.
Auer B., Arndt H. Taxonomic composition and biomass of heterotrophic flagellates in relation to lake trophy and season // Freshwater Biol. 2001. V. 46. P. 959–972.
Auer B., Elzer U., Arndt H. Comparison of pelagic food webs in lakes along a trophic gradient and with seasonal aspects: influence of resource and predation // J. Plankton Res. 2004. V. 26. № 6. P. 697–709.
Azam F., Fenchel T., Field J.G., Gray J.S., Meyer-Reil L.A., Thingstad T.F. The ecological role of water-column microbes in the sea // Mar. Ecol. Prog. Ser. 1983. V. 10. P. 257–263.
Laybourn-Parry J., Parry J. Flagellates and the microbial loop // The Systematics Association Special Volume Series 59. The Flagellates, Unity, Diversity and Evolution. London, N.Y.: Taylor & Francis, 2000. P. 216–239.
Lee W. Small free-living heterotrophic flagellates from marine sediments of Gippsland Basin, South-Eastern Australia // Acta Protozool. 2015. V. 54. P. 53–76.
Lee W., Patterson D. Heterotrophic flagellates (Protista) from marine sediments of Botany Bay // Austr. J. Nat. History. 2000. V. 34. P. 483–562.
Mathes J., Arndt H. Biomass and composition of protozooplankton in relation to lake trophy in North German lakes // Mar. Microb. Food Webs. 1994. V. 4. P. 357–375.
Patterson D.J., Lee W.J. Geographic distribution and diversity of free-living heterotrophic flagellates // The flagellates: Unity, diversity and evolution. (Eds: Leadbeater BSC; Green JC). London and N.Y.: Taylor and Francis, 2000. P. 259–287.
Pomeroy L. The ocean’s food web, a changing paradigm // BioScience. 1974. V. 24. P. 499–504.
Sherr E.B., Sherr B.F. Role of microbes in pelagic food webs: a revised concept // Limnol. Oceanogr. 1988. V. 33. P. 1225–1226.
Tikhonenkov D.V., Mylnikov A.P., Gong Y.C., Feng W.S., Mazei Y. Heterotrophic Flagellates from Freshwater and Soil Habitats in Subtropical China (Wuhan Area, Hubei Province) // Acta Protozool. 2012. V. 51. P. 63–77.
Vørs N. Heterotrophic amoebae, flagellates and Heliozoa from the Tvarminne Area, Gulf of Finland, in 1988–1990 // Ophelia. 1992. V. 36. № 1. P. 1–109.
Weitere M., Arndt H. Structure of the heterotrophic flagellate community in the water column of the River Rhine (Germany) // Eur. J. Protistol. 2003. V. 39. P. 287–300.
Weisse T. The significance of inter- and intraspecific variation in bacterivorous and herbivorous protists // Antonie van Leeuwenhoek. 2002. V. 81. P. 327–341.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая