Известия РАН. Серия биологическая, 2022, № 6, стр. 626-635
Морфо-генетические особенности колонка (Mustela sibirica Pall.) на северо-восточной окраине ареала (бассейн средней Лены, Якутия)
Е. С. Захаров 1, 2, *, В. М. Сафронов 1, Н. Н. Захарова 2, Л. А. Пестрякова 2, Л. П. Корякина 3, S. Kruse 4, Н. А. Бочкарев 5
1 Институт биологических проблем криолитозоны СО РАН
677980 Якутск, проспект Ленина 41, Россия
2 Институт естественных наук СВФУ им. М.К. Аммосова
677000 Якутск, ул. Кулаковского 58, Россия
3 Арктический государственный агротехнологический университет
677007 Якутск, Сергеляхское шоссе 3, Россия
4 Институт полярных и морских исследований им. Альфреда Вегенера
14473 Потсдам, Телеграфенберг А45, Германия
5 Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
* E-mail: zevsable@gmail.com
Поступила в редакцию 07.06.2021
После доработки 08.11.2021
Принята к публикации 20.12.2021
- EDN: OUKGKD
- DOI: 10.31857/S1026347022060154
Аннотация
Рассмотрены половые и возрастные различия колонка по морфологическим признакам, оценена величина полового диморфизма по основным размерным характеристикам. Выявлено высокое гаплотипическое разнообразие и пониженный уровень нуклеотидного разнообразия колонка в Якутии. Установлены сходство якутского и западносибирского колонков по комплексу морфо-генетических признаков и их отличия от дальневосточного подвида, включая изменчивость фрагмента гена цитохром b мтДНК. Построена медианная сеть гаплотипов колонка, характеризующая филогенетические взаимоотношения между популяциями. Показаны возможные пути и последовательность расселения колонка в Северной Азии
Колонок широко распространен в Северной, Южной и Юго-Восточной Азии. В мировом ареале колонка описано 14 подвидов (Ellerman et al., 1951). На территории России встречаются два подвида – сибирский (Mustela sibirica sibirica Pallas, 1773) и дальневосточный (Mustela sibirica manchurica Pallas, 1911). Первый из них населяет восточную часть европейской части страны и Сибирь, второй – Приамурье и Приморье (Гептнер и др., 1967). Относительно светлый мех и мелкие размеры колонка на территории Якутии несколько отличали его от сибирской формы вида (Строганов, 1962). Позднее по размерам тела и черепа он был отнесен к номинальному подвиду (M. s. sibirica) с некоторыми отклонениями в структуре и окраске меха (Гептнер и др., 1967; Тавровский и др., 1971). Ареал колонка в Якутии охватывает Лено-Вилюйское и Лено-Амгинское междуречья и бассейны рр. Алдан и Олекма. Северная граница распространения проходит по левобережному бассейну р. Вилюй, восточная – по западным и южным отрогам Верхоянского хребта. Наибольшая плотность вида приурочена к долине р. Лены и бассейну р. Амга в пределах Центральной Якутии. Южнее административной границы Якутии и Станового хребта сибирский подвид заходит до бассейна р. Зея, где его сменяет более крупный дальневосточный подвид (Новиков, 1956; Бромлей и др., 1984). В данном сообщении охарактеризованы морфо-генетические отличия якутского колонка от западносибирских и дальневосточных популяций вида, показана изменчивость митохондриальной ДНК, филогения, история заселения видом территории Якутии.
МАТЕРИАЛЫ И МЕТОДЫ
Основу статьи составляют морфометрические исследования 77 тушек колонка, собранных в бассейне средней Лены в 2003–2018 гг. Дополнительно были измерены 53 черепа колонков Центральной Якутии из зоологической коллекции Института биологических проблем криолитозоны СО РАН за 1950–1980 гг. Приведены промеры 124 черепов колонка из Западной Сибири, 16 черепов из бассейна р. Амур, 3 – из Забайкалья, 1 – из бассейне р. Кама, хранящихся в зоологическом музее Института систематики и экологии животных СО РАН (г. Новосибирск). Масса тела дана по тушкам без шкурок. Для краниологической характеристики использованы 8 признаков: кондилобазальная длина, общая длина, основная длина, длина лицевого отдела, длина мозгового отдела, скуловая ширина, межглазничная ширина, мастоидная ширина. Возраст определяли по числу годовых слоев в цементе клыка (Клевезаль, 2007).
Степень полового диморфизма оценивали в процентах по формуле D = X♂ – X♀ ⁄X♀ × 100, где D – величина полового диморфизма, X♂ и X♀ – средние величины признаков для самцов и самок (Павлинов, Россолимо, 1974).
Статистический анализ и визуализацию проводили в программной среде для статистических вычислений R-Project функция 'hclust', использовали метод минимальной дисперсии Уорда для поиска компактных сферических кластеров (https:// www.rdocumentation.org/packages/stats/versions/3.6.2/topics/hclust).
Выделение ДНК проводили фенольно-хлороформным методом из фиксированной в 96%-ом этаноле мышечной ткани (Sambrook et al., 1989). Выделенную ДНК хранили при температуре 4°C. Выполнен анализ изменчивости первой субъединицы гена цихром b мт ДНК, амплифицированного в полимеразной цепной реакции с использованием разработанных внешних праймеров MmarL1 5'‑GACAAAATCCCATTCCACC-3' Forward и MmarH1 5'-GTAATTA ATATACTACAAAGACT-CTTCATTT-3' Reverse. Амплификацию фрагмента проводили в реакционной смеси объемом 20 мкл. Программа амплификации фрагмента цитохрома b включала этап первоначальной денатурации ДНК: +95°C – 5 мин; 32 цикла синтеза фрагмента: +95°C – 1 мин, +56°C – 50 с, +72°C – 1 мин 15 с; заключительный этап достройки концов: +72°C – 5 мин. В результате амплификации фрагмента гена были получены последовательности длиной в 600 нуклеотидных оснований (н.о.). Полученные ПЦР продукты очищали с помощью набора реактивов “БИОСИЛИКА” (Новосибирск, Россия) и секвенировали по прямому и обратному праймерам на автоматическом анализаторе ABI 3130xl Genetic Analyser (“Applied Biosystems”) в компании “Синтол”. Затем нуклеотидные последовательности выравнивали с помощью алгоритма ClustalW и редактировали вручную. Полученные последовательности были депонированы в базу данных GenBank и их номера приведены в табл. 1.
Таблица 1.
Данные по гаплотипам выборки колонка
| Гаплотип | Номер регистрации в Генбанке | Район отбора проб | Источник |
|---|---|---|---|
| Hap_1 | AP017418 AP017395-AP017396 |
Забайкалье Урал |
Shalabi et al., 2016 |
| MZ269423 MZ269425 MZ269426 MZ269428 MZ269429 MZ269432 MZ269433 MZ269438 MZ269443 MZ269445 MZ269446 MZ269447 MZ269448 MZ269449 MZ269450 MZ269451 |
Якутия Якутия Якутия Якутия Якутия Якутия Якутия Якутия Якутия Алтай Алтай Алтай Алтай Алтай Алтай Алтай |
Наши данные | |
| Hap_2 | AP017419-AP017421 AP017397 |
Япония (Цусима) Япония (Цусима) |
Shalabi et al., 2016 |
| JQ739197 JQ739196 JQ739194 |
п-в Корея п-в Корея п-в Корея |
Koh et al., 2012 | |
| AB564132 | басс. р. Амур | Hosoda et al., 2011 | |
| Hap_3 | AP017417 AP017394 |
Забайкалье Забайкалье |
Shalabi et al., 2016 |
| Hap_4 | JQ739195 | п-в Корея | Koh et al., 2012 |
| Hap_5 | JQ739193 | п-в Корея | Koh et al., 2012 |
| Hap_6 | JQ739191 | п-в Корея | Koh et al., 2012 |
| Hap_7 | JQ739190 | п-в Корея | Koh et al., 2012 |
| Hap_8 | AB564131 | басс. р. Амур | Hosoda et al., 2011 |
| Hap_9 | JQ739192 JQ739189 |
п-в Корея п-в Корея |
Koh et al., 2012 |
| Hap_10 | AB564135 | п-в Корея | Hosoda et al., 2011 |
| Hap_11 | JQ739198 | п-в Корея | Koh et al., 2012 |
| Hap_12 | JQ739188 | п-в Корея | Koh et al., 2012 |
| Hap_13 | AP017413- AP017416 AP017393 |
о. Тайвань п-в Корея |
Shalabi et al., 2016 |
| AB051243 | о. Тайвань | Hosoda et al., 2000 | |
| Hap_14 | AB026108 | Япония (Киото) | Kurose et al., 2000 |
| Hap_15 | MZ269424 MZ269427 MZ269434 MZ269435 MZ269436 MZ269440 MZ269441 MZ269444 |
Якутия Якутия Якутия Якутия Якутия Якутия Якутия Якутия |
Наши данные |
| Hap_16 | MZ269430 MZ269431 |
Якутия Якутия |
Наши данные |
| Hap_17 | MZ269437 | Якутия | Наши данные |
| Hap_18 | MZ269439 MZ269442 |
Якутия Якутия |
Наши данные |
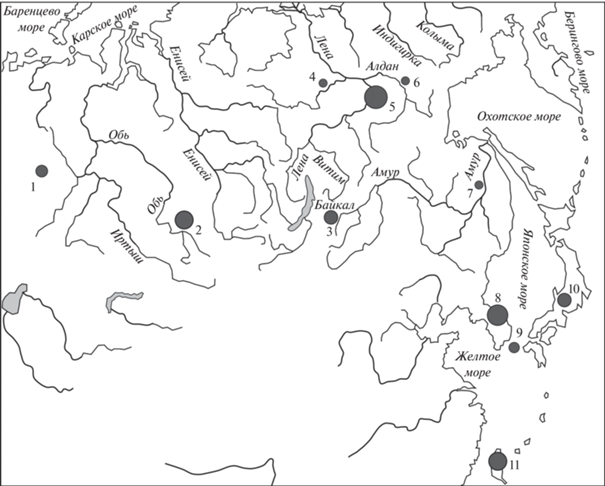
Для выявления полиморфизма нуклеотидных последовательностей использовали следующие параметры: число полиморфных (сегрегирующих) сайтов (S), число гаплотипов (h), разнообразие гаплотипов (Hd), нуклеотидное разнообразие (π), среднее число нуклеотидных различий (k). Все расчеты выполняли в программе DnaSP v. 5.10 (Librado, Rozas, 2009). Кроме собственного материала из бассейнов среднего течения р. Лены (Центральная Якутия) и верхнего течения р. Бия (Республика Алтай) в генетический анализ включены данные по нуклеотидным последовательностям у колонка в других частях ареала из базы данных GenBank NCBI (табл. 1). Географическое распространение использованных в работе гаплотипов колонка показано на рис. 1.
Рис. 1.
Географическое распределение гаплотипов колонка в ареале (1 – Урал; 2 – Басс. верхнего течения реки Обь (Алтай); 3 – Забайкалье; 4 – Басс. нижнего течения реки Вилюй (Якутия); 5 – Басс. средней Лены (Якутия); 6 – Басс. нижнего течения реки Алдан (Якутия); 7 – Басс. реки Амур (Приморье); 8 – П-ов Корея; 9 – Архипелаг Цусима; 10 – Остров Хонсю (Япония); 11 – Остров Тайвань). Величина кружков пропорциональна размеру выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Половые и возрастные различия морфологических признаков колонка в Якутии мало изучены. Величина полового диморфизма колонков в возрасте до 1 года (7–10 мес) по массе тела составляла 62.9%, по длине – 14.1%. У взрослых зверьков межполовые различия выражены резче. По длине тела они достигали 19.3%. По массе взрослые самцы были, в среднем, в 2.2 раза тяжелее взрослых самок (табл. 2). Молодые самки уступали взрослым самкам по массе и длине тела на 4 и 2%. У молодых и взрослых самцов эти показатели отличались на 28 и 6% соответственно, свидетельствуя о большей продолжительности весового и линейного роста у самцов-сеголетков, чем у одновозрастных самок. По длине стопы и хвоста молодые и взрослые зверьки практически не отличались.
Таблица 2.
Морфологические показатели колонка в Якутии
| Возрастная группа |
Показатель | Масса тела, г | Длина тела, мм | Длина стопы, мм | Длина хвоста, мм |
|---|---|---|---|---|---|
| Молодые самки |
M ± m | 245.4 ± 8.7 | 298.7 ± 2.9 | 50.6 ± 0.3 | 153.3 ± 1.9 |
| n | 24 | 27 | 22 | 26 | |
| Молодые самцы |
M ± m | 399.8 ± 24.8 | 340.9 ± 7.0 | 60.7 ± 1.4 | 187.9 ± 13.1 |
| n | 18 | 18 | 11 | 17 | |
| Взрослые самки |
M ± m | 254.6 ± 9.6 | 305.3 ± 2.7 | 48.8 ± 1.1 | 157.6 ± 2.0 |
| n | 9 | 9 | 6 | 9 | |
| Взрослые самцы |
M ± m | 556.0 ± 30.0 | 364.1 ± 4.1 | 62.0 ± 0.7 | 182.3 ± 9.9 |
| n | 21 | 22 | 17 | 18 |
По большинству краниологических показателей молодые и взрослые самцы статистически значимо превосходили одновозрастных самок (p < 0.01). Величина полового диморфизма увеличивалась с возрастом. По кондилобазальной длине у молодых самцов и самок она составляла 11.2%, у взрослых – 16.3%, по скуловой ширине соответственно 14.0 и 20.9%. Возрастные различия по промерам черепа среди самок не отмечены. Размеры черепа взрослых самцов по шести признакам из восьми были больше, чем у молодых самцов (p < 0.01), что, как и приведенные выше данные по массе и длине тела, указывает на их более длительный рост в сравнении с самками (табл. 3).
Таблица 3.
Краниологические показатели колонка в Якутии
| Возрастная группа |
Показатель | Признак*, мм | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| Молодые самки |
M ± m | 54.3 ± 0.2 | 54.4 ± 0.2 | 49.6 ± 0.3 | 25.4 ± 0.2 | 35.2 ± 0.2 | 27.8 ± 0.2 | 11.1 ± 0.5 | 24.0 ± 0.1 |
| n | 27 | 24 | 27 | 27 | 27 | 26 | 27 | 27 | |
| Молодые самцы |
M ± m | 60.4 ± 0.6 | 60.5 ± 0.7 | 54.8 ± 0.6 | 29.8 ± 0.5 | 38.4 ± 0.4 | 31.7 ± 0.4 | 11.8 ± 0.2 | 27.2 ± 0.4 |
| n | 24 | 22 | 24 | 24 | 23 | 25 | 24 | 2 4 | |
| Взрослые самки |
M ± m | 53.9 ± 0.5 | 54.4 ± 0.3 | 49.1 ± 0.5 | 25.1 ± 0.4 | 34.0 ± 0.3 | 28.7 ± 0.6 | 10.9 ± 0.4 | 24.0 ± 0.2 |
| n | 22 | 20 | 22 | 22 | 22 | 22 | 22 | 22 | |
| Взрослые самцы |
M ± m | 62.7 ± 0.3 | 62.8 ± 0.3 | 57.0 ± 0.3 | 32.0 ± 0.4 | 38.5 ± 0.3 | 34.7 ± 0.3 | 12.5 ± 0.1 | 28.3 ± 0.4 |
| n | 29 | 25 | 29 | 28 | 29 | 28 | 28 | 29 | |
Сравнение средних показателей размеров черепа колонка из бассейнов рр. Лены, Амура и Западной Сибири показало, что в обеих половых группах среднеленские зверьки более сходны с западносибирскими, менее – с амурскими. Малочисленная выборка черепов из Забайкалья не использовалась в данном анализе.
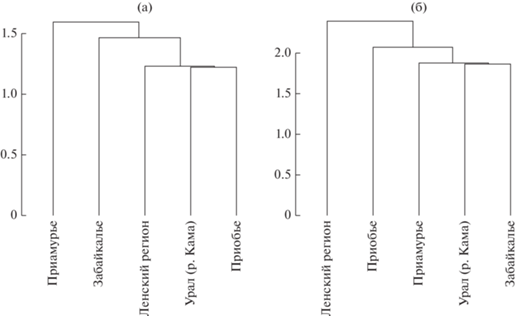
Результаты кластерного анализа краниологических показателей самцов и самок из пяти географических популяций колонка демонстрируют дендрограммы, показанные на рис. 2. Среди самок в основании дендрограммы расположились амурские и забайкальские зверьки, среднеленские, обские (западносибирские) и одна особь из бассейна р. Кама образовали хорошо дифференцированный кластер. Среди самцов основание дендрограммы образуют среднеленские и обские колонки, а отдельный кластер – амурские и забайкальские. Таким образом, межпопуляционное сравнение размеров черепа колонка по средним показателям и их кластерный анализ, дают сходные результаты. В обоих случаях среднеленские колонки обнаруживают большое морфологическое сходство с западносибирскими, а забайкальские с амурскими зверьками.
Рис. 2.
Географическая дифференциация колонка по краниометрическим признакам (а – самки, б – самцы) методом минимальной дисперсии Уорда.
Изменчивость митохондриальной ДНК в разных частях ареала колонка относительно высокая (табл. 4). Якутский (среднеленский) колонок на этом фоне отличается относительно большим гаплотипическим разнообразием и пониженным уровнем нуклеотидного разнообразия. В целом на территории России показатели генетической изменчивости несколько ниже, чем в Корее и Японии.
Таблица 4.
Полиморфизм последовательностей фрагмента ген cyt b мтДНК в разных частях ареала колонка
| № | Район | n | S | h | Hd | π | k |
|---|---|---|---|---|---|---|---|
| 1 | Забайкалье | 3 | 2 | 2 | 0.667 | 0.00287 | 1.333 |
| 2 | Урал (Челябинская, Сверловская области) | 2 | 0 | 1 | – | – | – |
| 3 | Япония (Архипелаг Цусима и о-в Хонсю) | 5 | 8 | 2 | 0.400 | 0.00690 | 3.200 |
| 4 | Приморье (бассейн Амура) | 2 | 3 | 2 | 1.000 | 0.00647 | 3.000 |
| 5 | Полуостров Корея | 13 | 14 | 10 | 0.949 | 0.00658 | 3.051 |
| 6 | Остров Тайвань | 5 | 0 | 1 | – | – | – |
| 7 | Якутия (басс. средней Лены) | 22 | 4 | 5 | 0.714 | 0.00292 | 1.355 |
| 8 | Западная Сибирь (Алтай, р. Бия) | 7 | 0 | 1 | – | – | – |
| 9 | Общая выборка колонка | 59 | 23 | 18 | 0.856 | 0.00712 | 3.303 |
| 10 | Россия | 36 | 8 | 8 | 0.672 | 0.00290 | 1.346 |
| 11 | Корея, Япония | 23 | 16 | 11 | 0.854 | 0.00862 | 4.000 |
На медианной сети гаплотипов колонка выделены три гаплогруппы, характеризующие филогенетические взаимоотношения между географическими популяциями вида (рис. 3).
Рис. 3.
Медианные сети гаплотипов колонков: 1 – О-в Тайвань (белый); 2 – Архипелаг Цусима и о-в Хонсю (серый); 3 – Забайкалье (темно-серый); 4 – П-ов Корея (черный); 5 – Приморье (бассейн Амура) (белый с черным кругом); 6 – Урала (Челябинская, Сверловская области) (серый с черным кругом); 7 – Якутии (Лено-Алданское и Лено-Вилюйское междуречья) (черный с белым кругом); 8 – Алтая (басс. р. Бия) (белый с черным прямоугольником); 9 – Черная окружность обозначает необнаруженные или вымершие гаплотипы. Цифры на связях отражают число замен между гаплотипами. Размер кругов (от 1 до 5) соответствует количеству особей, представляющих данный гаплотип.
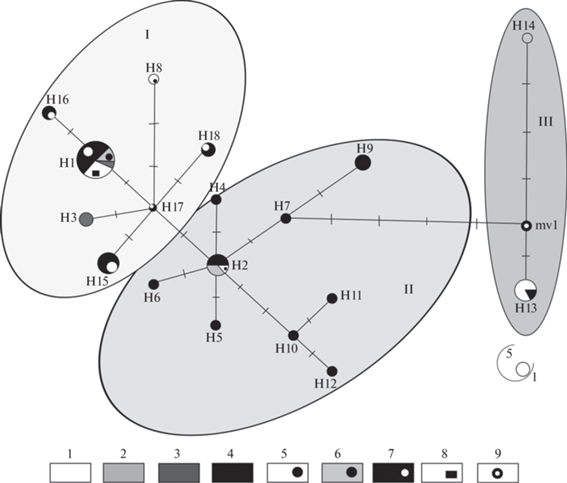
В первую группу (I) вошли в основном гаплотипы колонка Алтая, Урала, Якутии, Забайкалья и одного образца из Приморья. Во вторую гаплогруппу (II) вошли главным образом колонки п-ова Корея, архипелага Цусима, а также одна особь из Приморья. В пределах этой группы обособлены колонки с гаплотипами Н_10, Н_11 и Н_12. Третью четко обособленную группу (III) образовали колонки с о-вов Тайвань и Хонсю. Наиболее удален в ней гаплотип H_14 (о-в Хонсю, Япония), связанный со второй и третьей гаплогруппами посредством 7 мутационных шагов и необнаруженного или вымершего гаплотипа.
Максимальные значения показателя межпопуляционной подразделенности FST получены при попарном сравнении географически наиболее удаленных континентальных популяций с популяцией Японского архипелага (табл. 5). В других вариантах попарного сравнения выборок значения FST были довольно низкими (от 0.131 до 0.670; в среднем, 0.411).
Таблица 5.
Попарные значения FST исследованных выборок колонка
| № | Район отбора проб | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| 1 | Забайкалье и Приморье | 0 | ||||
| 2 | Западная Сибирь (Алтай, р.Бия) | 0.388 | 0 | |||
| 3 | Япония (о-ва Цусима, Хонсю) | 0.421 | 0.670 | 0 | ||
| 4 | Полуостров Корея | 0.334 | 0.587 | 0.257 | 0 | |
| 5 | Якутия (средняя Лена) | 0.131 | 0.351 | 0.557 | 0.410 | 0 |
Тест на нейтральность эволюции Tajima’s в рассматриваемых популяциях дал отрицательные и недостоверные значения, как для отдельных выборок, так и для всей гаплогруппы (табл. 6). Отрицательная и на грани достоверности величина отмечена только для выборки с Японского архипелага. Показатели теста Fu’s Fs также в основном отрицательны и в большинстве случаев статистически незначимы. Отрицательное достоверное значение отмечено для объединенной выборки забайкальских и приморских колонков, а также для всей исследованной выборки. Величина Фу для гаплотипов колонка с Японских островов имеет положительное значение.
Таблица 6.
Тест на нейтральность популяций колонка
| Районы отбора проб | n | Tajima’s D (p) | Fu’s Fs (p) |
|---|---|---|---|
| 1. Забайкалье и Приморье | 5 | –0.561 (0.399) | –5.572 (0.024) |
| 2. Западная Сибирь (Алтай, р.Бия) | 7 | – | – |
| 3. Япония (о-ва Цусима, Хонсю) | 5 | –1.192 (0.095) | 3.679 (0.971) |
| 4. Полуостров Корея | 18 | 0.152 (0.608) | –1.850 (0.169) |
| 5. Якутия (средняя Лена) | 22 | 0.659 (0.781) | –0.211 (0.438) |
| Для всей выборки | 59 | –1.052 (0.146) | –5.572 (0.030) |
| Россия | 36 | –0.881 (–0.881) | –2.381 (0.08) |
| Корея и Япония | 23 | –0.2779 (0.432) | –2.007 (0.169) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Морфология. Колонок характеризуется хорошо выраженным половым диморфизмом массы и размеров тела и черепа. Наибольшие половые различия у взрослых колонков выявлены по массе тела, которые у самцов были вдвое больше, чем у самок. Это согласуется с литературными данными по разнице массы тела у самцов и самок разных видов куницеобразных, включая колонка, варьирующей в пределах от 1.4 у куницы и солонгоя до 3.1 раз у итатси (Терновский, Терновская, 1994). Возрастная динамика массы и величины тела и черепа у молодых самцов колонка занимает более продолжительный период, чем у самок; они позже достигают веса и размеров взрослых животных.
По данным В.А. Тавровского и др. (1971), полученным в середине прошлого столетия, средние показатели массы и длины тела взрослых самцов (353 ± 10.4 г и 332 ± 3.0 мм) и самок (203 ± 7.0 г и 277 ± 4.0 мм) якутского колонка значительно меньше (p < 0.01), чем в нашей выборке (см. табл. 2). Как мы полагаем, это связано с использованием разных методов определения возраста и разным возрастным составом исследованных зверьков, а не с реальным увеличением их размеров. Такие же различия выявляются по кондилобазальной длине, скуловой и мастоидной ширине черепа у самцов (p < 0.01), у самок эти показатели сходны, кроме мастоидной ширины (p < 0.01). Сравнение наших выборок черепов взрослых колонков (1–3+ года) за 1950–1980 гг. и 2000-е гг. не выявило хронологической изменчивости, их размерные характеристики соответствовали таковым M. s. sibirica.
Изменчивость митохондриальной ДНК. По уровням гаплотипического и нуклеотидного разнообразия среднеленская популяция колонка близка к сибирским популяциям вида. Изначально низкая эффективная численность и пониженный биотический потенциал подобных группировок при накоплении генетической изменчивости могут значительно повышаться, обеспечивая популяционный рост (Avise, 2000). В Приморье, Японии и на Корейском п-ове колонок характеризуется генетическими параметрами предковых популяций.
Филогения. Медианная сеть гаплотипов колонка на значительной части Северной Азии четко разделена на гаплогруппы. Континентальные популяции образуют две группы, соответствующие подвидовому разделению на дальневосточную (M. s. manchurica Pall., 1911) и сибирскую формы (M. s. sibirica Pall., 1773) (Аристов, Барышников, 2001). В группу manchurica вошли преимущественно гаплотипы колонка из Приморья и п-ова Корея, в группу sibirica – из бассейнов р. Лены и р. Оби.
Предполагается, что расселение колонка из коренного ареала на юго-востоке Азии и Приморья происходило в постледниковый период и продвинулось до западных пределов в первой половине XIX в. (Кассал, 2013). Это подтверждается отсутствием плейстоценовых находок колонка в северной части современного ареала, а также низкими и в большинстве своем недостоверными значениями Tajima’s D и Fu’s Fs в сибирских популяциях (Ishikawa и др., 2020; наши данные).
На юге Дальнего Востока ископаемые останки колонка известны с позднего плейстоцена (Алексеева, Барышников, 2020). В Средней Сибири, на севере Приангарья они датируются ранним голоценом (8–10.3 тыс. л. н.) (Клементьев, 2014). В бассейн средней Лены он проник, в среднем, голоцене во время климатического оптимума и окончательного формирования современной растительности (6–5 тыс. л. н.) (Боескоров, Барышников, 2013). Однако остаются неизвестными границы распространения и численность колонка в этом регионе. В документах о ясачных сборах в Якутии в XVII в. упоминаются все массовые пушные виды – соболь, лисица, песец, горностай, белка, однако сведения о колонке отсутствуют. Не упоминается мех колонка в описаниях одежды народов Якутии в XVII–XVIII в. (Гаврильева, 2000; Миллер, 2009). Сообщения о заготовках колонка появляются только в начале XIX в., причем сразу о больших их объемах. В 1837–1843 гг. из Якутии ежегодно вывозилось от 1050 до 5000 шкурок этого вида (Некоторые замечания о Якутской ярмарке, 1817; Павлов, 1972; Дьяконов, 1990). Изложенное может объясняться двумя причинами: поздним вовлечением в пушной рынок шкурок колонка вследствие снижения численности и добычи более популярных пушных видов; подъемом численности колонка и повышением эффективности его промысла. Одним из факторов этого роста численности могло быть снижение угнетающего пресса со стороны соболя, истребленного к тому времени на больших территориях. Их обостренные межвидовые отношения и агрессивность соболя по отношению к колонку наблюдались во многих частях ареала (Тимофеев, Надев, 1955; Войлочников, 1977; и др.).
Идентичность морфо-генетических признаков якутского колонка с сибирскими популяциями, а также сравнительно позднее появление в Якутии свидетельствуют о сложной истории освоения им данного региона. Из этих и палеонтологических данных (см. выше) можно предположить, что первоначально расселение колонка из исходного ареала шло в западном направлении – в Среднюю и Западную Сибирь. Заселение колонком холодных районов Якутии было вторичным явлением в этом процессе, возникшим по мере адаптации и формирования новых популяций в Сибири, а затем расширения их ареала на северо-восток.
Финансирование. Исследования выполнены в рамках проектной части государственного задания в сфере научной деятельности Министерства науки и высшего образования РФ по теме FSRG-2020-0019 “Био- и хеморазнообразие экосистем, эволюция и генетические особенности биоиндикаторов Восточной Сибири и разработка технологий освоения возобновляемых растительных ресурсов”, 2020–2022 гг. и “Структура и динамика популяций и сообществ животных холодного региона Северо-Востока России в современных условиях глобального изменения климата и антропогенной трансформации северных экосистем: факторы, механизмы, адаптации, сохранение” (номер гос. регистрации АААА-А17-117020110058-4)
Соблюдение этики работы с животными. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Алексеева Э.В., Барышников Г.Ф. Позднеплейстоценовые и голоценовые остатки хищных млекопитающих (Carnivora) из пещеры Близнец на юге Дальнего Востока России // Тр. Зоологического института РАН. 2020. Т. 324. № 3. С. 388–444.
Аристов А.А., Барышников Г.Ф. Млекопитающие фауны России и сопредельных территорий. Хищные и ластоногие. СПб., 2001. 560 с.
Боескоров Г.Г., Барышников Г.Ф. Позднечетвертичные хищные млекопитающие Якутии. М.: Наука, 2013. 210 с.
Бромлей Г.Ф., Костенко В.А., Николаев И.Г., Охотина М.В., Юдин В.Г., Братенков П.В. Млекопитающие Зейского заповедника. Владивосток: ДВНЦ АН СССР, 1984. 142 с.
Войлочников А.Т. Колонок. Общие сведения. Предбайкалье и Забайкалье. Дальний Восток // Колонок, горностай, выдра. М.: Наука, 1977. С. 5–70.
Гаврильева Р.С. Одежда народа Саха конца XVII–середины XVIII века: опыт этнографической реконструкции // Дисс. на соиск. уч. степ. канд. ист. наук. Якутск, 2000. 221 с.
Гептнер В.Г., Наумов Н.П., Юргенсон П.Б., Слудский А.А., Чиркова А.Ф., Банников А.Г. Млекопитающие Советского Союза. Т. 2. Часть 1. Морские коровы и хищные. М.: Высшая школа, 1967. 1004 с.
Дьяконов А.Л. Пушной промысел в Якутии конца XVIII−середины XIX века. Якутск: ЯНЦ СО АН СССР, 1990. 144 с.
Кассал Б.Ю. Колонок Mustela sibirica в среднем Прииртышье // Рос. Журн. Биол. Инвазий 2013. №3. С. 38–59.
Клевезаль Г.А. Принципы и методы определения возраста млекопитающих. М.: Товарищество научных изданий КМК, 2007. 288 с.
Клементьев А.М. Раннеголоценовая фауна северной Ангары (материалы археологических объектов) // Известия Иркутского Гос. Университета. Сер. Геоархеология. Этнология. Антропология. 2014. Т. 8. С. 31–44.
Миллер Г.Ф. Описание сибирских народов / Изд. А.Х. Элерт, В. Хинтцше / Пер. с нем. А.Х. Элерт. М.: Памятники исторической мысли, 2009. 456 с. (Источники по истории Сибири и Аляски из российских архивов: VIII, 1; Герард Фридрих Миллер. Этнографические труды. Часть 1.
Некоторые замечания о Якутской ярмарке // Казанские известия. 1817. № 103. С. 473–474.
Новиков Г.А. Хищные млекопитающие фауны СССР. М.-Л.: Изд-во АН СССР, 1956. 294 с.
Павлинов И.Я., Россолимо О.Л. Половые различия в развитии, размерах и пропорциях черепа лесной куницы Martes martes L. (MAMMALIA, MUSTELIDAE) // Бюллетень МОИП, отд. Биологии, 1974. Т. 79(6). С. 23–35.
Павлов П.Н. Пушной промысел в Сибири XVII в. Красноярск, 1972. 408 с.
Строганов С.У. Звери Сибири. Хищные. М: Изд-во АН СССР, 1962. 458 с.
Тавровский В.А., Егоров О.В., Кривошеев В.Г. и др. Млекопитающие Якутии. М.: Наука, 1971. 660 с.
Терновский Д.В., Терновская Ю.Г. Экология куницеобразных. Новосибирск: ВО Наука, 1994. 223 с.
Тимофеев В.В., Надеев В.Н. Соболь. М.: Изд-во техн. и экон. лит-ры по вопросам заготовок, 1955. 404 с.
Avise J.C. Phylogeography: The History and Formation of Species. Cambridge, MA: Harvard Univ. Press, 2000.
Ellerman J.R., Morrison-Scott T.C.S. Checlist of Palaearctic and Indian mammals 1758 to 1946. L.: British Museum, 1951. 810 p.
Hosoda T., Sato J.J., Lin L.K. Chen Y.J., Harada M., Suzuki H. 2011. Phylogenetic history of mustelid fauna in Taiwan inferred from mitochondrial genetic loci // Can. J. Zool. Vol. 89: 559–569. 4 https://doi.org/10.1139/Z11-029
Hosoda T., Suzuki H., Harada M., Tsuchiya K., Han S.H., Zhang Y., Kryukov A.P., Lin L.K. Evolutionary trends of the mitochondrial lineage differentiation in species of genera Martes and Mustela // Genes Genet. Syst. 2000. 75(5): 259–267.
Ishikawa K., Abramov A.V., Amaike Y., Nishita Y., Masuda R. Phylogeography of the Siberian weasel (Mustela sibirica), based on a mitochondrial DNA analysis // Biological Journal of the Linnean Society. 2020. V. 129. P. 587–593. https://doi.org/10.1093/biolinnean/blz202
Koh H.S., Jang K.H., Oh J.G., Han E., Jo J.E., Ham J.E., Jeong S.K., Lee J.H., Kim K., Kweon G.H., In S.T. Lack of mitochondrial DNA sequence divergence between two subspecies of the Siberian Weasel from Korea: Mustela sibirica coreanus from the Korean Peninsula and M.s. quelpartis from Jeju Island // Anim. Szst. Evol. Divers. 2012. V. 28. № 2: P. 133–136. https://doi.org/10.5635/ASED.2012.28.2.133
Kurose N., Abramov A.V., Masuda, R. Intrageneric diversity of the cytochrome B gene and phylogeny of eurasian species of the genus mustela (mustelidae, carnivora) // Zool. Sci. 2000. 17 (5): 673–679. https://doi.org/10.2108/zsj.17.673
Shalabi M., Abramov A.V., Kosintsev P.A., Lin L-K, Han S.H., Watanabe S., Yamazaki K., Kaneko Y., Masuda R. Comparative phylogeography of the endemic Japanese weasel (Mustela itatsi) and the continental Siberian weasel (Mustela sibirica), revealed by complete mitochondrial genome sequences // Biol. J. the Linnean Society. 2016. 120: 333–348. https://doi.org/10.1111/bij.12891
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual, 2nd edn. Cold Spring Harbor Laboratory Press, New York, 1989. P. 1–421.
Librado P., Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data // Bioinformatics 2009. V. 25. P. 1451–1452.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


