Известия РАН. Серия биологическая, 2022, № 6, стр. 614-625
Морфологическая изменчивость степной пеструшки (Lаgurus lagurus Pall) на северо-востоке ареала
Т. А. Дупал 1, *, С. А. Абрамов 1, Ю. Н. Литвинов 1
1 Институт систематики и экологии животных СО РАН
630091 Новосибирск, ул. Фрунзе, 11, Россия
* E-mail: gf@eco.nsc.ru
Поступила в редакцию 21.06.2021
После доработки 05.10.2021
Принята к публикации 20.10.2021
- EDN: VJIHKP
- DOI: 10.31857/S1026347022060051
Аннотация
С помощью многомерного статистического анализа исследована изменчивость 12 краниальных и 7 дентальных признаков взрослых особей степной пеструшки из 6 популяций северо-восточной части ареала. Уровень выявленных межпопуляционных различий в размерах и форме черепа значительно превышает уровень половых различий. Изолированные популяции степной пеструшки из Чулымо-Енисейской котловины характеризуются более крупными размерами черепа по сравнению с животными из Западной Сибири и Казахстана, а также относительно меньшей длиной лицевого отдела и носовых костей, относительно более короткими зубными рядами, меньшей высотой затылочной кости. Самой мелкой формой является карасукская популяция. Сравнение географических дистанций между выборками с подвидовой систематикой позволило отнести степных пеструшек из Чулымо-Енисейской котловины к подвиду abacanicus, а всех остальных – к подвиду lagurus.
Известно, что изоляция является важной предпосылкой для видообразования. Поток генов между популяциями может быть подавлен какой – либо физической или географической преградой. Если две популяции географически изолированы, то они дивергируют генетически и, в конечном итоге, могут развиться изолирующие механизмы, приводящие к морфологическим различиям (Майр, 1971, 1974). Понимание того, что межпопуляционная морфологическая изменчивость реализуется через совокупность как внутренних (генетических), так и внешних (экологических) средовых факторов, позволяет вести поиск общих закономерностей географической изменчивости, учитывая, что изоляция является одним из основных условий сохранения отчетливых межпопуляционных различий. Как считал С.С.Шварц (1980, стр.127), “любая в репродуктивном отношении изолированная популяция (полная изоляция не обязательна) морфологически специфична”.
Развитие молекулярно-генетических исследований привело к новому подходу анализа различий между популяциями и таксонами. Однако таксономическая и филогенетическая трактовка генетических результатов может не соответствовать морфологическим данным (Ковалева и др., 2012), которые приводятся в систематических сводках. Тем более, что межпопуляционные особенности отдельных видов млекопитающих морфологически изучены очень слабо и встает вопрос о надежности выделения внутривидовых форм. Использование морфометрических признаков с применением многомерного статистического анализа в межпопуляционных сравнениях становится в настоящее время хорошим инструментом для понимания разных форм изменчивости.
Широко распространенные грызуны, обитающие в различных ландшафтах и с разной степенью изоляции популяций, могут служить модельным объектом для изучения различных форм внутривидовой изменчивости. Одним из таких видов является степная пеструшка Lagurus lagurus Pall. (1773), заселяющая равнинные, горные степи и полупустыни. Ареал вида включает низовье Днепра, Южный Урал, Северный Казахстан, Зайсан, восточное Прибалхашье, Алтайские и Кулундинские степи, распространен в Рязанской, Саратовской областях и в Чувашии. Южная часть ареала – это горы и предгорья Северного Тянь-Шаня и Джунгария, север Китая. Изолированные участки ареала встречаются в Убсу-Нурской и в Минусинской котловинах (Огнев 1950; Громов. Ербаева, 1995; Shenbrot, Krasnov, 2005).
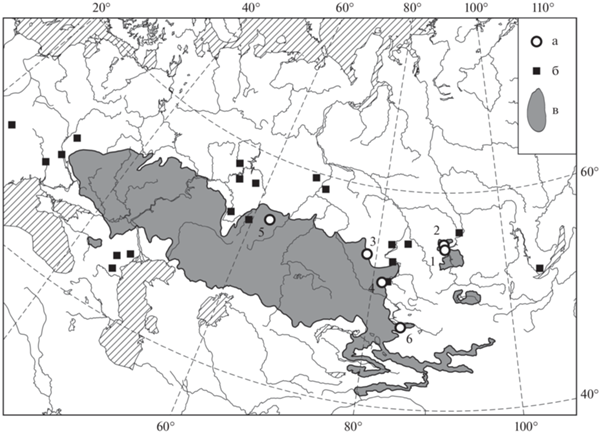
Из палеонтологической летописи известно, что на территории Восточной Европы и Северной Азии степная пеструшка встречается со среднего плейстоцена. На территории Западной Сибири Lagurus cf. lagurus обнаружена в нижнеиртышской фауне совместно с тундровыми, степными и лесными видами (Косинцев и др., 2004). Ископаемая фауна Чембакчинской свиты, в которой присутствует степная пеструшка, соответствует тобольскому горизонту, TL-даты включают интервал 390 ± 80–290 ± 58 тыс.лет назад (Волкова и др., 2002), что соответствует 11–12 изотопным стадиям среднего плейстоцена (Shakleton, Opdyke, 1977). Во второй половине позднего плейстоцена животные заселяли перигляциальные ландшафты со своеобразным (в широком смысле) типом климатического режима и растительного покрова. Характерной особенностью этого периода были суровый климат, малое количество осадков (особенно зимних), сильно разреженная лесистость, холодолюбивая и ксерофитная флора, широкое развитие мерзлотных процессов и относительно твердое состояние почвы летом. Потепление в голоцене сопровождалось увеличением влажности и расширением лесной растительности. Произошло сокращение ареала L. lagurus (рис. 1), которое привело, по-видимому, к определенным морфологическим изменениям (Поздняков, Сенотрусова, 2006). Западная часть ареала сместилась в восточном направлении, а восточная в западном. В конце голоцена степная пеструшка исчезла в Западной Европе, в Западной Украине, с территории Русской равнины, Среднего Урала, Среднего Енисея, Кузнецкой котловины, Северо-Западного Алтая и Предбайкалья. Сократилась юго-восточная часть ареала. Непрерывная часть современного ареала проходит по степной зоне и полупустыне Евразии. Кроме того, остались два небольших изолированных участка в Хакасии и Монголии.
Рис. 1.
Карта-схема мест отлова (а), находок ископаемых остатков (б), современный ареал (по Shenbrot, Krasnov B.R., 2005, (в) степной пеструшки. Номера выборок в табл. 2.
Целью работы является изучение межпопуляционной изменчивости краниальных и одонтологических признаков степной пеструшки при отсутствии и наличии изоляционных барьеров, и сопоставление найденных морфологических различий с существующими представлениями о внутривидовой таксономии этого вида.
МАТЕРИАЛЫ И МЕТОДЫ
Материал собирали в подзоне лугостепей степной зоны юга Западной Сибири, в 15 км южнее г. Карасук (Новосибирская обл.) в 2003–2015 гг. Отлавливали животных ловчими канавками с конусами, а иногда давилками и живоловками. Собранный материал составил 156 зверьков. Наряду с полевым материалом исследованы музейные коллекции черепов из Зоологических музеев Института систематики и экологии животных СО РАН (Новосибирск) и Зоологического института РАН (Санкт-Петербург).
Для выявления половых и возрастных отличий по экстерьерным признакам у животных из Карасука анализировали длину тела, хвоста и ступни, массу тела и состояние половой системы. Самцы и самки карасукской популяции были разбиты на три возрастные группы: молодые, взрослые и перезимовавшие (Тупикова, Каледа, 1957; Шварц, 1980). Сеголетки массой тела 16–19 г. длиной тела 85–94 мм, половозрелые самцы с массой семенника больше 100 мг, беременные и с плацентарными пятнами самки отнесены к группе взрослых животных (ad1). Размножающиеся зверьки, отловленные в начале лета, массой тела более 20 г, длиной тела больше 100 мм, с хорошо развитыми гребнями черепа, включены в группу перезимовавших (ad2). Причем, перезимовавшие самки в отловах очень редки, так как основное время в начале лета проводили в гнездах с новорожденными. Неполовозрелые сеголетки массой тела 10–15 г. отнесены к группе молодых (subad). В летний период в отловах преобладают половозрелые и неполовозрелые сеголетки, а доля перезимовавших животных очень мала. При оценке различий между взрослыми самцами и самками карасукской популяции показано, что по длине и массе тела достоверных различий нет. Длина хвоста больше у самок (p < 0.01), а ступня достоверно больше у самцов (p < 0.001), что видимо, связано с половыми особенностями роста пеструшек (табл. 1). Для анализа морфологической изменчивости черепа и первого нижнекоренного зуба (m1) были сформированы выборки из взрослых самцов и самок, которые представлены в табл. 2.
Таблица 1.
Половые различия экстерьерных признаков половозрелых сеголетков степной пеструшки карасукской популяции
| Признак | Самцы, ad1, n = 39 | t | Самки, ad1, n = 30 | ||
|---|---|---|---|---|---|
| M ± m | CV | M ± m | CV | ||
| Длина тела, мм | 90.34 ± 0.91 | 6.3 | 0.61 | 91.40 ± 1.48 | 7.6 |
| » хвоста | 11.68 ± 0.27 | 14.6 | 2.67** | 12,08 ± 0.28 | 10.8 |
| » ступни | 13.65 ± 0.17 | 7.9 | 3.92*** | 12.65 ± 0.19 | 7.2 |
| Масса тела, г. | 18.54 ± 0.54 | 18.1 | 0.35 | 18.89 ± 0.82 | 20.4 |
Таблица 2.
Географические координаты мест отлова и объем выборок взрослых самцов и самок степной пеструшки
| Локалитет | Географич. координаты | Кол-во самцов |
Кол-во самок |
Всего | Источник |
|---|---|---|---|---|---|
| Хакасия, Ширинский р-он, с. Соленоозерное (1) | 54.725°с.ш. 89.918° в.д. |
21 | 19 | 40 | ИСиЭЖ СО РАН |
| Красноярский край, Ужурский р-он, оз. Учум (2) |
55.125° с.ш. 89.706° в.д. |
12 | ИСиЭЖ СО РАН |
||
| Новосибирская обл., Карасукский р-он, с. Троицкое (3) |
53.729° с.ш. 77.865° в.д. |
24 | 24 | 48 | Данные авторов |
| Алтайский край, Локтевский, Змеиногорский р-оны (4) | 51.158° с.ш. 82.083° в.д. |
2 | 14 | ЗИН РАН |
|
| Северный Казахстан, Кустанайская обл. (5) | 53.487° с.ш. 64.207° в.д. |
5 | 4 | 9 | ЗИН РАН |
| Казахстан, Восточно-Казахстанская обл., Зайсанский р-он (6) |
47.313° с.ш. 84.796° в.д. |
7 | 8 | 15 | ЗИН РАН |
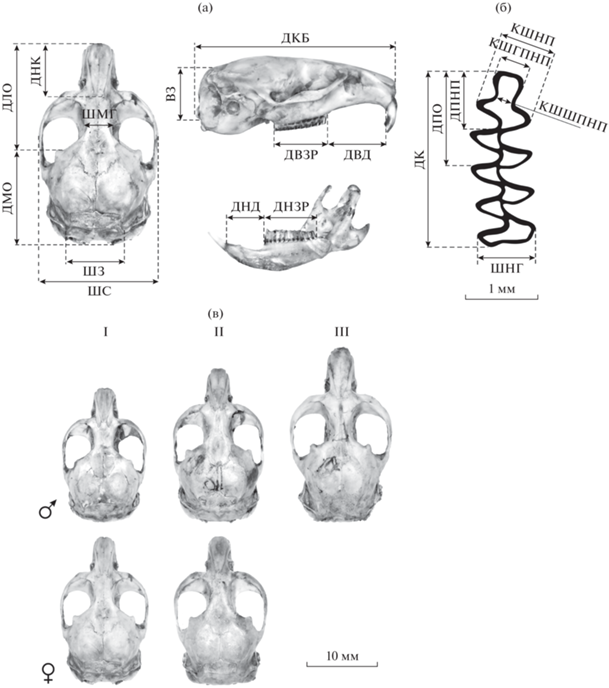
Краниальную изменчивость степной пеструшки изучали по 12 признакам: (1.ДКБ) кондилобазальная длина черепа – от наиболее выдающейся вперед части межчелюстной кости до мыщелков; (2.ШС) скуловая ширина – наибольшее расстояние между наружными краями скуловых дуг; (3.ДНК) – длина носовых костей; (4. ШМГ) межглазничная ширина – наиболее узкое расстояние между глазницами; (5. ДЛЧ) длина лицевой части – расстояние от выдающейся вперед челюстной кости до мозговой коробки в области сочленения лобной и чешуйчатой костей; (6. ДМЧ) длина мозгового части – расстояние от передней части мозговой коробки до задней стороны затылочных мыщелков; (7. ШЗ) затылочная ширина – наибольшая ширина в области затылка (8. ВЗ) затылочная высота черепа – расстояние от клиновидной кости до верхней точки ламбдоидного гребня затылочной кости; (9. ДВД) длина верхней диастемы – от переднего края альвеол первых коренных зубов до заднего края ближайшей альвеолы резца по правой стороне; (10. ДВЗР) длина верхнего зубного ряда – от переднего края первого правого моляра до заднего края третьего моляра; (11. ДНД) длина нижней диастемы – от переднего края альвеол первого моляра (m1) до альвеол резца по правой стороне; (12. ДНЗР) длина нижнего зубного ряда – от переднего края (m1) до заднего края третьего моляра по правой стороне. Признаки правого m1: (13. ДК) – длина коронарного первого нижнекоренного зуба; (14. ДПО) – длина параконидного отдела; (15. ДПНП) – длина передней непарной петли; (16.ШНГ) – ширина наибольшая гипоконида; (17. КШПНП) – косая ширина ПНП; (18. КШГПНП) – косая ширина головки ПНП; (19. КШШГПНП) – косая ширина шейки головки ПНП. Схема промеров черепа и m1 приведены на рис. 2.
Рис. 2.
Схема промеров черепа (а), жевательной поверхности m1 (б), морфологические особенности черепа самцов и самок разных возрастных групп степной пеструшки (в): I – subad, II – ad1, III – ad2.
Измерения черепа сделаны с помощью штангенциркуля с точностью до 0.01 мм, промеры первого нижнего коренного зуба измерены в мм по жевательной поверхности на микроскопе МВС10 с помощью окулярмикрометра.
Для статистического анализа изменчивости краниальных и дентальных метрических признаков применяли подход, предложенный Мосиманном (Mosimann, 1970), позволяющий анализировать форму после устранения влияния размеров. В качестве единственной переменной, характеризующей общий размер черепа, было использовано среднее геометрическое всех измерений особи, вычисляемое как корень n-й степени от произведения n измерений (Mosimann, 1970; Jungers et al., 1995). В качестве переменных, характеризующих форму черепа, использованы отношения исходных линейных промеров к общему размеру (среднему геометрическому). Полученные таким образом переменные содержат информацию о форме после устранения эффекта изометрического роста (Jungers et al., 1995; Lague, Jungers, 1996). Натуральные логарифмы отношений исходных признаков и геометрического среднего использовали в качестве исходных данных для последующего анализа. Полученные переменные формы являются избыточными с точки зрения информации, так как одна степень свободы теряется из-за масштабирования (Claude, 2013), и поэтому для описания вариации формы необходимы только 18 переменных. Для уменьшения размерности был выполнен анализ главных компонент всех 19 переменных формы, и только первые 18 главных компонент были использованы для последующего многомерного анализа.
Различия между географическими выборками исследовали с применением одномерного и многомерного дисперсионного анализов (ANOVA\ MANOVA). Перед проведеиием одномерного дисперсионного анализа данные проверяли на соответствие нормальному распределению с помощью критерия Шапиро–Уилка (Shapiro, Wilk, 1965) и на равенство дисперсий, используя тест Левена (Levene, 1960). Перед проведением многомерного дисперсионного анализа данные проверяли на мултинормальность в тесте Дорника –Хансена (Doornik, Hansen, 2008) и эквивалентность ковариационных матриц, используя M-критерий Бокса (Box, 1949). Также после проведения дисперсионного анализа остатки графически проверяли на нормальность распределения. Во всех случаях распределение остатков соответствовало нормальному. Для оценки величины эффекта вычисляли частичный эта-квадрат (част.η2), отражающий долю изменчивости зависимых переменных, которая объясняется эффектом.
Известно, что пол животных может быть существенным фактором изменчивости (Schulte –Hostedde, 2008), поэтому предварительно с помощью двухфакторного дисперсионного анализа был проведен анализ значимости половых различий при анализе географической изменчивости. Географическое происхождение (site) и пол (sex) животного рассматривали как факторы. При анализе общего размера использована смешанная модель, при этом фактор пола рассматривали как фиксированный, поскольку количество его уровней a priori задано объективным критерием “самец–самка”. Для каждого фактора были определены пропорциональные вклады суммы квадратов (%SS) в общей изменчивости (Leamy, 1983; Bronner et al., 2007). Так как не для всех особей пол известен, анализ выполнен для двух наиболее репрезентативных географических выборок животных с известным полом: ширинской и карасукской.
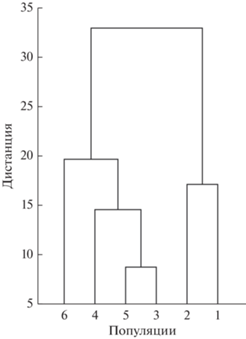
Для анализа и визуализации межгрупповых различий формы черепа проводили + канонический дискриминантный анализ (Klecka, 1980). На основе дистанций Махаланобиса, вычисленных в дискриминантном анализе, построена дендрограмма методом невзвешенного попарного среднего арифметического (UPGMA).
Все вычисления и построения графиков выполнены в программах PAST v. 4.03 (Hammer et al., 2001) и Statistica 8 (StatSoft Inc.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ значимости факторов изменчивости. Согласно тесту Шапиро–Вилка (0.91 < W < 0.98, p > 0.05), распределение всех выборок не отличается от нормального, а тест Левена (F3.72 = 2.4, p = = 0.08) свидетельствует об однородности дисперсии. Двухфакторный дисперсионный анализ общего размера (R2 = 0.77, F3.72 = 80.5, p < 0.001) животных с известным полом показал, что различия по географическому фактору (site) высоко значимы (F1.72 = 857.26, p < 0.0010.05, част.η2 = 0.998), в то время, как фактор пола (sex) (F1.72 = 8.39, p > 0.1, част.η2 = 0.893, p > 0.05) и взаимодействие факторов (site × sex) (F1.72= 0.28, p > 0.5, част.η2 = 0.004, p > 0.05) не значимы.
Многомерный дисперсионный анализ переменных формы по 2-м факторам: пола (sex) и географическому (site), выявил высокую значимость обоих факторов при отсутствии значимого взаимодействия между ними (табл. 3). Доля изменчивости, связанная с полом, невелика и значительно меньше доли межпопуляционной изменчивости.
Таблица 3.
Оценка значимости полового диморфизма при анализе межпопуляционных различий карасукской и ширинской популяций по переменным формы. Значимые факторы отмечены жирным шрифтом
| Источник изменчивости | %SS | Wilks’s λ | F | Df | p | Част. η2 |
|---|---|---|---|---|---|---|
| Site | 28.2 | 0.092 | 30.26 | 18, 55 | <0.0001 | 0.908 |
| Sex | 3.8 | 0.485 | 3.25 | 18, 55 | 0.004 | 0.515 |
| site*sex | 1.1 | 0.691 | 1.37 | 18, 55 | 0.186 | 0.309 |
Таким образом, при анализе комплекса краниальных и одонтологических признаков половой диморфизм либо не значим (общий размер), либо его доля сравнительно мала (переменные формы). Это позволяет при рассмотрении географической изменчивостью пренебречь изменчивостью, связанной с полом животных. Поэтому дальнейший анализ географических различий выполнен на основе однофакторной модели для объединенной выборки самцов, самок и животных, пол которых не известен.
Анализ географической изменчивости общего размера. При сравнении шести географических выборок пеструшек по общему размеру выявлены высоко значимые различия между ними (R2 = 0.57, F5.126 = 33.4, p < 0.001). Попарное сравнение выборок (рис. 3, табл. 4) показало, что наибольшими общими размерами характеризуются особи ширинской и учумской популяций, а наименьшим – особи из окрестностей Карасука. Выборки из Казахстана и Алтая занимают промежуточное положение.
Рис. 3.
Средние значения общего размера и 95% доверительный интервал выборок: 1 – ширинская, 2 – учумская, 3 – карасукская, 4 – алтайская, 5 – кустанайская, 6 – зайсанская.
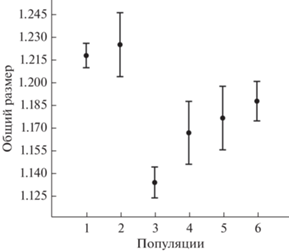
Таблица 4.
Значимость различий по общему размеру при попарном сравнении географических выборок в тесте Тьюки. Под диагональю приведены значения Q-критерия, над диагональю – уровень значимости p. Жирным шрифтом отмечены высоко значимые различия (p < 0.05)
| Выборка | (1) | (2) | (3) | (4) | (5) | (6) |
|---|---|---|---|---|---|---|
| Ширинская (1) | 0.986 | 0.000 | 0.000 | 0.004 | 0.314 | |
| Учумская (2) | 0.925 | 0.000 | 0.000 | 0.007 | 0.229 | |
| Карасукская (3) | 16.630 | 11.970 | 0.018 | 0.002 | 0.004 | |
| Алтайская (4) | 6.959 | 6.267 | 4.606 | 0.975 | 0.794 | |
| Кустанайская (5) | 5.301 | 5.020 | 5.624 | 1.058 | 0.986 | |
| Зайсанская (6) | 2.915 | 3.162 | 5.275 | 1.813 | 0.937 |
Анализ географической изменчивости по переменным формы. Все выборки (за исключением выборки с Зайсана, состоящей из 6 экз.) соответствуют мультинормальному распределению (тест Дорника–Хансена: Ep = 49.79, p > 0.05). Тест Бокса показал равенство ковариационных матриц исследуемых выборок (Тест Бокса: M = 7931.8, Monte Carlo p = 0.185), что позволяет использование для дальнейшего анализа параметрического дисперсионного и дискриминантного анализов.
По результатам дисперсионного анализа различия между выборками по переменным формы высоко значимы (MANOVA: Wilks’s λ = 0.015, F90.533 = 8.266, p < 0.001, част.η2 = 0.582). При проведении канонического дискриминантного анализа (рис. 4) наиболее значимыми являются первые три дискриминантные функции, на которые приходится в совокупности 92.1% межгрупповой дисперии. Все дистанции между выборками высоко значимы при p < 0.01. Проверке качества классификации с использованием процедуры “складного ножа” показала, что 81.2% особей были правильно отнесены к своей выборке на основании дискриминантных функций (табл. 5). Наименьшее количество ошибок сделано при классификации ширинской и учумской выборок. К “своей” выборке отнесены 97.5 и 83.3% особей этих выборок соответственно, в то время, как качество классификации остальных выборок составляет 58.3–78.5%, что свидетельствует о большей морфологической обособленности данной географической формы.
Рис. 4.
Расположение географических выборок степной пеструшки в плоскости 1-2 (а) и 1-3 (б) дискриминантных функций: 1 – ширинская, 2 – учумская, 3 – карасукская, 4 – алтайская, 5 – кустанайская, 6 – зайсанская.
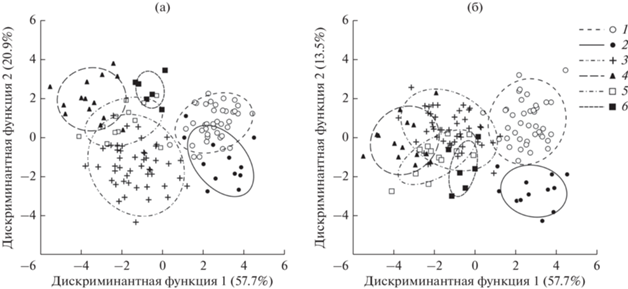
Таблица 5.
Результат классификации особей степной пеструшки в дискриминантном анализе на основе переменных формы с использованием процедуры “складного ножа”. По диагонали показано число корректно определенных особей. Недиагональные элементы указывают количество особей, ошибочно отнесенных к другой выборке. Процент корректно классифицированных особей указан в последнем столбце
| Выборка | (1) | (2) | (3) | (4) | (5) | (6) | % |
|---|---|---|---|---|---|---|---|
| Ширинская (1) | 39 | 0 | 1 | 0 | 0 | 0 | 97.5 |
| Учумская (2) | 1 | 10 | 0 | 0 | 0 | 1 | 83.3 |
| Карасукская (3) | 1 | 2 | 37 | 3 | 5 | 0 | 77.1 |
| Алтайская (4) | 0 | 0 | 1 | 11 | 2 | 0 | 78.6 |
| Кустанайская (5) | 0 | 0 | 2 | 0 | 7 | 3 | 58.3 |
| Зайсанская (6) | 0 | 0 | 0 | 0 | 2 | 4 | 66.7 |
Согласно расположению выборок в пространстве дискриминантных функций, учумская и ширинская обособлены от всех остальных выборок вдоль первой оси (рис. 4а). На основании коэффициентов корреляции первой дискриминантной функции с исходными признаками (табл. 6) особи ширинской и учумской выборок характеризуются по сравнению с остальными выборками относительно меньшей длиной лицевого отдела и носовых костей, относительно более короткими верхним и нижним зубными рядами, относительно меньшей высотой затылочной кости. Среди одонтологических признаков наибольшую связь с первой дискриминантной функцией имеют коронарная длина, косая ширина головки и шейки передней непарной петли m1 (табл. 6). Причем особи ширинской и учумской популяций отличаются относительно большей коронарной длиной и относительно меньшей шириной головки и шейки передней непарной петли.
Таблица 6.
Коэффициенты корреляции между исходными признаками и дискриминантыми функциями (ДФ)
| Признак | ДФ 1 | ДФ 2 | ДФ 3 |
|---|---|---|---|
| 1. ДКБ | –0.55 | –0.07 | –0.06 |
| 2. ШС | –0.48 | –0.06 | 0.18 |
| 3. ДНК | –0.60 | 0.15 | –0.35 |
| 4. ШМГ | 0.14 | –0.27 | 0.21 |
| 5. ДЛО | –0.79 | 0.09 | 0.08 |
| 6. ДМО | –0.22 | 0.12 | 0.23 |
| 7. ШЗ | 0.01 | 0.21 | 0.40 |
| 8. ВЗ | –0.63 | 0.43 | 0.07 |
| 9. ДВД | –0.14 | 0.56 | –0.09 |
| 10. ДВЗР | –0.77 | –0.29 | 0.06 |
| 11. ДНД | 0.56 | 0.24 | –0.24 |
| 12. ДНЗР | –0.79 | 0.18 | 0.18 |
| 13. ДК m1 | –0.63 | –0.37 | 0.28 |
| 14. ДПО | –0.05 | –0.15 | 0.24 |
| 15. ДПНП | 0.04 | 0.09 | –0.03 |
| 16. ШНГ | –0.30 | –0.14 | 0.01 |
| 17. КСПНП | 0.14 | –0.36 | 0.07 |
| 18. КШГПНП | 0.48 | –0.03 | –0.69 |
| 19. КШШПНП | 0.49 | –0.05 | 0.31 |
Вдоль второй оси наибольшие различия проявляются между карасукской и алтайской популяциями. Выборки из Казахстана занимают между ними промежуточное положение, при этом группа особей из окрестностей оз. Зайсан хорошо обособлена в плоскости 1 и 2 осей от большинства выборок, перекрываясь только со второй выборкой из Казахстана. Согласно коэффициентам корреляции признаков со второй дискриминантной функцией (табл. 6) особи карасукской выборки характеризуются по сравнению с алтайской и казахскими выборками относительно меньшей длиной верхней диастемы и относительно большей высотой затылочной кости, относительно большими коронарной длиной и косой шириной передней непарной петли.
По третьей оси выявляются значительные различия между учумской и ширинской выборками, в то время как все остальные выборки перекрываются (рис. 4б). Согласно коэффициентам корреляции признаков с третьей дискриминантной функцией (табл. 6) особи ширинской популяции отличаются от особей учумской популяции главным образом относительно большей шириной головки передней непарной петли m1.
Кластерный анализ позволяет суммировать информацию по всем дискриминантным функциям и дать визуальную оценку сходства/различия между географическими выборками на основе дистанций Махаланобиса, вычисленной при проведении дискриминантного анализа. Как видно на рис. 5 все выборки разделились на два кластера. Один кластер объединяет учумскую и ширинскую популяции. Второй кластер включает выборки карасукской, алтайской, зайсанской и кустанайской популяций степной пеструшки. При этом наиболее сходными оказались карасукская и кустанайская выборки, животные которых обитают в северо-восточной части основного ареала (рис. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный анализ географической изменчивости краниальных и дентальных признаков степной пеструшки показал, что значимые различия проявляются в размерах и форме черепа. Что касается признаков первого нижнекоренного зуба, то они вносят меньший вклад в межпопуляционную изменчивость. Карасукская популяция характеризуется меньшими размерами относительно других, а наиболее крупные размеры показывают учумская и ширинская популяции (рис. 3). Наиболее существенными признаками в дискриминацию выборок по форме черепа вносят длина лицевого отдела, носовых костей, нижнего и верхнего зубного ряда, высота затылочной кости. Среди одонтологических признаков наиболее значимы такие признаки как коронарная длина, косая ширина головки и шейки передней непарной петли m1 (табл. 5). В основном по этим признакам ширинская и учумская популяции отличаются от четырех других популяций.
Как известно для вида описано четыре подвида: lagurus (уральский), abacanicus (минусинский), aggressus (темный), altorum (светлый) (Огнев, 1950; Громов, Ербаева, 1995). Минусинский подвид abacanicus является самым восточным, распространен в Хакасии и в окрестностях Минусинска, между Абаканским хребтом с запада и р.Енисей, Саянами с востока. Распространение подвида ограничено кольцом горной тайги, в которую зверьки не проникают и таким образом его популяции изолированы от основного видового ареала. Наиболее широко распространен подвид lagurus, ареал которого включает Украину, юг европейской части России, Южный Урал, Казахстан, Алтайские и Кулундинские степи. Подвид aggressus распространен в Рязанской, в северной части Саратовской и Оренбурской областей, в северной части Кустанайской области (Громов, Ербаева, 1995). Граница между подвидами lagurus и aggressus не выявлена и очень часто пеструшек трудно отнести к той или иной форме (Огнев, 1950; Громов, Поляков, 1977). Самый южный подвид altorum обитает в горах и предгорьях Центральной Азии (Убсу-Нурская котловина), Китай.
Отличия между подвидами описаны, в основном, по окраске меха, а размеры тела, хвоста и ступни чаще всего перекрываются (Огнев, 1950). Как известно, изменчивость окраски меха у зверьков разных местообитаний, в разные сезоны года, различного возраста может превышать подвидовую, то встает вопрос о таксономической надежности этого признака. По другим признакам, таким как размеры, форма черепа и моляров, отличия между подвидами не изучены (Абрамсон, Лисовский, 2012). У вида диплоидный набор хромосом равен 54, коренные зубы без корней и без цемента (Громов, Ербаева, 1995).
Судя по географическому положению выборок, они относятся к трем подвидам. В систематической сводке Огнева (1950) приводится следующая характеристика. Подвид abacanicus: длина тела 95–120 мм, хвоста 11–14 мм, задней ступни 13–15 мм. Летний мех на спине светлый сероватый с палевой примесью, черная полоса на спине отчетлива, брюшко серое с желтизной и рыжиной. Хвост короткий белесо-желтоватый с длинной кистью волос. Приводятся данные о значении краниологических признаков, но по каким признакам черепа он отличается от всех остальных непонятно (Огнев, 1950). Уральский подвид lagurus (номинативный): длина тела 91–115 мм, длина хвоста 9–13.1 мм, длина задней ступни 12–14.3 мм. Летний спинной мех бледный, палево-серый, часто с примесью легкой рыжины, полоска на спине узкая темно-серого или серо-бурого тона. Брюшная область серовато-белесая с желтизной. Хвост одноцветный белесый с оттенком желтизны, короткий с кисточкой. Подвид aggressus – самый темный подвид, цвет спинного меха серее, брюхо белесое, с легкой примесью серого оттенка и с желтоватым налетом. Хвост одноцветный, белесо-желтоватый с относительно длиной кисточкой на конце. Размеры тела не отличаются от уральского подвида. По приведенным выше описаниям подвидов трудно выделить четкие критерии различий между ними, а признаки черепа, по которым они отличались бы, не приводятся.
Если выявленную нами географическую изменчивость шести популяций степной пеструшки по признакам черепа и зуба сопоставить с подвидовой систематикой, то можно сделать следующие заключение. Ширинская и учумская популяции, животные которых обитают в Чулымо-Енисейской котловине и отличаются от всех остальных, соответствуют подвиду abacanicus. Все остальные популяции относятся к подвиду lagurus. По размерам черепа подвид abacanicus значимо крупнее других форм, и пропорции черепа отличаются от номинативного подвида. Пеструшки подвида abacanicus характеризуются относительно меньшей длиной лицевого отдела, носовых костей, нижнего и верхнего зубного ряда, а также меньшей затылочной высотой.
Известно, что количественные признаки черепа и нижней челюсти характеризуются высокой наследуемостью (Atchley et al., 1981; Sparks, Jantz, 2002; Efimov et al., 2005). При этом характеристики формы как правило связаны с несколькими локусами количественных признаков (Birdsall et al., 2000; Zimmerman et al., 2000; Klingenberg et al., 2001; Chase et al., 2002; Workman et al., 2002). Таким образом, различия формы, обнаруженные в этом исследовании, позволяют предположить, что пеструшки из разных популяций генетически отличаются друг от друга по соответствующим локусам признаков. Сочетание уменьшенного потока генов между участками ареала, связанного с увеличением расстояния между ними, и дрейфа во время колебаний численности часто служит приемлемым объяснением морфологических различий. Выявленный нами уровень морфологической дифференциации между популяциями степной пеструшки, тем не менее, не всегда согласуется с моделью изоляции расстоянием (Wriht, 1943). Так, наиболее сходными по форме оказались значительно удаленные друг от друга популяции, карасукская и кустонайская, в то время, как географически более близкие к карасукской, учумская и ширинская популяции, значительно отличаются как по размерам, так и по форме черепа. Скорее всего, морфологические особенности минусинского подвида связаны с полной изоляцией от основного ареала. О высокой степени дивергенции говорит тот факт, что подвид abacanicus по сравнению с другими подвидами обладает более низким уровнем обмена веществ, более высокой химической терморегуляцией, меньшей амплитудой изменчивости температуры тела и потребления кислорода (Гладкина, Мейер, 1963; Гладкина, 1972). Вероятно, эти сохранившиеся до настоящего времени эколого-физиологические особенности были характерны для животных холодных перигляциальных степей. По палеонтологическим данным известно, что в позднем плейстоцене степная пеструшка была многочисленной на территории Евразии (рис. 1). Изучение ископаемых остатков степной пеструшки показало, что коронарная длина m1 увеличивалась от среднего до первой половины позднего плейстоцена, а в дальнейшем уменьшалась до современных форм. Причем эти изменения связывают с адаптацией к палеоклиматическим условиям (Струкова, 2002).
Карасукская, алтайская, кустанайская и зайсанская популяции, среди которых самой мелкой формой является карасукская, относятся к уральскому подвиду lagurus. Пеструшки карасукской популяции обитают на северо-восточной границе основного ареала, где распространены мозаично и численность их невелика (Дупал, 2008, 2014). Возможно, морфологические особенности карасукской популяции объясняются краевым эффектом, который встречается у географически разобщенных популяций грызунов (Васильев и др., 2004).
* * *
Применение многомерного статистического анализа при исследовании морфометрических признаков степной пеструшки показало, что доля изменчивости связанной с полом невелика и значительно меньше доли межпопуляционной изменчивости, что позволило не учитывать половые различия при анализе географических различий.
Как известно, изоляция влияет на дифференциацию популяций и может приводить к разнообразным морфологическим ответам на действие отбора. Показано, что изолированные популяции степной пеструшки из Чулымо-Енисейской впадины характеризуются крупными размерами черепа и особенностями формы, и отличаются от животных из Западной Сибири и Казахстана. Возможно, эти популяции сохранились на данной территории с конца плейстоцена. В это время в северной части Азии были распространены перигляциальные холодные степи. Адаптация животных к низким температурам проявилась в увеличении размеров, изменении фенотипа. Степные пеструшки с этой территории относятся к подвиду abacanicus. Причем ареал этого подвида значительно сократился за последние 10 тыс. лет. Среди популяций уральского подвида наиболее мелкой формой является карасукская популяция. Возможно, уменьшение размеров к периферии ареала в большей степени связано с факторами среды, где большое значение имеет мозаичность местообитаний и невысокая численность L. lagurus в Кулундинской степи.
Финансирование. Исследование выполнено в рамках Программы фундаментальных научных исследований (ФНИ) государственной академии наук на 2021–2025 гг. (проект 122011800263-6).
Соблюдение этики в работе с животными. Исследование проведено в соответствии с Хельсинкской декларацией, с соблюдением руководящих требований приказа Министерства высшего и среднего образования Российской Федерации (№ 742 от 13 ноября 1984 г.) и Федерального закона Российской Федерации (от 19.12.2018 № 498-ФЗ). Полевые процедуры и протоколы были одобрены Институциональными комитетами по уходу и использованию животных Института систематики и экологии животных (протокол 2020-02, 2021-01). В исследовании не участвовали исчезающие или охраняемые виды.
Список литературы
Абрамсон Н.И., Лисовский А.А. Подсемейство Arvicolinae // Млекопитающие России: систематико-географический справочник. Сб. тр. Зоол. музея МГУ. Т. 52. / под ред. Павлинова И.Я., Лисовского А.А. М.: Т-во науч. изд. КМК. 2012. С. 220–276.
Васильев А.Г., Фалеев В.И., Галактионов Ю.К., Ковалева В.Ю., Ефимов В.М., Епифанцева Л.Ю., Поздняков А.А., Дупал Т.А., Абрамов С.А. Реализация морфологического разнообразия в природных популяциях млекопитающих (2-е изд. испр.). Новосибирск: Изд-во СО РАН, 2004. 232 с.
Волкова И.С., Архипов С.А., Бабушкин А.Е., Кулькова И.А., Гуськов С.А., Кузьмина О.Е., Левчук Л.К., Михайлова И.В., Сухорукова С.С. Стратиграфия нефтегазоносных районов Западной Сибири. Кайнозой Западной Сибири. Новосибирск: СО РАН. 2002. 243 с.
Гладкина Т.С. Межвидовые и внутривидовые особенности терморегуляции серых полевок и степной пеструшки // Тез. докл. 5-ой Всесоюз. эколого-физиологической конференции. Новосибирск: 1972. С. 14–16.
Гладкина Т.С., Мейер М.Н. Влияние летних условий на состояние степной пеструшки и узкочерепной полевки в Северном Казахстане // Тр. Всес. научно-исслед. ин-та защиты растений. Л.: 1963. Вып. 18. С. 153–173.
Громов И.М., Ербаева М.А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. СПб. Л.: Зоол. ин-т, 1995. 520 с.
Громов И.М., Поляков И.Я. Полевки (Microtinae). Фауна СССР. Млекопитающие / Под ред. Скарлато О.А. Л.: Наука, 1977. Т. 3. 504 с.
Дупал Т.А. Популяционная динамика и изменения структуры сообществ мелких млекопитающих Северной Кулунды // Зоол. журн. 2008. Т. 87. № 5. С. 609–613.
Дупал Т.А. Распространение, численность и структура популяции степной пеструшки (Lagurus lagurus, Rodentia, Arvicolinae) на периферии ареала // Зоол. журн. 2014. Т. 93. № 12. С. 1454–1460. https://doi.org/10.7868/S0044513414120071
Ковалева В.Ю., Абрамов С.А., Дупал Т.А., Ефимов В.М., Литвинов Ю.Н. Анализ соответствия и комбинирование молекулярно-генетических и морфологических данных в зоологической систематике // Изв. РАН. Сер. биол. 2012. № 4. С. 404–414.
Косинцев П.А., Бобковская Н.Е., Бородин А.В., Зиновьев Е.В., Некрасов А.И., Трофимова С.С. Трогонтериевый слон Нижнего Иртыша. Екатеринбург: Изд-во Волот, 2004. 260 с.
Майр Э. Популяции, виды и эволюция. М.: Мир. 1974. 457 с.
Майр Э. Принципы зоологической систематики. М.: Мир. 1971. 454с.
Млекопитающие Казахстана. В 4-х томах. Т. 1.Ч. 3. Алма-Ата: Наука КазССР, 1978. 492 с.
Огнев С.И. Звери СССР и прилежащих стран (звери Восточной Европы и Северной Азии). М.-Л.: Изд-во АН СССР. 1950. Т. 7. 706 с.
Поздняков А.А., Сенотрусова М.М. Анализ морфотипической изменчивости степной пеструшки // Бюл. МОИП, отд. биол. 2006. Т. 111. Вып. 3. С. 18–23.
Струкова Т.В. Степная пеструшка (Lagurus lagurus Pall.) и узкочерепная полевка (Microtus gregalis Pall.) в четвертичных фаунах Среднего и Южного Зауралья: Автореф. дис. канд. биол. наук. Екатеринбург: ЦМИК, 2002. 24 с.
Тупикова Н.В., Каледа Л.В. Определение возраста грызунов // Фауна и экология грызунов. 1957. Вып. 5. С. 119–154.
Шварц С.С. Экологические закономерности эволюции. М.: Наука. 1980. 276 с.
Atchley W., Rutledge J., Cowley D. Genetic components of size and shape. II. Multivariate covariance patterns in the rat and mouse skull // Evolution. 1981. V. 35(6). P. 1037–1055. https://doi.org/10.2307/2408119
Birdsall K., Zimmerman E., Teeter K., Gibson G. Genetic variation for the positioning of wing veins in Drosophila melanogaster // Evol. Dev. 2000. V. 2(1). P. 16–24. https://doi.org/10.1046/j.1525-142x.2000.00034.x
Box G.E.P. A general distribution theory for a class of likelihood criteria // Biometrika. 1949, V. 36(3–4). P. 317–346. https://doi.org/10.2307/2332671
Bronner G.N., van der Merwe M., Njobe K. Nongeographic cranial variation in two medically important rodents from South Africa, Mastomys natalensis and Mastomys coucha // J. Mammalogy. 2007. V. 88(5). P. 1179–1194. https://doi.org/10.1644/06-MAMM-A-439R.1
Chase K., Carrier D.R., Adler F.R., Jarvik T., Ostrander E.A., Lorentzen E.D., Lark K.G. Genetic basis for systems of skeletal quantitative traits: Principal component analysis of the canid skeleton // Proc. Nat. Acad. Sci. 2002. V. 99(15). P. 9930–9935. https://doi.org/10.1073/pnas.152333099
Claude J. Log-shape ratios, procrustes superimposition, elliptic Fourier analysis: three worked examples in R // Hystrix. 2013. V. 24(1). P. 94–102. https://doi.org/10.4404/hystrix-24.1-6316
Doornik J.A., Hansen H. An omnibus test for univariate and multivariate normality* // Oxf. Bull. Econ. Stat. 2008. V. 70. P. 927–939. https://doi.org/10.1111/j.1468-0084.2008.00537.x
Efimov V., Kovaleva V., Markel A. A new approach to the study of genetic variability of complex characters // Heredity. 2005. V. 94(1). P. 101–107. https://doi.org/10.1038/sj.hdy.6800580
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Paleontol. Electron. 2001. V. 4(1), art.4. 9 p. http://palaeo-electronica.org/2001_1/past/issue1_01.htm.
Jungers W.L., Falsetti A.B., Wall C.E. Shape, relative size, and size-adjustments in morphometrics // Am. J. Phys. Anthropol. 1995. V. 38. P. 137–161. https://doi.org/10.1002/ajpa.1330380608
Klecka W. Discriminant Analysis // Sage University Paper Series on Quantitative aplications in the Social Sciences, Ser. 07-019. Beverly Hills/London, 1980. 72 p. https://doi.org/10.4135/9781412983938
Klingenberg C.P., Leamy L.J., Routman E.J., Cheverud J.M. Genetic architecture of mandible shape in mice: Effects of quantitative trait loci analyzed by geometric morphometrics // Genetics. 2001. V. 157(2). P. 785–802. https://doi.org/10.1093/genetics/157.2.785
Lague M.R., Jungers W.L. Morphometric variation in Plio-Pleistocene hominid distal humeri // Am. J. Phys. Anthropol. 1996. V. 101. P. 401–427. https://doi.org/10.1002/(SICI)1096-8644(199611)101: 3<401::AID-AJPA8>3.0.CO;2-0
Leamy L. Variance partitioning and effects of sex and age on morphometric traits in random bred house mice // J. Mammalogy. 1983. V. 64(1). P. 55–61. https://doi.org/10.2307/1380750
Levene H. Robust tests for equality of variances // Contributions to probability and statistics / Eds Olkin I., Ghurye S.G., Hoeffding W., Madow W.G., Munn H.B. Stanford Univ. Press, 1960. P. 278–292.
Mosimann J.E. Size allometry: size and shape variables with characterizations of the lognormal and generalized gamma distributions // J. Am. Stat. Assoc. 1970. V. 65. P. 930–948. https://doi.org/10.1080/01621459.1970.10481136
Schulte-Hostedde A.I. Sexual size dimorphism in rodents // Rodent Societies: An Ecological and Evolutionary Perspective Rodent Societies / Eds Wolff J.O., Sherman P.W. University of Chicago Press, 2008. P. 115–128.
Shakleton N.J., Opdyke N.D. Oxydegen isotope and paleomagnetic evidence for early Northern Hemisphere glaciation // Nature. 1977. V. 270. № 5634. P. 216–219. https://doi.org/10.1038/270216a0
Shapiro S.S., Wilk M.B. An analysis of variance test for normality (complete samples) // Biometrika. 1965. V. 52(3–4). P. 591–611. https://doi.org/10.2307/2333709
Shenbrot G.I., Krasnov B.R. An atlas ofthe geographic distribution of the arvicoline rodents of the world (Rodentia, Muridae: Arvicolinae). Sofia-Moscow: Pensoft. 2005. 336 p.
Sparks C.S., Jantz R.L. A reassessment of human cranial plasticity: Boas revisited // Proc. Natl. Acad. Sci. 2002. V. 99(23). P. 14636–14639. https://doi.org/doi:10.1073/pnas.222389599
Workman M.S., Leamy L.J., Routman E.J., Cheverud J. Analysis of quantitative trait locus effects on the size and shape of mandibular molars in mice // Genetics. 2002. V. 160(4). P. 1573–1586.
Wright S. Isolation by distance // Genetics. 1943. V. 28(2). P. 114–138. https://doi.org/10.1093/genetics/28.2.114
Zimmerman E., Palsson A., Gibson G. Quantitative trait loci affection components of wing shape in Drosophila melanogaster // Genetics. 2000. V. 155(2). P. 671–683.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая