Известия РАН. Серия биологическая, 2023, № 2, стр. 149-159
Физиолого-биохимическая характеристика и биотехнологический потенциал гидролитических галоалкалотолерантных бактерий содового шламохранилища
Ю. Г. Максимова 1, 2, *, А. В. Шилова 1, В. В. Егорова 1, В. А. Щетко 3, А. Ю. Максимов 1, 2
1 Институт экологии и генетики микроорганизмов УрО РАН – филиал Пермского федерального исследовательского центра УрО РАН
614081 Пермь, ул. Голева, 13, Россия
2 Пермский государственный национальный исследовательский университет
614990 Пермь, Букирева, 15, Россия
3 Государственное научное учреждение Институт микробиологии НАН
220141 Минск, Купревича, 2, Беларусь
* E-mail: maks@iegm.ru
Поступила в редакцию 26.01.2022
После доработки 31.08.2022
Принята к публикации 01.09.2022
- EDN: HANYNK
- DOI: 10.31857/S1026347022700068
Аннотация
Изучены особенности проявления гидролитической активности галоалкалотолерантных бактерий Pseudomonas peli 3-Т, Microbacterium kitamiense 16-ДБ и Bacillus aequororis 5-ДБ, выделенных из грунта территории содового шламохранилища и содового осадка действующего шламонакопителя АО “Березниковский содовый завод” (Пермский край, Россия). Показано, что максимальные активности внеклеточных липаз и амилаз трех исследованных бактерий проявлялись при рН 11 и высокой концентрации хлорида натрия (50–200 г/л). Культивирование P. peli 3-Т на минеральной среде с 0.5%-ным глицерином (источник углерода) и 0.03%-ной мочевины (источник азота) позволяет получить биомассу (6.9 г/л) и активность внеклеточной (1.26 Ед/л) и ассоциированной с клетками липазы (3.02 Ед/мг сухих клеток) с высоким экономическим коэффициентом потребления субстрата (138%). Показана эффективность иммобилизации клеток P. peli 3-Т и B. aequororis 5-ДБ для использования в биотрансформации липидов и крахмала. Клетки P. peli 3-Т, иммобилизованные адсорбцией на каолине и включением в структуру гелей альгината бария и агарозы, сохраняли от 40.4 до 63.8% от активности липазы клеток в суспензии. Иммобилизованные адсорбцией на каолине клетки B. aequororis 5-ДБ сохраняли 42.5% липазной и 90.7% амилазной активности по сравнению с исходными. При этом активности исследованных ферментов P. peli 3-Т и B. aequororis 5-ДБ сохранялись в течение 6-ти последовательных реакций. Амилазная активность иммобилизованных клеток M. kitamiense 16-ДБ при адсорбции на каолине и хитозане снижалась до 2.7–3.5% от исходной и полностью ингибировалась при иммобилизации включением в гели альгината бария или агарозы.
Одними из востребованных ферментов для пищевой, химической, фармацевтической, целлюлозно-бумажной промышленности и кормопроизводства являются липазы (триацил-глицеролацилгидролазы, E.C.3.1.1.3), катализирующие расщепление сложноэфирной связи в триглицеридах, а также способные осуществлять реакцию переэтерификации – обмена структурных элементов в молекулах сложных эфиров (Безбородов, Загустина, 2014). Липазы разных организмов (животные, растения, микроорганизмы: микромицеты, бактерии) активны при разном диапазоне рН, температуры и минерализации среды. Липазы микроорганизмов, устойчивые в щелочной среде, могут быть перспективны для производства моющих средств, органического синтеза, пищевой и фармацевтической промышленности (Fujinami, Fujisawa, 2010; Sarethy et al., 2011). Ферменты, стабильные в среде с высоким содержанием соли, обычно активны также в органических и водно-органических смесях (Kumar et al., 2012; DasSarma, DasSarma, 2015), поэтому устойчивые к высокой минерализации среды липазы могут применяться для переэтерификации жирных кислот в биотехнологическом производстве биодизельного топлива, протекающем в присутствии органических растворителей. Высокая специфичность липаз позволяет свести к минимуму негативные побочные реакции, связанные с образованием солей жирных кислот, по сравнению с аналогичным процессом промышленного органического синтеза (Bajaj et al., 2010).
Использование липаз в качестве биокатализаторов в промышленных масштабах имеет свои недостатки: их выделение и очистка экономически затратны, а фермент в растворе не может быть использован многократно (Lόpez-Fernández et al., 2021). Липазы, ассоциированные с клетками, более стабильны. Увеличить стабильность такого фермента, а также обеспечить его многократное применение можно иммобилизацией (ограничением подвижности) целых клеток продуцирующих его микроорганизмов (Zaitsev et al., 2019). Микробные клетки в иммобилизованном состоянии защищены от неблагоприятных воздействий внешней среды, в результате чего они могут эффективно трансформировать субстрат в течение более длительного времени и при более высокой концентрации, а также в более широком диапазоне рН, относительно свободных клеток (Eş et al., 2015), поэтому использование иммобилизованных микробных клеток в биотехнологических процессах повышает их эффективность (Максимов и др., 2007).
Амилазы (КФ 3.2.1.1) – ферменты класса гидролаз, катализирующие гидролиз крахмала с образованием декстринов или глюкоолигосахаридов. Они составляют около 25% ферментов, получаемых в производственных масштабах, используются преимущественно в пищевой промышленности (в хлебопечении, для осветления фруктовых соков), обработке бумаги и текстиля. Амилазы галоалкалофильных микроорганизмов сохраняют активность в диапазоне рН 8–11, перспективны для применения в производстве моющих средств, способны повысить эффективность процессов разжижения крахмала при промышленном использовании (Sarethy et al., 2011).
В экстремальных условиях среды природного или антропогенного происхождения могут развиваться микроорганизмы с уникальными свойствами (Gupta et al., 2014). В щелочной и высокоминерализованной средах микроорганизмы продуцируют внеклеточные ферменты (Fujinami, Fujisawa, 2010; Sarethy et al., 2011), которые представляют интерес для биотехнологического применения в условиях высокого рН и низкой активности воды.
В связи с вышеизложенным, поиск новых продуцентов амилаз и липаз среди микроорганизмов, обитающих в щелочных высокоминерализованных биотопах, представляется перспективным для производства моющих средств, кормов для сельскохозяйственных животных, в переработке отходов.
Цель работы сфокусирована на изучении условий культивирования и иммобилизации клеток галоалкалотолерантных штаммов Pseudomonas peli 3-Т – продуцента липазы, Microbacterium kitamiense 16-ДБ – продуцента амилазы и Bacillus aequororis 5-ДБ – продуцента липазы и амилазы, выделенных из грунта содового производства и содового осадка.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы, условия культивирования и ростовые характеристики. Из грунта восстанавливающихся после эксплуатации территорий содового шламохранилища АО “Березниковский содовый завод” (г. Березники, Пермский край, Россия) были ранее выделены микроорганизмы P. peli 3-Т (GenBank MT860703) – продуцент липазы, B. aequororis 5-ДБ (GenBank MT875306) – продуцент липазы и амилазы. Из содового осадка был выделен M. kitamiense 16-ДБ (GenBank MT872083) – продуцент амилазы (Шилова и др., 2021).
Культуры исследуемых микроорганизмов выращивали на минеральной среде Пфеннига (г/л): KH2PO4, 0.3; MgCl2, 0.3, СаСl2, 0.03; дрожжевой экстракт, 0.5; раствор микроэлементов по Липперту–Витману (1 мл). Источники азота (N): мочевина, хлорид аммония или нитрат аммония, 0.03%. Для проявления липазной активности этих бактерий использовали источники углерода (C): глицерин (чда, Россия), твин-20 (“Ferak”, Германия), твин-80 (“Ferak”, Германия), оливковое масло (“Global Village”, Испания) или подсолнечное масло (“Altero”, Россия), 1%. Для проявления амилазной активности использовали источник C: крахмал растворимый (ЗАО “ННПЦ ГИП”, Россия), 1%.
Все культуры выращивали в конических колбах (250 мл), в которые вносили 100 мл среды, инокулировали суспензией микроорганизмов (0.5 мл, ОП540 = 1.0) и инкубировали на роторной качалке (115 об./мин, 25°С, 8 сут.) Бактериальный рост оценивали по изменению ОП540 среды на фотоэлектроколориметре КФК-3, ширина кюветы 1 см (Россия). Полученную суспензию клеток центрифугировали (14 000 g, 10 мин), осадок высушивали (50°С, 48 ч) и взвешивали. Затем строили калибровочную кривую зависимости ОП540 суспензии от веса клеток (г/л).
Удельную скорость роста (µ, ч–1) рассчитывали по формуле:
(1)
$\mu = {1 \mathord{\left/ {\vphantom {1 {{\text{О}}{{{\text{П}}}_{0}}\left( {{{\Delta {\text{ОП}}} \mathord{\left/ {\vphantom {{\Delta {\text{ОП}}} {\Delta t}}} \right. \kern-0em} {\Delta t}}} \right)}}} \right. \kern-0em} {{\text{О}}{{{\text{П}}}_{0}}\left( {{{\Delta {\text{ОП}}} \mathord{\left/ {\vphantom {{\Delta {\text{ОП}}} {\Delta t}}} \right. \kern-0em} {\Delta t}}} \right)}},$где ОП0 – оптическая плотность при λ 540 нм в момент времени t0; ΔОП – изменение оптической плотности культуральной среды при λ 540 нм за время Δt, ч.
Сухую биомассу клеток (X) определяли по разности ее максимальной и начальной величин
(2)
$X = {{X}_{{\max }}}--{{X}_{0}},\,\,{{\text{г}} \mathord{\left/ {\vphantom {{\text{г}} {\text{л}}}} \right. \kern-0em} {\text{л}}},$где X0 – биомасса в начальное время, Xmax – максимальная биомасса по окончании культивирования.
Экономический коэффициент потребления субстрата (Y, %) определяли по формуле:
где X – биомасса после инкубирования, г/л; С – масса потребленного субстрата, г/л.
Определение активности липазы бактериальных штаммов. Липазную активность бактерий определяли биохимической реакцией с р-нитрофениллауратом, который под действием липазы расщеплялся с образованием окрашенного продукта р-нитрофенола (Bulow, Mosbach, 1987).
Суспензию клеток (4 мл) центрифугировали (4500 g, 20 мин), отделяли супернатант, осадок 2–3 раза промывали фосфатным буфером (4 мл, рН 8) и ресуспендировали в 4 мл этого же буфера. Затем вносили 50 мкл р-нитрофениллаурата (10 мМ) и инкубировали 1 ч при 25°С. Активность липазы определяли по приросту оптической плотности при λ 405 нм (спектрофотометр Ultraspec 3000 “GE Healthcare”, США).
Удельную активность липазы (Е) рассчитывали по формуле:
(4)
${\text{Е}} = {{{\text{О}}{{{\text{П}}}_{{405}}} \times {{{10}}^{6}}} \mathord{\left/ {\vphantom {{{\text{О}}{{{\text{П}}}_{{405}}} \times {{{10}}^{6}}} {(18.3 \times {{{10}}^{3}}lt)}}} \right. \kern-0em} {(18.3 \times {{{10}}^{3}}lt)}},\,\,({\text{мкмоль}}\,\,{\text{ми}}{{{\text{н}}}^{{--1}}}\,\,{{{\text{л}}}^{{--1}}}),$где ОП405 – оптическая плотность при λ 405; 106 – коэффициент пересчета моль в мкмоль; 18.3 × 103 – коэффициент молярной экстинкции р-нитрофенола, л ⋅ см–1 ⋅ моль–1; l – толщина кюветы, см; t – время инкубации пробы, мин.
Удельную липазную активность выражали в мкмоль продукта реакции, образующегося в минуту (Ед) на литр среды культивирования (Ед/л) или на мг сухих клеток (Ед/мг).
Определение активности амилазы бактериальных штаммов. Активность амилазы оценивали с помощью коммерческого набора реактивов Альфа-Амилаза-Ольвекс ООО “Ольвекс Диагностикум” (Россия). Реакция основана на гидролизе синтетического субстрата этилиден-р-нитрофенилмальтогептазиды с образованием нитрофенилмальтозидов, которые подвергаются дальнейшему расщеплению альфа-глюкозидазой до глюкозы и окрашенного продукта р-нитрофенола. Суспензию клеток бактерий разделяли на осадок и супернатант. Осадок промывали фосфатным буфером (4 мл, рН 8) 2–3 раза и ресуспендировали в 4 мл того же буфера. Реакцию проводили в плоскодонном 96-луночном полистироловом планшете. К 100 мкл образца добавляли 100 мкл реагента коммерческого набора, содержащего HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) – буферную основу, pH 8, раствор хлористого магния и натрия, α-глюкозидазу, холат натрия, азид натрия и субстрат 4,6-этилиден(G7)-p-нитрофенил-(G1)-α, D-мальтогептозид. Активность фермента определяли по изменению оптической плотности среды при λ 405 нм, измеряемой на планшетном ридере Infinite M1000 “Tecan” (Швейцария) пятикратно с интервалом в 1 мин. Активность амилазы рассчитывали по формуле (4).
Влияние рН и концентрации хлорида натрия на липазную и амилазную активность бактерий. Культуру P. peli 3-Т выращивали на среде с 1%-ным твином-80, M. kitamiense 16-ДБ – с 1%-ным крахмалом растворимым, Bacillus aequororis 5-ДБ – с 1%-ным крахмалом растворимым для индукции амилазной активности или 1%-ным твином-80 – липазной активности. Исследовали влияние разных концентраций NaCl (0.5, 5, 50, 100, 200 г/л) и рН (6, 8, 9, 11) на рост P. peli 3-Т, M. kitamiense 16‑ДБ и B. aequororis 5-ДБ. После культивирования биомассу бактерий отделяли от культуральной среды центрифугированием (20 мин, 4500 g) и определяли внеклеточную и ассоциированную с клетками липазную и амилазную активность.
Иммобилизация бактериальных клеток методом адсорбции на неорганическом (каолин) и органическом (хитозан) носителях. Суспензию клеток P. peli 3-Т, M. kitamiense 16-ДБ и B. aequororis 5-ДБ центрифугировали (4500 g, 20 мин), надосадочную жидкость удаляли, осадок ресуспендировали в фосфатном буфере (рН 8), центрифугировали повторно при указанном режиме и осадок промывали. Затем определяли ОП540 суспензии клеток на фотоэлектроколориметре КФК-3 (Россия).
Суспензию клеток в фосфатном буфере смешивали с каолином (“Merck”, Германия) в соотношении 10 мл суспензии/0.5 г каолина и инкубировали 60 мин на шейкере (115 об./мин, 25°С). Затем эту суспензию фильтровали через бумажный фильтр “красная лента” (ООО “Мелиор XXI”, Россия) и определили ОП540 фильтрата. Осадок на фильтре промывали буферным раствором и определяли ОП540 промывного раствора.
Массу адгезированных (иммобилизованных) на каолине клеток (Мкл, мг) определяли по формуле:
(5)
${{{\text{М}}}_{{{\text{кл}}}}} = CV{{\left( {{\text{О}}{{{\text{П}}}_{{{\text{исх}}}}} - {\text{О}}{{{\text{П}}}_{{{\text{фильтр}}}}} - {\text{О}}{{{\text{П}}}_{{{\text{смыв}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{\text{О}}{{{\text{П}}}_{{{\text{исх}}}}} - {\text{О}}{{{\text{П}}}_{{{\text{фильтр}}}}} - {\text{О}}{{{\text{П}}}_{{{\text{смыв}}}}}} \right)} {{\text{О}}{{{\text{П}}}_{{{\text{исх}}}}}}}} \right. \kern-0em} {{\text{О}}{{{\text{П}}}_{{{\text{исх}}}}}}},$где C – концентрация клеток в суспензии до адгезии, мг/мл, V – объем суспензии, из которой адгезировали клетки, мл; ОПисх – оптическая плотность суспензии клеток до адгезии; ОПфильтр – оптическая плотность фильтрата; ОПсмыв – оптическая плотность промывного раствора.
Величину адсорбции А (мг сухих кл./г носителя) определили по формуле:
(6)
${\text{А}} = {{{\text{М}}}_{{{\text{кл}}}}} \times {{1000} \mathord{\left/ {\vphantom {{1000} m}} \right. \kern-0em} m},$где m – масса носителя, мг.
Для иммобилизации клеток на хитозане (“Sigma”, Япония) получали гранулы: готовили 2%-ный раствор хитозана в 2%-ной уксусной кислоте и накапывали с помощью шприца объемом 5 мл в 1 М раствор KOH, инкубировали при комнатной температуре в течение 4 ч, в результате получали отвердевшие гранулы геля хитозана. Полученные гранулы промывали 0.01 М калий-фосфатным буфером, рН 7.2 ± 0.2 до нейтральной реакции промывного раствора и затем активировали инкубацией с равным объемом 2.5%-ного глутарового альдегида 12 ч. Трижды промывали гранулы фосфатным буфером, объем которого в 2 раза превышал таковой альдегида. Затем к гранулам неактивированного и активированного глутаровым альдегидом хитозана добавляли суспензию клеток, и помещали на 4 ч в холодильник. Массу адгезированных клеток на хитозане определяли, как описано выше.
Иммобилизация бактериальных клеток P. peli 3-Т и M. kitamiense 16-ДБ методом включения в структуру геля альгината и агарозы. Суспензию бактерий смешивали со стерильным раствором 2%-ного альгината натрия (“Fluka”, Швейцария), отношение 1 : 2), а затем полученную смесь набирали в шприц и выдавливали в охлажденный 0.1 М раствор хлорида бария. Полученные таким способом гранулы альгината бария диаметром 2 мм, содержащие клетки бактерий, ресуспендировали в свежем растворе BaCl2, выдерживали 24 ч при 4–6°С и отмывали дистиллированной водой.
Суспензию бактериальных клеток в 0.01 М калий-фосфатным буфере (рН 7.2 ± 0.2) смешивали с 4%-ным раствором агарозы (“Хеликон”, Россия) в соотношении 1 : 3 (при 40–45°С). Полученную смесь разливали в чашки Петри (слой 2 мм) и после ее застывания нарезали скальпелем на квадраты (2 × 2 мм).
У полученных таким образом иммобилизованных в альгинате и агарозе клеток определяли ферментативную активность.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение характеристики роста галоалкалотолерантных штаммов. Рост P. peli 3-Т, M. kitamiense 16-ДБ и B. aequororis 5-ДБ оценивали на среде с различными источниками C (табл. 1). Показано, что M. kitamiense 16-ДБ способен расти на всех 11-ти источниках C, P. peli 3-Т – на глюкозе, инозите, манните, сахарозе, сорбите, сукцинате, цитрате, а B. aequororis 5-ДБ – только на инозите, мальтозе и сукцинате.
Таблица 1.
Рост (+) бактериальных штаммов на среде Пфеннига с разными источниками углерода
| Углерод, 0.1% | P. peli 3-Т | M. kitamiense 16-ДБ | B. aequororis 5-ДБ |
|---|---|---|---|
| Глюкоза | + | + | – |
| Дульцит | – | + | – |
| Инозит | + | + | + |
| Ксилоза | – | + | – |
| Лактоза | – | + | – |
| Мальтоза | – | + | + |
| Маннит | + | + | – |
| Сахароза | + | + | – |
| Сорбит | + | + | – |
| Сукцинат | + | + | + |
| Цитрат | + | + | – |
Динамика роста P. peli 3-Т на среде с различными источниками C (глицерин, твин-20, подсолнечное и оливковое масло) и N (мочевина, хлорид и нитрат аммония) показана на рис. 1. Эти соединения C способны индуцировать липазную активность.
Рис. 1.
Рост P. peli 3-Т на среде с разными источниками углерода: 1 – глицерином, 2 – твин-20, 3 – подсолнечным маслом, 4 – оливковым маслом и азота: а – мочевиной, б – нитратом аммония, в – хлоридом аммония. ОП540 – оптическая плотность при λ 540 нм.

Установлено, что глицерин является лучшим источником C для накопления биомассы P. peli 3-Т (ОП540 = 1.6 ± 0.4). Эти псевдомонады утилизировали также твин-20, подсолнечное и оливковое масло (в сочетании с источниками N), однако с внесением мочевины рост был наибольшим, а время адаптации к этим источникам C практически не выявлено. Следует отметить, что рост этой культуры на растительных маслах характеризовался агрегацией ее клеток, что приводило, в свою очередь, к снижению оптической плотности жидкой среды. Кроме того, на среде с растительными маслами отмечен меньший выход ее биомассы, что связано, очевидно, с их гидрофобностью и меньшей доступностью растительных масел для клеток.
Определено накопление биомассы P. peli 3-Т, активность внеклеточной и ассоциированной с клетками липазы, эффективность использования субстрата и удельная скорость роста в логарифмической фазе (табл. 2). Удельная скорость роста P. peli 3-Т была наибольшей в среде с глицерином (1%) и нитратом аммония (0.03%), однако этот источник N ингибировал активность внеклеточной липазы и в дальнейших экспериментах не использовался.
Таблица 2.
Биомасса P. peli 3-Т в среде Пфеннига с разными источниками C и N, липазная активность (ЛА), удельная скорость роста в логарифмической фазе (μ) и экономический коэффициент потребления субстрата (Y)
| C, % | N, 0.03% | Биомасса сухая, г /л | ЛА, *Ед/л (**Ед/мг) | μ, ч–1 | Y, % |
|---|---|---|---|---|---|
| Глицерин, 1 | (NH2)2CO | 9.3 | 0.6 (1.81) | 0.03 | 93 |
| NH4Cl | 9.1 | 0 (1.26) | 0.04 | 91 | |
| NH4NO3 | 10.5 | 0.001 (1.13) | 0.41 | 105 | |
| Глицерин, 0.5 | (NH2)2CO | 6.9 | 1.26 (3.02) | 0.08 | 138 |
| Твин-20, 1 | (NH2)2CO | 6.4 | 0.06 (0.5) | 0.04 | 64 |
| NH4Cl | 6.1 | 0.1 (0.6) | 0.04 | 61 | |
| NH4NO3 | 6.3 | 0.0009 (0.8) | 0.04 | 63 | |
| Подсолнечное масло, 1 | (NH2)2CO | 8.9 | 0.6 (0.003) | 0.1 | 89 |
| NH4Cl | 4.1 | 0 (0.007) | 0.04 | 41 | |
| NH4NO3 | 2.5 | 0.13 (0.09) | 0.005 | 25 | |
| Оливковое масло, 1 | (NH2)2CO | 1.1 | 0.23 (0.2) | 0.0003 | 10 |
| NH4Cl | 2.8 | 0.14 (0.004) | 0.06 | 28 | |
| NH4NO3 | 2.2 | 0.01 (0.004) | 0.02 | 22 |
Наибольший выход биомассы P. peli 3-Т (9.1–10.5 г/л) был получен на среде с глицерином (1%), большой – с глицерином (0.5%). Также высокие значения этого показателя наблюдались при росте на твине-20 и подсолнечном масле (с мочевиной). Следовательно, наиболее эффективно используемым углеродным субстратом для P. peli 3‑Т оказался глицерин (0.5–1%), кроме того, этот вариант эксперимента характеризовался и высоким экономическим коэффициентом потребления.
Установлено, что внесение мочевины (источник N) и глицерина (источник C) в питательную среду способствует увеличению липазной активности P. peli 3-Т. Активность липазы в надосадочной жидкости среды с глицерином (0.5%) и мочевиной достигала 1.26 Ед/л, а с другими источниками C и N – не превышала 0.6 Ед/л. Внесение твин-20 в среду не вызывало увеличения внеклеточной липазной активности P. peli 3-Т.
Ассоциированная с клетками липазная активность P. peli 3-Т при росте с мочевиной и глицерином (0.5 и 1%) достигала 3.02 и 1.81 Ед/мг соответственно, с другими источниками C и N не превышала 1.26 Ед/мг. Растительные масла не способствовали увеличению активности ассоциированной с клетками липазы для этого штамма.
Таким образом установлено, что мочевина и глицерин как источники N и С способствуют увеличению как внеклеточной, так и ассоциированной с клетками липазной активности P. peli 3-Т. Активность липазы, ассоциированной с его клетками, с твин-20 достигает 0.5–0.8 Ед/мг. В то же время растительные масла в присутствии мочевины индуцировали только внеклеточную липазу, а твин-20 – преимущественно ассоциированную с клетками. Такой факт можно объяснить гидрофобностью растительных масел: их липиды не способны проникать через клеточные мембраны (они являются субстратом только для внеклеточных липаз). Однако твин-20, как амфифильный субстрат, способен проникать в периплазматическое пространство клеток и, тем самым, становится доступным для ассоциированных с клетками липаз.
Полученные результаты свидетельствуют об индуцибельном характере экспрессии липазы у P. peli 3-Т, что соотносится с данными литературы для других микроорганизмов (Zhang et al., 2003; Grbavčić et al., 2007; Шеламова, Тырсин, 2012).
В итоге, для получения наибольшей биомассы культуры P. peli 3-Т, обладающей липазной активностью, предложена среда Пфеннига с добавлением глицерина (источник С, 0.5%) и мочевины (источник N, 0.3 г/л).
Влияние рН и концентрации хлорида натрия в среде культивирования на липазную и амилазную активность P. peli 3-Т, M. kitamiense 16-ДБ и B. aequororis 5-ДБ. Поскольку изучаемые штаммы бактерий были изолированы из щелочной среды с высокой концентрацией хлорида натрия, то мы изучили их гидролитическую активность в зависимости от этих факторов. Наибольшая активность внеклеточной липазы P. peli 3-Т оказалась при рН 11 и 100 г/л NaCl, а наименьшая – при рН 6. Наибольшая активность ассоциированной с клетками липазы выявлена при рН 8 и 0.5–100 г/л NaCl (рис. 2). Высокий уровень внеклеточной липазной активности P. peli 3-Т проявлялся в исследованном диапазоне рН (8–11). Изменение концентрации NaCl (от 0.5 до 200 г/л) влияло незначительно на активность внеклеточной липазы при изученном диапазоне рН.
Рис. 2.
Влияние рН и концентрации NaCl (1 – 0,5, 2 – 5, 3 – 50, 4 – 100, 5 – 200 г/л) на липазную активность P. peli 3-Т: (а) – внеклеточная, (б) –ассоциированная с клеточной поверхностью.

Следует отметить, что активность ассоциированной с клетками липазы, была высокой и при рН 6.0, что свидетельствует о сохранности этого фермента в периплазматическом пространстве. При рН 11 и высокой концентрации NaCl (50–200 г/л) активность ассоциированной с клетками липазы достигала 1.0–1.4 Ед/мг сух. веса клеток, а с 0.5 и 5 г/л NaCl – не превышала 0.3 Ед/мг.
Установлено, что у M. kitamiense 16-ДБ активность внеклеточной амилазы практически не изменялась при варьировании концентрации хлорида натрия от 0.5 до 200 г/л и рН от 7 до 11, а максимум ее активности наблюдался при рН 11 и 100 г/л соли. При этом ассоциированная с клетками амилазная активность этого штамма была максимальна при рН 10 и 0.5 г/л NaCl (рис. 3).
Рис. 3.
Влияние рН и концентрации NaCl (1 – 0.5, 2 – 5, 3 – 50, 4 – 100, 5 – 200 г/л) на амилазную активность M. kitamiense 16-ДБ (а) – внеклеточная, (б) –ассоциированная с клеточной поверхностью.
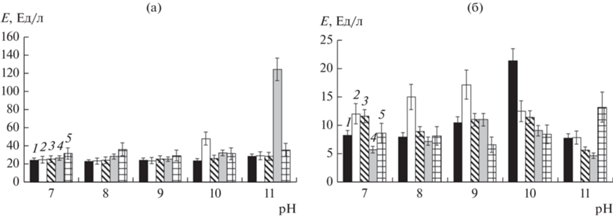
Штамм B. aequororis 5-ДБ, как упомянуто выше, обладает амилазной и липазной активностью. Показано, что B. aequororis 5-ДБ характеризуется высокой активностью этих внеклеточных ферментов в щелочном диапазоне рН (максимум при рН 11). В среде с рН 11 активность ферментов была выше с большим содержанием соли (50 г/л), (рис. 4). При этом ассоциированная с клетками липазная активность этого штамма была наибольшей при рН 10 и 0.5 г/л NaCl, а ассоциированная с клетками амилазная активность – при рН 9 и 0.5 г/л соли.
Рис. 4.
Липазная (1, 2) и амилазная (3, 4) активность (% от таковой при рН 7 и 0.5 г/л NaCl) в супернатанте культуры Bacillus aequororis 5-ДБ при различных рН и концентрациях NaCl: 0.5 (1, 3) и 50 г/л (2, 4).
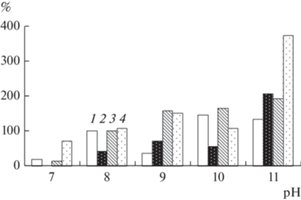
Показано, что наибольшая активность внеклеточных липаз и амилаз трех исследованных бактерий, выявлена при рН 11 и высокой концентрации NaCl (50–200 г/л). Очевидно, что высокое значение рН и содержание NaCl в среде для роста алкалофильных и алкалотолерантных прокариотов является благоприятным. Известно, что высокая концентрация катионов Na обеспечивает поддержание электрохимического градиента протонов в сильнощелочной среде за счет работы антипортера Na+/H+ (Krulwich et al., 2011). Это энергетически выгодное состояние клетки может обеспечить усиление метаболических процессов, в том числе и экспрессии генов гидролитических ферментов.
Иммобилизация клеток P. peli 3-Т, M. kitamiense 16-ДБ и B. aequororis 5-ДБ методом адсорбции. В биотехнологии часто возникает необходимость в иммобилизации клеток микроорганизмов. Известно, что иммобилизация клеток дает возможность многократного использования такого биокатализатора и осуществления непрерывных процессов. Адсорбция и адгезия микробных клеток на разных носителях обычно предпочтительны, поскольку не вызывают ингибирования их ферментативной активности или массообмена. Так, если липаза или амилаза ассоциированы с клеточной поверхностью или находятся в периплазматическом пространстве клетки, целесообразно иммобилизовать микробные клетки. Большинство проведенных ранее исследований по данному направлению посвящено иммобилизации клеток грибов с липазной активностью на гранулах полиуретана, полистирола, губчатых материалах естественного и искусственного происхождения (Oda et al., 2005; Hama et al., 2007; Tamalampudi et al., 2008; Koda et al., 2010; Arumugam, Ponnusami, 2014; Ferrarezi et al., 2014; Surendhiran et al., 2014; Amoah et al., 2016; Guldhe et al., 2016; Rakchai et al., 2016). Культуру продуцента, как правило, выращивают вместе с материалом носителя, в результате чего происходит самоиммобилизация – прорастание гиф гриба в пористом материале. Такие биокатализаторы использовали в основном в процессах получения биодизельного топлива. В ряде работ показано, что иммобилизованные клетки продуцировали липазу во внешнюю среду (Taskin et al., 2016). Есть и примеры иммобилизации клеток бактерий Bacillus subtilis (Oliveira et al., 2019) и Ralstonia pickettii в геле агара, альгината и полиакриламида (Hemachander et al., 2001).
В настоящем исследовании проводили иммобилизацию P. peli 3-Т и M. kitamiense 16-ДБ методами адсорбции на каолине и определяли ассоциированную с клетками ферментативную активность. Установлено, что при адсорбции P. peli 3-Т на каолине сохранялось 40.4% исходной липазной активности (табл. 3). Адсорбированные на каолине клетки B. aequororis 5-ДБ сохраняли 42.5% липазной и 90.7% амилазной активности. При этом наблюдалась значительная стабилизация активности этих ферментов. Кроме того, активность сохранялась для 6-ти повторных реакций трансформации субстрата (не менее 74% от исходной).
Таблица 3.
Характеристика иммобилизованных клеток P. peli 3-Т, M. kitamiense 16-ДБ и B. aequororis 5-ДБ на разных носителях
| Носитель/способ иммобилизации | Масса адсорбированных клеток, мг/г | Активность, Ед/мг | Активность после иммобилизации, % |
|---|---|---|---|
| P. peli 3-Т (исходная суспензия 2.17 г/л) Липазная активность (0.930 ± 0.251 Ед/мг) |
|||
| Каолин/адсорбция | 42.6 ± 5.2 | 0.376 ± 0.058 | 40.4 |
| Альгинат бария/включение в гель | – | 0.446 ± 0.072 | 47.9 |
| Агароза / включение в гель | – | 0.590 ± 0.300 | 63.8 |
| M. kitamiense 16-ДБ (исходная суспензия 3.23 г/л) Амилазная активность (3.445 ± 0.713 Ед/мг) |
|||
| Каолин/адсорбция | 57.84 ± 2.98 | 0.096 ± 0.023 | 2.8 |
| Неактивированный хитозан/адсорбция | 7.97 ± 1.97 | 0.098 ± 0.015 | 2.8 |
| Активированный хитозан/ковалентная сшивка | 6.23 ± 1.11 | 0.122 ± 0.072 | 3.5 |
| B. aequororis 5-ДБ (исходная суспензия 1.95 г/л) Липазная активность (20.765 ± 1.232 Ед/мг) |
|||
| Каолин/адсорбция | 46.71 ± 3.45 | 8.819 ± 0.189 | 42.5 |
| Амилазная активность (12.386 ± 0.272 Ед/мг) | |||
| Каолин/адсорбция | 46.71 ± 3.45 | 11.233 ± 0.19 | 90.7 |
При адсорбции M. kitamiense 16-ДБ на каолине амилазная активность значительно снижалась и составляла лишь 2.8%. Такое снижение наблюдали при адсорбции клеток этой бактерии на активированном и неактивированном хитозане (2.8 и 3.5% соответственно). Амилаза актинобактерии M. kitamiense 16-ДБ локализована не внутри клеток и не в периплазматическом пространстве, как у грамотрицательных бактерий, а ассоциирована с поверхностью, а также не защищена полисахаридной капсулой, как у бацилл, поэтому наблюдаемое снижение активности иммобилизованных клеток может быть обусловлено контактом с мелкодисперсным носителем (табл. 3).
Иммобилизация клеток P. peli 3-Т и M. kitamiense 16-ДБ методом включения в структуру гелей альгината бария и агарозы. При включении клеток P. peli 3-Т в структуру геля альгината бария и агарозы наблюдался высокий уровень сохранения активности липазы: 47.9 и 63.8% соответственно (табл. 3). Клетки в структуре альгината бария сохраняли ферментативную активность на протяжении ряда циклов использования, так за 6 циклов сохранялось 65.2% активности от таковой первого цикла. Стабильность полученного нами биокатализатора при повторных циклах трансформации субстрата была выше таковой, известной в литературе: клетки Ralstonia pickettii с липазной активностью использовали только 3 раза с потерей 10% активности в каждом цикле (Hemachander et al., 2001).
Крахмал является высокомолекулярным полимерным субстратом, который не проникает в клетки, поэтому амилазы гидролизуют его во внеклеточной среде. Много исследований посвящено иммобилизации выделенных амилаз (Akkaya et al., 2012; Mageswari et al., 2012; Verma, Raghav, 2021). В научной литературе есть также сведения об иммобилизации клеток дрожжей для получения амилазы в процессе их культивирования. Так, клетки Saccharomycopsis fibuligera A11-c были включены в структуру геля поливинилового спирта (Gen et al., 2014), а клетки Saccharomyces cerevisiae иммобилизованы на бактериальной целлюлозе (Khanpanuek et al., 2022). У культуры M. kitamiense 16-ДБ большая часть амилазной активности ассоциирована с клетками, поэтому в нашей работе были иммобилизованы бактериальные клетки с активностью амилазы.
Показано, что иммобилизация M. kitamiense 16-ДБ в структуре гелей агарозы и альгината бария приводит к полному ингибированию амилазной активности. Ингибирование ферментативной активности амилазы может быть связано с диффузионными затруднениями при конверсии сложного полимерного субстрата иммобилизованными клетками.
Из полученных данных можно заключить, что иммобилизованные клетки P. peli 3-Т и B. aequororis 5-ДБ сохраняют значительную часть липазной и/или амилазной активности и могут эффективно использоваться для гидролиза соответствующих субстратов.
* * *
Таким образом, была изучена активность внеклеточных гидролаз (липаза, амилаза) трех алкалотолерантных штаммов (P. peli 3-Т, B. aequororis 5-ДБ, M. kitamiense 16-ДБ) в условиях повышенного значения рН и содержания хлорида натрия. Наибольшая активность липазы (P. peli 3-Т и B. aequororis 5-ДБ) и амилазы (M. kitamiense 16-ДБ и B. aequororis 5-ДБ) выявлена при сочетании высокого значения рН (11) и содержания NaCl (50–200 г/л) в среде. Показано, что клетки P. peli 3-Т, иммобилизованные на каолине, в геле альгината бария и агарозы, сохраняли 40–64% исходной активности липазы; B. aequororis 5-ДБ (каолин) – 42% липазы и 91% амилазы; M. kitamiense 16-ДБ (каолин, хитозан) – 3–4% амилазы. Галоалкалотолерантные бактерии, выделенные из высокоминерализованной щелочной среды антропогенного происхождения (содового шламохранилища), могут быть перспективными продуцентами ферментов для производства моющих средств, переработки биогенного сырья, отходов пищевой промышленности и сельского хозяйства.
Финансирование. Исследование выполнено при финансовой поддержке Правительства Пермского края в рамках научного проекта № С-26/507, идентификация штаммов выполнена в рамках темы “Поиск и селекция новых перспективных микроорганизмов для целей биотехнологии. Создание иммунохимических диагностических систем”, номер государственной регистрации НИОКТР 122010800029-1.
Список литературы
Безбородов А.М., Загустина Н.А. Липазы в реакциях катализа в органическом синтезе (обзор) // Прикладная биохимия и микробиология. 2014. Т. 50. № 4. С. 347–373.
Максимов А.Ю., Максимова Ю.Г., Кузнецова М.В., Олонцев В.Ф., Демаков В.А. Иммобилизация на углеродных сорбентах клеток штамма Rhodococcus ruber gt1, обладающего нитрилгидратазной активностью // Прикладная биохимия и микробиология. Т.43. № 2. 2007. С. 193–198.
Шеламова С.А., Тырсин Ю.А. Индукция биосинтеза липаз микромицетом. Вестник ОГУ. 2012. № 1(137). С. 172–176.
Шилова А.В., Максимов А.Ю., Максимова Ю.Г. Выделение и идентификация алкалотолерантных бактерий с гидролитической активностью из содового шламохранилища // Микробиология. 2021. Т. 90. № 2. С. 155–165.
Akkaya B., Yenidunya A.F., Akkaya R. Production and immobilization of a novel thermoalkalophilic extracellular amylase from bacilli isolate // Int. J. Biol. Macromol. 2012. V. 50. P. 991–995.
Amoah J., Ho S.-H., Hama S., Yoshida A., Nakanishi A., Hasunuma T., Ogino C., Kondo A. Converting oils high in phospholipids to biodiesel using immobilized Aspergillus oryzae whole-cell biocatalysts expressing Fusarium heterosporum lipase // Biochem. Eng. J. 2016. V. 105. P. 10–15.
Arumugam A., Ponnusami V. Biodiesel production from Calophyllum inophyllum oil using lipase producing Rhizopus oryzae cells immobilized within reticulated foams // Renewable Energy. 2014. V. 64. P. 276–282.
Bajaj A., Lohan P., Jha P.N., Mehrotra R. Biodiesel production through lipase catalyzed transesterification: An overview // J. Mol. Catal. B: Enzym. 2010. V. 62. P. 9–14.
Bulow L., Mosbach K. The expression in E. coli of a polymeric gene coding for an esterase mimic catalyzing the hydrolysis of p-nitrophenyl esters // FEBS Lett. 1987. V. 210. P. 147–152.
DasSarma S., DasSarma P. Halophiles and their enzymes: Negativity put to good use // Curr. Opin. Microbiol. 2015. V. 25. P. 120–126.
Eş I., Vieira J.D.G., Amaral A.C. Principles, techniques, and applications of biocatalyst immobilization for industrial application // Appl. Microbiol. Biotechnol. 2015. V. 99. P. 2065–2082.
Ferrarezi A.L., Ohe T.H.K., Borges J.P., Brito R.R., Siqueira M.R., Vendramini P.H., Quilles Jr.J.C., Nunes C. da C.C., Bonilla-Rodriguez G.O., Boscolo M., Da-Silva R., Gomes E. Production and characterization of lipases and immobilization of whole cell of the thermophilic Thermomucor indicae seudaticae N31 for transesterification reaction // J. Mol. Catal. B: Enzym. 2014. V. 107. P. 106–113.
Fujinami S., Fujisawa M. Industrial applications of alkaliphiles and their enzymes – past, present and future // Environ. Technol. 2010. V. 31(8–9). P. 845–856.
Gen Q., Wang Q., Chi Z.-M. Direct conversion of cassava starch into single cell oil by co-cultures of the oleaginous yeast Rhodosporidium toruloides and immobilized amylases-producing yeast Saccharomycopsis fibuligera // Renewable Energy. 2014. V. 62. P. 522–526.
Grbavčić S.Ž., Dimitrijević–Branković S.I., Bezbradica D.I., Šiler–Marinković S.S., Knežević Z.D. Effect of fermentation conditions on lipase production by Candida utilis // J. Serb. Chem. Soc. 2007. V. 72(8–9). P. 757–765.
Guldhe A., Singh P., Kumari S., Rawat I., Permaul K., Bux F. Biodiesel synthesis from microalgae using immobilized Aspergillus niger whole cell lipase biocatalyst // Renewable Energy. 2016. V. 85. P. 1002–1010.
Gupta G.N., Srivastava S., Khare S.K., Prakash V. Extremophiles: an overview of microorganism from extreme environment // Int. J. Agriculture, Environment & Biotechnol. 2014. V. 7(2). P. 371–380.
Hama S., Yamaji H., Fukumizu T., Numata T., Tamalampudi S., Kondo A., Noda H., Fukuda H. Biodiesel-fuel production in a packed-bed reactor using lipase-producing Rhizopus oryzae cells immobilized within biomass support particles // Biochem. Eng. J. 2007. V. 34. P. 273–278.
Hemachander C., Bose N., Puvanakrishnan R. Whole cell immobilization of Ralstonia pickettii for lipase production // Process Biochem. 2001. V. 36. P. 629–633.
Khanpanuek S., Lunprom S., Reungsang A., Salakkam A. Repeated-batch simultaneous saccharification and fermentation of cassava pulp for ethanol production using amylases and Saccharomyces cerevisiae immobilized on bacterial cellulose // Biochem. Eng. J. 2022. V. 177. 108258.
Koda R., Numata T., Hama S., Tamalampudi S., Nakashima K., Tanaka T., Ogino C., Fukuda H., Kondo A. Ethanolysis of rapeseed oil to produce biodiesel fuel catalyzed by Fusarium heterosporum lipase-expressing fungus immobilized whole-cell biocatalysts // J. Mol. Catal. B: Enzym. 2010. V. 66. P. 101–104.
Krulwich T.A., Liu J., Morino M., Fujisawa M., Ito M., Hicks D.B. Adaptive mechanisms of extreme alkaliphiles / In book: Extremophiles Handbook. Ed. K. Horikoshi. Springer, 2011. P. 119–139.
Kumar S., Karan R., Kapoor S., Singh S.P., Khare S.K. Screening and isolation of halophilic bacteria producing industrially important enzymes // Brazil. J. Microbiol. 2012. V. 43(4). P. 1595–1603.
Lόpez-Fernández J., Benaiges M.D., Valero F. Second- and third-generation biodiesel production with immobilised recombinant Rhizopus oryzae lipase: Influence of the support, substrate acidity and bioprocess scale-up // Biores. Technol. 2021. V. 334. 125233
Mageswari A., Subramanian P., Chandrasekaran S., Sivashanmugam K., Babu S., Gothandam K.M. Optimization and immobilization of amylase obtained from halotolerant bacteria isolated from solar salterns // J. Genet. Eng. Biotechnol. 2012. V. 10. P. 201–208.
Oda M., Kaieda M., Hama S., Yamaji H., Kondo A., Izumoto E., Fukuda H. Facilitatory effect of immobilized lipase-producing Rhizopus oryzae cells on acyl migration in biodiesel-fuel production // Biochem. Eng. J. 2005. V. 23. P. 45–51.
Oliveira A.F., Bastos R.G., de la Torre L.G. Bacillus subtilis immobilization in alginate microfluidic-based microparticles aiming to improve lipase productivity // Biochem. Eng. J. 2019. V. 143. P. 110–120.
Rakchai N., H-Kittikun A., Zimmermann W. The production of immobilized whole-cell lipase from Aspergillus nomius ST57 and the enhancement of the synthesis of fatty acid methyl esters using a two-step reaction // J. Mol. Catal. B: Enzym. 2016. V. 133. S128–S136.
Sarethy I.P., Saxena Y., Kapoor A., Sharma M., Sharma S.K., Gupta V., Gupta S. Alkaliphilic bacteria: applications in industrial biotechnology // J. Ind. Microbiol. Biotechnol. 2011. V. 38. P. 769–790.
Surendhiran D., Vijay M., Sirajunnisa A.R. Biodiesel production from marine microalga Chlorella salina using whole cell yeast immobilized on sugarcane bagasse // J. Environ. Chem. Eng. 2014. V. 2(3). P. 1294–1300.
Tamalampudi S., Talukder M.R., Hama S., Numata T., Kondo A., Fukuda H. Enzymatic production of biodiesel from Jatropha oil: A comparative study of immobilized-whole cell and commercial lipases as a biocatalyst // Biochem. Eng. J. 2008. V. 39. P. 185–189.
Taskin M., Ucar M.H., Unver Y., Kara A.A., Ozdemir M., Ortucu S. Lipase production with free and immobilized cells of cold-adapted yeast Rhodotorula glutinis HL25 // Biocatal. Agric. Biotechnol. 2016. V. 8. P. 97–103.
Verma N.K., Raghav N. Comparative study of covalent and hydrophobic interactions for α-amylase immobilization on cellulose derivatives // Int. J. Biol. Macromol. 2021. V. 174. P. 134–143.
Zaitsev S.Yu., Savina A.A., Zaitsev I.S. Biochemical aspects of lipase immobilization at polysaccharides for biotechnology // Adv. Colloid Interface Sci. 2019. V. 272. 102016.
Zhang L.Y., Wei D.Z., Tong W.Y. Effective inducers for lipase production by Candida rugosa // Ann. Microbiol. 2003. V. 53(4). P. 499–504.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


