Известия РАН. Серия биологическая, 2023, № 5, стр. 487-498
Кариологическое исследование изолированной популяции сосны обыкновенной (Pinus sylvestris) Ширинской степи Республики Хакасия
Т. С. Седельникова 1, *, А. В. Пименов 1, С. П. Ефремов 1
1 Институт леса им. В.Н. Сукачева СО РАН – обособленное подразделение ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, стр. 28, Россия
* E-mail: tss@ksc.krasn.ru
Поступила в редакцию 23.08.2022
После доработки 06.02.2023
Принята к публикации 26.02.2023
- EDN: TPRBUQ
- DOI: 10.31857/S1026347022600716
Аннотация
Представлены результаты кариологического исследования периферийной изолированной популяции сосны обыкновенной (Pinus sylvestris L.), произрастающей в Ширинской степи Хакасии. В семенном потомстве деревьев выявлены нарушения числа хромосом (миксоплоидия) и широкий спектр хромосомных перестроек, включая уникальные множественные аберрации. Впервые на популяционном уровне диагностирована максимально высокая для данного вида встречаемость геномных и хромосомных перестроек. Фактически все семенное потомство карышской популяции сосны обыкновенной является мутантным, что свидетельствует о вероятных адаптивных изменениях генотипов в условиях изоляции.
Краевые, или маргинальные популяции видов рода сосна (Pinus L.) занимают локальные территории на периферии ареалов и экологических границах распространения, приуроченных к высотно-поясным и интразональным ландшафтам. Существенное влияние на формирование генетической структуры маргинальных популяций сосен, обусловливающих различную степень их изоляции относительно насаждений из основной части ареалов, наряду с происхождением, оказывают пространственные, орографические, фенологические, фитоценотические барьеры (Санников, Петрова, 2007; Седельникова, 2014).
Географическая и экологическая обособленность периферийных популяций сосен увеличивает вероятность самоопыления деревьев и скрещивания между близкими генотипами, приводит к ограничению потока генов через пыльцу и семена (Милютин и др., 2013). Описаны генетические эффекты, связанные с изоляцией популяций сосен. Так, в маргинальных популяциях сосны Палласа (Pinus pallasiana D. Don) в горах юга Крыма и меловой формы сосны обыкновенной (Pinus sylvestris L. var. cretacea Kalenicz. ex Kom.) в степных районах востока Украины обнаружен избыток гомозиготных генотипов (Korshikov et al., 2007). В периферийных популяциях P. sylvestris, произрастающих на юге Сибири, а также на болотах центральной части Марийской низменности, выявлено большое количество уникальных и редких аллелей (Тихонова, Семериков, 2010; Гладков, Шейкина, 2019). Исследования, проведенные в изолятах сосны веймутовой (Pinus strobus L.) в регионе Северное Онтарио в Канаде показали, что они характеризуются существенно более низкими параметрами аллельного и генотипического разнообразия по сравнению с популяциями из центральной части ареала (Chhatre, Rajora, 2014). Генетическое своеобразие присуще также реликтовым популяциям P. sylvestris из островных боров Восточно-Европейской равнины и южной окраины Уральской горной страны (Рябухина и др., 2020).
Маргинальные популяции сосен имеют ряд кариологических и цитогенетических особенностей. Существенная изменчивость кариотипа по морфометрическим параметрам хромосом обнаружена между изолированными популяциями сосны черной (Pinus nigra Arn.), располагающимися на периферии ареала, и другими группами популяций этого вида в горных районах Болгарии, а также между репродуктивно обособленными болотными и суходольными популяциями P. sylvestris в Западной Сибири (Муратова, Седельникова, 1993; Naydenov et al., 2003). В периферийных популяциях P. sylvestris, произрастающих на юго-западной оконечности ареала (горы Португалии), южной границе произрастания и за ее пределами (сухие степи юга Сибири и Нижнего Поволжья), а также в условиях экологической изоляции (меловые субстраты Среднерусской возвышенности) выявлены цитогенетические аномалии (Сосна…, 1988; Седельникова, 2003; Буторина, Мозгалина, 2004; Машкина и др., 2012; Pavia, 2013; Седельникова, Пименов, 2021).
В отдельных работах, выполненных на объектах равнинной и горной территории Западной Сибири, прослежено совместное изолирующее влияние природной обстановки и факторов, связанных с хозяйственной деятельностью человека – мелиорации, рубок, рекреационной нагрузки, селекции – на генетическую структуру популяций сосен и цитогенетические признаки слагающих их деревьев (Пименов, Седельникова, 2006; Oreshkova et al., 2014, 2020). Дальнейшие исследования влияния естественной и антропогенной изоляции на лесные экосистемы с участием сосны представляется весьма актуальным, поскольку позволяют не только прослеживать микроэволюционные и адаптивные тренды в популяциях, но и прогнозировать риски снижения их биоразнообразия, изменения генофонда семенного потомства.
Целью настоящей работы, выполненной в контексте данной проблематики, является исследование числа хромосом, параметров кариотипа и хромосомных перестроек в изолированной экологически маргинальной популяции сосны обыкновенной в Ширинской степи Хакасии. Новизна проведенного исследования определяется уникальностью островного популяционного изолята P. sylvestris, произрастающего в экологически экстремальных лесорастительных условиях.
МАТЕРИАЛЫ И МЕТОДЫ
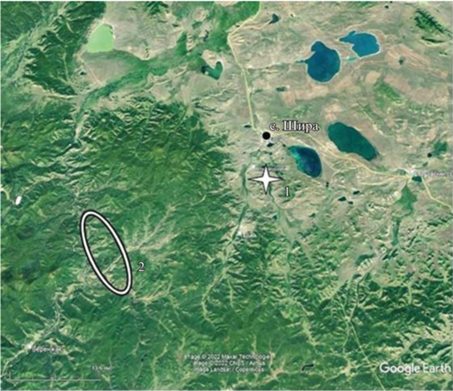
Исследованная популяция сосны обыкновенной расположена в Ширинском районе Республики Хакасия на остепненном склоне ступенчато-выпуклой формы горного обрамления левобережного сектора долины р. Карыш (54°24′33′′ с.ш. 89°59′11′′ в.д.), далее – популяция “Карыш” (рис. 1). Насаждение представляет собой сосняк низкотравно-мшистый пятнисто-мертвопокровный V класса бонитета, произрастающий на горном щебнисто-крупчатом мелкоземе. Средние таксационные показатели деревьев составляют: возраст – 109 лет, высота – 15.0 м, диаметр – 21.2 см. По своей структуре это разновозрастное, преимущественно редкостойное насаждение с примесью лиственницы сибирской (Larix sibirica Ledeb.) и березы повислой (Betula pendula Roth). Преобладают световые формы P. sylvestris с низкой кроной и сильно-сбежистой формой ствола, с большей частотой, по сравнению с крупными региональными популяциями, в насаждении представлены карликовые и полукарликовые морфотипы сосны и деревья с “ведьмиными метлами”.
Рис. 1.
Картографическая визуализация расположения популяции P. sylvestris “Карыш” (1) относительно ближайшей крупной видовой группировки естественного генезиса (2) в Ширинском районе Республики Хакасия.
Напочвенный покров развит слабо, доминируют мертвопокровные участки с мощным слоем опавшей хвои и шишек. Подлесок редкий, представлен Spiraea trilobata L., Spiraea chamaedryfolia L., Cotoneaster melanocarpus Fisch. ex Blytt, Caragana arborescens Lam., Caragana frutex (L.) C. Koch, Rosa acicularis Lindl. Основу разреженного травянистого яруса составляют ксерофитные и мезо-ксерофитные виды: Iris ruthenica Ker-Gawl., Pulsatilla patens (L.) Mill., Carex macroura Meinsh., Calamagrostis arundinacea (L.) Roth, Calamagrostis epigeios (L.) Roth, Poa stepposa (Kryl.) Roshev., Stipa capillata L., Helictotrichon schellianum (Hack.) Kitag., Woodsia glabella R. Br., Woodsia ilvensis (L.) R. Br. В мохово-лишайниковом ярусе господствует Aulacomnium turgidum (Wahlenb.) Schwägr., в дерновинках которого встречаются Polytrichum gracile Sm., Polytrichum strictum Sm., Cladonia deformis Hoffm., Cladonia fimbriata (L.) Fr.
В связи с хорошей инсоляцией для насаждения характерно обильное и регулярное семеношение, а также наличие жизнеспособного подроста, занимающего в основном расщелины скал и пологие участки с выраженным гумусовым горизонтом. Карышская популяция P. sylvestris – насаждение “островного” типа. Оно изолировано от ближайшей крупной группировки сосны естественного происхождения дистанционно (на расстояние около 30 км), фитоценотически (“буферными” древостоями лиственницы и березы) и орографически (сложно структурированными хребтово-долинными комплексами восточных отрогов Кузнецкого Алатау, с перепадами высот до 200–250 м) (рис. 1). Сочетание указанных факторов, блокирующих перенос пыльцы и семенного материала, определяет репродуктивную изоляцию популяции “Карыш”. Изолированное положение данной популяции сосны, сохраняющееся на протяжении длительного времени, усугубляется периодическими рубками и пожарами. Вследствие этого наилучшим состоянием отличаются группировки деревьев, произрастание которых приурочено к местам выхода гранитоидных пород на каменистых склонах с минимальным количеством травяно-подстилочного “горючего” материала.
Сбор семян осуществлялся в 2013 г., метеорологические параметры которого соответствуют среднемноголетним значениям климата по метеостанции с. Шира (http://www.pogodaiklimat.ru/ history/29756.htm). Семена проращивали в год их сбора (осенью 2013 г.) в чашках Петри, проростки обрабатывали 1% р-ром колхицина в течение 4–6 ч, после промывания производили их фиксацию спиртово-уксусной смесью (3 : 1), хранили в холодильнике при постоянной температуре от +3 до +5°С.
Для кариологического анализа при изготовлении временных (“давленых”) препаратов применялась методика Л.Ф. Правдина с соавторами (1972), с собственными модификациями. Хранившиеся с момента фиксации 1% р-ром колхицина (C22H25NO6) в холодильнике проростки извлекались из спиртово-уксусной смеси (3 : 1) и подвергались окрашиванию 1% р-ром ацетогематоксилина (C16H14O6). Для приготовления красителя 1 г сухого гематоксилина растворяли в 50 мл дистиллированной воды путем нагревания на водяной бане. После отстаивания раствора в него добавлялась “ледяная” уксусная кислота до нужного объема. В каждом из циклов окрашивания 5–6 корешков погружались вначале в 4% водный р-р железоаммонийных квасцов (FeNH4(SO4)2 ⋅ 12H2O) на 5–10 мин (до изменения окраски апикального участка корешка), а затем помещались в приготовленный краситель и выдерживались в течение 15–20 мин. Затем на предметном стекле от исследуемого корешка отрезался апикальный участок не более 3–5 мм длины и сразу же помещался в каплю 60% р-ра хлоралгидрата (C2H3Cl3O2), применяемого в целях просветления и мацерации препарата. В течении 2–5 мин препарат раздавливался под покровным стеклом с помощью деревянной палочки и стального шпателя. Для удаления излишней влаги с препарата использовалась фильтровальная бумага. Препараты просматривали под микроскопом Axiostar plus (Carl Zeiss), с применением системы формирования изображений AxioVision. Метафазные пластинки фотографировали в иммерсионной системе (окуляр ×10, объектив ×90).
Всего было изучено 60 корневых меристем и 1508 клеток – популяционная выборка, полученная при проращивании семян, собранных методом путем случайной выборки с 50 деревьев различной селекционной ценности (по 5–10 шишек с каждого дерева), расположенных по трансекте от подножия до вершины горной гряды, включающей основные варианты почвенно-гидрологических и фитоценотических разностей.
Для измерения фотографировали в 30 препаратах (каждый препарат – один проросток) по одной метафазной пластинке с полным набором, хорошим разбросом и сходной степенью спирализации хромосом. В дальнейшем из сформированного пула метафазных пластинок для статистического анализа хромосомных параметров были выбраны 10 пластинок по модальному классу, в соответствии со значениями общей длины хромосомных наборов (∑ La, мкм), укладывающихся в интервале спирализации x ± 1σ. Измерялись: длина длинного (L, µm) и короткого (S, µm) плеч каждой хромосомы набора. Определялись: абсолютная длина каждой хромосомы набора, С (С = L + S, µm); длина хромосом гаплоидного набора, LHC (LHC = ΣС/2, µm); относительная длина каждой хромосомы набора, (C/длина гаплоидного набора ×100, %); центромерный индекс каждой хромосомы набора, CI (CI = S/C × 100, %); соотношение плеч, или arm ratio, r (r = L/S, %). Размеры хромосом, с учетом их абсолютной длины, оценивались по классификации А. Lima-de-Faria (1980): мелкие (<4 µm), средние (4–12 µm), длинные (>12 µm). Выявление гомологов и определение типов хромосом проводили по стандартной номенклатуре (Levan et al., 1964) на основе положения центромеры в соответствии со значениями показателей центромерного индекса (CI) и соотношения плеч (r): метацентрические (m) (r = 1.01–1.69, CI = 37.5–50.0), субметацентрические (sm) (r = 1.70–2.99, CI = 37.5–25.0), субтелоцентрические (st) (r = 3.00–6.99, CI = 25.0–12.5), телоцентрические (t) (r > 7, CI < 12.5).
Хромосомные перестройки анализировали на стадии метафазы митоза, учитывая их спектр и частоту встречаемости в пересчете на число исследованных корневых меристем и клеток (шт./%).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Диплоидный набор семенного потомства сосны обыкновенной из популяции “Карыш” включает 24 хромосомы (2n = 2х = 24). Основная часть, или 93.3% исследованных проростков семян является миксоплоидами, содержащими, наряду с диплоидными, клетки с кратно увеличенным числом хромосом – триплоидные (2n = 3х = 36) и тетраплоидные (2n = 4х = 48), а также клетки с измененным не кратно гаплоидному набору числом – анеуплоидные (2n = 27; 2n = 42). Нарушения числа хромосом наблюдались примерно в каждой десятой клетке миксоплоидных проростков. Наиболее часто встречались проростки с тетраплоидными клетками, c меньшей частотой – проростки, имеющие одновременно тетраплоидные и триплоидные клетки, а также проростки с триплоидными клетками. Единично отмечены проростки, в которых совместно присутствовали тетраплоидные, триплоидные и анеуплоидные клетки (табл. 1). На рис. 2 представлены микрофотографии метафазных клеток P. sylvestris с различным числом хромосом.
Таблица 1.
Изменчивость числа хромосом, встречаемость и спектр хромосомных перестроек у Pinus sylvestris в популяции ”Карыш”
| Число изученных корневых меристем/клеток, шт. | 60/1508 | ||
| Число корневых меристем с измененным числом хромосом, шт./% | 56/93.3 | ||
| Число клеток с измененным числом хромосом, шт./% | 163/10.8 | ||
| Хромосомный набор корневых меристем, шт./% | 2n = 24 | 4/6.7 | |
| 2n = 24; 36 | 13/21.6 | ||
| 2n = 24; 48 | 24/40.0 | ||
| 2n = 24; 36; 48 | 17/28.3 | ||
| 2n = 24; 27; 48 | 1/1.7 | ||
| 2n = 36; 42; 48 | 1/1.7 | ||
| Число корневых меристем с хромосомными перестройками шт./% | 48/80.0 | ||
| Число и спектр хромосомных перестроек в метафазных клетках, шт./% | Всего | 153/10.1 | |
| В том числе | Кольцевые хромосомы | 75/5.0 | |
| “надетые” кольцевые хромосомы | 13/0.8 | ||
| Ацентрические кольца | 10/0.6 | ||
| Полицентрические хромосомы | 10/0.6 | ||
| Фрагменты | 24/1.7 | ||
| Множественные нарушения | 21/1.4 | ||
Рис. 2.
Метафазные пластинки с различным числом хромосом в популяции P. sylvestris “Карыш”: (a) 2n = 24; (б) 2n = 36; (в), (г) 2n = 48; (д), (е) 2n = 48 и фрагмент 2n = 24. Масштабная линейка – 10 µm.

Одновременное присутствие клеток разного уровня плоидности в тканях обусловливается соматической редукцией хромосом, их неразъединением, элиминацией, удвоением и другими причинами (Буторина, 1989). Как и в популяции “Карыш”, миксоплоидия и другие формы изменчивости числа хромосом встречаются в популяциях сосны обыкновенной, произрастающих на границах ареалов и экологических пределах распространения. В семенном потомстве деревьев с наростами, опухолями, полукарликов и некоторых типичных особей, произрастающих в Центральной Якутии, Южном Забайкалье и Тыве, встречались миксоплоиды (2n = 24, 36 и 24, 48), гипо- и гиперанеуплоиды (с 2n = 22 и 28). У сосны обыкновенной в Южном Забайкалье миксоплоидия (2n = 24, 48) отмечалась не только в потомстве, но и у материнских растений. В репродуктивно изолированной болотной популяции P. sylvestris в Западной Сибири миксоплоидия (2n = 24, 36 и 24, 48) была обнаружена у деревьев с “ведьминой метлой”. У сосны обыкновенной, растущей за южным пределом ареала в Нижнем Поволжье, миксоплоиды (2n = 24, 36; 24, 48 и 24, 36, 48) выявлялись в потомстве типичных деревьев (Муратова, Седельникова, 2004; Sedelnikova et al., 2011; Машкина и др., 2012).
Предполагается, что миксоплоидия является одним из основных факторов, повышающих адаптивный потенциал растений, в том числе древесных, в неблагоприятных условиях среды (Буторина, 1989; Кунах, 2011). Онтогенетические вариации числа хромосом в соматических клетках способны влиять на репродуктивные свойства растений. Сочетание клеток различной плоидности у миксоплоидных растений приводит к изменению дозы генов, усилению пластичности их генома, обеспечению генетического разнообразия потомства (Кунах, 2011).
Проанализированы параметры хромосом карышской популяции сосны обыкновенной. Установлено, что в ее кариотипе содержится одиннадцать пар (I–XI) длинных хромосом, абсолютная длина (С) которых варьирует от 12.8 до 16.9 µm, относительная длина – от 3.3 до 4.4%, и одна пара (XII) хромосом среднего размера, абсолютная длина (С) которых составляет 11.5 µm, относительная длина – 3.0%. Суммарная длина гаплоидного набора хромосом (LHC) составляет 191.0 ± 3.08 µm. В соответствии с параметрами центромерного индекса (CI) и соотношения плеч (r), изменяющимися соответственно от 41.9 до 48.2% и от 1.1 до 1.4%, все хромосомы относятся к метацентрическому типу. Девять пар (I–IX) длинных симметричных хромосом образуют единую группу, две пары (X и XI) более асимметричных длинных и одна пара (XII) асимметричных средних хромосом идентифицируются индивидуально. Морфометрическая характеристика хромосом карышской популяции P. sylvestris приведена в табл. 2. Размеры и морфологические типы хромосом у P. sylvestris из популяции “Карыш” соответствуют параметрам, установленным для данного вида.
Таблица 2.
Морфометрические параметры хромосом Pinus sylvestris в популяции “Карыш”
| Номера хромосом | Абсолютная длина, C |
Относительная длина |
Центромерный индекс, CI | Соотношение плеч, r |
||||
|---|---|---|---|---|---|---|---|---|
| x ± mx, µm | CV, % | x ± mx, % | CV, % | x ± mx, % | CV, % | x ± mx, % | CV, % | |
| I–IX | 16.9 ± 0.11 | 8.8 | 4.4 ± 0.02 | 7.3 | 48.2 ± 0.12 | 3.3 | 1.1 ± 0.01 | 6.7 |
| X | 14.1 ± 0.22 | 6.9 | 3.7 ± 0.06 | 6.8 | 45.7 ± 0.55 | 5.4 | 1.2 ± 0.03 | 10.3 |
| XI | 12.8 ± 0.17 | 5.9 | 3.3 ± 0.03 | 4.7 | 42.7 ± 0.33 | 3.5 | 1.3 ± 0.02 | 6.5 |
| XII | 11.5 ± 0.21 | 8.3 | 3.0 ± 0.05 | 7.2 | 41.9 ± 0.42 | 4.5 | 1.4 ± 0.02 | 7.9 |
По литературным данным, диплоидный набор сосны обыкновенной из различных условий произрастания включает 12 пар хромосом метацентрического типа, длина которых составляет примерно 10–18 µm. Три пары (X–XII) более коротких метацентрических хромосом в разных наборах в той или иной степени сдвинуты в сторону субметацентричности (Сосна…, 1988; Muratova, 1997; Kalashnik, Starova, 1997; Муратова, Седельникова, 2004; и др.). В маргинальных популяциях сосны обыкновенной размеры хромосом могут уменьшаться. Один из ее подвидов, сосна лапландская (P. sylvestris L. subsp. lapponica Fries), произрастающая на крайней северной границе распространения, а также болотная форма (P. sylvestris L. f. nana Pallas) отличаются мелкими размерами хромосом – 8–12 µm (Абатурова, Вишняков, 1980; Муратова, Седельникова, 1993). Возможно, что уменьшение длины хромосом болотной формы сосны связано с перестройками районов ядрышковых организаторов, предположительно, хромосомными транслокациями (Муратова, Седельникова, 2004).
В карышской популяции сосны обыкновенной выявлены разнообразные хромосомные перестройки, встречавшиеся примерно в 80.0% проростков семян в каждой десятой клетке (табл. 1). По характеру нарушений в основном наблюдались кольцевые структуры различного диаметра и морфологии – кольца с центромерой (кольцевые хромосомы) и ацентрические кольца, не имеющие центромеры. Иногда совместно встречались кольцевые хромосомы и кольца, “надетые” на обычную хромосому, двойные кольца, а также одновременно две или три кольцевые структуры в одной клетке. С меньшей частотой встречаемости обнаружены хромосомы, имеющие несколько центромер – полицентрические (дицентрические, трицентрические), а также хроматиновые фрагменты крупных и мелких размеров. При наличии одной или нескольких кольцевых хромосом число хромосом не изменялось, оставаясь равным 2n = 24. В том случае, когда присутствовали дицентрическая или трицентрическая хромосомы, число хромосом составляло, соответственно, 2n = 23 или 2n = 22 (при этом общее количество центромер оставалось всегда равным 24).
В некоторых клетках наблюдались сложные (множественные) хромосомные перестройки, включающие одновременно несколько типов аномалий. Множественные перестройки представлены кольцевыми структурами, встречающимися совместно с хромосомами, “скрученными в узел”, дицентрическими или трицентрическими хромосомами, фрагментами, а также кольцевыми хромосомами, “надетыми” на дицентрические хромосомы, дицентрическими и трицентрическими хромосомами с фрагментами. На рис. 3, 4 приведены микрофотографии некоторых хромосомных нарушений, выявленных в популяции сосны обыкновенной “Карыш”. Сочетание и морфологическое проявление хромосомных аномалий, составляющих множественные перестройки, в каждом конкретном случае уникальны.
Рис. 3.
Хромосомные перестройки в популяции P. sylvestris “Карыш”: (а)–(г) – кольцевые хромосомы различного диаметра; (д) – кольцевая хромосома и “надетая” кольцевая хромосома; (е) – “надетая” кольцевая хромосома; (ж) – двойное кольцо; (з) – крупный хроматиновый фрагмент; (и), (к) – фрагменты; (л) – два фрагмента; (м) – дицентрическая хромосома. Масштабная линейка – 10 µm. Хромосомные перестройки указаны стрелками.

Рис. 4.
Множественные мутации (состоящие более чем из одного типа хромосомных перестроек) в популяции P. sylvestris “Карыш”: (а) – “надетая” на дицентрическую хромосому кольцевая хромосома; (б) – кольцевая хромосома и “скрученная в узел” хромосома; (в) – кольцевая хромосома и фрагмент; (г) – кольцевая хромосома и четыре фрагмента; (д) – дицентрическая хромосома и два фрагмента; (е) – трицентрическая хромосома и ацентрическое кольцо; (ж) – кольцевая хромосома малого диаметра и два фрагмента; (з) – трицентрическая хромосома и фрагмент; (и) – дицентрическая хромосома и фрагмент. Масштабная линейка – 10 µm. Хромосомные перестройки указаны стрелками.

Хромосомные перестройки свидетельствуют о наличии крупных структурных мутаций хромосом. Как правило, полицентрические хромосомы диагностируют перицентрическую инверсию, затрагивающую разные плечи хромосомы, кольцевые хромосомы – делеции теломерных участков с последующим соединением плеч в кольцо и формированием дистальных ацентрических фрагментов (у ацентрических колец замыкающийся в кольцо фрагмент не имеет центромеры). “Надетость” кольцевых хромосом является своеобразной формой структурной изменчивости хромосом и служит одним из прямых доказательств соматического кроссинговера (Дубинин, 1986; Коряков, Жимулев, 2009). Такие хромосомные перестройки, как ацентрические кольца и фрагменты, у сосны обыкновенной элиминируются в процессе клеточных делений. Кольцевые хромосомы могут проходить через митоз (Сосна…, 1988).
Многими авторами описаны различные типы хромосомных аномалий в маргинальных популяциях сосен. У P. sylvestris на северной границе произрастания в Центральной Якутии найдены мелкие и крупные ацентрические кольца, кольцевые хромосомы с фрагментами и без фрагментов, кольцевая хромосома 8-образной конфигурации, “надетые” кольцевые хромосомы, полицентрические и асимметричные (субакро- или акроцентрические) хромосомы, фрагменты, а также сложные мутации. В популяциях P. sylvestris, локализованных на южной границе ареала (Воронежская область, Хакасия, Тыва, юг Красноярского края, Южное Забайкалье) и за его пределами (Волгоградская область), выявлены кольцевые хромосомы, ацентрические кольца, “надетые” кольцевые хромосомы, полицентрические хромосомы, остаточные ядрышки в метафазе, микроядра, фрагменты, множественные нарушения, а также ана-телофазные аномалии митоза – отставание, забегание и неравномерное расхождение хромосом, мосты (Сосна…, 1988; Muratova, 1997; Седельникова, 2003, 2014; Муратова, Седельникова, 2004; Машкина и др., 2012; Пардаева и др., 2017; Седельникова, Пименов, 2021).
В изолированной популяции сосны обыкновенной “Рибера дас Неграс” в Португалии, произрастающей в горах Серра-ду-Жереш на юго-западном пределе распространения, встречалось одновременно до трех типов хромосомных аберраций – кольцевых хромосом, фрагментов, а также полицентрических хромосом. Множественные хромосомные перестройки рассматриваются как характерные именно для периферийных популяций P. sylvestris (Pavia, 2013).
Несмотря на распространенность цитогенетических аномалий у сосен на периферии произрастания, с такой высокой частотой, как в карышской популяции P. sylvestris, на популяционном уровне они не выявлялись. По данным табл. 1, около 98% проростков семян карышской популяции сосны имеют нарушения числа хромосом и/или хромосомные перестройки. Ранее лишь у единичных карликовых особей сосны обыкновенной на южной окраине ареала в Южном Забайкалье были отмечены аномалии хромосом в 80–100% проростков (Сосна…, 1988).
При цитогенетическом исследовании P. sylvestris было установлено, что хромосомные мутации приводят к неравномерному распределению хромосом между дочерними клетками, потере генетического материала, возникновению анеуплоидии, повышению гетерогенности клеточных линий и другим последствиям (Машкина и др., 2012). Некоторые хромосомные повреждения “жесткого типа” (С-митоз, пульверизация и агглютинация хромосом), выявленные у сосны обыкновенной в условиях радиоактивного загрязнения в зоне Чернобыльской АЭС, являются летальными (Butorina, Evstratov, 1996). Хромосомные перестройки могут вызывать видимые изменения фенотипа и нарушение развития растений. Хромосомные мутации и другие цитогенетические аномалии наиболее часто наблюдались в популяциях P. sylvestris у деревьев, имеющих плакучую форму кроны, наросты, “ведьмины метла”, карликовых и полукарликовых (Седельникова, Муратова, 1999; Седельникова, 2003; Сосна…, 1988; Машкина и др., 2012). Массово такие формы деревьев встречаются только в маргинальных популяциях сосен, в экстремальных для их произрастания условиях.
Возможно, что некоторые хромосомные перестройки имеют адаптивное значение и благодаря этому распространяются в отдельных популяциях растений (Бадаева, Салина, 2013). Возникающие под воздействием неблагоприятных факторов хромосомные аберрации в популяциях P. sylvestris приводят к перераспределению наследственной информации между хромосомами, увеличению диапазона нормы реакции растений, мобилизации дополнительного резерва их изменчивости (Машкина и др., 2012). Геномные и хромосомные перестройки различного типа в маргинальных насаждениях сосны обыкновенной свидетельствуют о повышении уровня генетической изменчивости семенного потомства в неблагоприятных условиях произрастания. При этом случайно появившаяся адаптивная мутация имеет больше шансов закрепиться в изолированной популяции.
Возможно, что некоторые хромосомные перестройки имеют адаптивное значение и благодаря этому распространяются в отдельных популяциях растений (Бадаева, Салина, 2013). Хромосомные перестройки имеют различное значение для эволюционной динамики геномов хвойных в экстремальных условиях их произрастания. Считается, что эволюция генома видов семейства Pinaceae сопровождается в основном двумя типами хромосомных перестроек – инверсиями и реципрокными транслокациями (Puizina et al., 2008). Хромосомные перестройки типа инсерций и дупликаций провоцируются мобильными генетическими элементами, возрастание активности которых в экстремальных условиях может играть адаптивную роль (Feschotte et al., 2007). Возникающие под воздействием неблагоприятных факторов хромосомные аберрации в популяциях P. sylvestris приводят к перераспределению наследственной информации между хромосомами, увеличению диапазона нормы реакции растений, мобилизации дополнительного резерва их изменчивости (Машкина и др., 2012). Вероятно, возникновение хромосомных перестроек различного типа и их высокая концентрация в насаждениях сосны обыкновенной, произрастающих в условиях изоляции и экологической экстремальности, может рассматриваться как мера их генетического разнообразия и отражать определенную степень экологической пластичности. При этом случайно появившаяся адаптивная мутация имеет больше шансов закрепиться в изолированной популяции.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что обособленная популяция сосны обыкновенной “Карыш”, произрастающая в Ширинской степи Хакасии, характеризуется высокой генетической нестабильностью. К общим признакам, присущим карышской популяции P. sylvestris и другим, ранее изученным периферийным популяциям данного вида, относится широкий спектр геномных и хромосомных перестроек, включая множественные аберрации. Специфической особенностью, отличающей карышскую популяцию сосны обыкновенной, является максимально высокая встречаемость нарушений числа хромосом (миксоплоидии) и хромосомных перестроек: фактически все семенное потомство деревьев является мутантным. Индуцирование геномных и хромосомных перестроек в семенном потомстве деревьев, по всей вероятности, происходит под воздействием комплекса факторов. В их числе: сухость и бедность, свойственная горным щебнисто-крупчатым мелкоземам остепненных ландшафтов; пространственно-, фитоценотически- и орографически-обусловленная репродуктивная изоляция насаждения от других популяций; антропогенное стресс-воздействие вследствие периодических рубок и пожаров. Появление мутантных растений (рассматриваемых на уровне проростков, содержащих генетически различные группы клеток) свидетельствует об изменениях генетической структуры карышской популяции сосны обыкновенной и ее дифференциации. Геномные и хромосомные перестройки, наряду с высокой элиминацией их носителей, вероятно, приводят к формированию адаптированных генотипов, сохраняющих способность к выживанию и воспроизведению, повышают устойчивость популяции в условиях ее изоляции.
Финансирование. Работа выполнена в рамках государственного задания ФИЦ КНЦ СО РАН по теме “Функционально-динамическая индикация биоразнообразия лесов Сибири” № 0287-2021-0009.
Список литературы
Абатурова Г.А., Вишняков А.А. Кариотип лапландской сосны // Цитология и генетика. 1980. Т. 14. № 4. С. 36–40.
Бадаева Е.Д., Салина Е.А. Структура генома и хромосомный анализ растений // Вавиловский журн. генетики и селекции. 2013. Т. 17. № 4/2. С. 1017–1043.
Буторина А.К. Факторы эволюции кариотипов древесных // Успехи соврем. биол. 1989. Т. 108. Вып. 3(6). С. 342–357.
Буторина А.К., Мозгалина И.Г. Особенности цитогенетических показателей сосны меловой и сосны обыкновенной // Экология. 2004. № 3. С. 185–189.
Гладков Ю.Ф., Шейкина О.В. Генетический полиморфизм деревьев сосны обыкновенной из смежных болотной и суходольной ценопопуляций по ядерным микросателлитным локусам // Вестник ПГТУ. 2019. Т. 44. № 4. С. 70–79. https://doi.org/10.25686/2306-2827.2019.4.70
Дубинин Н.П. Общая генетика. 3-е изд. М.: Наука, 1986. 560 с.
Коряков Д.Е., Жимулев И.Ф. Хромосомы. Структура и функции. Новосибирск: Изд-во СО РАН, 2009. 258 с.
Кунах В.А. Пластичность генома соматических клеток и адаптивность растений // Молекулярная и прикладная генетика. 2011. Т. 12. С. 7–14.
Машкина О.С., Тихонова И.В., Муратова Е.Н., Мурая Л.С. Цитогенетические особенности семенного потомства карликовых сосен на юге Восточной Сибири // Хвойные бореальной зоны. 2012. Т. ХХХ. № 1–2. С. 127–135.
Милютин Л.И., Новикова Т.Н., Тараканов В.В., Тихонова И.В. Сосна степных и лесостепных боров Сибири. Новосибирск: ГЕО, 2013. 127 с.
Муратова Е.Н., Седельникова Т.С. Кариологическое исследование болотных и суходольных популяций сосны обыкновенной (Pinus sylvestris L.) // Экология. 1993. № 6. С. 41–50.
Муратова Е.Н., Седельникова Т.С. Геномные и хромосомные мутации у сосны обыкновенной (Pinus sylvestris L.) в экстремальных условиях произрастания // Хвойные бореальной зоны. 2004. Вып. 2. С. 128–140.
Пардаева Е.Ю., Машкина О.С., Попов В.Н. Состояние генеративной сферы Pinus sylvestris L. по данным цитогенетического анализа в условиях изменяющегося климата на территории Воронежской области // Сибир. экол. журн. 2017. № 3. С. 313–320. https://doi.org/10.15372/SEJ20170308
Пименов А.В., Седельникова Т.С. Аномалии митоза в проростках Pinus sylvestris (Pinaceae) на евтрофном осушенном болоте // Ботан. журн. 2006. Т. 91. № 10. С. 1537–1544.
Правдин Л.Ф., Бударагин В.А., Круклис М.В., Шершукова О.П. Методика кариологического изучения хвойных пород // Лесоведение. 1972. № 2. С. 67–75.
Рябухина М.В., Калякина Р.Г., Фризен Н.В. Молекулярно-генетические исследования популяций Pinus sylvestris L. на примере Восточно-Европейской равнины и южной окраины Уральской горной страны // Turczaninowia. 2020. Т. 23. № 1. С. 116–125. https://doi.org/10.14258/turczaninowia.23.1.12
Санников С.Н., Петрова И.В. Феногеография популяций древесных растений: проблемы, методы и некоторые итоги // Хвойные бореальной зоны. 2007. Т. XXIV. № 2–3. С. 288–296.
Седельникова Т.С. Хромосомные и геномные мутации у сосны обыкновенной в Нижнем Поволжье // Лесоведение. 2003. № 6. С. 28–33.
Седельникова Т.С. Дифференциация популяций видов семейства Pinaceae в экосистемах лесных болот и суходолов Западной Сибири // Сибирский лесной журн. 2014. № 1. С. 93–103.
Седельникова Т.С., Муратова Е.Н. Цитологическое изучение сосны обыкновенной типа “ведьмина метла” на болоте // Цитология. 1999. Т. 41. № 12. С. 1082.
Седельникова Т.С., Пименов А.В. Изменчивость числа хромосом и хромосомные перестройки у Pinus sylvestris (Pinaceae) в засушливых условиях Нижнего Поволжья и Южной Сибири // Ботан. журн. 2021. Т. 106. № 4. С. 353–362. https://doi.org/10.31857/S0006813621040116
Сосна обыкновенная в Южной Сибири / Отв. ред. Милютин Л.И. Красноярск: Изд-во ИЛиД СО АН СССР, 1988. 150 с.
Тихонова И.В., Семериков В.Л. Генетический полиморфизм карликовых сосен на юге Средней Сибири // Экология. 2010. № 5. С. 330–335.
Butorina A.K., Evstratov N. The first detected case of amitosis in pine // Forest Genetics. 1996. V. 3. № 3. P. 137–139.
Chhatre V.E., Rajora O.P. Genetic divergence and signatures of natural selection in marginal populations of a Keystone, Long-Lived Conifer, Eastern white pine (Pinus strobus) from Northern Ontario // PLoS ONE. 2014. V. 9(5). P. e97291.
Feschotte C., Pritham E.J. DNA transposons and the evolution of eukaryotic genomes // Annu. Rev. Genet. 2007. V. 41. P. 331–336. https://doi.org/10.1146/annurev.genet.40.110405.090448
Kalashnik N., Starova N. Karyotype variability of Scots pine (Pinus sylvestris L.) in Ural mountain populations // Cytogenetic studies of forest trees and shrub species: contributions by members of the IUFRO Cytogenetics Working Party / Eds. Borzan Z., Schlarbaum S.E. Zagreb: Hrvatske sume, 1997. P. 131–147.
Korshikov I.I., Pirko N.N., Mudrik E.A., Pirko Ya.V. Maintenance of genetic structure in progenies of marginal mountainous and steppe populations of three species of Pinaceae Lindl. family in Ukraine // Silvae Genetica. 2007. V. 56. № 1. P. 1–10. https://doi.org/10.1515/sg-2007-0001
Levan A., Fredga K., Sandberg A.A. Nomenclature for centromeric position on chromosomes // Hereditas. 1964. V. 52. P. 201–220.
Lima-de-Faria A. Classification of genes, rearrangements and chromosomes according to the chromosome field // Hereditas. 1980. V. 93. P. 1–46.
Muratova E.N. Cytogenetical study of Scots pine (Pinus sylvestris L.) in the Central Yakutia // Cytogenetic studies of forest trees and shrub species: contributions by members of the IUFRO Cytogenetics Working Party / Eds. Borzan Z., Schlarbaum S.E. Zagreb: Hrvatske sume, 1997. P. 157–177.
Naydenov K., Tremblay F., Ganchev P. Karyotypic diversity in European black pine (Pinus nigra Arn.) from Bulgarian provenances // Phyton. 2003. V. 43. Fasc. 1 9–28 21. 7.
Oreshkova N.V., Sedel’nikova T.S., Pimenov A.V., Efremov S.P. Analysis of genetic structure and differentiation of the bog and dry land populations of Pinus sibirica Du Tour based on nuclear microsatellite loci // Russian J. Genetics. 2014. V. 50. № 9. P. 934–941. https://doi.org/10.1134/S1022795414090105
Oreshkova N.V., Sedel’nikova T.S., Efremov S.P., Pimenov A.V. Genetic polymorphism of Siberian stone pine (Pinus sibirica Du Tour) in Kuznetsk Alatau // Contemporary Problems of Ecology. 2020. V. 13. № 6. P. 569–576. https://doi.org/10.1134/S1995425520060116
Pavia I.M.M. Molecular and cytogenetic characterization of Pinus sylvestris L. populations. Dissertação de Mestrado em Genética Molecular Comparativa e Tecnológica. Universidade de Trás-os-Montes e Alto Douro. 2013. 102 p.
Puizina J., Sviben T., Krajačić-Sokol I. et al. Cytogenetic and molecular characterization of the Abies alba genome and its relationship with other members of the Pinaceae // Plant Biol. 2008. № 10. P. 256–267. https://doi.org/10.1111/j.1438-8677.2007.00018.x
Sedel’nikova T.S., Muratova E.N., Pimenov A.V. Variability of chromosome numbers in Gymnosperms // Biology bulletin reviews. 2011. V. 1. № 2. P. 100–109. https://doi.org/10.1134/S2079086411020083
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


