Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1611-1616
Новые технологии с применением ультракоротких лазерных импульсов для вспомогательных репродуктивных технологий
И. В. Ильина 1, *, Ю. В. Храмова 2, М. А. Филатов 2, А. Д. Иванова 2, Д. С. Ситников 1
1 Федеральное государственное бюджетное учреждение науки
Объединенный институт высоких температур Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, Биологический факультет
Москва, Россия
* E-mail: ilyina_inna@mail.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Представлены разработанные с применением лазеров ультракороткой длительности технологии для репродуктивной медицины: технология лазерной гравировки кода на защитной оболочке эмбрионов для их идентификации на преимплантационных сроках развития, а также технология вспомогательного лазерного хэтчинга на стадии ранней бластоцисты для инициирования процесса вылупления эмбриона из блестящей оболочки в заданном месте.
ВВЕДЕНИЕ
Лазерные источники излучения давно стали неотъемлемыми диагностическими и терапевтическими инструментами в различных областях медицины. Не являются исключением и вспомогательные репродуктивные технологии (ВРТ) – относительно молодое, но активно развивающееся направление медицины, основной целью которого является решение проблемы бесплодия у супружеских пар. В ВРТ лазеры применяются для воздействия как на мужские, так и на женские половые клетки [1]. В первом случае лазерные источники используют для повышения двигательной активности сперматозоидов [2, 3] или их иммобилизации перед выполнением интрацитоплазматической инъекции сперматозоида [4, 5]. Во втором случае лазеры используют в основном для микрохирургии прозрачной оболочки яйцеклетки/эмбриона [6, 7] или отдельных микрохирургических манипуляций с клетками эмбриона (например, при биопсии трофэктодермы эмбриона) [8, 9].
В настоящей работе представлены новые технологии, направленные на повышение эффективности и безопасности существующих методик ВРТ, за счет применения лазерных источников излучения ультракороткой длительности для микрохирургии блестящей оболочки яйцеклеток или преимплантационных эмбрионов. Первая из разработанных технологий заключается в воздействии ультракороткими импульсами (УКИ) на блестящую оболочку яйцеклетки/эмбриона для формирования на ней микронадрезов в форме буквенно-цифрового кода, что позволяет легко идентифицировать каждый эмбрион в период его преимплантационного развития и исключить риск выбора не того эмбриона при осуществлении переноса в полость матки.
Вторая технология также заключается в лазерной микрохирургии блестящей оболочки, но уже на более поздних сроках преимплантационного развития (на стадии бластоцисты), когда происходит дифференцировка клеток, и формируются внутренняя клеточная масса (ВКМ) и трофобласт. Четко определяемая локализация ВКМ на этой стадии позволяет формировать отверстие в оболочке именно в том месте, которое является наиболее предпочтительным, и таким образом управлять началом и местом процесса вылупления эмбриона. Так, вылупление “трофобластом вперед” предпочтительно, когда для проведения предимплантационной генетической диагностики необходимо отобрать небольшое количество клеток трофэктодермы (т.е. провести биопсию). Таким образом, разрабатываемую технологию можно назвать технологией управляемого лазерного хэтчинга.
Сама технология формирования отверстия в оболочке эмбриона с целью облегчения его вылупления не нова и в зарубежной литературе обозначается термином laser-assisted hatching (вспомогательный лазерный хетчинг) [10]. Однако в большинстве случаев данная процедура выполняется на ранних сроках развития (стадии дробления), когда между клетками эмбриона и блестящей оболочкой имеется достаточно свободного пространства, чтобы исключить риск возможных тепловых повреждений эмбриона при лазерной диссекции оболочки импульсами милли- или микросекундной длительности [6, 11, 12]. Именно лазерные системы на основе диодных лазеров, генерирующих излучение на длине волны 1.48 мкм с длительностью импульсов от сотен микросекунд до нескольких миллисекунд, наиболее широко распространены в клиниках репродуктивной медицины за счет своей относительно невысокой стоимости и простоты в использовании.
Благодаря предельной локализации УКИ во времени и пространстве, их применение для микрохирургии живых биологических объектов существенно снижает риск тепловых повреждений и позволяет проводить на эмбрионах такие микрохирургические процедуры, выполнение которых с помощью милли- и микросекундных лазерных систем было невозможно. Эффективность лазерных источников излучения ультракороткой длительности была ранее продемонстрирована для энуклеации яйцеклеток [13], слияния бластомеров [14, 15] и биопсии эмбрионов [16, 17]. Представленные в настоящей статье разработки дополняют широкий спектр технологий, применяющих УКИ, для эмбриональной микрохирургии.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
Ключевыми элементами экспериментального стенда для проведения эмбриональной микрохирургии является фемтосекундный иттербиевый лазер “ТЕТА” (ООО “Авеста”, Россия), инвертированный микроскоп Olympus IX-71 и блок сопряжения, в котором осуществляется управление параметрами лазерного излучения и режимами облучения. Фото и схема экспериментальной установки показаны на рис. 1. Лазерный источник генерирует лазерные импульсы длительностью 280 фс с энергией 100 мкДж на длине волны λ = 1028 нм и частотой следования до 5 кГц. Для лазерной микрохирурги было решено использовать излучение второй гармоники (λ = 514 нм). Во-первых, выбранная длина волны попадает в окно прозрачности воды, что минимизирует линейное поглощение при распространении в водной среде. Во-вторых, она обеспечивает фокусировку в пятно меньшего размера, что позволяет достичь лучшего пространственного разрешения при микрохирургии.
Рис. 1.
Фотография экспериментальной установки (а): 1 – фемтосекундный лазер, 2 – блок сопряжения, 3 – инвертированный микроскоп. Схема установки (б): 1 – фемтосекундный лазер, 2 – поляризационный ослабитель, 3 – нелинейный кристалл, 4 – телескоп, 5 – зеркало, 6 – тубусная линза, 7 – дихроическое зеркало, 8 – микрообъектив, 9 – двухкоординатный моторизованный столик, 10 – чашка Петри, 11 – линзовый конденсор, 12 – осветитель, 13 – ПЗС камера.

В блоке сопряжения осуществляется управление энергией импульсов лазерного излучения, а также размером и расходимостью лазерного пучка для оптимального заполнения входной апертуры микрообъектива микроскопа и фокусировки излучения в заданной плоскости. Из блока сопряжения излучение направляется в микроскоп и фокусируется на объекте микрообъективом с увеличением 20× и числовой апертурой 0.5 в пятно диаметром ~2 мкм.
В качестве модельных объектов были использованы эмбрионы мыши линии C57BL/6J и CBA. Содержание животных и манипуляции, связанные с получением эмбрионов, проводились в рамках соответствующих стандартов и требований комитета по биоэтике Биологического факультета МГУ имени М.В. Ломоносова. Процедура извлечения эмбрионов и их культивирования до и после эксперимента полностью аналогична процедуре, описанной нами ранее [18]. Эмбрионы экспериментальной группы перемещали из инкубатора в капли среды для манипуляций, нанесенные на поверхность пластиковых чашек Петри с тонким стеклянным дном, которые затем фиксировали на моторизованном двухкоординатном столе микроскопа. Управление перемещением стола осуществлялось с помощью специально разработанного программного обеспечения. Изображение с ПЗС-камеры микроскопа также отображалось в данной программе и позволяло контролировать процесс лазерного воздействия. Отметим, что сфокусированное лазерное излучение оставалось неподвижным относительно объекта, а микрохирургия осуществлялась путем перемещения моторизованного стола вдоль задаваемой в программе траектории.
Перед проведением серии экспериментов был определен допустимый диапазон энергий лазерных импульсов, в соответствии с методикой, описанной ранее [19]. Для этого было выбрано несколько эмбрионов, на оболочку которых воздействовали УКИ и наблюдали формирование микронадрезов. Энергию УКИ постепенно увеличивали от минимального значения, когда надрез на оболочке детектируется с помощью световой микроскопии, до значения, при котором вблизи области воздействия начинается формирование кавитационных пузырьков. Каждый последующий надрез при увеличении энергии импульсов выполняли на новом участке блестящей оболочки. Возникновение многочисленных кавитационных пузырьков больших размеров опасно для эмбриона и может привести к его необратимым повреждениям. Поэтому в качестве верхней границы безопасного диапазона энергий УКИ было выбрано значение, при котором вероятность возникновения единичных кавитационных пузырьков микронного размера составляла 50%. Было установлено, что для импульсов длительностью 280 фс и частотой следования 5 кГц оптимальный диапазон энергий лазерных импульсов составил 19–53 нДж. Энергия импульсов в экспериментах была установлена на уровне близком к нижней границе и составляла 20.0 ± ± 0.5 нДж, что тем не менее позволяло формировать на оболочке достаточно четкие микронадрезы.
ФЕМТОСЕКУНДНАЯ ЛАЗЕРНАЯ МАРКИРОВКА ЭМБРИОНОВ
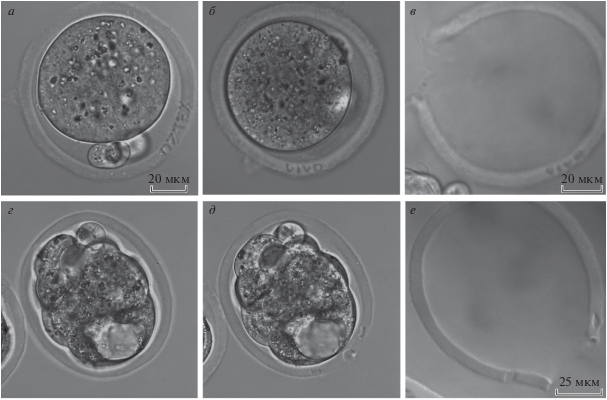
Экспериментальная группа включала 33 зиготы. Контрольные группы интактного и параллельного контроля включали 38 и 43 зиготы соответственно. Буквенно-цифровой код, формируемый на блестящей оболочке зиготы, представлял собой набор из 4–5 символов. Процесс маркировки с учетом поиска наиболее подходящей для нанесения кода плоскости и области на оболочке занимал не более двух минут. При этом время, затрачиваемое на создание кода в программе с использованием графических примитивов, составляло 30–40 с, а его воспроизведение на оболочке – 8–13 с. На рис. 2а, 2б в качестве примера представлены эмбрионы с нанесенными кодами. Было установлено, что нанесенный на стадии зиготы код, сохраняется на протяжении всего периода преимплантационного развития и даже после вылупления эмбриона может быть обнаружен на пустой оболочке (рис. 2в). Подобная маркировка эмбрионов с помощью фемтосекундного лазера позволяет безошибочно идентифицировать преимплантационные эмбрионы и минимизировать риск их перепутывания, что может иметь необратимые последствия при работе с эмбрионами человека [20]. Следует отметить, что процедура лазерной маркировки эмбрионов не оказывала негативных последствий на их развитие. Все эмбрионы экспериментальной группы достигли стадии бластоцисты и 27 из 33 эмбрионов (81.8%) находились на стадии хэтчинга в момент их планового наблюдения. Полученные показатели сопоставимы с данными для контрольных групп: 70% (30 из 43 эмбрионов из группы интактного контроля) и 81% (31 из 38 эмбрионов из группы параллельного контроля) находились на стадии хэтчинга в момент их плановой оценки.
Рис. 2.
Фемтосекундная лазерная микрохирургия прозрачной оболочки эмбрионов: формирование на оболочке кодов “07TEX” и “VIVO” соответственно (а–б); демонстрация кода “VIVO”, различимого на оболочке даже после вылупления эмбриона из нее (в); формирование отверстия в оболочке эмбриона на стадии ранней бластоцисты для инициирования вылупления эмбриона трофобластом вперед (г–е): ранняя стадия бластоцисты (видна полость, положение внутренней клеточной массы и трофэктодермы известно) (г); отверстие в оболочке и дополнительные микронадрезы, сформированные с помощью фемтосекундной лазерной микрохирургии (д); оболочка эмбриона после вылупления (е), на которой сохранились два микронадреза, что подтверждает вылупление трофобластом вперед через искусственно сформированное на стадии ранней бластоцисты отверстие.
УПРАВЛЯЕМЫЙ ХЭТЧИНГ С ПОМОЩЬЮ ЛАЗЕРНОЙ МИКРОХИРУРГИИ ОБОЛОЧКИ НА СТАДИИ РАННЕЙ БЛАСТОЦИСТЫ
Экспериментальная группа состояла из 30 эмбрионов на стадии ранней бластоцисты, у которых ВКМ и трофобласт были четко различимы. Группы интактного и параллельного контроля включали 35 и 30 эмбрионов на стадии ранней бластоцисты соответственно.
Процесс естественного вылупления эмбрионов у различных млекопитающих имеет свои особенности и является предметом активного изучения. В последнее время исследователями были сделаны предположения о наличии полярности у процесса вылупления и влиянии места начала хэтчинга на дальнейший потенциал развития и имплантации эмбрионов [21].
С учетом этого, разработка эффективной и безопасной технологии, позволяющей инициировать процесс хэтчинга в нужном месте (либо вблизи ВКМ, либо вблизи трофобласта) имеет важное значение. Так, при необходимости проведения биопсии бластоцисты, наиболее предпочтительным является вылупление эмбриона трофобластом вперед.
Для инициирования хэтчинга эмбрионов трофобластом вперед была проведена лазерная микрохирургия оболочки эмбрионов экспериментальной группы (рис. 2г, 2д). Вначале в оболочке формировали отверстие размером 5–10 мкм, а затем по обе стороны от отверстия было сделано по дополнительному “микронадрезу” (размером не более 10 мкм). Данные насечки позволяли точно установить, каким образом проходит вылупление эмбриона (через сформированное отверстие или в другом месте). Как можно видеть на рис. 2е, вылупление эмбриона осуществляется именно через заранее сформированное отверстие. Полученные данные продемонстрировали эффективность данной технологии: 28 из 30 (93.3%) эмбрионов экспериментальной группы начали процесс вылупления именно в том месте, где было сформировано отверстие (1 эмбрион (3.4%) начал вылупление не в области лазерного воздействия, а еще 1 эмбрион отставал в сроках развития и на момент оценки эмбрионов не перешел на стадию хэтчинга). Данная методика продемонстрировала более высокие показатели хэтчинга по сравнению с эмбрионами двух контрольных групп: в группе интактного контроля вылупились 30 из 35 эмбрионов (85.7%), а в группе параллельного контроля – 25 из 30 (83.3%).
Следует отметить, что возможность успешного хэтчинга эмбрионов после лазерной диссекции оболочки на стадии ранней бластоцисты была продемонстрирована ранее [21, 22]. В качестве лазерного инструмента применяли инфракрасные диодные лазеры, генерирующие импульсы на длине волны 1.48 мкм длительностью от сотен микросекунд до нескольких миллисекунд. Размер отверстия после однократного воздействия подобным лазерным импульсом составляет 10 мкм. Зачастую размер отверстия расширяли до 20–50 мкм, воздействуя несколькими импульсами, так как полагали, что это исключит риск “застревания” эмбриона в оболочке в процессе вылупления.
В настоящей работе впервые показано, что успешный “управляемый” хэтчинг (в заданном месте) возможен при микрохирургии оболочки на стадии ранней бластоцисты и формировании отверстия малого размера (менее 10 мкм). В отличие от сквозных отверстий, размером порядка 10 мкм, формируемых при использовании коммерчески доступных лазерных систем, УКИ деликатно воздействуют на оболочку эмбриона, при этом ширина микронадреза может составлять порядка 2 мкм. Формирование отверстия малого размера инициирует вначале вылупление небольшого количества клеток, что в случае проведения биопсии трофэктодермы существенно упрощает процесс забора клеток независимо от способа их отсечения (механического или лазерного).
Помимо применения фемтосекундных лазерных импульсов авторами были проведены пилотные исследования по микрохирургии оболочки с помощью лазерных импульсов пикосекундной длительности. Это было сделано для оценки потенциала применения в ВРТ источников излучения пикосекундной длительности, так как применение их вместо фемтосекундных позволило бы удешевить стоимость конечного прибора для потенциальных покупателей. В то же время длительность импульсов пикосекундных лазеров (а значит и риск тепловых повреждений) в миллионы раз меньше по сравнению с длительностью микро- и миллисекундных лазеров, в настоящее время используемых в ВРТ.
Для проведения данного эксперимента имеющаяся лазерная установка была перестроена на генерацию импульсов пикосекундной длительности. Для этого излучение было заведено в экспериментальную схему в обход временного компрессора лазерного источника ТЕТА. Измеренная длительность лазерного импульса составила 25 пс. Был определен допустимый диапазон энергий пикосекундных лазерных импульсов для выполнения микрохирургических процедур: 90‒180 нДж. Как видно, он в несколько раз превышает оптимальные значения энергий при использовании фемтосекундных лазерных импульсов. Тем не менее, последующий анализ жизнеспособности эмбрионов после однократной микродиссекции оболочки с помощью пикосекундных лазерных импульсов на стадии ранней бластоцисты не выявил каких-либо отклонений в сроках развития по сравнению с контрольными группами и группой эмбрионов, подвергнутых процедуре вспомогательного хэтчинга с применением фемтосекундных лазерных импульсов. Таким образом, впервые была показана принципиальная возможность проведения процедуры управляемого вспомогательного хэтчинга с применением лазерных импульсов пикосекундной длительности. Для подтверждения безопасности эмбриональной микрохирургии с помощью пикосекундных лазерных импульсов исследования будут продолжены на значительной статистической выборке.
ЗАКЛЮЧЕНИЕ
В настоящей работе рассмотрены две технологии, основанные на применении лазерных импульсов ультракороткой длительности для микрохирургии прозрачной оболочки эмбрионов на разных сроках их преимплантационного развития. Технология фемтосекундной лазерной маркировки эмбрионов благодаря нанесению уникального кода позволяет идентифицировать эмбрионы на протяжении всего периода преимплантационного развития, при этом не оказывает негативного влияния на жизнеспособность и показатели развития эмбрионов. Технология управляемого лазерного хэтчинга, заключающаяся в формировании отверстия в оболочке эмбриона на стадии ранней бластоцисты, когда хорошо различимы ВКМ и трофэктодерма, позволяет инициировать вылупление эмбриона именно в том месте, которое является наиболее предпочтительным. В работе показано, что формирование отверстия в оболочке эмбриона вблизи трофобласта в 93.3% случаев инициирует вылупление эмбриона через данное отверстие. Показатели успешного хэтчинга после данной процедуры в экспериментальной группе превышают процент успешно вылупившихся эмбрионов в контрольных группах. Также впервые показана возможность реализации управляемого лазерного хэтчинга с помощью пикосекундных лазерных импульсов.
Исследование выполнено на оборудовании ЦКП “ЛФК” и УНУ “ЛТФК” ОИВТ РАН, при финансовой поддержке РФФИ и Правительства Москвы в рамках научного проекта № 19-32-70036.
Список литературы
Davidson L.M., Liu Y., Griffiths T. et al. // Reprod. Biomed. Online. 2019. V. 38. № 5. P. 725.
Sato H., Landthaler M., Haina D. et al. // Andrologia. 1984. V. 16. P. 23.
Yazdi S.R., Bakhshi S., Alipoor F.J. et al. // Lasers Med. Sci. 2014. V. 29. P. 97.
Montag M., Rink K., Delacretaz G. et al. // Hum. Reprod. 2000. V. 15. P. 846.
Ebner T., Moser M., Yaman C. et al. // Fertil. Steril. 2002. V. 78. № 2. P. 417.
Li M.W., Kinchen K.L., Vallelunga J.M. et al. // Reprod. 2013. V. 145. № 3. P. 245.
Gabrielsen A., Agerholm I., Toft B. et al. // Hum. Reprod. 2004. V. 19. № 10. P. 2258.
McArthur S.J., Leigh D., Marshall J.T. et al. // Fertil. Steril. 2005. V. 84. № 6. P. 1628.
Aoyama N., Kato K. // Reprod. Med. Biol. 2020. V. 19. № 3. P. 222.
Tadir Y., Wright W.H., Vafa O. et al. // Hum. Reprod. 1991. V. 6. P. 1011.
Douglas-Hamilton D.H., Conia J. // J. Biomed. Opt. 2001. V. 6. № 2. P. 205.
Chatzimeletiou K., Picton H.M., Handyside A.H. // Reprod. Biomed. Online. 2001. V. 2. P. 178.
Kuetemeyer K., Lucas-Hahn A., Petersen B. et al. // J. Biomed. Opt. 2010. V. 15. Art. № 046006.
Ильина И.В., Овчинников А.В., Ситников Д.С. и др. // ТВТ. 2013. Т. 51. № 2. С. 198; Ilina I.V., Ovchinnikov A.V., Sitnikov D.S. et al. // High Temp. 2013. V. 51. P. 173.
Osychenko A., Zalessky A.D., Kostrov A. et al. // J. Biomed. Opt. 2017. V. 22. № 12. Art. № 125006.
Sitnikov D.S., Ovchinnikov A.V., Ilina I.V. et al. // High Temp. 2014. V. 52. P. 803.
Ilina I.V., Khramova Y.V., Filatov M.A. et al. // High Temp. 2015. V. 53. P. 804.
Ilina I.V., Khramova Y.V., Filatov M.A., Sitnikov D.S. // J. Assist. Reprod. Genet. 2019. V. 36. № 6. P. 1251.
Ilina I.V., Khramova Y.V., Filatov M.A., Sitnikov D.S. // Biomed. Opt. Expr. 2019. V. 10. № 6. P. 2985.
Spriggs M. // Med. Ethics. 2003. V. 29. P. 65.
Miyata H., Matsubayashi H., Fukutomi N. et al. // Fertil. Steril. 2010. V. 94. № 6. P. 2444.
Ren X., Liu Q., Chen W. et al. // J. Assist. Reprod. Genet. 2013. V. 30. P. 691.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


