Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1605-1610
Исследование индукции двунитевых разрывов в фибробластах кожи человека терагерцевым излучением высокой интенсивности
Д. С. Ситников 1, *, И. В. Ильина 1, С. А. Гурова 2, Р. О. Шаталова 2, В. А. Ревкова 3
1 Федеральное государственное бюджетное учреждение науки
Объединенный институт высоких температур Российской академии наук
Москва, Россия
2 Обнинский институт атомной энергетики – филиал федерального государственного автономного образовательного учреждения высшего образования “Национальный исследовательский ядерный университет “МИФИ”
Обнинск, Россия
3 Федеральное государственное бюджетное учреждение
“Федеральный научно-клинический центр специализированных видов медицинской помощи
и медицинских технологий” Федерального медико-биологического агентства России
Москва, Россия
* E-mail: Sitnik.ds@gmail.com
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Представлены результаты исследования воздействия широкополосных импульсов терагерцевого (ТГц) излучения с пиковой интенсивностью ~30 ГВт ∙ см–2 и напряженностью электрического поля ~3.5 МВ ∙ см–1 на фибробласты. Получены данные о кинетике изменений количества фокусов фосфолирированного гистона γH2AX, являющихся маркерами двунитевых разрывов ДНК. Показано, что значения фокусов сохраняются неизменными в течение 24 ч после облучения.
ВВЕДЕНИЕ
На сегодняшний день разработке источников неионизирующего терагерцевого (ТГц) излучения уделяется особое внимание. Такие установки активно используются в различных сферах: военная и гражданская связь, скрининг и визуализация в научных и медицинских исследованиях, контроль качества продуктов питания и фармацевтических препаратов. Вопрос биологической безопасности был поднят с появлением первых источников терагерцевого излучения. В настоящий момент накоплен большой объем результатов экспериментальный исследований, демонстрирующих как отсутствие изменений в клетках при воздействии ТГц излучения, так и их наличие (в частности, изменение проницаемости мембран, изменение экспрессии генов или количества микроядер в клетках, см. обзоры [1–4]). Вопрос генотоксичности ТГц излучения за последнее десятилетие так же не утратил своей актуальности и до сих пор вызывает живой интерес исследователей по всему миру. При этом проведенный анализ работ дает весьма противоречивые результаты. Например, исследования фосфорилирования гистона H2AX [5, 6], а также метод комет-тест [2, 7–9] свидетельствуют об отсутствии повреждения ДНК в фибробластах (линия HFFF2) и эмбриональных стволовых клетках (линия hESCs). С другой стороны, серия работ Титовой и др. (например, [10]) демонстрирует увеличение количества γH2AX в образцах искусственной кожи человека при ТГц воздействии. Возможное объяснение заключается в типе используемого ТГц источника. Интенсивность импульса ТГц излучения в [10] достигает ~70 МВт ∙ см–2, что по нашим оценкам на несколько порядков превышает значения в работах других авторов [2, 5–9]. Важность таких параметров как высокая пиковая и низкая средняя мощность импульсно-периодического ТГц излучения при изучении его воздействия на работу ДНК подчеркивается (со ссылкой на теоретические исследования [11]) в работе [12]. Все вышеперечисленное позволяет считать используемый нами источник ТГц излучения на основе оптического выпрямления [13] наиболее подходящим для исследования влияния ТГц излучения на биологическую активность клеток (результаты изучения пролиферативной активности мезенхимальных стволовых клеток человека и клеток линии НЕК-293 были представлены ранее в [14]). Если дозовые и временные зависимости индукции фокусов фосфорилирования гистонов H2AX ионизирующим излучением хорошо изучены, то применение мощного импульсного ТГц излучения в данной области исследований весьма ограниченно.
Целью настоящего исследования является оценка количества фокусов фосфорилирования гистонов H2AX при облучении фибробластов кожи человека мощными импульсами широкополостного терагерцевого излучения, а также скорости их элиминации. Достигаемая в эксперименте интенсивность ТГц импульса превышает значения в работе [10] более чем на 2 порядка и является, насколько нам известно, одной из самых высоких среди работ, посвященных исследованию влияния ТГц излучения на биологическую активность клеток.
ЭКСПЕРИМЕНТАЛЬНАЯ СХЕМА
В качестве источника ТГц излучения был выбран кристалл OH1 (диаметр 6 мм, толщина 420 ± ± 10 мкм, Rainbow Photonics, Switzerland) поскольку он имеет высокий коэффициент преобразования и обеспечивает гладкий спектр генерируемого ТГц излучения в диапазоне 0.2–3 ТГц. В качестве источника накачки в эксперименте использовалась фемтосекундная лазерная система на основе кристалла хром:форстерит (ООО Авеста, Россия) с дополнительным узлом многопроходного усилителя [13], обеспечивающая генерацию лазерных импульсов длительностью 95 ± 5 фс на длине волны 1240 нм с энергией 1.1 ± 0.05 мДж, следующих с частотой 100 Гц.
Схема собранной экспериментальной установки для облучения клеточной культуры представлена на рис. 1а, а ее подробное описание можно найти в [15]. Для достижения максимальной интенсивности (а соответсвенно и напряженности электрического поля) ТГц импульсов при облучении клеток необходимо сфокусировать ТГц излучение в пятно минимального размера. С этой целью был использован зеркальный телескоп, состоящий из двух внеосевых параболоидов с фокусными расстояниями 15 и 152.4 мм (Thorlabs), собранный после узла ТГц источника. Для фокусировки ТГц пучка использовалось параболическое зеркало диаметром 50.8 мм (MPD229H-M01, Thorlabs) с фокусным расстоянием 50.8 мм. Для измерения временного профиля ТГц импульса и оценки пространственного распределения энергии сфокусированных импульсов ТГц излучения были применены методика электрооптического детектирования и ножевой метод измерений соответственно. Зарегистрированный временной профиль ТГц импульса и его спектр представлены на рис. 1б и 1в. Измеренные минимальные размеры сфокусированного ТГц пучка вдоль координат X и Y составили по полувысоте 308 и 270 мкм соответственно. Для упрощения процесса установки мишени (для расположения монослоя клеток в плоскости перетяжки ТГц пучка) в схеме было собрано плечо оптического контроля. Оно состояло из микрообъектива (40×, NA = 0.6), ПЗС камеры (VSC-756-USB, ООО Видеоскан) и плоского зеркала, установленного между ними. Система оптического контроля настраивалась таким образом, чтобы формировать в плоскости ПЗС-матрицы резкое изображение предмета (например, ножа в ножевом методе), находящегося в плоскости перетяжки ТГц пучка; точность установки составляла Δz = ±10 мкм.
Рис. 1.
а – Экспериментальная схема: 1 – фемтосекундный лазер, 2, 5 – ирисовая диафрагма, 3 – поляризационный ослабитель, 4 – линзовый телескоп, 6 – кристалл OH1 с фильтром, 7 – зеркальный телескоп, 8 – фокусирующее зеркало, 9 и 9 ' – чашка Петри в ТГц и видео-каналах, 10 – клетки, 11 – подогреваемая плита и крышка, 12 – трехкоординатный столик, 13 – микрообъектив, 14 – ПЗС-камера, 15 – осушаемый бокс, 16 – адсорбционный осушитель, 17 – воздушный компрессор; б – временной профиль ТГц импульса: 1 – профиль электрического поля, 2 – гауссова огибающая; в – спектр ТГц импульса.

Клеточная культура, высаженная на дно пластиковой посуды (чашка Петри), во время облучения должна находиться в оптимальных условиях. Для этого в экспериментальной схеме была предусмотрена система подогрева (ibidi, Германия), состоящая из нагреваемых плиты и крышки, а также контроллера температуры. Система подогрева чашки Петри (обеспечивала поддержание температуры 37°С при облучении клеток) закреплялась на трех-координатной системе позиционирования, состоящей из моторизованных столиков: 8MT167-100 (Standa) для перемещения вдоль осей X и Y и 8MT173-20 (Standa) – вдоль оси Z. Видеонаблюдение и облучение клеток осуществлялось сквозь пластиковое дно культуральной посуды.
Для минимизации потерь, связанных с поглощением ТГц излучения во влажном воздухе, часть узлов экспериментальной схемы была собрана в осушаемом боксе с относительной влажностью воздуха 2–3%. Для осушения воздуха использовался безмасляный компрессор (SB4-100.OLD15T, Remeza) и адсорбционный осушитель (ADS3, Ceccato).
Оценка значений пиковой интенсивности и напряженности электрического поля ТГц импульса, воздействующего на клетки в чашке Петри в фокальной плоскости параболы была сделана ранее в [15], а соответствующие значения составили ~30 ГВт ∙ см–2 и ~3.5 МВ ∙ см–1.
МЕТОДЫ
Культура первичных фибробластов кожи человека
Фибробласты кожи человека были получены из кожи молодого здорового донора, подписавшего письменное информированное согласие. Фрагмент кожи размером 2 × 2 × 2 мм промывали дважды фосфатно-солевым буфером Дульбекко (DPBS) с добавлением 1Х раствора антибиотика-антимикотика (Gibco, США). Далее фрагмент измельчали скальпелем до состояния кашицы. Полученную суспензию промывали дважды в DPBS и инкубировали с коллагеназой I типа (Gibco, США) в течение 2 ч с использованием орбитального шейкера при температуре 37°С. После инкубации фермент инактивировали 100% фетальной бычьей сывороткой. Полученный раствор центрифугировали 4 мин при 400 g. Далее осадок ресуспендировали в культуральной среде и высаживали на культуральный пластик в плотности 1.5 ‧ 105 клеток ∙ см–2. Среда представляла собой модифицированную по способу Дульбекко среду Игла, смешанную со средой Хам (DMEM/F12, Gibco, USA), с добавлением 10% фетальной бычьей сыворотки (Gibco, USA), 2 мM L-глутамина (GlutaMAX, (Gibco), раствора антибиотика-антимикотика (1X; Gibco, USA). Клетки культивировали в условиях инкубатора при 37°C и 5% CO2. По достижении монослоя их обрабатывали раствором трипсина (1X, TrypLE, Gibco) и переносили в новые культуральные флаконы в соотношении 1 : 3. Для эксперимента клетки также предварительно обрабатывали раствором трипсина (1X, TrypLE, Gibco), подсчитывали их общее количество и переносили в культуральные чашки с полимерным дном и специальными силиконовыми вставками (ibidi, № 80466), в концентрации 5 ‧ 105 клеток ∙ см–2. Для поддержания кислотно-основного баланса среды во время облучения, предварительно к культуральной среде добавляли раствор HEPES (Gibco).
Подготовленные чашки были разделены на 2 группы: экспериментальную (подвергаемую воздействию импульсов ТГц излучения) и группу параллельного контроля (содержащуюся в тех же условиях, но без внешнего ТГц воздействия).
Облучение клеток
Облучение клеточной культуры осуществлялось в течение заданного времени tо = 0.5 ч. Облучение осуществлялось последовательностью импульсов ТГц излучения, следующих с частотой fp = 100 Гц. Отличительной особенностью используемой экспериментальной установки является низкая частота следования ТГц импульсов по сравнению с зарубежными исследованиями (как правило 1 кГц), а, следовательно, и низкое значение средней мощности ТГц излучения Pav = = 1.5 мВт при высоких пиковых значениях. Полученные ранее оценки показывают, что термическое воздействие на клеточную культуру минимально, а нагрев в области воздействия не превышает 2.8°C [15].
Размер облученной области клеток определялся размером сфокусированного ТГц пучка. Для облегчения обнаружения этой области при последующем анализе клеток ее границы помечались с помощью лазерной гравировки (элементы ТГц кристалл и ТГц фильтр временно убирались из схемы), а энергия лазерных импульсов уменьшалась поляризационным ослабителем.
Иммуноцинохимическое исследование
Для проведения иммуноцитохимического анализа клетки фиксировали в чашке Петри 4% раствором забуференного формалина, содержащим 0.1% сапонина в течение 20 мин при комнатной температуре с последующей двукратной промывкой DPBS. Далее клетки инкубировали в течение 1.5 ч при 37°С с первичными поликлональными антителами кролика против γH2AX (разведение 1 : 1000, abcam11174), предварительно растворенными в DPBS с 0.5% Triton-X100 и 0.5% Tween 20, с добавлением 1% козьей сыворотки для блокирования неспецифического связывания антител. После инкубации клетки промывали трижды DPBS с 0.5% Triton-X100 и 0.5% Tween 20 и инкубировали в течение 1 ч со вторичными козьими анти-кроличьими IgG (H + L) антителами (конъюгированные с Alexa Fluor 633, разведение 1 : 400; Invitrogen USA), так же растворенными в DPBS с 0.5% Triton-X100 и 0.5% Tween 20, с добавлением 1% козьей сыворотки. Затем чашки Петри промывали трижды DPBS. Ядра клеток окрашивали красителем Hoechst 33342 (Thermo Fisher Scientific). Иммунофлуоресцентное исследование проводили с использованием сканирующего лазерного конфокального микроскопа Nikon A1 (Nikon Co., Япония).
Статистический анализ
Оценка количества фокусов двунитевых разрывов проводилась на основе соотношения количества гистонов γН2АХ в перерасчете на количество клеток в зоне облучения. Все эксперименты были проведены в трех повторностях. Анализ статистической значимости проводили с помощью критерия Стьюдента с поправкой Крамера–Уэлча (р < 0.05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фосфорилирование гистона Н2АХ (называемого γH2AX) играет ключевую роль в сигнализировании двунитевых разрывов ДНК [16] – процессе, хорошо изученном при воздействии ионизирующего излучения и встречающемся при ТГц облучении лишь с использованием источников высокой пиковой мощности (например, [10]). Фосфорилирование гистона Н2АХ способно вызывать сигналы как для контрольных точек чувствительного к повреждению ДНК клеточного цикла, так и для белков репарации ДНК [17, 18]. Таким образом, совместное присутствие белков репарации (53BP1, BRCA1, Rad51) и γH2AX может являться индикатором контрольных точек первоначального распознавания клеткой повреждения ДНК. При этом механизм воздействия на клетки неионизирующего мощного терагерцевого излучения и роль последнего в формировании фокусов γH2AX до конца не изучены.
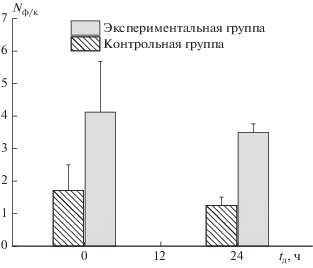
Поскольку формирование фокусов γH2AX может происходить в клетке спонтанно, например, в результате прохождения клеткой той или иной стадии клеточного цикла или быть обусловлено процессом старения, в исследовании была использована группа параллельного контроля. На рис. 2 представлены результаты исследования количества γH2AX гистонов, приходящихся на одну клетку Nф/к как в экспериментальной, так и в группе контроля. При одинаковом времени облучения tо = 0.5 ч клетки были разделены на две группы, отличающиеся временем их фиксации после облучения (обозначаемое далее “временем дожития”) tд.
Как было показано на примере радиационного воздействия [16], половина от максимального количества фокусов регистрируется через 1 мин, в то время как максимальное наблюдается через 9–30 мин. Для регистрации максимального эффекта, время фиксации клеток после окончания облучения было выбрано равным 30 мин. В клетках экспериментальной группы, с временем дожития tд = 0.5 ч наблюдалось повышение уровня фосфорилирования гистона γH2AX в ~2.4 раза по сравнению со значением в контрольной группе. В экспериментальной группе с временем дожития tд = 24 ч было обнаружено меньшее количество фокусов двунитевых разрывов, однако, данные различия с первой экспериментальной группой (tд = 0.5 ч) являлись статистически не значимыми. Характерные микрофотографии клеток из всех 4-х групп представлены на рис. 3. Каких-либо изменений морфологии клеток или их апоптоза в области облучения не отмечалось ни в одной экспериментальной группе. Следует отметить, что зарегистрированное количество фокусов γH2AX близко по уровню значениям Nф/к, полученным при воздействии на фибробласты кожи человека ионизирующего излучения в малых дозах (~20 мГр) [19].
Рис. 3.
Репрезентативные микрофотографии фокусов γH2AX в ядрах диплоидных нормальных фибробластов человека: а и в – экспериментальные группы с фиксацией клеток через 30 мин и 24 часа после облучения; б и г – параллельный контроль к а и в соответственно.

Однако, формирование фокусов γH2AX может быть не связано с образованием двунитевых разрывов, а, как показано в работах [20, 21], являться следствием теплового шока клетки. В этом случае тепловое повреждение вызывает изменения в структуре хроматина более высокого порядка, приводящие к повреждению ДНК, и/или маскирование повреждения ДНК при воздействии тепло-лабильных белков [22]. Отличительной особенностью термического воздействия (42°С) в указанной работе являлось сохранение повышенного количества фокусов спустя более 24 ч после эксперимента. Вероятно, такой эффект связан с повреждением вилки репликации и нарушением работы систем репарации. Согласно нашим оценкам температура в области фокусировки ТГц излучения со средней мощностью Pav = 1.5 мВт не превышала 40°С, что ниже значения 41.5°С, приводящего к формированию фокусов γH2AX при нагреве клеток [23]. Вместе с тем, рассмотренный альтернативный механизм фосфорилирования гистонного белка при термоиндуцированной перестройке хроматина нельзя полностью исключать из-за возможного микро-перегрева сильно поглощающих в ТГц диапазоне элементов клеток.
С другой стороны, ряд исследователей отмечали, что воздействие ТГц излучения на клетки кожи может способствовать гипер- и гипо-экспрессии генов, которые отвечают как за клеточные сигнальные каскады, проонкогены и гены-супрессоры, так и гены регуляции клеточного метаболизма [24, 25]. Таким образом, формирование фокусов γH2AX может быть связано с изменением структуры ДНК и как следствие состоянием хроматина.
Проведенные экспериментальные исследования показали, что при воздействии импульсного терагерцевого излучения с высокой пиковой интенсивностью количество фокусов γH2AX гистонов увеличивается и сохраняется в течение продолжительного времени. Регистрируемый уровень фокусов схож с результатом облучения фибробластов кожи ионизирующим излучением в малых дозах. Однако, наблюдаемый эффект может являться следствием не только формирования в клетке двухцепочечных разрывов ДНК, но и быть обусловленным другими причинами, такими как тепловое воздействие или изменение структуры хроматина. Представленные данные являются результатом пилотных исследований и будут продолжены с применением расширенных методов диагностики и значений статистической выборки.
ЗАКЛЮЧЕНИЕ
В настоящей работе представлены результаты исследования импульсно-периодического воздействия ТГц излучения с пиковой интенсивностью ~30 ГВт ∙ см–2 на фибробласты кожи человека. Показано, что в случае непродолжительного облучения (30 мин) в клетках повышается количество фокусов γН2АХ, число которых слабо изменяется в течение следующих 24 ч после воздействия.
Исследования выполнены с использованием УНУ “Лазерный тераваттный фемтосекундный комплекс”, входящий в состав ЦКП “Лазерный фемтосекундный комплекс” ОИВТ РАН при финансовой поддержке РФФИ (проект № 19-02-00762).
Список литературы
Wilmink G.J., Grundt J.E. // J. Infrared. Millim. THz Waves. 2011. V. 32. № 10. P. 1074.
Hintzsche H., Stopper H. // Crit. Rev. Env. Sci. Tech. 2012. V. 42. № 22. P. 2408.
Fëdorov V.I., Serdyukov D.S., Cherkasova O.P. et al. // J. Opt. Technol. 2017. V. 84. № 8. P. 509.
Ильина И.В., Ситников Д.С., Агранат М.Б. // ТВТ. 2018. Т. 56. № 5. С. 814; Il’ina I.V., Sitnikov D.S., Agranat M.B. // High Temp. 2018. V. 56. № 5. P. 789.
Bogomazova A.N., Vassina E.M., Goryachkovskaya T.N. et al. // Sci. Rep. 2015. V. 5. P. 1.
Franchini V., De Sanctis S., Marinaccio J. et al. // Environ. Mol. Mutagen. 2018. V. 59. № 6. P. 476.
Hintzsche H., Jastrow C., Heinen B. et al. // Radiat. Res. 2013. V. 179. № 1. P. 38.
Ангелуц А.А., Гапеев А.Б., Есаулков М.Н. и др. // Квант. электрон. 2014. Т. 44. № 3. С. 247; Angeluts A.A., Gapeyev A.B., Esaulkov M.N. et al. // Quant. Electron. 2014. V. 44. № 3. P. 247.
Amicis A. De, Sanctis S. De, Cristofaro S. Di. et al. // Mutat. Res. Rev. Genet. 2015. V. 793. P. 150.
Titova L.V., Ayesheshim A.K., Golubov A. et al. // Biomed. Opt. Expr. 2013. V. 4. № 4. P. 559.
Alexandrov B.S., Gelev V., Bishop A.R. et al. // Phys. Lett. A. 2010. V. 374. № 10. P. 1214.
Weightman P. // Phys. Biol. 2012. V. 9. № 5. Art. № 053001.
Овчинников А.В., Чефонов О.В., Ситников Д.С. и др. // Квант. электрон. 2018. Т. 48. № 6. С. 554; Ovchinnikov A.V., Chefonov O.V., Sitnikov D.S. et al. // Quant. Electron. 2018. V. 48. № 6. P. 554.
Sitnikov D.S., Ilina I.V., Revkova V.A. et al. // High Temp. 2020. V. 58. № 1. P. 36.
Sitnikov D.S., Ilina I.V., Pronkin A.A. // Opt. Engin. 2020. V. 59. № 6. Art. № 061613.
Rogakou E.P., Pilch D.R., Orr A.H. et al. // J. Biol. Chem. 1998. V. 273. № 10. P. 5858.
Kopp B., Khoury L., Audebert M. // Arch. Toxicol. 2019. V. 93. № 8. P. 2103.
Bekker-Jensen S., Lukas C., Kitagawa R. et al. // J. Cell Biol. 2006. V. 173. № 2. P. 195.
Грехова А.К., Еремин П.С., Осипов А.Н. и др. // Радиац. биол. радиоэкол. 2015. Т. 55. № 4. P. 395.
Laszlo A., Fleischer I. // Int. J. Hyperth. 2009. V. 25. № 3. P. 199.
Roti Roti J.L., Pandita R.K., Mueller J.D. et al. // Int. J. Hyperth. 2010. V. 26. № 1. P. 67.
Takahashi A., Mori E., Nakagawa Y. et al. // Int. J. Hyperth. 2017. V. 33. № 3. P. 336.
Takahashi A., Matsumoto H., Nagayama K. et al. // Cancer Res. 2004. V. 64. № 24. P. 8839.
Echchgadda I., Cerna C. Z., Sloan M. A. et al. // Proc. SPIE. 2015. V. 9321. Art. № 93210Q.
Hough C.M., Purschke D.N., Huang C. et al. // Proc. 44th IRMMW-THz. IEEE (Paris, 2019). P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая