Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1597-1600
Магнитные частицы для выделения ДНК из клеток крови
А. В. Комина 1, 2, *, Р. Н. Ярославцев 1, 3, Ю. В. Герасимова 3, С. В. Столяр 1, 3, И. А. Ольховский 1, 2, М. Ш. Баирмани 4, 5
1 Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
2 Красноярский филиал Федерального государственного бюджетного учреждения “Гематологический научный центр” Министерства здравоохранения Российской Федерации
Красноярск, Россия
3 Институт физики имени Л.В. Киренского Сибирского отделения Российской академии наук –
обособленное подразделение Федерального государственного бюджетного научного учреждения
Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения
Российской академии наук”
Красноярск, Россия
4 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Астраханский государственный университет”
Астрахань, Россия
5 Зеленый университет Аль-Касым, Биотехнологический колледж
Аль-Касым, Ирак
* E-mail: komivlann@yandex.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Метод выделения ДНК из клеток крови, использующий магнитные частицы, обладает преимуществом экономии времени и перспективы автоматизации процесса выделения. Разработан метод получения магнитных наночастиц железа для выделения ДНК из клеток крови. Получены и исследованы магнитные наночастицы, обладающие характеристиками, достаточными для выделения геномной ДНК из лейкоцитов.
ВВЕДЕНИЕ
Молекулярно-генетические исследования клеток крови играют очень важную роль с современной медицине, и в частности, гематологии. Выявление генетических нарушений или изменений в реализации генетической информации является важным диагностическим и прогностическим фактором при лечении заболеваний крови. Так, хронический миелолейкоз в 95% случаев диагностируется по присутствию в опухолевых клетках особой химерной молекулы РНК BCR-ABL1, количество которых позволяет судить о степени прогрессии заболевания и выраженности ответа на лечение [1]. Большое количество различных генетических модификаций являются определяющими при исследованиях острых лейкозов, миелопролиферативных заболеваний и др. [2]. Кроме того, выявление мутаций в ДНК злокачественных клеток крови позволяет подобрать индивидуальную схему лечения для каждого случая заболевания [3, 4].
Выделение нуклеиновых кислот – ДНК или РНК – первый и очень важный этап большинства молекулярно-генетических исследований. От количества и качества очищенной молекулы зависит валидность результата исследования и правильность сделанных выводов. На сегодняшний день, описано несколько способов выделения нуклеиновых кислот из крови, как внутриклеточных молекул, так и нуклеопротеиновых комплексов, циркулирующих вне клеток [5]. Они учитывают особенности материала, но каждый имеет свои достоинства и недостатки [6]. Одним из перспективных среди них является использование магнитных частиц с особыми покрытиями, позволяющими захватывать молекулы нуклеиновых кислот. Этот метод обладает преимуществами меньших затрат времени (в сравнении с осаждением), меньшей токсичностью реагентов (в сравнении с фенол-хлороформной экстракцией), меньшими требованиями к лабораторному оборудованию (отсутствие необходимости центрифугирования). При этом использование магнитных частиц позволяет добиваться получения нуклеиновых кислот высокой чистоты для исследований высокопроизводительными и требовательными методами (микрочипирование, секвенирование нового поколения). Наконец, использование магнитов открывает возможности для автоматизации процессов выделения нуклеиновых кислот. Однако, несмотря на преимущества и активные исследования [7], на сегодняшний день в России реагенты для выделения нуклеиновых кислот на магнитных частицах разрабатываются недостаточно, оставаясь недооцененными, подобно методу безлинзовой микроскопии крови [8], и многие наборы приобретаются из зарубежных стран, что повышает их стоимость. Основными трудностями, которые необходимо преодолевать при использовании данного метода, являются способность магнитных наночастиц к агломерации [9], что снижает их функционально активную площадь для захвата молекул нуклеиновых кислот, а также способность соединений железа влиять на протекание последующих реакций с очищенной молекулой.
Целью настоящей работы являлась разработка доступной технологии синтеза магнитных наночастиц железа для выделения ДНК из клеток крови для проведения молекулярно-генетических исследований.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для получения частиц магнетита были использованы хлориды железа FeCl3 и FeCl2 ∙ 6H2O в молярном соотношении 2 : 1, в соответствии с методикой, описанной Пертаковой А.В. с коллегами [10]. Осаждение частиц магнетита происходило при защелачивании раствора аммиачной водой (25%) до pH 10 при помощи быстрого введения щелочи тонкой струей через иглу шприца. После внесения аммиачной воды емкость с реакционной смесью герметично закрывали и инкубировали при непрерывном перемешивании 30 мин.
Для сепарации полученного осадка использовали неодимовый магнит. Частицы стабилизировали 5 мМ цитратом натрия (pH 6–7) и отмывали деионизованной водой до получения чистой промывной жидкости.
В качестве доступного покрытия для магнитных наночастиц был выбран оксид кремния в виде тетраэтоксисилана (ТЭОС, TEOS). Для покрытия частицы магнетита суспендировали в смеси этанол : вода (9 : 1) в концентрации 20, 10 мг/мл и перемешивали в течение 10 мин. Затем вносили TEOS из расчета 70 мкл на 200 мг наночастиц.
При нанесении покрытия использовалось два режима обработки: разбиение ультразвуком в режиме кавитации (в течение 1 ч) и механическое перемешивание. Все варианты магнитных наночастиц с покрытием оксидом кремния отмывали дистиллированной водой с сепарацией на неодимовом магните и хранили в ультрачистой воде (18 мОм/см3) в концентрации 400 мг/мл.
Полученные образцы исследовались с помощью просвечивающего электронного микроскопа Hitachi HТ7700 и вакуумного Фурье-спектрометра VERTEX 80V (BRUKER) в средней ИК области 380–4000 см–1 центра коллективного пользования Красноярского научного центра СО РАН.
Для выделения ДНК при помощи разработанных магнитных наночастиц использовали набор реагентов “ДНК-собр-В” (AmpliSens, Москва, Россия) в соответствии с протоколом производителя, но используя магнитные наночастицы вместо поставляемого в наборе силикатного сорбента. Выделение ДНК производили из лейкоцитов, полученных из 130 мкл крови человека. Количество и качество геномной ДНК оценивали при помощи электрофореза в 1.5% агарозном геле.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты исследования методом просвечивающей электронной микроскопии высокого разрешения наночастиц Fe3O4@SiO2 полученных при механическом перемешивании представлены на рис. 1. В процессе покрытия оксидом кремния при механическом перемешивании произошло образование конгломератов наночастиц железа с общей силикатной оболочкой. Средний размер частиц при использовании механического перемешивания составляет ~10 нм, однако, за счет агрегации, общий размер частицы с покрытием увеличился до сотен нм. Согласно дифракционному изображению наночастицы представляют собой магнетит со структурой шпинели.
Рис. 1.
Изображения, полученные с помощью просвечивающего электронного микроскопа высокого разрешения наночастиц Fe3O4@SiO2 синтезированных при механическом перемешивании: (а) внешний вид частиц; (б) картина микродифракции.

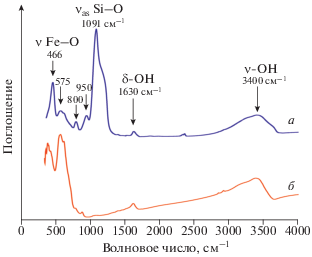
На рис. 2 представлен ИК–Фурье спектр наночастиц Fe3O4@SiO2, полученных при механическом перемешивании, в сравнении со спектром Fe3O4. В спектре образцов наночастиц Fe3O4@SiO2 мы наблюдаем появление очень сильного колебания с максимумом 1091 см–1, которое относится к валентным ассиметричным колебаниям силаксановых групп (νas Si–O–Si) [11]. В спектрах, исследуемых образцов валентное колебание ν–ОН образует интенсивную полосу в области 3200–3600 см–1. Положение и характер этой полосы зависит от участия гидроксильной группы в водородной связи, в нашем случае широкая и слабоструктурированная полоса свидетельствует о большом разнообразии состояний молекул воды в образцах. Полоса деформационных колебаний воды δ–ОН расположена в области 1600–1650 см–1. Слабые колебания 950 и 800 см–1 в спектре наночастиц Fe3O4@SiO2 относится к деформационным и валентным колебаниям силанольных групп Si–OН соответственно рис. 2а. Для полос с частотами менее 600 см–1 довольно трудно провести соотнесение с конкретными колебаниями, но они так или иначе связаны с колебаниями связей Fe–O. Также известно, что колебания связей Fe–O и Si–O в их оксидных соединениях различаются незначительно. Отсутствие полосы поглощения ~3700 см–1 свидетельствует об успешном модифицировании по свободным силанольным группам. Анализ инфракрасных спектров, позволяет утверждать, что силоксановые группы принимают участие в процессах связи между магнитными частицами Fe3O4 и слоем кремнезема, а силанольные группы наиболее активны на поверхности и являются химически активными для образования ковалентной связи.
ЗАКЛЮЧЕНИЕ
При выделении ДНК частицами для изготовления покрытия которых использовалось механическое перемешивание было получено количество ДНК, сравнимое таковым при использовании коммерческого набора с силикатным сорбентом (рис. 3а). Однако на начальных этапах апробации при оценке качества полученной ДНК на электрофорезе отмечалось изменение свойств очищенной молекулы, отражаемое в виде неполного вхождения ДНК в агарозный гель (рис. 3). Это может быть связано с дозозависимым влиянием магнитных наночастиц железа на молекулы ДНК, способными взаимодействовать с основаниями молекулы и вызывать изменения ее структуры [12], либо с наличием посторонних примесей в растворе. Преодоление повреждающего действия магнетита на молекулы живого организма описано в литературе, и для его преодоления предлагаются химические модификации наночастиц при синтезе [13, 14], однако в настоящей работе при работе с отдельными молекулами была предпринята попытка избегания дополнительных компонентов. И уже при уменьшении количества вносимых при выделении магнитных частиц с 18 до 15 мг в образец эффект влияния магнитных частиц был заметно снижен: на электрофорезе отмечалось равномерное вхождение очищенной ДНК в агарозный гель (рис. 3). Количество ДНК, выделенной наночастицами, при изготовлении покрытия которых, использовался ультразвук, было значительно меньше (рис. 3) и в отдельных экспериментах приравнивалось к следовому, несмотря на ожидаемое уменьшение агрегации и увеличение отношения площади поверхности силикатного покрытия к объему частиц. Причины такого эффекта требуют более тщательного изучения, однако, в силу отсутствия желаемого результата при выделении ДНК, в настоящей работе более подробное исследование этих частиц не производилось. Однако описанное ранее влияние акустической кавитации на структуру частиц ферригидрита позволяет предполагать подобные процессы и в данном случае [15].
Рис. 3.
Электрофорез в агарозном геле очищенной геномной ДНК, выделенной при помощи набора реагентов ДНК-сорб В с использованием различных сорбентов: коммерческий силикатный сорбент (с1-3), магнитные наночастицы, покрытые оксидом кремния при механическом перемешивании при внесении в пробу 18 мг (мп1) и 15 мг (мп2, мп3) наночастиц; магнитные наночастицы, покрытые оксидом кремния при участии ультразвука (му1). гДНК – геномная ДНК. 50kb – ДНК маркер.

Таким образом, получение магнитных наночастиц оксида железа для эффективного выделения ДНК в лабораторных условиях возможно без использования ультразвуковой дезагрегации частиц, при помощи простого механического перемешивания. При этом, снижение влияния наночастиц железа на ДНК возможно контролировать при помощи изменения количества частиц.
Список литературы
Chauhan R., Sazawal S., Pati H.P. // Ind. J. Hematol. Blood Transfus. 2018. V. 34. № 2. P. 197.
Kang Z.J., Liu Y.F., Xu L.Z. et al. // Chin. J. Cancer. 2016. V. 35. P. 48.
Alikian M., Gerrard G., Subramanian P.G. et al. // Am. J. Hematol. 2012. V. 87. № 3. P. 298.
Челышева Е.Ю., Шухов О.А., Лазарева О.В. и др. // Клин. онкогем. 2012. Т. 5. № 1. С. 13; Chelysheva E.Y., Shukhov O.A., Lazareva O.V. et al. // Clin. Oncohematol. 2012. V. 5. № 1. P. 13.
Тамкович С.Н., Челобанов Б.П., Дужак Т.Г. // Изв. АН. Сер. хим. 2015. Т. 64. № 6. С. 1458; Tamkovich S.N., Chelobanov B.P., Duzhakc T.G. // Russ. Chem. Bull. Int. Ed. 2015. V. 64. № 6. P. 1458.
Ali N., Rampazzo R.C.P., Costa A.D.T. et al. // Biomed. Res. Int. 2017. V. 2017. Art. № 9306564.
Berensmeier S. // Appl. Microbiol. Biotechnol. 2006. V. 73. № 3. P. 495.
Градов О.В., Насиров Ф.А., Яблоков А.Г. // Фотоника. 2018. Т. 12. № 7(75). С. 716.
Sharma G., Kodali V., Gaffrey M. et al. // Nanotoxicology. 2014. V. 8. № 6. P. 663.
http://www.science-education.ru/ru/article/view?id=10559.
Sobhani S., Pakdin-Parizia Z. // RSC Adv. 2014. V. 4. № 25. P. 13071.
Ansari M.O., Parveen N., Ahmad M.F. et al. // Sci. Rep. 2019. V. 9. Art. № 6912.
Нгуен Т.Л., Низамов Т.Р., Абакумов М.А. и др. // Изв. РАН. Сер. физ. 2018. Т. 82. № 9. С. 1335; Nguyen T.L., Nizamov T.R., Abakumov M.A. et al. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 9. P. 1214.
Демин А.М., Хонина Т.Г., Шадрина Е.В. и др. // Изв. АН. Сер. хим. 2019. № 6. С. 1178; Demin A.M., Kho-nina T.G., Shadrina E.V. et al. // Russ. Chem. Bull. 2019. V. 68. № 6. P. 1178.
Столяр С.В., Баюков О.А., Ладыгина В.П. и др. // Изв. РАН. Сер. физ. 2017. Т. 81. № 5. С. 660; Sto-lyar S.V., Bayukov O.A., Ladygina V.P. et al. // Bull. Russ. Acad. Sci. Phys. 2017. V. 81. № 5. P. 608.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая