Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1601-1604
Синтез, свойства и тестирование биогенных наночастиц ферригидрита in vivo
С. В. Столяр 1, 2, 3, В. П. Ладыгина 2, А. В. Болдырева 2, *, О. А. Коленчукова 3, А. М. Воротынов 1, М. Ш. Баирмани 4, 5, Р. Н. Ярославцев 1, 2, Р. С. Исхаков 1
1 Институт физики имени Л.В. Киренского Сибирского отделения Российской академии наук –
обособленное подразделение Федерального исследовательского центра
“Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
2 Федеральное государственное бюджетное научное учреждение
“Федеральный исследовательский центр “Красноярский научный центр
Сибирского отделения Российской академии наук”
Красноярск, Россия
3 Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
Красноярск, Россия
4 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Астраханский государственный университет”
Астрахань, Россия
5 Зеленый университет Aль-Касым, Биотехнологический колледж
Аль-Касым, Ирак
* E-mail: lampa15@bk.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
При культивировании микроорганизмов Klebsiella oxytoca, получен золь, содержащий биогенные наночастицы ферригидрита. В статье приводятся данные по изучению его физических свойств и влияния на организм лабораторных животных в модели экспериментальной гемолитической анемии по показателям функциональной активности эритроцитов и морфологическому описанию органов.
ВВЕДЕНИЕ
Ферригидрит Fe2O3 · nH2O или оксигидроксид Fe3+ по сравнению с гидроксидами и оксидами Fe3+ является соединением с наибольшей метастабильностью. Благодаря этому ферригидрит играет огромную роль в метаболизме живых организмов. Он формируется в ядре белкового комплекса – ферритина, представляющего собой капсулу из белка – апоферритина. Размер наночастиц ферригидрита лежит в диапазоне от 2 до 8 нм. Несмотря на то, что ферригидрит характеризуется антиферромагнитным порядком с температурой Нееля ~350 K, наличие дефектов, обусловленных наноразмерным состоянием, приводит к появлению у антиферромагнитной частицы нескомпенсированного магнитного момента [1–5]. Последнее открывает перспективы использования наночастиц ферригидрита в различных экологических [6, 7] и биомедицинских приложениях [8, 9]. Для лечения железодефицитной анемии используются железосодержащие комплексы, покрытые полисахаридами. Фармацевтические железо-полисахаридные комплексы состоят из наночастиц гидроксида железа размером несколько нанометров. Наночастицы ферригидрита, синтезируемые Klebsiella oxytoca, встроены в полисахаридную матрицу, поэтому также могут оказаться перспективным препаратом при железодефицитной анемии. Перспектива практического использования наночастиц ферригидрита требует изучения механизмов взаимодействия наночастиц с клетками организма, путей их преобразования и выведения, а также возможные токсические эффекты.
Цель данной работы заключается в изготовлении биогенных наночастиц ферригидрита в результате культивирования микроорганизмов Klebsiella oxytoca, изучении их физических свойств, а также в исследовании влияния золя ферригидрита на организм лабораторных животных при моделировании гемолитической анемии.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Используемые микроорганизмы Klebsiella oxytoca были выделены из сапропеля озера Боровое (Красноярский край). Микроорганизмы культуры Klebsiella oxytoca были высеяны на среду Lovley на цитрате железа. Для выделения ферригидрита из осадка и получения золя бактериальная биомасса была отделена от надосадочной жидкости, далее клетки бактерий разрушались ультразвуком. Полученный осадок промывали дистиллированной водой.
Спектры магнитного резонанса измеряли на спектрометре Bruker ELEXSYS 560, работающем в X-диапазоне (характерная частота СВЧ излучения ~9.4 ГГц) в диапазоне температур 100–300 K. Размер наночастиц определяли методом динамического рассеяния света (ДРС, DLS) на приборе Zetasizer Nano (Malvern Instruments Ltd, HeNe лазер, λ = 632.8 нм, Центр коллективного пользования (ЦКП) ФИЦ КНЦ СО РАН, г. Красноярск).
Для исследования влияния наночастиц на организм лабораторных животных использовали золь ферригидрита, концентрация железа в котором составляла 2.4 г/л. Концентрацию железа измеряли на атомно-абсорбционном спектрометре Perkin Elmer A Analyst 400 ЦКП ФИЦ КНЦ СО РАН. Дозировка стабилизированной суспензии ферригидрита была выбрана из расчета лечебной дозы коммерческого препарата ферранимала 75 (ООО Фирма “А-БИО”, Россия), представляющего собой коллоидный раствор комплекса гидроокиси трехвалентного железа в декстране.
Влияние препаратов изучали на половозрелых самцах крыс породы Вистар, массой тела 220 ± 40 г, из которых были сформированы 3 группы: 1 (8 крыс) – интактные животные; 2 (8 крыс) – многократное введение ферранимала-75; 3 (8 крыс) – многократное введение стабилизированной суспензии ферригидрита. У всех животных вызывалась токсическая гемолитическая анемия на первые сутки после начала эксперимента, путем внутрибрюшинного введения солянокислого фенилгидрозина в дозе 6 мг/100 гр массы тела.
В момент наступления анемии (4 сут) начинали воздействие препаратами (в одной дозировке 75 мг/кг Fe(III), внутримышечно, в заднебедренную группу мышц), которое продолжалось в течение 30 сут, каждые 8 сут. На 1, 4, 8, 15 и 30 сут определялись такие функциональные показатели эритроцитов, как насыщение гемоглобина кислородом и способность крови к переносу кислорода на приборе ABL-800 FLEX (Radiometr, Дания).
По окончании эксперимента всех животных подвергали эвтаназии. Материалом для гистологического исследования служили образцы печени и селезенки, из которых готовили гистологические препараты по стандартными методикам с окрашиванием для обзорных целей гематоксилином и эозином и на соединения железа [III] – по Перлсу.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
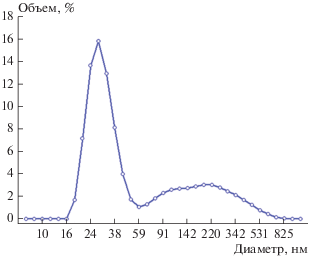
Результаты определения гидродинамического радиуса наночастиц в золях показаны на рис. 1. Распределение наночастиц имеет полимодальный вид с модальными значениями 28.2, 105.7 и 220.2 нм. Фактически, диаметр наночастиц ферригидрита, определенный с помощью просвечивающей электронной микроскопии, составляет 2–7 нм. Регистрируемые по динамическому рассеянию наночастицы представляют собой агрегаты. Агрегация магнитных наночастиц в коллоидных растворах обусловлена электростатическим и магнитостатическим взаимодействиями. Доля наноразмерных агрегатов с гидродинамическим диаметром порядка 28 нм составляет 65%, а доля крупных образований – 35%.
На рис. 2 приведена температурная зависимость ширины линии ферромагнитного резонанса ΔH(T) высушенного золя наночастиц. На вставке на рис. 2 приведены кривые резонансного поглощения для трех температур. Интенсивность сигнала ФМР практически линейно уменьшалась во всем измеряемом диапазоне температур, свидетельствуя о том, что наночастицы находятся в разблокированном, SP состоянии.
Рис. 2.
Температурная зависимость ширины линии ферромагнитного резонанса наночастиц ферригидрита. На вставке спектры ФМР для трех температур.

Согласно результатам [10], в порошках хаотически ориентированных частиц ферромагнетиков и ферритов, ширина линии поглощения оказывается немонотонной функцией температуры: ΔH(T) = ΔHs(T) + ΔHu(T), где ΔHs(T) – вклад в уширение, обусловленный суперпарамагнетизмом наночастиц, ΔHu(T) – вклад в уширение обусловленный разбросом направлений полей анизотропии частиц (неоднородное уширение). ΔHs(T) и ΔHu(T) являются функциями ланжевеновского параметра x = MVω/γkT, где M – намагниченность, V – объем частицы, k – постоянная Больцмана, Т – температура, ω – частота, γ – гиромагнитное отношение. ΔHs(T)= ωα(x – L1)/(√3xγL1); ΔHu(T) = = 3ωεL2/γL1, где α = 0.01 – параметр затухания, ε = = Kγ/Mω, K – константа анизотропии, L1,2 – функции Ланжевена. Кривая, проведенная на рис. 2 характеризуется двумя подгоночными параметрами: KV и MV. В нашем случае KV = 1.25 · · 10–14 эрг и MV = 2.37 · 10–17 emu. Полученная величина анизотропии находится в хорошем согласии с величинами KV для ферригидритов различного происхождения. Так, для ферритина KV = = 2.5 · 10–14 эрг [11], для ферригидрита, полученного методом химического осаждения KV = 2 · 10–14 эрг [12].
Исследование влияния золя ферригидрита, при экспериментальном моделировании гемолитической анемии у крыс показало его большую эффективность относительно коммерческого препарата ферранимал-75. Так, во 2 и 3 группах, на четвертые сутки после введения фенилгидрозина отмечено снижение исследуемых показателей в 1.65 раза (p = 0.036) относительно контрольной группы. На 15 сут после введения золя ферригидрита и коммерческого препарата во 2 группе происходила стабилизация показателей и возвращение их к контрольному диапазону при этом, у крыс 3 группы исследуемые показатели были выше контроля в 1.2 раза (р = 0.04).
Морфологические изменения, обнаруженные при изучении печени крыс 1 группы, включают в себя, нарушение гемодинамики и развитие альтернативных процессов в паренхиматозных клетках органа. Балочное строение органа сохранено, гепатоциты в состоянии зернистой дистрофии. Окраска по Перлсу отрицательная.
При исследовании печени животных 2 группы, отмечались дистрофические процессы и отложение гемосидерина в паренхиме органа (рис. 3а). Балочное строение печени сохранено, гепатоциты в состоянии зернистой дистрофии. Окраска по Перлсу положительная.
Рис. 3.
Гистологические препараты органов крысы. Окуляр ×10, объектив ×40. (а) Печень крысы 2 группы. Отмечается отложение гемосидерина. Окраска гематоксилином и эозином. (б) Печень крысы 3 группы. Видны единичные частицы, окрашенные в синий цвет. Окраска по Перлсу. (в) Селезенка крысы 2 группы. Отмечается отложение гемосидерина в красной и белой пульпе. Окраска гематоксилином и эозином. (г) Печень крысы 3 группы. Видны наночастицы ферригидрита, окрашенные в синий цвет в красной и белой пульпе органа.
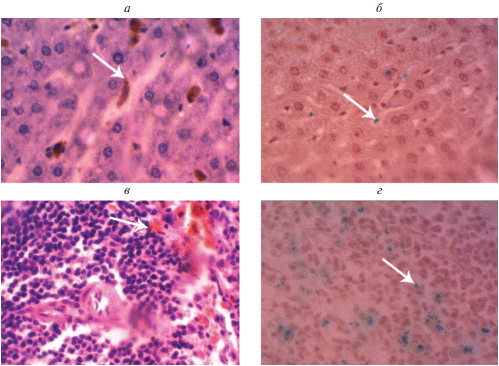
В печени у крыс 3 группы отмечается сохранение балочного строения органа. Гепатоциты находились в состоянии умеренной зернистой дистрофии. Окраска по Перлсу положительная и показывает частичное распределение наночастиц железа в паренхиме органа (рис. 3б).
Микроморфология селезенки у крыс 1 группы не нарушена. Паренхима органа представлена хорошо различимой красной и белой пульпой. Окраска по Перлсу отрицательная.
При исследовании селезенки 2 опытной группы основные структурные элементы органа в виде белой и красной пульпы хорошо различимы. Фолликулы средних и крупных размеров. В красной и белой пульпе отмечается отложение гемосидерина в виде зерен (рис. 3в), дающих положительную реакцию на железо при окраске по Перлсу.
В селезенке крыс 3 группы, отмечалось распространение наночастиц как в паренхиме, так в строме органа, дающих положительную реакцию при окраске по Перлсу (рис. 3г). В селезенке отмечается увеличение площади красной пульпы, по отношению к белой. Фолликулы имели разные размеры.
ЗАКЛЮЧЕНИЕ
В работе были исследованы наночастицы биогенного ферригидрита, синтезированные в результате культивирования бактерий Klebsiella oxytoca. Из температурных зависимостей ширины линии ФМР определены величины, характеризующие анизотропию и намагниченность: KV = 1.25 · 10–14 эрг и MV = 2.37 · 10–17 emu соответственно.
Изучение функциональной активности эритроцитов показало быстрое восстановление контрольных параметров при воздействии золя ферригидрита в отличие от коммерческого препарата ферранимала-75.
Результаты гистологического исследования показывают разное накопление железа. Коммерческий препарат обладает хронической токсичностью, и характеризуются накоплением железа в печени и селезенке в виде гемосидерина. При введении в организм золя ферригидрита отмечается частичное отложение гемосидерина в печени, что указывает на быструю элиминацию из органа и отложение в селезенке, свидетельствующие о компенсаторном усилении гемопоэза.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований, Правительства Красноярского края, Красноярского краевого фонда поддержки научной и научно-технической деятельности в рамках научного проекта № 19-42-240012 р_а “Магнитный резонанс в наночастицах ферригидрита: эффекты, связанные со структурой “ядро–оболочка”. Работа поддержана грантом Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук № МК-1263.2020.3.
Список литературы
Silva N.J.O., Amaral V.S., Carlos L.D. // Phys. Rev. B. 2005. V. 71. № 18. Art. № 184408.
Seehra M.S., Singh V., Song X. et al. // J. Phys. Chem. Sol. 2010. V. 71. № 9. P. 1362.
Balaev D.A., Krasikov A.A., Dubrovskiy A.A. et al. // J. Appl. Phys. 2016. V. 120. № 18. Art. № 183903.
Балаев Д.А., Красиков А.А., Дубровский А.А. и др. // Физ. тв. тела. 2016. Т. 58. № 2. С. 280; Balaev D.A., Krasikov A.A., Dubrovskiy A.A. et al. // Phys. Sol. St. 2016. V. 58. № 2. P. 287.
Столяр С.В., Баюков О.А., Гуревич Ю.Л. и др. // Изв. РАН. Сер. физ. 2007. Т. 71. № 9. С. 1320; Stolyar S.V., Bayukov O.A., Gurevich Yu.L. et al. // Bull. Russ. Acad. Sci. Phys. 2007. V. 71. № 9. P. 1286.
Casentini B., Gallo M., Baldi F. // J. Environ. Chem. Eng. 2019. V. 7. № 1. Art. № 102908.
Столяр С.В., Баюков О.А., Ладыгина В.П. и др. // Изв. РАН. Сер. физ. 2017. Т. 81. № 5. С. 660; Stolyar S.V., Bayukov O.A., Ladygina V.P. et al. // Bull. Russ. Acad. Sci. Phys. 2017. V. 81. № 5. P. 608.
Инжеваткин Е.В., Коленчукова О.А., Добрецов К.Г. и др. // Бюлл. эксп. биол. и мед. 2020. Т. 169. № 5. С. 614.
Stolyar S.V., Balaev D.A., Ladygina V.P. et al. // J. Supercond. Nov. Magn. 2018. V. 31. № 8. P. 2297.
Poperechny I.S., Raikher Y.L. // Phys. Rev. B. 2016. V. 93. № 1. Art. № 14441.
Wajnberg E., El-Jaick L.J., Linhares M.P. et al. // J. Magn. Reson. 2001. V. 153. № 1. P. 69.
Столяр С.В., Ярославцев Р.Н., Исхаков Р.С. и др. // ФТТ. 2017. Т. 59. № 3. С. 555; Stolyar S.V., Yaroslav-tsev R.N., Iskhakov R.S. et al. // Phys. Sol. St. 2017. V. 59. № 3. P. 555.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая