Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1530-1536
Развитие метода поверхностно-селективного лазерного спекания: модификация и формирование 3D структур для тканевой инженерии
Н. В. Минаев 1, *, Т. С. Демина 2, 3, С. А. Минаева 1, А. А. Дулясова 1, 4, Е. Д. Минаева 1, 4, С. А. Гончуков 4, 5, Т. А. Акопова 3, П. С. Тимашев 1, 2, 6
1 Федеральное государственное учреждение “Федеральный научно-исследовательский центр
“Кристаллография и фотоника” Российской академии наук, Институт фотонных технологий
Российской академии наук
Москва, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
Первый Московский государственный медицинский университет имени И.М. Сеченова
Министерства здравоохранения Российской Федерации (Сеченовский Университет),
Институт регенеративной медицины
Москва, Россия
3 Федеральное государственное бюджетное учреждение науки
Институт синтетических полимерных материалов имени Н.С. Ениколопова Российской академии наук
Москва, Россия
4 Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
5 Федеральное государственное бюджетное учреждение науки
Физический институт имени П.Н. Лебедева Российской академии наук
Москва, Россия
6 Федеральное государственное бюджетное учреждение науки
Федеральный исследовательский центр химической физики имени Н.Н. Семенова Российской академии наук
Москва, Россия
* E-mail: minaevn@gmail.com
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Описано применение метода поверхностно-селективного лазерного спекания для формирования и модификации архитектуры трехмерных структур из биосовместимых и биорезорбируемых материалов на основе полилактида. Реализуемый подход позволяет в значительной степени исключить процессы термодеградации спекаемых материалов, локализуя процессы нагрева на их поверхности. Это достигается с помощью селективного поглощения лазерного излучения среднего инфракрасного диапазона (1.9 мкм) в тонком слое на поверхности полимерных частиц (волокон) благодаря нанесению мелкодисперсных водяных капель или использованию гигроскопичных покрытий, интенсивно поглощающих энергию используемого лазерного излучения по сравнению с полимерным материалом.
ВВЕДЕНИЕ
Методы лазерных технологий в медицине активно развивались в отделе Лазерной атомно-молекулярной технологии (ЛАМТ) ОПЛТ ИПЛИТ РАН под руководством В.Н. Баграташвили с середины 1990 гг. Совместно с медиками здесь были разработаны основы лазерной инженерии хрящей и технология неинвазивной термопластики хрящевых тканей [1]. В 2000 г. были опубликованы первые результаты использований этой технологии в клинике для коррекции формы перегородки носа [2], а в 2006 г. вышла монография “Лазерная инженерия хрящей” [3]. C использованием лазерных технологий в отделе ЛАМТ на подложки различной природы наносились биосовместимые покрытия [4], а также исследовалось воздействие лазерного излучения на биологические ткани [5].
Группа под руководством В.Н. Баграташвили начала вести работы в новом междисциплинарном направлении – тканевой инженерии. Одним из подходов тканевой инженерии является замещение фрагмента ткани или органа искусственным матриксом (скаффолдом), изготовленным из биосовместимых и биорезорбируемых материалов [6–9], в ряде случаев заселенных клетками (тканеинженерная конструкция). Матриксы должны обладать заданной трехмерной структурой и рядом свойств, таких как способность к биорезорбции с определенной скоростью, соответствующей формированию новой ткани, способность поддерживать адгезию, рост и направленную дифференциацию клеток. Другие функциональные характеристики матрикса также должны соответствовать функциям замещаемой ткани или органа [6, 7]. Стоит отметить, что, наиболее перспективными для формирования матриксов для тканевой инженерии являются аддитивные технологии, т. к. позволяют создавать трехмерные матриксы с заданной структурой и свойствами [10–14].
Научная группа В.Н. Баграташвили, имевшая значительный опыт в создании биосовместимых материалов, предложила оригинальный метод создания трехмерных структур, основанный на поверхностно-селективном лазерном спекании (ПСЛС) полимерных частиц посредством сенсибилизатора, который хорошо поглощает лазерное излучение [15]. В качестве сенсибилизатора вначале использовали наночастицы углерода. При воздействии лазерного излучения этот порошок значительно нагревается, что может привести к термодеструкции полимера. Тем не менее, благодаря локализации сенсибилизатора на поверхности полимерных частиц, полного их плавления обычно не происходит, что важно в случаях использования термолабильных биологически активных наполнителей [16]. Метод ПСЛС был успешно применен для формирования трехмерных структур для тканевой инженерии. Было показано, что на сформированных структурах происходит направленная дифференцировка мезенхимальных стволовых клеток в остеобласты [17] и регенерацией костной ткани [18].
В 2015 г. разработанный метод ПСЛС получил свое развитие, когда в качестве сенсибилизатора стали использовать мелкодисперсный аэрозоль воды и лазерное излучение с длиной волны 1.9 мкм для нагрева [19]. Это позволило отказаться от частиц углерода, что повысило биосовместимость создаваемых структур и скорость их формирования. В представленной работе метод ПСЛС на основе аэрозоля воды используется для дополнительной пространственной сшивки полимерных структур из нетканых материалов, полученных методом элетроформования.
МАТЕРИАЛЫ И МЕТОДЫ
Для реализации метода ПСЛС используется излучение инфракрасного лазера с длиной волны 1.9 мкм, слабо поглощающееся в полимерных материалах (коэффициент поглощения <1 см–1), и обладающее значительно более высоким поглощением в воде (~100 см–1) [19]. Такой подход позволяет формировать трехмерные структуры необходимой архитектуры путем спекания поверхностного слоя полимерных частиц из-за локализации процесса нагрева на их поверхности. Метод ПСЛС позволяет формировать трехмерные структуры из различных материалов, включая биосовместимые коммерчески доступные и одобренные к применению полимеры из клинической практики, а также проводить модификацию архитектуры готовых трехмерных структур.
В настоящей работе использовали полилактид (ПЛ) – синтетический биорезорбируемый полиэфир, который одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration) (США) и имеет длительную историю успешного применения в клинике в качестве саморассасывающихся хирургических нитей, крепежных конструкций и различных матриксов для регенеративной медицины [20–23]. В работе использовали ПЛ марки Natureworks 4043D, из которого формовали нетканые волокнистые материалы и микрочастицы. Также в работе использовали хитозан с молекулярной массой 80 кДа и степенью ацетилирования 0.15 и амфифильный сополимер хитозана с олиго(L,L-лактидом) и коллагеном [18].
Размер частиц порошка определяет, с одной стороны, разрешение (размер единичного элемента) формируемых методом ПСЛС структур, с другой сказывается на производительности метода. Распределение частиц порошка по размерам и их форма определяют плотность упаковки и эффект усадки после спекания [16]. В случае ПСЛС также важно обеспечить эффективную и равномерную локализацию процесса поглощения лазерного излучения среднего ИК-диапазона сенсибилизатором нагрева на поверхности частиц порошка. С учетом выбора воды в качестве сенсибилизатора и гидрофобной природы ПЛ, необходимо нанести гигроскопичное покрытие на поверхность частиц полимера.
В настоящей работе формировали покрытие из хитозана – продукта деацетилирования природного полисахарида хитина. Этот выбор обусловлен рядом факторов: хитозан достаточно легко сорбирует воду и удерживает ее; хитозан является биосовместимым и биодеградируемым полимером и широко используется в тканевой инженерии, т.к. обеспечивает хорошую адгезию и рост различных клеток [24, 25]; будучи полиоснованием хитозан может нейтрализовать продукт деградации ПЛ – молочную кислоту и предотвращать локальное закисление ткани, приводящее к развитию воспалительного процесса [26].
Микрочастицы для дальнейшего их спекания в трехмерные структуры методом ПСЛС получали с помощью двух разных подходов. В первом случае исходные гранулы ПЛ измельчали в механической мельнице при температуре минус 22°С и отбирали для дальнейшей работы фракцию частиц с размерами 100–200 мкм. Поверхность полученных микрочастиц покрывали хитозаном по следующей методике. Молотый порошок ПЛ диспергировали в смеси ацетона с водой (1 : 1 об./об.) в течение 2 ч при постоянном перемешивании на магнитной мешалке для частичного набухания поверхностного слоя частиц ПЛ. Далее порошок быстро фильтровали для отделения раствора ацетон/вода и помещали в 1 мас. % раствор хитозана в 1% уксусной кислоты и инкубировали в течение 24 ч для иммобилизации хитозана в набухший поверхностный слой порошка ПЛ [23]. Порошок с иммобилизованным хитозаном промывали дистиллированной водой до удаления несвязанного хитозана и сушили в тонком слое в беспылевом шкафу.
Использование микрочастиц нерегулярной морфологии не является оптимальным для ПСЛС, а необходимость дополнительного многостадийного этапа нанесения покрытия из хитозана в процессе пост-обработки молотых микрочастиц снижает технологичность этого подхода. Для решения этих проблем был реализован другой подход для получения микрочастиц со структурой ядро/оболочка – получение методом испарения из эмульсий масло/вода [24]. При испарении растворителя из дисперсной “масляной” фазы (раствора полилактида) формируется ядро микрочастицы, а эмульгатор, растворенный в дисперсионной “водной” среде для стабилизации границы раздела фаз масло/вода, остается иммобилизованным на их поверхности и формирует оболочку. В настоящей работе в качестве эмульгатора использовали сополимер хитозана с олиголактидом и коллагеном. Благодаря прививке на основную цепь хитозана фрагментов гидрофобного олиголактида, сополимер обладает амфифильными свойствами и способен эффективно работать в качестве эмульгатора, обеспечивая высокий выход микрочастиц, а также аффинность хитозана/коллагена к ядру из полилактида и прочность их сцепления с ядром. В качестве дисперсной “масляной” фазы использовали 6 мас. % раствор ПЛ в смеси дихлорметан : ацетон (9 : 1 об./об.), который диспергировали в дисперсионной “водной” среде – 1 мас. % растворе сополимера хитозана в 2% уксусной кислоте. Смешение фаз масло/вода в соотношении (1 : 9 об./об.) проводили с помощью четырех-лопастной мешалки при скорости 700 об./мин при контролируемой температуре до полного испарения растворителей из дисперсной фазы и получения твердых микрочастиц из ПЛ с поверхностным слоем, обогащенным сополимером хитозана. Микрочастицы промывали дистиллированной водой, замораживали и сушили лиофильно.
Нетканые волокнистые материалы широко используются в качестве полимерной основы при регенерации тканей полых органов, которые состоят из нескольких слоев различных типов клеток (трахея, уретра и т.д.), и для успешного культивирования которых необходимо варьировать морфологию/архитектуру подложки [27]. Регулирование архитектуры на стадии формирования нетканых материалов методом электроспининга требует решения достаточно сложных технологических задач, поэтому разработка простых и эффективных методов “настройки” их структуры/свойств является важной задачей. В настоящей работе в качестве средства регулирования архитектуры готовых структур из нетканых материалов из ПЛ применяется метод ПСЛС. Нетканый материал получали методом электроформования на установке NanoNC (Модель ESR100D) из 10 мас. % раствора ПЛ в дихлорэтане. Процесс проводили с помощью инъекционной иглы 23G при напряжении +23…27.5 кВ, со скоростью подачи формовочного раствора 0.1–1 мл/ч, температуре 20–23°С и влажности не более 50%. Расстояние между иглой и коллектором (пластина из нержавеющей стали 30 × 30 см) варьировали от 18 до 20 см.
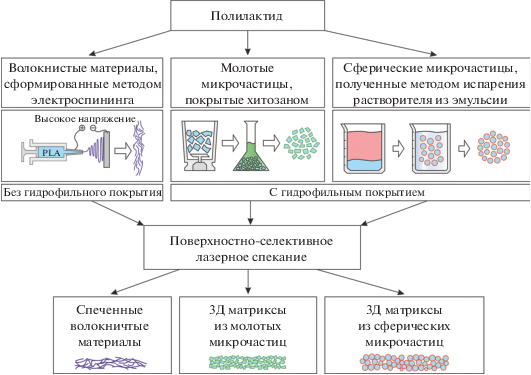
На рис. 1 схематично представлены использованные в работе методы получения материалов и их модификация методом ПСЛС. Для реализации ПСЛС использовалась оригинальная установка [28]. В основе экспериментальной системы лежит одномодовый тулиевый волоконный инфракрасный лазер TLM-3 (НТО “ИРЭ-полюс”) с длиной волны 1.9 мкм. Высокая производительность установки обеспечивается системой доставки лазерного излучения, основанной на высокоскоростном двухзеркальном гальваносканере и инфракрасном F-theta объективе (SL-2000-100-160, RonarSmith, Сингапур), обеспечивающим формирование пятна диаметром 280 мкм в рабочем поле диаметром 30 или 50 мм с возможностью увеличения до 140 мм. Характерное разрешение лазерного воздействия, сопоставимое с размером сфокусированного лазерного пятна, находится в диапазоне 100–300 мкм. Система автоматического увлажнения обрабатываемого материала с помощью ультразвукового пьезоэлемента обеспечивает интенсивный поток мелкодисперсного водяного тумана на целевую поверхность c производительностью до 1 мг/с. Рабочие элементы системы нанесения и формирования слоев порошка выполнены из нержавеющей стали и стекла, что обеспечивает необходимый режим чистоты при работе с биологическими материалами. Все операции на системе максимально автоматизированы с целью улучшения воспроизводимости параметров образцов.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Формирование трехмерных структур заданной морфологии методом ПСЛС происходит путем послойного спекания дисперсных материалов (порошков), от характеристик которых зависит формирование и свойства получаемого изделия. В настоящей работе в качестве порошковых материалов для ПСЛС использовались микрочастицы из биосовместимого и биорезорбируемого полимера полилактида, покрытые гигроскопичным покрытием и вода в качестве сенсибилизатора нагрева [19].
Микрочастицы из ПЛ, сформированные методом механического помола с последующим покрытием хитозаном, имеют нерегулярную форму (см. рис. 2а). Для процесса спекания использовалось непрерывное лазерное излучение со следующими параметрами: длина волны – 1.9 мкм, плотность мощности – до 1.2 ⋅ 102 Вт/см2, диаметр пятна – ~280 мкм, скорость перемещения лазерного пятна – 20 мм/с, заливка контура в виде сетки (два набора параллельных линий под углом 90°), плотность заливки – 15 линий/мм. Полученная спеченная структура из микрочастиц сохранила свободный объем среди частиц и обладает необходимой механической прочностью для проведения манипуляций. Спеченные микрочастицы приобрели более скругленные очертания (см. рис. 2б).
Рис. 2.
Электронные фотографии микрочастиц, полученных методом помола и последующей модификации до воздействия лазерного излучения (a) и после процесса ПСЛС (б). Масштабный штрих 300 мкм.

Микрофотография синтезированных сферических частиц из ПЛ представлена на рис. 3а. Эти частицы были значительно удобнее в работе, особенно на этапе послойного формирования трехмерных структур, по сравнению с частицами, полученными первым методом механического измельчения. Параметры лазерного воздействия были аналогичны предыдущему режиму для микрочастиц, полученных методом помола. Однако, для получения оптимального режима использовалась немного увеличенная скорость перемещения лазерного пятна – 25 мм/с. Полученные структуры из спечённых сферических микрочастиц также обладали необходимой прочностью для проведения дальнейших манипуляций (см. рис. 3б).
Рис. 3.
Электронные фотографии сферических микрочастиц, полученных методом двойной эмульсии до воздействия лазерного излучения (a) и после процесса ПСЛС (б). Масштабный штрих 200 мкм.

Нетканый материал из ПЛ, полученный методом электроформования, состоящий из хаотично расположенных волокон со средним диаметром 3 мкм представлен на рис. 4а. Для модификации морфологии поверхности использовались параметры, аналогичные предыдущим режимам для микрочастиц, но использовалась более высокая скорость перемещения лазерного пятна – 50 мм/с и более низкая плотность заливки – 12 линий/мм. Воздействие лазерного излучения среднего ИК-диапазона на нетканый материал, увлажненный мелкодисперсным водяным аэрозолем в течение 20 с, приводит к частичному подплавлению поверхности волокон и их спеканию с образованием узлов или проплавленных отверстий (см. рис. 4б). Варьирование параметров лазерного излучения позволяет регулировать получаемый эффект обработки. Кроме того, при реализации подхода ПСЛС, возможно модифицирование нетканых материалов в глубине, т. к. излучение слабо поглощается самими полимерными волокнами и может достигать нижних слоев волокон.
Рис. 4.
Нетканый материал до воздействия лазерного излучения (a) и с измененной морфологией после процесса ПСЛС (б). Масштабный штрих 100 мкм.

В литературе представлены работы по прямому спеканию волокон с использованием лазерного излучения более коротковолнового диапазона (1064 нм), которые также отмечают возможность менять морфологию волокнистых материалов [29]. Однако в случае ПСЛС, подплавляется только поверхность нитей, а материал внутри структуры не подвергается перегреву и плавлению (см. рис. 4б). Это наблюдается также при формировании трехмерных структур из микрочастиц, что является важным преимуществом метода ПСЛС и дает возможность работать с материалами, наполненными термочувствительными компонентами [30].
ЗАКЛЮЧЕНИЕ
Показана перспективность метода поверхностно-селективного лазерного спекания для создания и модифицирования различных форм материалов биомедицинского назначения. Приведены различные подходы к получению полимерных дисперсных порошков, обладающих характеристиками, необходимыми для их послойного спекания и формования на их основе трехмерных структур с заданной архитектоникой. Оптимизированы и описаны основные параметры лазерного воздействия среднего ИК диапазона, обеспечивающие спекание полимерных порошков без их плавления по объему, что открывает возможности для создания мультифункциональных материалов, наполненных термочувствительными биоактивными соединениями. Также показана универсальность метода ПСЛС и его применимость для селективного структурирования сформованных другими методами полимерных волокнистых материалов.
Представленная в настоящей статье работа является продолжением и развитием идей, предложенных Виктором Николаевичем Баграташвили [15, 16, 19]. К настоящему моменту наука накопила огромный запас знаний и практически истощила возможности прорывов в отдельных отраслях. В сложившейся ситуации особую роль играют ученые, способные заглянуть за границы этих отраслей и расширить область своих интересов на соседние направления, работая на стыке различных дисциплин. Виктор Николаевич Баграташвили смог собрать воедино наработки в области физики, полимерной химии и биологии, сформировав на их основе новое динамично развивающееся направление материаловедения, нацеленное на решение биомедицинских задач с использованием физических методов воздействия. Идеи В.Н. Баграташвили развиваются и, мы уверены, они обеспечат тот прорыв в материаловедении, который необходим для широкого распространения принципов регенеративной медицины в повседневной клинической практике.
Работа выполнена при поддержке РФФИ (проекты № 18-29-17050 в части формования нетканых материалов методом электроспининга и № 18-32-20184 в части разработки методики поверхностно-селективного лазерного спекания), Министерства науки и высшего образования в рамках выполнения работ по государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части развития лазерных аддитивных технологий и ИСПМ РАН в части исследования материалов из алифатических полиэфиров, Russian academic excellence project “5-100”.
Список литературы
Helidonis E., Sobol E., Kavvalos G., Bizakis J. et al. // Am. J. Otolaryngol. 1993. V. 14. № 6. P. 410.
Sobol E., Sviridov A., Omel’chenko A. et al. // Biotechnol. Genet. Eng. Rev. 2000. V. 17. № 1. P. 553.
Баграташвили В.Н., Басков А.В., Борщенко И.А. и др. Лазерная инженерия хрящей. М.: Физматлит, 2006. 488 с.
Ball M., Downes S., Scotchford C. et al. // Biomaterials. 2001. V. 22. № 4. P. 337.
Sobol E.N., Sviridov A.P., Bagratashvili V.N. // Proc. SPIE. 1993. V. 2080. P. 130.
Asghari F., Samiei M., Adibkia K. et al. // Artif. Cells Nanomed. Biotechnol. 2017. V. 45. № 2. P. 185.
Jafari M., Paknejad Z., Rad M.R. et al. // J. Biomed. Mater. Res. B. 2017. V. 105. № 2. P. 431.
Bandyopadhyay S., Hablitz J.J. // J. Neurophysiol. 2007. V. 97. № 6. P. 4120.
Yeong W.Y., Sudarmadji N., Yu H. et al. // Acta Biomater. 2010. V. 6. № 6. P. 2028.
Mazzoli A. // Med. Biol. Engin. Comput. 2013. V. 51. № 3. P. 245.
Schmid M., Amado A., Wegener K. // J. Mater. Res. 2014. V. 29. № 17. P. 1824.
Moreno Madrid A.P., Vrech S.M., Sanchez M.A. et al. // Mater. Sci. Engin. C. 2019. V. 100. № 3. P. 631.
Demina T.S., Bardakova K.N., Minaev N.V. et al. // Polymers (Basel). 2017. V. 9. № 7. P. 302.
Eosoly S., Brabazon D., Lohfeld S. et al. // Acta Biomater. 2010. V. 6. № 7. P. 2511.
Antonov E.N., Bagratashvili V. N., Whitaker M.J. et al. // Adv. Mater. 2005. V. 17. № 3. P. 327.
Antonov E.N., Bagratashvili V.N., Howdle S.M. et al. // Laser Phys. 2006. V. 16. № 5. P. 774.
Kanczler J.M., Mirmalek-Sani S.-H., Hanley N.A. et al. // Acta Biomater. 2009. V. 5. № 6. P. 2063.
Kuznetsova D., Prodanets N., Rodimova S. et al. // Cell Adh. Migr. 2017. V. 11. № 3. P. 233.
Антонов Е.Н., Кротова Л.И., Минаев Н.В. // Квант. электрон. 2015. Т. 45. № 11. С. 1023; Antonov E.N., Krotova L.I., Minaev N.V. et al. // Quant. Electron. 2015. V. 45. № 11. P. 1023.
Poh P.S.P., Chhaya M.P., Wunner F.M. // Adv. Drug Deliv. 2016. V. 107. P. 228.
Ge Z., Tian X., Heng B.C., Fan V. et al. // Biomed. Mater. 2009. V. 4. № 2. Art. № 021001.
Bose S., Vahabzadeh S., Bandyopadhyay A. // Mater. Today. 2013. V. 16. № 12. P. 496.
Rosenzweig D.H., Carelli E., Steffen T. et al. // Int. J. Mol. Sci. 2015. V. 16. № 7. Art. № 15118.
Anitha A., Sowmya S., Kumar P.T.S. et al. // Prog. Polym. Sci. 2014. V. 39. № 9. P. 1644.
Ahsan S.M., Thomas M., Reddy K.K. et al. // Int. J. Biol. Macromol. 2018. V. 110. P. 97.
Shen Y., Tu T., Yi B. et al. // Acta Biomater. 2019. V. 97. P. 200.
Romanova O.A., Tenchurin T.H., Demina T.S. et al. // Cell Prolif. 2019. V. 52. № 3. P. 12598.
Минаев Н.В., Антонов Е.Н., Минаева С.А. и др. // ПТЭ. 2019. № 1. С. 150.
Tiaw K.S., Goh S.W., Hong M. et al. // Biomaterials. 2005. V. 26. № 7. P. 763.
Antonov E.N., Bagratashvili V.N., Bochkova S.A. et al. // Proc. 6th PBP Meeting (Barcelona, 2008).
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая