Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1537-1541
Гибридные лазерные нанотехнологии для борьбы с резистентными бактериальными биопленками
А. А. Ионин 1, С. А. Гончуков 1, 4, Д. А. Зазымкина 1, А. Н. Кириченко 3, С. И. Кудряшов 1, А. А. Настулявичус 1, *, Ю. М. Романова 1, 2, И. Н. Сараева 1, Н. А. Смирнов 1, Э. Р. Толордава 1, 2
1 Федеральное государственное бюджетное учреждение науки
Физический институт имени П.Н. Лебедева Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное учреждение
“Национальный исследовательский центр эпидемиологии и микробиологии
имени почетного академика Н.Ф. Гамалеи” Министерства здравоохранения Российской Федерации
Москва, Россия
3 Федеральное государственное бюджетное научное учреждение
“Технологический институт сверхтвердых и новых углеродных материалов”
Москва, Россия
4 Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский ядерный университет “МИФИ”
Москва, Россия
* E-mail: ganuary_moon@mail.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Представлены активные и пассивные гибридные методы борьбы с биопленками и планктонной формой патогенных микроорганизмов на основе различных бактерицидных наноматериалов, полученных с помощью современных лазерных технологий. Описан инновационный мобильный лазерно-аппликационный метод полного подавления биопленок in situ.
ВВЕДЕНИЕ
В настоящее время одной из проблем мирового масштаба является борьба с патогенными микроорганизмами [1]. Особенно устойчивыми являются возбудители, способные к формированию биопленок. Биопленки являются формой микробных сообществ, фиксированных на различных поверхностях [2]. Большинство организмов обладает способностью формировать биопленки. Традиционными методами борьбы с микроорганизмами считаются антибиотики, дезинфицирующие химические средства [3]. Данные методы не являются панацеей и у них есть свои минусы. Так, у микробов может появляться резистентность к антибиотикам, а химические вещества по большой части вредны и для самого человеческого организма. Решение проблемы антимикробной резистентности является одной из ключевых в современной медицине. Поэтому на повестке дня современной медицинской микробиологии стоит поиск альтернативных способов борьбы с патогенными микроорганизмами.
В последние годы появилось большое количество работ, в которых предлагают новые методы борьбы с микроорганизмами. К таким разработкам можно отнести создание микро- или наноструктур на поверхности материалов [4–6]. Данные структуры могут обладать уникальными физико-химическими свойствами. Идею использовать наноструктуры в борьбе с микроорганизмами учёные почерпнули из природы. Известным примером является плотная текстура из наноиголок на крыльях цикады, которые обладают механическим бактерицидным эффектом, а также свойством гидрофобности.
Одним из наиболее востребованных методов получения микро-нанорельефа является лазерное текстурирование поверхности. Этот метод является востребованным благодаря своей простоте и эффективности, а также широкому кругу материалов, из которых можно получить нужные структуры. Так, искусственные нанопичковые структуры, сформированные с помощью лазерного излучения, были получены на поверхностях металлов, полупроводников, полимеров [7–9]. Успешно используются для борьбы с бактериями антибактериальные наночастицы, действующие посредством генерации синглетного кислорода или его других реакционноспособных форм [10–14]. Также, большое внимание исследователей привлекает антимикробная фотодинамическая терапия, которая благодаря окислительному характеру повреждений клеточных компонентов препятствует развитию устойчивости [15–18].
В настоящей работе исследовалась бактерицидная активность различных типов наноматериалов и поверхностных наноструктур, полученных с помощью современных лазерных технологий, в отношении патогенных микроорганизмов в форме планктона и биопленок. Также, изучались возможности инновационного лазерно-аппликационного метода полного подавления биопленок in situ.
МАТЕРИАЛЫ И МЕТОДЫ
Лазерная фабрикация квазирегулярных микро-наноструктур на поверхности полированной пластины кремния n-типа и нержавеющей стали марки 12X18H10T осуществлялась с помощью волоконного фемтосекундного лазера Satsuma с длиной волны 1030 нм, длительностью импульса: 300 фс и частотой сканирования 160 кГц. На поверхности выбирался участок размерами 1 × 1 см. Лазерное излучение фокусировалось на поверхности в пятно размером 1/e ≈ 15 мкм. В качестве среды обработки использовались дистиллированная вода и воздух.
Генерация наночастиц и перенос металлических пленок в виде наночастиц на бактериальные биопленки осуществляли с помощью волоконного наносекундного лазера HTF MARK (Булат) (длина волны – 1064 нм, длительность импульса на полувысоте – 120 нс, максимальная энергия в импульсе – 1мДж, частота повторения импульсов – до 80 кГц). Излучение фокусировалось и сканировалось гальваносканнером с фокусным расстоянием объектива 160 мм. Металлические пленки напылялись на полимерные подложки методом магнетронного распыления в атмосфере аргона. Пластик с напыленной на него тонкой (≈120 нм) металлической (Au, Ag, Cu) пленкой подвергали воздействию лазерного излучения с энергией в импульсе 0.2 мДж, частотой следования импульса 20 кГц и скоростью сканирования 1500 мм/с. Минимальный размер пятна фокусировки при этом составлял ≈80 мкм, интенсивность излучения достигала 100 МВт/см2. Расстояние между мишенью и стеклом с биопленкой составляло 2 мм.
Визуализация структурированных поверхностей и наночастиц производилась с помощью сканирующего электронного микроскопа (СЭМ, JEOL 7001F). Элементный состав анализировался методом энергодисперсионной рентгеновской спектроскопии (ЭДРС, INCA (Oxford Instruments)).
Антибактериальное действие образцов было проверено на грамположительных бактериях золотистого стафилококка и грамотрицательных синегнойной палочки. Эти бактерии использовались в планктонной форме и форме их биопленок – прочных полимерных матриц, которые позволяют бактериям оставаться в гидратированной среде, обеспечивая тем самым их высокое антибиотическое сопротивление. 18-часовая культура каждой бактерии, которая выращивалась в питательной среде (лизогенный бульон, LB), разбавлялась свежим LB 1 : 100. Затем, 2 мл лизогенного бульона в чашке Петри помещали под исследуемое стекло. Для формирования биопленок требовалась 4-часовая инкубация при температуре 37°С.
Для исследований планктонных бактерий ночную бульонную культуру разводили 100 раз, центрифугировали и удаляли питательный бульон. Осевшие на дне пробирки бактерии ресуспендировали в физиологический раствор и разливали по 1 мл в лунки 24-луночного планшета. В лунки помещали образцы одинакового размера. Планшет с образцами ставили на качалку и инкубировали в течение 60 мин в термостате при температуре 37°С. Затем бактерии высевали на плотную питательную среду и считали КОЕ (колониеобразующая единица). Контролем в этих опытах служили пластины чистого (неструктурированного) металла и/или стекла. Опыты проводили в трех повторах. Жизнеспособность бактерий оценивали с помощью набора красителей Live/Dead Bacterial Viability Kit. Для этого, вначале на поверхность исследуемых и контрольных образцов наносили бактериальные культуры (капли объемом 200 мКл) и инкубировали в течение 60 мин во влажной камере. Затем образцы окрашивали флуоресцентными красками пропидиум иодидом и Цито9, следуя протоколу метода окрашивания LIVE/DEAD, а после окрашивания промывали стерильной водой. Такой метод исследования позволяет выявлять живые и мертвые клетки бактерий. Живые бактерии флюоресцируют зеленным цветом, а мертвые – красным.
РЕЗУЛЬТАТЫ
Периодические поверхностные наноструктуры, генерируемые ультракороткими лазерными импульсами в дистиллированной воде на поверхности кремния, демонстрируют уменьшение КОЕ/мл патогенных грам-положительных микроорганизмов S.aureus от начальной концентрации примерно на 1 порядок, что в микробиологической практике обычно считается незначительным (значительным считается уменьшение на 3–4 порядка). При этом, бактерицидное действие этих наноструктур на культуру грам-отрицательных бактерий P. aeruginosa места не имеет (табл. 1). Несколько лучшую бактерицидную эффективность показали кремниевые структуры с нанесенными на них коллоидными серебряными наночастицами – снижение на 2 порядка для культуры S. aureus и полпорядка для культуры P. aeruginosa (табл. 1). Примечательно, что для нано-структурированной стали, содержащей значительное количество цито-токсичного никеля [5], характерно снижение на 1 порядок по обеим культурам (табл. 1). Таким образом, проведённое исследование показало, что нано/микро-структурированные образцы не обладают ярко выраженным бактерицидными свойствами по отношению к планктонной форме патогенных бактерий этих культур. Бактерицидный эффект структурированных поверхностей проявлялся только при непосредственном контакте с бактериями в красном окрашивании образцов (рис. 1). Механизм гибели бактерий обусловлен, по-видимому, механическим фактором (влияние острых шипов наноструктур) [4], а также фотодинамической активностью составляющих их наночастиц [10].
Таблица 1.
Влияние образцов нано/микро-структурированных поверхностей на значения КОЕ/мл для клинических изолятов, находящихся в планктонном состоянии. В силу особенности процедуры измерения – децимальное разведение с титрованием – погрешность измерения не превышала единицы в том же десятичном порядке
| Структурированные поверхности | КОЕ/мл бактерий | |
|---|---|---|
| S. aureus | P. aeruginosa | |
| Si структуры | (5 ± 1) · 105 | (3 ± 1) · 106 |
| Si структуры + Ag НЧ | (2 ± 1) · 104 | (6 ± 1) · 105 |
| Steel структуры | (2 ± 1) · 105 | (3 ± 1) · 106 |
| Steel (контроль) | (2 ± 1) · 106 | (5 ± 1) · 107 |
| Si (контроль) | (4 ± 1) · 106 | (3 ± 1) · 106 |
| Стекло (контроль) | (8 ± 1) · 106 | (3 ± 1) · 107 |
Рис. 1.
СЭМ-снимки структурированной поверхности кремния (а); кремния с серебряными наночастицами (б); нержавеющей стали (в); живые и мертвые бактериальные клетки на соответствующих структурированных поверхностях (г–е). Красный флуоресцентный краситель окрасил мертвые клетки, а зеленый – живые.

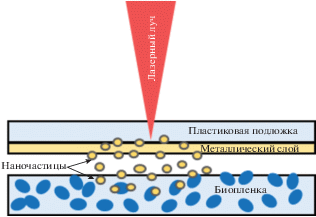
В связи с тем, что нано/микро-структурированные поверхности не проявляют значимое бактерицидное действие по отношению к биопленкам, был разработан новый эффективный метод борьбы с биопленками с помощью лазерного переноса металлических наночастиц с поверхности полимера непосредственно на поверхность биопленки. На рис. 2 показана схема аппликационного лазерного переноса наночастиц с прозрачной подложки на биопленки патогенных микроорганизмов. При воздействии умеренно интенсивного (∼10 МВт/см2) наносекундного лазерного излучения на нанокристаллиты металлической пленки происходило тепловое расширение материала, более выраженное в атмосферу, чем в полимерную подложку, что приводило к быстрому смещению центра масс кристаллитов от поверхности и отрыву при преодолении энергии адгезии с полимерной подложкой. Этот “прыжковый” механизм хорошо известен в технологии лазерной очистки наночастиц с критических поверхностей [19, 20]. Дополнительно, существенный импульсный нагрев нанокристаллитов вызывал нагревание и разложение полимера в области их контакта, создающее трамплино-образную реактивную выталкивающую силу [19, 20]. В итоге, металлическая пленка в виде совокупности составляющих ее кристаллитов отлетала от мишени и через воздушный промежуток шириной в 2 мм попадала на стеклянную подложку с бактериальной биопленкой, где в итоге образовывались наблюдаемые с помощью сканирующей электронной микроскопии скопления нанокристаллитов (наночастиц), частично покрытые полимером подложки. Роль данного полимера в проявление бактерицидной активности металлических наночастиц в настоящее время активно исследуется методами ИК-микроскопии и конфокальной КР-микроскопии.
Рис. 2.
Схема/принцип аппликационного лазерного переноса наночастиц с прозрачной подложки на биопленки патогенных микроорганизмов.
После проведения стандартных микробиологических процедур, определялось КОЕ. Результаты представлены в табл. 2. При использовании предложенного метода в ряде случаев – для серебряных и медных наночастиц – выявлена полная гибель живой суточной биопленки. При переносе золотых наночастиц и при воздействии лазера через пластиковую подложку без металлической пленки бактерицидного воздействия не выявлено. Эти результаты показывают, что бактерицидность перенесенных наночастиц не связана непосредственно с воздействием лазера и температурой наночастиц. Напротив, эффективность метода обусловлена химическими свойствами наночастиц серебра и меди – их токсичностью в отношении патогенных бактерий. Предложенный экономичный и потенциально мобильный способ позволяет повысить локальность, доступность и эффективность разрушения биопленки за счет бактерицидного эффекта металлических наночастиц при незначительном прямом лазерном воздействии на биопленку.
Таблица 2.
Влияние аппликационного лазерного переноса наночастиц золота, меди и серебра (с контролем по аналогичному лазерному воздействию через пластиковую подложку без металлической пленки) на значения КОЕ/мл для сформированных за 24 ч биопленок. В силу особенности процедуры измерения – децимальное разведение с титрованием – погрешность измерения не превышала единицы в том же десятичном порядке (в случае нулевых показаний – на уровне единичной бактерии)
| Бактерии | КОЕ/мл бактерий | ||||
|---|---|---|---|---|---|
| Нано-частицы серебра | Нано-частицы меди |
Нано-частицы золота | Лазер через пластик (без металлической пленки) | Нативная биопленка |
|
| S. aureus | 0 | 0 | (2 ± 1) · 106 | (4 ± 1) · 106 | (4 ± 1) · 106 |
| P. aeruginosa | 0 | 0 | (3 ± 1) · 107 | (10 ± 1) · 106 | (3 ± 1) · 107 |
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что лазерно-нано/микро структурированные поверхности обладают бактерицидным действием в отношении патогенных бактерий в планктонной форме, причем это воздействие особенно эффективно проявляется при непосредственном контакте микробов с поверхностью. Предложенный иновационный мобильный способ аппликационного лазерного переноса наночастиц серебра или меди на поверхность зрелых бактериальных биопленок патогенных микроорганизмов S. aureus и P. aeruginosa приводит к их практически полной гибели.
Исследования поддержаны Российским научным фондом (проект № 18-15-00220).
Список литературы
Beloeil P.A. Борьба с устойчивостью к антибиотикам с позиций безопасности пищевых продуктов в Европе. Copenhagen: ЕРБ ВОЗ, 2011.
López D., Vlamakis H., Kolter R. // Biofilms. 2010. V. 2. № 7. Art. № a000398.
Гренкова Т.А., Селькова Е.П., Гусарова М.П. и др. // Эпидем. Вакцинопроф. 2014. Т. 74. № 1. С. 29.
Ivanova E.P., Hasan J., Webb H. et al. // Small. 2012. V. 8. № 16. P. 2489.
Nastulyavichus A.A., Kudryashov S.I., Smirnov N.A. et al. // Laser Phys. Lett. 2019. V. 16. № 9. Art. № 096002.
Linklater D.P., Juodkazis S., Ivanova E.P. // Nanoscale. 2017. V. 9. № 43. Art. № 16564.
Kietzig A.M., Mirvakili M.N., Kamal S. et al. // J. Adhes. Sci. Technol. 2011. V. 25. № 20. P. 2789.
Koufaki N., Ranella A., Aifantis K.E. et al. // Biofabrication. 2011. V. 3. № 4. Art. № 045004.
Ranella A. Barberoglou M., Bakogianni S. et al. // Acta Biomater. 2010. V. 6. № 7. P. 2711.
Nastulyavichus A., Kudryashov S., Smirnov N. et al. // Appl. Surf. Sci. 2019. V. 469. P. 220.
Choi O., Hu Z. // Environ. Sci. Technol. 2008. V. 42. № 12. P. 4583.
Ba L.A. Döring M., Jamier V. et al. // Org. Biomol. Chem. 2010. V. 8. № 19. P. 4203.
Jose G.P., Stefansson S., Kim M.S., Ahn S.N. // J. Nanobiotechnol. 2011. V. 9. P. 1.
Zonaro E., Lampis S., Turner R.J. et al. // Front. Microbiol. 2015. V. 6. P. 584.
Wang Y., El-Din M.G., Perez-Estrada L.A. et al. // Photochem. Photobiol. 2015. V. 91. № 1. P. 124.
Akhlyustina E.V., Meerovich G.A., Tiganova I.G. et al. // J. Phys. Conf. Ser. 2019. V. 1189. № 1. Art. № 012033.
Cieplik F., Späth A., Regensburger J. et al. // Free Radic. Biol. Med. 2013. V. 65. P. 477.
Li X., Tian Q., Zheng G. et al. // J. Surg. Res. 2013. V. 184. № 2. P. 1013.
Kudryashov S.I., Allen S.D., Shukla S.D. // Particul. Sci. Technol. 2006. V. 24. P. 281.
Kudryashov S.I., Allen S.D. // Particul. Sci. Technol. 2008. V. 26. P. 109.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


