Известия РАН. Серия физическая, 2020, T. 84, № 2, стр. 188-191
Разработка микрофлюидного устройства со встроенной системой электродов для измерения импеданс-спектров клеточных моделей в режиме реального времени
В. А. Петров 1, Т. Н. Герасименко 1, *, О. В. Киндеева 2, И. Н. Газизов 2, С. А. Шилин 1, Д. А. Сахаров 1
1 Общество с ограниченной ответственностью “Научно-технический центр “БиоКлиникум”
Москва, Россия
2 Федеральное государственное автономное образовательное учреждение высшего профессионального образования “Дальневосточный федеральный университет”
Владивосток, Россия
* E-mail: t.gerasimenko@bioclinicum.com
Поступила в редакцию 30.08.2019
После доработки 16.09.2019
Принята к публикации 28.10.2019
Аннотация
В работе представлена математическая модель распределения потенциала и напряженности электрического поля в ячейках микрофлюидного устройства для культивирования монослоя клеток с различными геометриями встроенных электродов. На основе анализа результатов расчета выбрана конструкция измерительной ячейки и геометрия электродов.
Биологические барьеры (кожа, эпителий кишечника, гематоэнцефалический барьер и т.д.) играют колоссальную роль в поддержании целостности и жизнеспособности живых организмов. Моделирование таких барьеров in vitro чрезвычайно важно для разработки новых лекарственных препаратов и поиска способов их эффективной доставки.
Чаще всего моделирование осуществляется с помощью специальных мембранных вставок, на которых выращивается один или несколько слоев клеток. Для воссоздания параметров микроокружения ткани используются различные микрофлюидные устройства, моделирующие кровоток с помощью циркулирующего течения питательной среды. При этом на всех этапах культивирования клеток необходимо иметь возможность неинвазивным образом контролировать их жизнеспособность и барьерную функцию [1].
Классическим методом контроля целостности клеточного монослоя является измерение трансэпителиального сопротивления (transendothelial electrical resistance, TEER) [2]. Интактный монослой, как правило, имеет сопротивление порядка нескольких кОм [2], что существенно превосходит сопротивление культуральной среды между электродами. Резкое падение TEER обычно свидетельствует о нарушении целостности барьера. В большинстве существующих коммерческих решений измерения осуществляются на частоте порядка 12.5 Гц, для того чтобы избежать экранировки электродов при постоянном токе [3]. Для измерений в них обычно используется внешний электрод, который погружается в ячейку для культивирования клеток. Такой подход оказывается малопригодным для микрофлюидных устройств, так как требует извлечения мембранной вставки, что нарушает стерильность и микроокружение клеток. Кроме того, измерение импеданса в некотором диапазоне частот и последующий анализ полученных спектров позволяет получить более точные результаты по сравнению с классическим способом измерения TEER на одной частоте [4].
В данной работе решалась задача поиска оптимальной геометрии электродов, встроенных в измерительную ячейку микрофлюидного чипа (рис. 1). Требовалось подобрать такую геометрию, которая была бы максимально простой в изготовлении, обеспечила бы необходимую точность измерений, не влияя при этом на стерильность, объем циркулирующей среды и доступность клеточного монослоя для оптических методов исследования.
Рис. 1.
Микрофлюидный чип (вид с разнесенными элементами): 1 – крышка с электродами, 2 – мембранная вставка, 3 – клеточная ячейка, 4 – слой полимера с микроканалами для циркуляции питательной среды, 5 – предметное стекло с напыленными электродами, 6 – перистальтический насос.

Микрофлюидный чип был разработан на базе устройств, совместимых с микробиореактором “Homunculus”, созданных ранее нашей научной группой [5] (рис. 1). Он содержит замкнутый микроканал и три лунки, в две из которых могут быть вставлены мембранные вставки HTS Transwell (Corning, США), предназначенные для культивирования барьерных тканей. Центральная лунка предназначена для проведения сопутствующих измерений. Питательная среда приводится в движение встроенным перистальтическим микронасосом (рис. 1) [6]. Контроль целостности монослоя предполагалось проводить с помощью разработанного нашей научной группой прибора для импедансной спектроскопии.
Для повышения точности измерений было решено использовать четырехэлектродную измерительную схему [7]. Рабочий (WE) и один из сенсорных электродов (SE2) помещаются в пробку, закрывающую ячейку. Для положения противоэлектрода (CE) и еще одного сенсорного электрода (SE1) возможны различные варианты, однако для обеспечения приемлемой точности измерений измеренное сопротивление среды между электродами и емкость системы электродов не должны превосходить сопротивление и емкость клеточного монослоя (единицы кОм и единицы мкФ [8]).
При расчете измеряемого сопротивления среды и емкости системы электродов предполагалось, что среда электронейтральна и изотропна. Распределение потенциала в системе в этом случае описывается уравнением Лапласа с граничными условиями, соответствующими ненулевому постоянному потенциалу на рабочем электроде и нулевому потенциалу на противоэлектроде (заземление). На сенсорных электродах было задано условие плавающего потенциала [9]. Точные аналитические решения подобных задач известны только для ограниченного числа геометрий [10], поэтому поставленная задача была решена численно. Плавающий потенциал на сенсорных электродах задавался так, как это описано в работе [9]: при численном решении электрод заменялся диэлектриком с очень большой (бесконечной) по сравнению со средой диэлектрической проницаемостью. Окончательно, решаемая краевая задача имеет следующий вид:
(1)
$\left\{ \begin{gathered} \varepsilon \Delta \varphi = 0,\,\,\,\,r \in {{\Omega }_{m}} \hfill \\ {{\varepsilon }_{{el}}}\Delta {{\varphi }_{{el}}} = 0,\,\,\,\,r \in {{\Omega }_{{el}}} \hfill \\ \varphi = {{\varphi }_{{{\text{WE}}}}},\,\,\,\,r \in {{\Gamma }_{{{\text{WE}}}}} \hfill \\ \varphi = {{\varphi }_{{{\text{CE}}}}},\,\,\,\,r \in {{\Gamma }_{{{\text{CE}}}}} \hfill \\ \varphi = {{\varphi }_{{el}}},\,\,\,\,r \in {{\Gamma }_{{{\text{SE}}1}}},\,\,\,\,r \in {{\Gamma }_{{{\text{SE}}2}}} \hfill \\ \varepsilon \frac{{\partial \varphi }}{{\partial{ \vec {n}}}} = {{\varepsilon }_{{el}}}\frac{{\partial {{\varphi }_{{el}}}}}{{\partial{ \vec {n}}}},\,\,\,\,r \in {{\Gamma }_{{{\text{SE1}}}}},\,\,\,\,r \in {{\Gamma }_{{{\text{SE}}2}}} \hfill \\ \frac{{\partial \varphi }}{{\partial{ \vec {n}}}} = 0,\,\,\,\,r \in {{\partial \Omega } \mathord{\left/ {\vphantom {{\partial \Omega } {\{ {{\Gamma }_{{{\text{WE}}}}},{{\Gamma }_{{{\text{CE}}}}}\} }}} \right. \kern-0em} {\{ {{\Gamma }_{{{\text{WE}}}}},{{\Gamma }_{{{\text{CE}}}}}\} }} \hfill \\ \end{gathered} \right.,$Рис. 2.
Моделируемые измерительные ячейки с планарными (а) и круговыми (г) электродами; б, д – распределения потенциала; в, е – электрического поля в них.
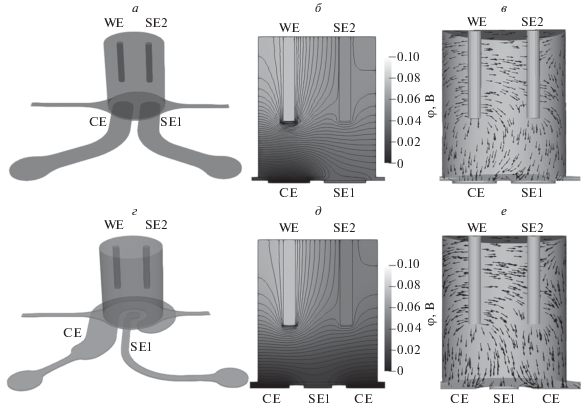
Компоненты вектора напряженности электрического поля определялись численным дифференцированием потенциала, после чего суммарный ток, текущий через рабочий электрод, вычислялся в соответствии с дифференциальным законом Ома. Измеряемое сопротивление среды затем определялось как отношение разности потенциалов между сенсорными электродами к суммарному току через рабочий электрод.
При расчете емкости суммарный заряд на рабочем электроде определялся из теоремы Остроградского–Гаусса, а соответствующая емкость затем вычислялась как отношение этого заряда к разности потенциалов между рабочим и противоэлектродом.
Во всех расчетах предполагалось, что на рабочий электрод подается напряжение 100 мВ. Электрические характеристики были взяты для натрий-фосфатного буфера, проводимость которого составляет 1.5 См ∙ м–1, а диэлектрическая проницаемость – 80 [11]. Значения проводимости варьируются у разных производителей в диапазоне 1.1–2.2 См · м–1, поэтому расчет дает возможность оценить порядок величины, но не ее точное значение.
Наиболее удобной для изготовления и практического использования является конфигурация, при которой все четыре электрода стержневые и располагаются в соседних лунках микрофлюидного устройства.
Расчетное сопротивление среды и емкость электродов в этом случае составили 150 кОм и 0.003 пФ соответственно. Столь высокое значение сопротивления делает невозможным применение такой конфигурации электродов. Существенно уменьшить вклад среды в импеданс можно, отказавшись от вставки электродов сверху устройства и нанося их на стекло так, чтобы один из сенсорных электродов и противоэлектрод были расположены в ячейке непосредственно под рабочим электродом. Были рассмотрены два варианта геометрии: в одной из них оба электрода представляют собой одинаковые параллельные полоски (рис. 2а), в другой – имеют форму, близкую к концентрическим окружностям (рис. 2г). Для обоих этих вариантов дополнительно была исследована зависимость сопротивления и емкости от угла поворота верхних стержневых электродов. Было показано, что в обоих случаях сопротивление среды не превышает 150 Ом, а емкость − единиц пФ, что существенно меньше ожидаемых значений для клеточного монослоя. При этом было показано, что геометрия с круговыми электродами в силу своей симметрии приводит к существенно меньшим вариациям измеряемых значений емкости и сопротивления, а электрическое поле внутри измерительной ячейки оказывается более однородным, чем в случае одинаковых параллельных электродов.
На основе проведенного анализа было принято решение использовать концентрические электроды. Экспериментальные измерения импеданс-спектров в пустой ячейке, проведенные в растворе PBS pH 7.2 (Gibco) при комнатной температуре в диапазонах частот от 10 Гц до 1 кГц с шагом 10 Гц и от 1 до 100 кГц с шагом 1 кГц, дали результаты порядка сотен Ом для сопротивления и единицы пФ для емкости в зависимости от угла поворота верхних стержневых электродов, что согласуется с теоретическими оценками. Дальнейшие эксперименты с клетками [12] показали, что предложенная геометрия электродов позволяет с достаточной точностью измерять импеданс-спектры клеточного монослоя.
Проведено математическое моделирование распределения потенциала и напряженности электрического поля в ячейках для культивирования монослоя клеток с различными геометриями встроенных электродов. Исходя из анализа полученных данных была выбрана геометрия электродов для измерительной ячейки, которая хорошо подходит для интеграции в микрофлюидное устройство и позволяет исследовать целостность клеточного монослоя неинвазивными методами. Теоретические оценки были подтверждены экспериментально. Разработанное в результате микрофлюидное устройство впоследствии успешно применялось для измерений импеданс-спектров клеточного монослоя.
Исследование выполнено при поддержке РНФ (грант № 16-19-10597).
Список литературы
Walter F.R., Valkai S., Kincses A. et al. // Sens. Actuators B. Chem. 2016. V. 222. P. 1209.
Odijk M., van der Meer A.D., Levner D. et al. // Lab. Chip. 2015. V. 15. P. 745.
Безбородов И.С., Поляков П.А., Русакова Н.Е. // Изв. РАН. Сер. физ. 2018. Т. 82. С. 1055; Bezborodov I.S., Polyakova P.A., Rusakova N.E. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. P. 953.
Никулин С.В., Князев Е.Н., Полозников А.А. и др. // Мол. биол. 2018. Т. 52. С. 667.
Киндеева О.В., Петров В.А., Герасименко Т.Н. и др. Демпфирующий элемент микрофлюидного чипа и микрофлюидный чип. Пат. РФ № 2016152523, кл. G01N33/48. 2018.
Gerasimenko T.N., Kindeeva O.V., Petrov V.A. et al. // Appl. Math. Model. 2017. № 52. P. 590.
Heaney M.B. Electrical conductivity and resistivity, electrical measurement, signal processing and displays. Los Angeles: CRC Press, 2003. 465 p.
van der Meer A.D., Jung K.H., van der Helm M.W. et al. // Lab. Chip. 2015. V. 15. P. 745.
Konrad A., Graovac M. // IEEE Trans. Magn. 1996. V. 32. P. 4329.
Polyakov P.A., Rusakova N.E., Samukhina Yu.V. // J. Electrostat. 2015. V. 77. P. 147.
Binette J.S., Garon M., Savard P. et al. // J. Biomech. Engin. 2004. V. 126. P. 475.
Никулин С.В., Герасименко Т.Н., Шилин С.А. и др. // Бюл. эксп. биол. и мед. 2018. Т. 166. С. 570.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


