Известия РАН. Серия физическая, 2020, T. 84, № 4, стр. 501-507
Исследование эффективности радиационной обработки форели электронным и рентгеновским излучениями
А. П. Черняев 1, 2, В. М. Авдюхина 1, У. А. Близнюк 1, *, П. Ю. Борщеговская 1, В. С. Ипатова 1, В. А. Леонтьев 1, Ф. Р. Студеникин 1, Д. С. Юров 2
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”,
Научно-исследовательский институт ядерной физики имени Д.В. Скобельцына
Москва, Россия
3 Федеральное государственное бюджетное научное учреждение
“Всероссийский научно-исследовательский институт лекарственных и ароматических растений”
Москва, Россия
* E-mail: uabliznyuk@gmail.com
Поступила в редакцию 30.10.2019
После доработки 25.11.2019
Принята к публикации 27.12.2019
Аннотация
Представлены результаты воздействия ускоренных электронов и рентгеновского излучения на микробиологические и органолептические показатели охлажденной форели. Для обоих типов воздействий установлены дозы, поглощаемые форелью, приводящие к подавлению ее микрофлоры в течение 15 сут после проведения обработки и не вызывающие изменений органолептических свойств продукта.
ВВЕДЕНИЕ
В настоящее время в мире широко используются различные методы радиационной обработки продуктов питания с использованием гамма-источников, тормозного и рентгеновского излучений, а также ускоренных электронов, генерируемых ускорителями. Радиационные технологии активно применяются для обеспечения микробиологической безопасности, сохранения качества и увеличения сроков хранения сельскохозяйственного сырья и пищевой продукции [1, 2]. Поскольку разные продукты питания различаются количественным содержанием белков, жиров и углеводов, а также уровнем микробиологического загрязнения, в связи с этим необходимо решать задачу оптимального подбора всех характеристик облучения, при которых достигается наибольший микробиологический эффект, не приводящий к нарушениям качества продукта [3–6].
В [6–8] представлены результаты воздействий различных типов ионизирующих излучений на микробиологические, физико-химические и органолептические показатели продуктов питания, так как выбор типа излучения является одним из наиболее важных факторов для достижения наибольшей эффективности проведения радиационной обработки.
В настоящее время на физическом факультете МГУ им. М.В. Ломоносова ведутся исследования по использованию различных видов ионизирующих излучений для радиационной обработки продуктов питания, в том числе сельскохозяйственной и рыбной продукции [9, 10]. В данной работе представлены результаты воздействия ускоренных электронов с энергией 1 МэВ и рентгеновского излучения на микробиологические и органолептические показатели охлажденной форели.
ВОЗДЕЙСТВИЕ ОБРАБОТКИ УСКОРЕННЫМИ ЭЛЕКТРОНАМИ
Материалы и методы
В качестве объекта исследования использовали форель радужную охлажденную. Для оценки органолептических свойств мяса рыбы были подготовлены куски массой 30 ± 3 г, толщиной 6–8 мм, линейными размерами 2.8 ± 0.2 см × 10.0 ± 0.5 см, помещенные в герметичную полипропиленовую упаковку. Для анализа микробиологических показателей к измельченному мясу форели (ρфорель = = (0.920 ± 0.04) г ∙ см–3) добавляли физиологический раствор (ρф. р-ра = 1.0043 г ∙ см–3) в соотношении 1 : 3 и гомогенизировали в стеклянном гомогенизаторе до получения однородной суспензии. 0.5 мл гомогената вносили в стерильные пластиковые пробирки типа Эппендорф объемом 2 мл. Итоговая плотность гомогената составляла ρ = 0.994 ± 0.040 г ∙ см–3.
Облучение всех исследуемых образцов проводили на ускорителе электронов непрерывного действия УЭЛР-1-25-Т-001 с энергией 1 МэВ и средней мощностью пучка 25 кВт [11]. Облучение образцов проводили по схеме, представленной на рис. 1, при температуре 18°С. Образцы выкладывались на дюралюминиевую пластину площадью 192 см2 на расстоянии 12 см от выхода пучка, их облучали в пяти различных дозах, пятикратно для каждой дозы облучения (рис. 1). Поскольку пробег электронов с энергией 1 МэВ в рыбе составляет не более 4 мм, для достижения равномерности облучения куски рыбы половину времени для каждой дозы облучали с одной стороны, затем переворачивали и облучали с противоположной стороны (рис. 1а). Толщина слоя гомогентата в пробирках составляла 2 ± 1 мм, электроны полностью поглощались во всем его объеме (рис. 1б). В ходе эксперимента ток пучка электронов не менялся. Контрольные образцы находились в тех же условиях, что и образцы, подвергавшиеся воздействию электронов.
Мощность дозы, поглощаемая опытными образцами с гомогенатом рыбного фарша, определяли, используя ферросульфатный метод дозиметрии. Дозиметрический раствор объемом 0.5 мл облучали в пробирках типа Эппендорф объемом 2 мл, схема облучения соответствовала облучению образцов с гомогенатом, время облучения варьировали от 5 до 20 с. Дозы, поглощенные дозиметрическим раствором, оценивали по изменению его оптической плотности с помощью спектрофотометра UV-3600 с рабочей длиной волны λ = 304 нм. Поглощенную дозу $D_{{{\text{фрикке}}}}^{{{\text{изм}}}}$ рассчитывали по формуле:
(1)
$D_{{{\text{фрикке}}}}^{{{\text{изм}}}} = {{(k\Delta S)} \mathord{\left/ {\vphantom {{(k\Delta S)} {[\pi G({\text{F}}{{{\text{e}}}^{{3 + }}})\varepsilon l],}}} \right. \kern-0em} {[\pi G({\text{F}}{{{\text{e}}}^{{3 + }}})\varepsilon l],}}$Мощность дозы излучения, полученного от ускорителя, составила 25 ± 2 Гр ∙ с–1. Поскольку плотности гомогената фарша и дозиметрического раствора Фрикке (ρфрикке = 1.024 г ∙ см–3) были близки, мощность дозы, измеренная с помощью дозиметрического раствора, совпадает с мощностью дозы, поглощенной гомогенатом. При прямых дозиметрических измерениях были получены дозы, поглощенные опытными образцами с гомогенатом рыбного фарша. В каждом сеансе облучения измеряли заряд на дюралюминиевой пластине после облучения и время облучения. Мощность облучения во всех экспериментах оставалась постоянной.
В табл. 1 приведены средние величины заряда, поглощенного пластиной, а также соответствующие ему времена облучения образцов и величины измеренных доз, поглощенных образцами. Погрешность в определении заряда составляла не более 3%.
Таблица 1.
Данные параметров облучения гомогената электронным излучением
| № | tоблуч, с | Q, нКл | $D_{{{\text{фрикке}}}}^{{{\text{изм}}}},$ кГр |
|---|---|---|---|
| 1 | 10 ± 1 | 12 250 ± 245 | 0.24 ± 0.03 |
| 2 | 18 ± 1 | 24 780 ± 495 | 0.48 ± 0.05 |
| 3 | 33 ± 1 | 50 180 ± 1003 | 0.96 ± 0.10 |
| 4 | 72 ± 1 | 147 500 ± 2950 | 2.8 ± 0.2 |
| 5 | 130 ± 1 | 294 000 ± 5880 | 5.6 ± 0.5 |
Дозы, поглощенные опытными образцами кусков форели, определяли путем моделирования с использованием программного кода GEANT4, основанного на методе Монте-Карло, с учетом экспериментально измеренного заряда на пластине при облучении в различных дозах. Моделирование строилось с учетом спектра электронов, полученных от ускорителя УЭЛР-1-25-Т-001, а также геометрии пластины и образцов, помещенных на нее. Моделировали дюралюминиевую пластину в форме параллелепипеда длиной 35 см, шириной 3 см и толщиной 0.8 см. Модель цельного куска рыбы представляла собой водный фантом в форме параллелепипеда длиной 10 см, шириной 3 см и высотой 0.8 мм, окруженного полиэтиленовой оболочкой толщиной 0.1 мм. Для достижения применимости статистической погрешности в определении дозы, поглощенной образцами, в ходе модельных расчетов рассматривалось 108 электронов. В использованной программе учитывали все возможные процессы взаимодействия электронов с веществом. Погрешность в определении их сечения взаимодействия не превышала 2%.
Доза, поглощенная водными фантомами, определялась по следующей формуле:
где ∆Emodel – энергия, поглощенная водным фантомом, Мmodel – масса фантома. Поскольку доза, поглощенная опытными образцами при облучении, пропорциональна заряду Qexp на дюралюминиевой пластине, то, используя величину поглощенной дозы в водном фантоме Dmodel, полученную путем моделирования с учетом заряда Qmodel, поглощенного дюралюминиевой пластиной, и экспериментально измеренного заряда Qexp, рассчитывалось величина поглощенной дозы в исследуемом образце Dphantom по формуле:(3)
${{D}_{{phantom}}} = \left( {\frac{{{{Q}_{{exp}}}}}{{{{Q}_{{model}}}}}} \right) \times {{D}_{{model}}}.$В табл. 2 указаны средние величины заряда на пластине при облучении кусков рыбы с двух сторон, а также соответствующие времена облучения образцов и величины рассчитанных доз, поглощенных образцами.
Таблица 2.
Данные параметров облучения образцов из форели электронным излучением
| № | tоблуч, с | Q, нКл | Dmodel, кГр | ||
|---|---|---|---|---|---|
| 1 сторона | 2 сторона | 1 сторона | 2 сторона | ||
| 1 | 10 ± 1 | 10 ± 1 | 8330 ± 1666 | 8600 ± 1720 | 0.25 ± 0.01 |
| 2 | 13 ± 1 | 14 ± 1 | 16 300 ± 3260 | 16 400 ± 3280 | 0.50 ± 0.02 |
| 3 | 25 ± 1 | 24 ± 1 | 33 100 ± 6620 | 33 610 ± 6722 | 1.00 ± 0.04 |
| 4 | 54 ± 1 | 55 ± 1 | 97 700 ± 19 540 | 97 800 ± 19 560 | 3.0 ± 0.1 |
| 5 | 103 ± 1 | 109 ± 1 | 195 400 ± 39 080 | 195 900 ± 39 180 | 6.0 ± 0.2 |
В ходе эксперимента каждые три дня в течение 15 сут после проведения обработки осуществляли мониторинг общей обсемененности гомогената фарша форели, хранящегося при температуре (2‒4)°С. Куски форели в ходе данного исследования подверглись также органолептическому исследованию: оценивали их внешний вид, запах и вкус.
Результаты и выводы
На момент начала исследования количество жизнеспособных клеток в охлажденной форели составляло N0 = (6.6 ± 1.8) ‧ 103 КОЕ ∙ г–1, что ниже предельно допустимого уровня обсемененности охлажденной рыбной продукции (105 КОЕ ∙ г–1). На рис. 2 представлено количество жизнеспособных клеток в образцах с гомогенатом, облученным в пяти различных дозах, и в контрольных необлученных образцах в зависимости от времени после обработки.
Рис. 2.
Зависимость общего количества жизнеспособных клеток в образцах, облученных ускоренными электронами в дозах 0 Гр (К), 0.24 кГр (1), 0.48 кГр (2), 0.96 кГр (3), 2.8 кГр (4), 5.6 кГр (5), от времени после проведения обработки.

Видно, что на 11-е сутки количество жизнеспособных клеток контрольных образцов превысило предельно допустимый уровень обсемененности рыбной продукции, с 11 по 15 сут он возрос до 2 ∙ 108 КОЕ ∙ г–1 Количество жизнеспособных бактерий в образцах, облученных в дозе 0.24 кГр, в первые четверо суток соответствовало контрольным показателям. За все время наблюдения их количество не превысило 106 КОЕ ∙ г–1. Похожая тенденция наблюдалась в образцах, подвергшихся облучению в дозах 0.48 и 0.96 кГр. С 8 по 11 сут наблюдения количество микроорганизмов в них увеличилось в 1000 раз по сравнению с начальным уровнем, затем на 15 сут эти показатели уменьшились до 105 КОЕ ∙ г–1, что соответствует предельно допустимому уровню обсемененности рыбной продукции. Количество живых микроорганизмов в образцах, облученных в дозах 2.8 и 5.6 кГр, за все время наблюдения не превысило 106 КОЕ ∙ г–1. На 15 сут исследования бактерии в гомогенате, облученном в дозе 2.8 кГр, практически отсутствовали. В образцах, подвергшихся обработке в дозе 5.6 кГр, их количество составляло порядка 106 КОЕ ∙ г–1, что ниже контрольного уровня на момент проведения мониторинга более чем в 100 раз.
По результатам органолептической экспертизы было установлено следующее. Дозы до 1 кГр не оказали видимого влияния на внешний вид образцов, а дозы 3 и 6 кГр изменили цвет форели изначально ярко-красный на светло-розовый с заметной желтизной, не соответствующий качественной продукции, причем это изменение становилось более выраженным с увеличением дозы облучения. На запах сырой рыбы так или иначе оказали влияние все дозы облучения. Для доз 0.25 и 0.5 кГр этот показатель изменился незначительно, и спустя час после проведения облучения образцы перестали различаться по запаху от контрольных. В случае 1 кГр запах был чуть более заметным и устойчивым, а образцы, облученные в дозах 3 и 6 кГр, имели стойкий, полностью отличный от контрольного, запах. Было установлено, что те же выводы можно сделать и о внешнем виде и запахе облученных, а затем термически обработанных образцов. По вкусовым свойствам образцы после термической обработки, облученные в дозах 0.25 и 0.5 кГр, оказались неотличимы от контрольного. Вкусовые качества образца, облученного в дозе 0.96 кГр, изменились незначительно. Образцы, облученные в дозе 3 кГр, показали значительные изменения во вкусе, а в дозе 6 кГр были полностью отличны по вкусу от контрольных необлученных образцов.
Таким образом, можно заключить, что облучение охлажденной форели пучком ускоренных электронов с энергией 1 МэВ в дозах от 0.5 до 6 кГр приводит к уменьшению количества жизнеспособных микроорганизмов в ней в течение 15 сут хранения при температуре (2–4)°С. Экспериментальное исследование изменения органолептических свойств форели показало, что при поглощенных дозах свыше 1 кГр происходят изменения в структуре волокон, цвете и запахе рыбы, что говорит о нарушении физико-химического состава вещества. Обработка ускоренными электронами в дозе 0.5 кГр по достижении 15 сут хранения снизила общее количество жизнеспособных клеток в рыбе, не вызывая изменений ее органолептических свойств.
ВОЗДЕЙСТВИЕ ОБРАБОТКИ РЕНТГЕНОВСКИМ ИЗЛУЧЕНИЕМ
Материалы и методы
Для оценки микробиологических и органолептических показателей были приготовлены образцы с гомогенатом фарша форели массой 0.5 ± ± 0.05 мл, которые помещали в пробирки типа Эппендорф объемом 2 мл. Образцы облучали рентгеновским излучением, источником которого являлся рентгеновский аппарат ДРОН УМ-2 со стандартной рентгеновской трубкой типа БСВ-23. Материал анода – медь, ток трубки – 26 мА и напряжение – 30 кВ не менялись в ходе экспериментального исследования [13]. Все эксперименты проводились при температуре 20°С. Образцы облучались в пяти различных дозах, пятикратно для каждой дозы облучения. Контрольные образцы находились в тех же условиях, что и образцы, подвергавшиеся обработке. На рис. 3 представлена схема проведения обработки фарша форели.
Для определения мощности дозы, поглощаемой опытными образцами рыбного фарша, использовался ферросульфатный метод дозиметрии. Схема облучения дозиметрического раствора полностью повторяла схему облучения гомогената фарша форели рентгеновским излучением. В табл. 3 указаны средние времена облучения образцов и значения доз, поглощенных образцами. Мощность дозы рентгеновского излучения, полученного от рентгеновской трубки, составила 1.10 ± 0.04 Гр ∙ с–1.
Результаты и выводы
Исследование микробиологических показателей фарша форели проводилось по той же методике, что и при обработке ускоренными электронами. Было установлено, что с увеличением дозы облучения количество микроорганизмов в гомогенате уменьшалось. На момент начала обработки общее количество жизнеспособных клеток составляло N0 = 1.3 ‧ 104 КОЕ ∙ г–1, что ниже предельно допустимого уровня обсемененности охлажденной рыбной продукции. После обработки количество микроорганизмов в образцах, обработанных в дозах от 0.18 до 0.92 кГр, уменьшалось с увеличением дозы облучения, причем при обработке в дозах от 1.8 до 5.5 кГр количество микроорганизмов уменьшилось более чем в 10 раз по сравнению с контрольным образцами, а при дозе 11 кГр после облучения жизнеспособные клетки в рыбе практически отсутствовали.
По результатам органолептической эксперитизы было установлено, что закономерности изменений внешнего вида рыбы, ее консистенции, цвета, запаха похожи при обработке как рентгеновским, так и электронным излучениями. Однако незначительные изменения цвета рыбы и ее запаха начали проявляться у образцов, обработанных рентгеновским излучением в дозе 0.46 кГр. Так, при обработке в дозе 0.92 кГр цвет фарша стал розовым (контрольные образцы имели ярко-красный цвет), запах значительно отличался от запаха необработанного фарша. Образец, обработанный в дозе 0.92 кГр, имел ярко выраженный горьковатый запах и бледно-розовый цвет. Фарш форели, обработанный в дозах 1.8–11 кГр, приобрел значительные изменения текстуры, цвета и запаха рыбы, причем с увеличением дозы эти изменения носили более выраженный характер.
Для оценки эффективности воздействия ускоренных электронов и рентгеновского излучения были построены зависимости относительного количества жизнеспособных клеток микроорганизмов N/N0 от дозы облучения электронным и рентгеновским излучениями спустя сутки после обработки (рис. 4). Экспериментальные зависимости количества клеток от дозы облучения можно описать функцией вида f(D) = ${{e}^{{a + bD + c{{D}^{2}} + d{{D}^{3}} + o({{D}^{3}})}}},$ где D – поглощенная доза излучения, a – параметр, определяющий положение кривой убыли микроорганизмов относительно осей координат, b, c и d – параметры, отражающие скорость убывания количества жизнеспособных клеток в гомогенате с увеличением дозы облучения. Значения параметров функции f(D), рассчитанные методом наименьших квадратов, составили: aэл = 0.17244 ± ± 0.045188 (отн. ед.), bэл = –0.00321 ± 0.000252 (Гр–1), cэл = (1.28 ± 0.13) ‧ 10–6 Гр–2, dэл = (–1.58 ± 0.16) ‧ ‧ 10–10 Гр–3 для электронного излучения, и aрент = = –0.02714 ± 0.003903 (отн. ед.), bрент = –0.00175 ± ± 0.00002 Гр–1, cрент = (5.89 ± 0.86) ‧ 10–7 Гр–2, dрент = (–607 ± 012) ‧ 10–10 Гр–3 для рентгеновского излучения. Коэффициенты корреляции составили Rэл= 0.97 и Rрент = 0.99 соответственно, что говорит об адекватности предложенной аппроксимации.
Рис. 4.
Экспериментальные зависимости относительного количества жизнеспособных клеток в гомогенате после воздействия электронами (1) и рентгеновским излучением (3) от дозы облучения. 2 и 4 – аппроксимации электронного и рентгеновского излучений.
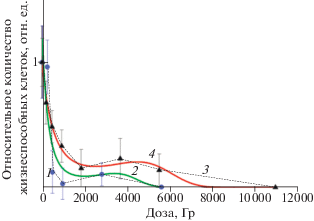
На рис. 4 видно, что в диапазоне доз от 0.2 до 6 кГр воздействие ускоренными электронами с мощностью дозы 25 ± 2 Гр ∙ с–1 приводит к большему снижению относительного количества жизнеспособных клеток в гомогенате форели по сравнению с воздействием рентгеновским излучением с мощностью дозы 1.1 ± 0.04 Гр ∙ с–1. Данный результат согласуется с исследованиями влияния мощности дозы на радиобиологический эффект воздействия ионизирующего излучения, проводимыми другими авторами [14–16]. В обоих случаях, начиная с 0.2 кГр, по мере возрастания дозы облучения микробиологические показатели гомогената уменьшаются, затем в диапазоне 3–5 кГр наблюдается относительное увеличение количества жизнеспособных клеток с увеличением дозы облучения, затем зависимости монотонно убывают. Немонотонный характер кривой убыли микроорганизмов в гомогенате может быть связан с видовым разнообразием бактерий и микроорганизмов, обладающих различной устойчивостью к воздействию ионизирующего излучения в условиях ограниченного ресурса питательной среды.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований было показано, что радиационная обработка гомогената форели приводит к снижению количества жизнеспособных микроорганизмов независимо от типа излучения.
Экспериментально установлено, что обработка ускоренными электронами гомогената форели в дозах от 0.5 кГр и выше обеспечивает достаточно высокую эффективность подавления жизнеспособных клеток в течение 15 сут после облучения. При дозах свыше 1 кГр происходят изменения органолептических свойств форели, что делает обработку с такими параметрами непригодной для данного типа продукции. Таким образом, в случае обработки форели электронным излучением установлен “рабочий” диапазон доз от 0.5 до 1 кГр, который позволяет контролировать микробиологические показатели продукта при сохранении его пригодности к дальнейшему употреблению.
Обработка форели рентгеновским излучением в дозах менее 2 кГр не обеспечивает достаточно высокую эффективность подавления микрофлоры рыбы. Изменения цвета и запаха наблюдаются при обработке в дозах свыше 0.46 кГр.
В диапазоне доз от 0.2 до 6 кГр воздействие ускоренными электронами с мощностью дозы 25 ± 2 Гр ∙ с–1 приводит к бόльшему снижению относительного количества жизнеспособных клеток микроорганизмов в гомогенате форели по сравнению с воздействием рентгеновским излучением с мощностью дозы 1.1 ± 0.04 Гр ∙ с–1. Т.е. при одних и тех же дозах облучения электронное излучение с вышеперечисленными параметрами более эффективно подавляет патогенную микрофлору по сравнению с рентгеновским излучением.
Исследование выполнено при финансовой поддержке РФФИ в рамках проекта № 18-016-00198а.
Список литературы
Козьмин Г.В., Гераськин С.А., Санжарова Н.И. Радиационные технологии в сельском хозяйстве и пищевой промышленности. Москва–Обнинск: Информполиграф, 2015. 400 с.
Черняев А.П., Варзарь С.М., Белоусов А.В. и др. // ЯФ. 2019. Т. 82. № 4. С. 1.
Oraei M., Motallebi A., Hoseini E. // Int. J. Food Sci. Techn. 2012. V. 47. № 5. P. 977.
Kim H.J., Chun H.H., Song H.J., Song K.B. // Radiat. Phys. Chem. 2010. V. 79. № 11. P. 1165.
Yang Z., Wang H., Wang W. et al. // Food Chem. 2014. V. 145. P. 535.
Kim H.-W., Kim Y.H.B., Hwang K.-E. et al. // Food Sci. Biotechnol. 2017. V. 26. № 4. P. 955.
Al-Bachir M. // Acta Sci. Pol. Techn. Aliment. 2017. V. 16. № 1. P. 17.
Qiulian K., Weiqiang Y., Ling Y. et al. // Radiat. Phys. Chem. 2017. V. 130. P. 265.
Авдюхина В.М., Близнюк У.А., Борщеговская П.Ю. и др. // Вест. Моск. ун-та. Сер. 3. Физ. Астрон. 2018. № 3. С. 99; Bliznyuk U.A., Avdyukhina V.M., Borchegovskaya P.Yu. et al. // Mos. Univ. Phys. Bull. 2018. V. 73. № 3. P. 33.
Близнюк У.А., Авдюхина В.М., Борщеговская П.Ю. и др. // Изв. РАН. Сер. физ. 2018. Т. 82. № 6. С. 824; Bliznyuk U.A., Avdyukhina V.M., Borchegovskaya P.Yu. et al. // Bull. Russ. Acad. Sci. Phys. 2018. V. 82. № 6. P. 740.
Yurov D.S., Alimov A.S., Ishkhanov B.S., Shvedunov V.I. // Phys. Rev. Spec. Top. V. 20. № 4. Art. № 044702.
Климанов В.А., Крамер-Агеев Е.А., Смирнов В.В. Дозиметрия ионизирующих излучений: Уч. пособ. М.: НИЯУ МИФИ, 2015. 740 с.
Горелик С.С., Скаков Ю.А., Расторгуев Л.Н. Рентгенограф. и электронно-оптич. анализ. М.: МИСиС, 1994. 328 с.
Саруханов В.Я., Исамов Н.Н., Епимахов В.Г., Колганов И.М. // Радиац. биол. и радиоэкол. 2010. Т. 50. № 5. С. 548.
Taghipour F. // Water Res. 2004. V. 38. № 18. P. 3940.
Simon-Deckers A., Brun E., Gouget B. et al. // Gold Bull. 2008. V. 41. № 2. P. 187.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая




