Известия РАН. Серия физическая, 2020, T. 84, № 5, стр. 626-627
Варьирование галоидного аниона – эффективный способ регулирования спектрально-яркостных характеристик люминесценции двухвалентного европия в конденсированной среде
Р. Г. Булгаков 1, *, С. М. Якупова 2, Д. И. Галимов 2
1 Институт физики молекул и кристаллов – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального
исследовательского центра Российской академии наук
Уфа, Россия
2 Институт нефтехимии и катализа – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра Российской академии наук
Уфа, Россия
* E-mail: profbulgakov@yandex.ru
Поступила в редакцию 28.11.2019
После доработки 19.12.2019
Принята к публикации 27.01.2020
Аннотация
Обнаружена яркая, видимая на свету не вооруженным глазом хемилюминесценция (ХЛ) иона Eu2+*, генерируемого при акцептировании энергии от триплетно-возбужденного изомасляного альдегида – продукта окисления диизобутилалюминийгидрида кислородом в ТГФ.
ВВЕДЕНИЕ
Явление ХЛ широко применяется в аналитической химии при изучении процессов передачи энергии, выделяющейся в экзотермических реакциях, создании химических источников света, определении антиоксидантной активности медпрепаратов [1–3 и ссылки в них]. Электронно-возбужденные трехвалентные ионы лантанидов (Ln3+*) являются одними из традиционных эмиттеров ХЛ, и в этом качестве известны с 1971 г. [1]. Закономерности механизмов генерации ионов Ln3+* хорошо изучены для самых разных типов ХЛ неорганических, органических и металлоорганических соединений [1, 2, 4, 5]. Однако способность двухвалентных ионов (Ln2+*) играть роль эмиттеров ХЛ обнаружена совсем недавно на примере ионов Eu2+* [6, 7] и Sm2+* [8] в системе (LnCl3 ∙ 6H2O–THF–O2)–iBu2AlН, где Bu = C4H9. Но в этой системе из-за длительности (≥5 мин) процессов дегидратации и восстановления ионов Ln3+ до Ln2+ не удается быстро достичь максимальной концентрации Eu2+, что снижает яркость ХЛ.
В связи с изложенным выше и с целью увеличения яркости ХЛ иона Eu2+, а также разработки эффективных способов регулирования цвета ХЛ в данной работе изучена возможность генерации цветорегулируемой ХЛ двухвалентного иона европия в системе (EuX2–THF–O2)–iBu2AlH, отличающейся тем, что в качестве исходного берется соединение, содержащее “готовый” двухвалентный ион европия и разные виды анионов галоидов X = ${\text{C}}{{{\text{l}}}^{ - }}$, ${\text{B}}{{{\text{r}}}^{ - }}$, ${{{\text{I}}}^{ - }}$.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
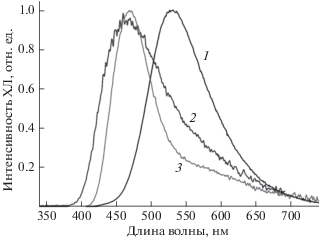
При введении iBu2AlH (0.8 ммоль) в раствор EuX2 (0.02 ммоль) в ТГФ (2 мл) возникает яркая ХЛ, наблюдаемая невооруженным глазом даже на свету в виде красивого свечения, цвет которого зависит от природы галоидного аниона, связанного с ионом Eu2+: зеленая для ${{{\text{I}}}^{ - }}$, голубая для ${\text{C}}{{{\text{l}}}^{ - }}$ и ${\text{B}}{{{\text{r}}}^{ - }}$. ХЛ регистрируется даже при следовых количествах кислорода в растворе, но отсутствует при полном удалении кислорода. Спектры ХЛ представляют собой широкие полосы, характерные для иона Eu2+ (рис. 1). Положения максимумов спектров ХЛ зависят от природы галоидного аниона: 530, 468 и 470 нм для ${{{\text{I}}}^{ - }}$, ${\text{C}}{{{\text{l}}}^{ - }}$ и ${\text{B}}{{{\text{r}}}^{ - }}$ соответственно. Длительность ХЛ (ṯ) также зависит от природы галоидного аниона для ${\text{C}}{{{\text{l}}}^{ - }}$ или ${\text{B}}{{{\text{r}}}^{ - }}$ ṯ = 20 мин, а для ${{{\text{I}}}^{ - }}$ ХЛ наблюдается невооруженным глазом несколько дней при умеренном доступе кислорода или 2–3 часа при барботировании О2 через реакционный раствор. Такая высокая яркость и рекордная длительность ХЛ делает ее перспективной для создания новых химических источников зеленого света. Измеренные нами квантовые выходы ХЛ (в %) уменьшаются в ряду анионов: 0.48 (${{{\text{I}}}^{ - }}$) > 0.027 (${\text{C}}{{{\text{l}}}^{ - }}$) > 0.015 (${\text{B}}{{{\text{r}}}^{ - }}$). Широкие полосы спектров ХЛ и времена жизни (сотни наносекунд) эмиттеров ФЛ реакционного раствора характерны для 5d1-люминесценции иона Eu2+*. Спектры ХЛ относительно спектра ФЛ исходных комплексов EuX2 ⋅ (THF)2 сдвинуты в красную область, что связано с образованием объемного комплекса EuX2 ⋅ (THF)2–iBu2AlH, в котором имеется связь Eu2+–iBu(H)–Al. Это уменьшает вероятность безызлучательной дезактивации ионов Eu2+* благодаря жесткой структуре этого комплекса. В результате имеет место пятикратное усиление интенсивности ФЛ иона Eu2+и увеличение величины τ (Eu2+*) от 243 до 280 нс при введении iBu2AlH в раствор EuCl2 в ТГФ. Батохромный сдвиг цвета ХЛ в ряду анионов ${\text{C}}{{{\text{l}}}^{ - }}$, ${\text{B}}{{{\text{r}}}^{ - }}$ и ${{{\text{I}}}^{ - }}$, связанных с ионом Eu2+, мы связываем с известным [10, 11] нефелоксетическим эффектом, обусловленным увеличением поляризуемости анионов в этом ряду.
Рис. 1.
Спектры ХЛ, возникающей в системе (EuX2–THF–O2)–iBu2AlH (298 K), где X = I (1), Cl (2) и Br (3).
Согласно результатам, полученным в данной работе, а также в наших предыдущих исследованиях [5–7], механизм ХЛ может быть представлен в виде упрощенной схемы (1)–(3) , в которой Eu2+обозначает ион двухвалентного европия в составе четырехцентрового комплекса с iBu2AlH, а R = iBu. Эмиттер ХЛ ион Eu2+* образуется за счет передачи энергии от первичного эмиттера – триплетно-возбужденного альдегида, генерирующегося в свободно-радикальной реакции окисления iBu2AlH кислородом, а именно на стадии диспропорционирования пероксильных радикалов ROO•.
(1)
${{{\text{R}}}_{{\text{2}}}}{\text{AlH}} + {{{\text{O}}}_{2}} \to {{{\text{R}}}^{\centerdot }}\xrightarrow{{{{{\text{O}}}_{2}}}}{\text{RO}}{{{\text{O}}}^{\centerdot }} \to \,{{\,}^{3}}{\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{CHC(H)O}}*,$ЗАКЛЮЧЕНИЕ
Разработана новая ХЛ-система на основе дигалоидов двухвалентного европия и диизобутилалюминийгидрида (EuX2–THF–O2)–iBu2AlH, перспективная для создания новых химических источников света и сенсоров определения ультранизких концентраций кислорода, отличающаяся высокой яркостью и легкостью регулирования цвета ХЛ от голубого до зеленого путем варьирования природы галоидного аниона.
Исследование проведено в соответствии с бюджетными темами ИФМК УФИЦ РАН, ИНК УФИЦ РАН при поддержке РФФИ (проект № 18-33-00201-мол_а).
Список литературы
Gundermann K.D., McCapra F. Chemiluminescence in organic chemistry. Heidelberg, Berlin: Springer-Verlag, 1987. 217 p.
Trofimov A.V., Vasil`ev R.F., Mielke K. et al. // J. Photochem. Photobiol. 1995. V. 62. P. 35.
Roda A., Mirasoli M., Michelini E. et al. // Biosens. Bioelectron. 2016. V. 76. P. 164.
Elbanowski M., Makowska B., Staninski K., Kacz-marek M. // J. Photochem. Photobiol. A. 2000. V. 130. P. 75.
Bulgakov R.G., Galimov D.I. Chemiluminescence of lanthanide ions. In book: A comprehensive guide to chemiluminescence. N.Y.: Nova Sci. Publ., 2019. P. 97.
Bulgakov R.G., Eliseeva S.M., Galimov D.I. // J. Lumin. 2013. V. 136. P. 95.
Bulgakov R.G., Eliseeva S.M., Galimov D.I. // RSC Adv. 2015. V. 5. P. 52132.
Bulgakov R.G., Eliseeva S.M., Galimov D.I. // J. Photochem. Photobiol. A. 2015. V. 300. P. 1.
Galimov D.I., Bulgakov R.G. // Lumin. J. Biol. Chem. Lumin. 2019. V. 34. P. 127.
Albin M., Horrock Jr. W.D. // Inorg. Chem. 1985. V. 24. P. 895.
Sinha S.P., Schmidtke H.H. // Mol. Phys. 1965. V. 10. P. 7.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


