Известия РАН. Серия физическая, 2020, T. 84, № 5, стр. 675-678
Исследование одноцепочечных ДНК с повторяющейся нуклеотидной последовательностью методами сканирующей зондовой микроскопии
Т. И. Шарипов 1, *, Р. Р. Гарафутдинов 2, Р. З. Бахтизин 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Башкирский государственный университет”
Уфа, Россия
2 Институт биохимии и генетики – обособленное структурное подразделение
Федерального государственного бюджетного научного учреждения Уфимского федерального
исследовательского центра Российской академии наук
Уфа, Россия
* E-mail: sha-t@yandex.ru
Поступила в редакцию 28.11.2019
После доработки 19.12.2019
Принята к публикации 27.01.2020
Аннотация
Методами сканирующей зондовой микроскопии исследована проводимость коротких одноцепочечных ДНК, состоящих из нуклеотидов dC. Установлено, что распределение молекул ДНК на поверхности подложек имеет равномерный характер. Измеренные вольтамперные характеристики позволили оценить дифференциальное электрическое сопротивление отдельных молекул d(C)12.
ВВЕДЕНИЕ
Исследование молекул нуклеиновых кислот как физических объектов представляет значительный интерес. Разнообразие их возможных структур (одно- и двухцепочечное состояние, линейные и кольцевые молекулы, различные конформационные формы, вариабельность нуклеотидного состава и др.) обусловливает широкий спектр объектов подобного рода. В последнее время появляются новые данные о зависимости физических характеристик ДНК от их строения. Так, показано, что на конформацию и жесткость ДНК влияют молекулярное окружение [1], нуклеотидный состав и метилирование [2]; было показано различие в характере разрушения ДНК при облучении водных растворов ультразвуком [3]. Одним из активно применяемых методов исследования физических параметров нуклеиновых кислот является сканирующая зондовая микроскопия (СЗМ). Особый интерес представляют синтетические одноцепочечные ДНК с гомонуклеотидной последовательностью, то есть состоящие из нуклеотидов одного типа. В таких структурах предполагается особый характер распределения электронной плотности и переноса заряда, поэтому интерес к ним стабильно высок, что связано с перспективами использования этих молекул в наноэлектронике. Попытки измерить электрическое сопротивление ДНК дают противоречивые результаты [4–7]. На неоднозначность результатов влияют условия эксперимента и тип исследуемых молекул ДНК, а именно длина, нуклеотидный состав, различная последовательность нуклеотидов в цепочке ДНК, количество цепочек в молекуле [8]. Изучение методами СЗМ топографии поверхности, иммобилизации на ней молекул ДНК важно также для разработки ДНК-микрочипов [9, 10]. Электрические свойства молекул ДНК можно изучать с помощью сканирующей туннельной микроскопии (СТМ). Для этого молекулу располагают между двумя электрическими контактами, одним из которых является проводящий зонд микроскопа, а другим – фрагмент поверхности подложки из электропроводящего материала. Цель работы – визуализация и исследование проводимости коротких одноцепочечных ДНК, состоящих из нуклеотидов только одного типа, азотистым основанием в которых является цитозин.
МАТЕРИАЛЫ И МЕТОДЫ
Олигонуклеотид d(С)12 синтезировали на автоматическом синтезаторе ASM-800 (“Биоссет”, Россия) амидофосфитным способом. СЗМ-исследования проводили на приборах Solver P47 и Ntegra-Prima (ОАО “НТ-МДТ Спектрум Инструментс”, Россия). Объектом исследования служили молекулы олигонуклеотида, состоящие из 12 одинаковых звеньев – дезоксицитидинов. Раствор олигонуклеотида d(C)12 в концентрации 5 нг/мкл прогревали при температуре 75–80°С в течение 6–7 мин для денатурации и затем каплю этого раствора объемом 5 мкл наносили на серебряную или слюдяную подложку.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее нами была показана возможность исследования одноцепочечных ДНК с помощью СЗМ [11, 12]. В данной работе получали АСМ-изображения олигонуклеотида d(C)12, на поверхности слюды. На одном из них (рис. 1а) четко визуализируются объекты сферической формы, из которых одни представляют собой отдельные молекулы олигонуклеотидов, а другие – агрегаты, являющиеся скоплениями единичных молекул олигонуклеотидов. Эти агрегаты имеют различные размеры по нормали и по латерали, что связано с различием в количестве молекул, входящих в их состав.
Рис. 1.
а – АСМ-изображение поверхности слюды с нанесенными на нее олигонуклеотидами d(C)12; б – профиль сечения олигонуклеотида, выполненного по линии, указанной на рис. 1а белым цветом.
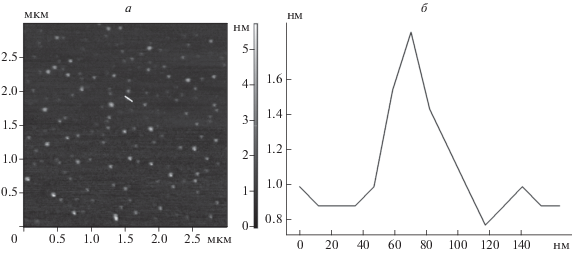
Поскольку наибольший интерес представляли наименьшие из наблюдаемых на АСМ-изображении объектов, которые, по нашему мнению, являются единичными молекулами, для них получали профиль сечения, по которому определяли геометрические параметры (рис. 1б). Так, в среднем размер подобных объектов по латерали составлял около 36 нм, высота – 0.95 нм, что согласуется с общепринятыми размерами подобных молекул, наблюдаемых на изображениях, полученных методом атомно-силовой микроскопии. Далее олигонуклеотиды d(C)12 наносили на атомарно ровную поверхность серебра и предварительно исследовали методом СТМ. Олигонуклеотиды четко визуализировались (рис. 2а) и располагались на поверхности подложки разреженно, что весьма удобно для последующего спектроскопического исследования.
Рис. 2.
а – СТМ-изображение поверхности серебра с нанесенными на нее олигонуклеотидами d(C)12; б – профиль сечения олигонуклеотида d(C)12, выполненного по линии, указанной на рис. 2а белым цветом; в – усредненная ВАХ олигонуклеотидов d(C)12.

Как правило, олигонуклеотиды на СТМ-изображениях представляются темными объектами с малыми размерами. Объясняется это тем, что они имеют меньшую электропроводность по сравнению с серебром. Проведя сечения по интересующим нас объектам, мы по профилям сечений (рис. 2б) оценили латеральные размеры этих объектов, которые в среднем оказались равными 20 нм. Измерение глубины наблюдаемых объектов дает результат около 3.5–4 нм. Указанная величина не является истинной, поскольку на СТМ-изображениях значения размеров по вертикали косвенные, ибо они являются топографическим отображением электрической проводимости в каждой отдельно взятой точке области сканирования.
После получения СТМ-изображений и визуализации олигонуклеотидов на поверхности подложки в режиме сканирующей туннельной спектроскопии были измерены их вольтамперные характеристики (ВАХ) на тех участках, где предположительно находились единичные молекулы олигонуклеотидов. В каждой точке снимали несколько ВАХ. Итоговая ВАХ получена путем усреднения набора ВАХ, снятых в одной точке. Выполнив описанным способом измерения ВАХ нескольких олигонуклеотидов, идентифицированных на области сканирования, показанной на рис. 2а, мы получили результирующую усредненную ВАХ (рис. 2в).
Кривая ВАХ оказалась нелинейной, имеет симметричный вид относительно нулевых значений и тока, и напряжения в диапазоне напряжений от –1.5 до +1.5 В. А в диапазоне напряжений больше +1.5 В и меньше –1.5 В – несимметричный вид. Используя ВАХ, можно вычислить дифференциальное электрическое сопротивление олигонуклеотида d(C)12. Для этого на ВАХ мы выбрали участок, на котором нет нулевых значений тока и в то же время нет значительных флуктуаций тока. На рис. 2в он выделен утолщенной красной линией. Рассчитали, что дифференциальное сопротивление отдельной молекулы примерно равно Rдиф = 0.85 · 108 Ом.
ЗАКЛЮЧЕНИЕ
Визуализация образцов, полученных после иммобилизации олигонуклеотида d(C)12 на твердотельную подложку, методами СЗМ показала равномерный характер распределения молекул ДНК либо в одиночном состоянии, либо в виде агрегатов вне зависимости от природы подложки (слюда или серебро). Кроме того, получены результаты экспериментального изучения электропроводности – усредненная ВАХ и оценено дифференциальное электрическое сопротивление молекул олигонуклеотида d(C)12.
Работа выполнена при финансовой поддержке в рамках гранта Республики Башкортостан молодым ученым (2019 г., договор № 29ГР).
Список литературы
Vologodskii A., Frank-Kamenetskii M.D. // Nucleic Acids Res. 2013. V. 41. P. 6785.
Perez A., Castellazzi C.L., Battistini F. et al. // Biophys. J. 2012. V. 102. P. 2140.
Garafutdinov R.R., Galimova A.A., Sakhabutdinova A.R., Chemeris A.V. // Mol. Biol. 2016. V. 50. P. 272.
Fink H.W., Schonenberger C. // Nature. 1999. V. 398. P. 407.
Porath D., Bezryadin A., de Vries S., Dekker C. // Nature. London. 2000. V. 403. P. 635.
Шарипов Т.И., Бахтизин Р.З. // Изв. вузов. Поволжский регион. Физ.-мат. науки. 2019. № 1. С. 133.
Sharipov T.I., Bakhtizin R.Z. // IOP Conf. Ser. Mater. Sci. Engin. 2017. V. 256. Art. № 012009.
Iijima M., Kato T., Nakanishi S. et al. // Chem. Lett. 2005. V. 34. № 8. P. 1084.
Аюпова А.Х., Гарафутдинов Р.Р., Талипов Р.Ф. и др. // Вест. Башкир. ун-та. 2012. Т. 17. № 4. С. 1677.
Sharipov T. I., Bakhtizin R.Z. // IOP Conf. Ser. Mater. Sci. Engin. 2017. V. 195. Art. № 012002.
Шарипов Т.И., Бахтизин Р.З. // Вест. Башкир. ун-та. 2013. Т. 18. № 2. С. 340.
Шарипов Т.И., Гоц С.С., Бахтизин Р.З. // Персп. материалы. 2011. № 12. С. 579.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


