Известия РАН. Серия физическая, 2020, T. 84, № 7, стр. 988-993
Стрейнтроника для нанобиомедицины. Управление биохимическими системами посредством контролируемой нанодеформации на макромолекулярном уровне
Ю. И. Головин 1, 2, *, Ал. О. Жигачев 2, Д. Ю. Головин 2, С. Л. Грибановский 2, А. В. Кабанов 1, 3, Н. Л. Клячко 1, 2, 3
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Тамбовский государственный университет имени Г.Р. Державина”
Тамбов, Россия
3 Университет Северной Каролины
Чапел-Хилл, США
* E-mail: yugolovin@yandex.ru
Поступила в редакцию 18.02.2020
После доработки 16.03.2020
Принята к публикации 27.03.2020
Аннотация
В работе приведен анализ современного состояния стратегии нано-магнито-механической актуации биохимических систем, утилизирующей концепцию стрейнтроники для задач наномедицины с помощью магнитных наночастиц, управляемых негреющим низкочастотным магнитным полем. Рассмотрены теоретические модели адресной нанодеформационной актуации биомолекулярных систем и последние экспериментальные результаты.
ВВЕДЕНИЕ
Стрейнтроника (straintronics) – инновационное направление в физике конденсированного состояния и электронике, интенсивно развивающееся последние несколько лет и подразумевающее управление свойствами твердых тел путем контролируемой упругой деформации [1]. Деформационно индуцируемые изменения электронного спектра, подвижности носителей, электрических, магнитных, оптических и других свойств сулят большие перспективы в сенсорной и информационной технологиях, энергетике и других областях. Однако потенциал концепции стрейнтроники не ограничивается этими направлениями и с успехом может быть распространен на другие сферы деятельности. В частности, в последнее время методами одномолекулярной силовой спектроскопии (ОМСС) было установлено, что механические силы и деформации играют большую роль в функционировании биоактивных макромолекул (ММ), различных ММ-структур и живых клеток [2–5].
Основные методы ОМСС – атомная силовая микроскопия, оптические и магнитные пинцеты, позволяющие перекрыть весь диапазон сил и соответствующих им деформаций, которые необходимы для управления самыми различными молекулярными процессами, представляющими интерес для нанобиомедицины. Так, с применением методов ОМСС было установлено, что силовое воздействие в диапазоне 0.1–10 пН может вызвать открытие ионных каналов, регулирующих потоки веществ через мембрану клетки, ее метаболизм и функционирование [6, 7]; в диапазоне 20–70 пН – вызывать конформационные изменения в ферментах, снижая или увеличивая их биокаталитическую активность; 50–100 пН – разупорядочивать и увеличивать проницаемость билипидных мембран для различных веществ, диффундирующих через них; 100–400 пН – индуцировать обратимый разрыв слабых связей. Силы F $ \gtrsim $ 2000 пН вызывают необратимое разрушение ковалентных связей [8] (табл. 1).
Таблица 1.
Характерные значения сил и индуцируемых ими эффектов в макромолекулах и клетках
| Объект | Эффект | Типичное пороговое значение силы, пН | Источник |
|---|---|---|---|
| Ионные каналы | Увеличение притока ионов | 0.1–10 | [6, 7, 9] |
| Взаимодействие белок–белок | Разрыв связи | 1–10 | [8] |
| Талин | Конформационные изменения | 20–50 | [7] |
| Связь антитело–антиген | Разрыв связи | 10–100 | [8] |
| Полимер | Изменение межатомных расстояний и углов в ММ | 1–300 | [10] |
| Белок | Анфолдинг | 100–300 | [8, 10] |
| Макромолекула | Разрыв ковалентной связи | 2000–5000 | [10, 11] |
Следует отметить, что критические значения сил для различных биомеханических откликов носят вероятностный характер и зависят от конкретного типа тестируемых ММ, температуры, рН окружающей среды, скорости и длительности приложения нагрузки, частоты наномеханических осцилляций и других факторов. Поэтому, как правило, они приводятся в виде соответствующих гистограмм или интервалов наиболее вероятных значений. Изменения в свойствах ММ и ММ-структур, индуцированные внешней силой, являются физической основой разнообразных механизмов механотрансдукции в клетках живых организмов [3, 5, 12, 13]. Это понятие объединяет в себе процессы преобразования деформационно-силового воздействия в биохимический отклик биомолекулярной системы, изменение ее функционала и даже запрограммированную смерть клеток – апоптоз, которые являются основой регуляции и приспособления живых организмов на клеточном уровне.
При всей привлекательности ОМСС как мощного исследовательского инструмента изучения механохимических процессов на уровне единичных ММ эту технологию невозможно использовать напрямую как биомедицинскую платформу для решения диагностических и терапевтических задач на уровне тканей, органов, организмов, поскольку она требует захвата одиночной ММ и помещения ее внутри громоздкой аппаратуры, несовместимой с организмом. Однако идеи и результаты ОМСС могут быть положены в основу дистанционного стимулирования ММ-систем в объектах макроскопических размеров (в том числе в человеческом организме) при введении в них магнитных наночастиц (МНЧ), управляемых внешними негреющими низкочастотными магнитными полями (НЧ МП). Благодаря такому подходу в последнее десятилетие активно развивается стратегия управления свойствами и процессами в биохимических системах посредством их нано-магнито-механической актуации (НММА) [14‒18], которая, по существу, основана на принципах стрейнтроники, реализуемой на уровне ММ. Эта стратегия может найти применение в диагностике, лекарственной и безлекарственной терапии или в объединяющем их подходе – нанотераностике [19, 20].
Для обеспечения силового воздействия в НММА обычно используют функционализированные однодоменные МНЧ (сфероидные диаметром около 10 нм или стержнеобразные с тем же диаметром и длиной 50–100 нм), управляемые НЧ МП c амплитудой В в десятки-сотни мТл и частотой f от десятых долей до нескольких сотен Гц. Наличие таких медиаторов воздействия НЧ МП на биообъекты позволяет концентрировать, трансформировать и передавать энергию МП небольшому числу ММ, конъюгированных с МНЧ. Максимальная величина энергии Um, сообщаемой полем B частице с магнитным моментом μ = JsρV, составляет Um = μB (здесь Js – намагниченность насыщения, ρ – плотность, V – объем МНЧ соответственно). Для обычно используемых МНЧ из магнетита (Js ≈ 80 А ∙ м2 ∙ кг–1) радиусом rm ≈ 8 нм величина Um в поле В = 0.4 Тл превышает тепловую энергию Ut ≈ kTR при комнатной температуре TR = = 300 К в ~102 раз, в то время как для любых объектов атомно-молекулярного масштаба в организме, обладающих магнитным моментом порядка магнетона Бора μB = 927.4 · 10–26 Дж ∙ Тл–1, она в тех же условиях составляет ~10–2kTR. Следовательно, при наличии МНЧ в биомолекулярной системе, вопрос об источнике энергии не стоит; актуальны лишь вопросы о путях каналирования и эффективности преобразования этой энергии в планируемые результаты. Ранее различными теоретическими и экспериментальными методами многократно было показано, что в МП с амплитудой В < 1 Тл и частотой f < 1 кГц нагрев МНЧ и окружающего их вещества пренебрежимо мал ($ \ll $10–3 K) [14, 15] и доминирующим факторами воздействия НЧ МП являются деформационно-механические (рис. 1).
Рис. 1.
Типичные значения частоты и амплитуды магнитного поля, активирующие различные каналы воздействия. Методы, обозначенные *, требуют предварительного введения МНЧ. УВЧ-физиотерапия − индукционный нагрев мягких тканей без МНЧ.
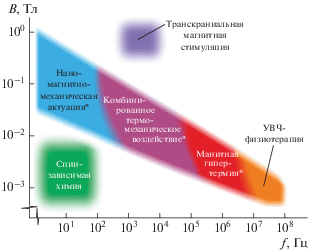
Цель настоящей работы – дать краткий обзор состояния исследований нано-магнито-механического подхода, включая теоретические модели и экспериментальные данные.
ТЕОРЕТИЧЕСКИЕ МОДЕЛИ
Как известно, в однородном МП B на однодоменную МНЧ с магнитным моментом μ действует вращательный момент М, максимальная величина которого М = μВ, а в неоднородном – еще и сила $\vec {F}$ = μgrad$\vec {B}$. В зависимости от характера и энергии взаимодействия МНЧ с окружающими ММ могут быть реализованы самые различные деформационно-силовые схемы и типы воздействия МНЧ на бионаноструктуры (растяжение, сжатие, сдвиг, кручение). В отличие от не селективного, не локального и не направленного теплового воздействия при магнитной гипертермии на частотах 105–106 Гц, при НММА на частотах до 103 Гц доминирующим фактором влияния являются деформации и взаимные смещения ММ, значимые лишь на расстояниях порядка размеров МНЧ и быстро убывающие за этими пределами.
Как показано в [14, 15], иммобилизованные МНЧ способны прикладывать к удерживающим их связям максимальные силы F ≈ $4kB{{J}_{s}}pr_{m}^{2},$ где k ~ 1 – формфактор МНЧ. До некоторой характерной частоты fc = μВ(12πηVHD)–1, которая определяется полем B, микровязкостью среды η и гидродинамическим объемом МНЧ VHD, величина силы F не зависит от частоты МП. При f > fc с ростом частоты поля сила F начинает снижаться, а интенсивность разогрева МНЧ нарастать (рис. 2). Однако независимость силы F от частоты МП в области f $ \ll $ fc вовсе не означает неизменность отклика биомолекулярной системы на нанодеформационное действие и его нечувствительность к изменению частоты механостимуляции. Рассмотрим этот вопрос подробнее. Как уже отмечалось, биомеханический отклик носит статистический характер. Эксперимент показывает, что в большинстве случаев для регистрации эффекта требуются длительные экспозиции объекта в поле (типично – 102–104 с). За это время молекулярная структура испытывает 103–106 циклов нагружения, тем большее, чем выше f. С одной стороны, это увеличивает вероятность преодоления различных энергетических барьеров, а с другой – хорошо известно, что с ростом скорости одиночного нагружения или частоты при периодическом возбуждении жесткость и прочность большинства связей в биомолекулярных объектах возрастает [21‒23]. При варьировании f характерные времена релаксации обрабатываемых полем ММ-структур могут совпасть с обратными частотами магнитомеханического возбуждения. В результате зависимость биохимического отклика от f может проявлять немонотонный характер. По этим и другим причинам клеточные структуры демонстрируют частотную селективность к переменным механическим сигналам, подобно радиоприемникам, настроенным на определенные полосы частот [7].
Рис. 2.
Соотношение теплового и нетеплового вкладов воздействия МНЧ в зависимости от частоты активирующего магнитного поля.

Итак: 1) силы, создаваемые однодоменными МНЧ в полях до 1 Тл, могут активировать различные механизмы механотрансдукции, поскольку достигают сотен пН (рис. 3); 2) наиболее эффективная нано-магнито-механическая актуация возможна при f < fc (рис. 2).
Рис. 3.
Теоретически полученные графики зависимости сил, создаваемых МНЧ разного размера в осциллирующем магнитном поле с различной амплитудой [14].
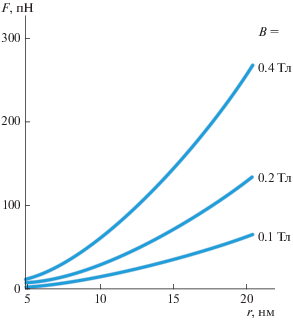
В отличие от сферических, стержнеобразные МНЧ, закрепленные на мембране искусственного контейнера или клетки, создают нормальные и латеральные силы, не зависящие от длины l МНЧ: F ≈ ${{J}_{s}}\rho \pi r_{m}^{2}B,$ а создаваемое ими давление p ≈ ≈ 4F/rml и линейное натяжение fτ≈ 2F/l может быть достаточным для локального разупорядочения липидных мембран и неспецифической активации ионных каналов [24, 25].
Янус-частицы, состоящие из двух разнородных материалов, обычно используют для асимметричной функционализации их поверхности [26], однако, помимо этого, они могут создавать большие силы и деформации, чем сферические частицы в аналогичных условиях [27].
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
Наиболее яркими и показательными экспериментами по НММА можно считать работы, демонстрирующие возможности управления активностью избранного фермента с помощью МНЧ в негреющем НЧ МП. Так, в работе [28] авторы иммобилизовали α-химотрипсин на кластерах МНЧ и наблюдали снижение активности фермента на 30% под действием НЧ МП. Авторы связывают наблюдаемый результат с конформационными изменениями в белке. В другой работе [17] были проведены эксперименты, в которых на МНЧ закреплялся комплекс химотрипсин-ингибитор, и под действием негреющего НЧ МП скорость реакции увеличивалась, что свидетельствует о разрыве слабых связей в комплексе за счет растяжения.
Перспективность применения НММА для адресной доставки лекарств к целевой ткани была продемонстрирована в ряде работ на липосомах [25, 29]. Сферические МНЧ, управляемые НЧ МП, разупорядочивали стенки липидных наноконтейнеров, увеличивая их проницаемость и ускоряя высвобождение загрузки [29]. В другой работе для аналогичных задач были успешно использованы магнитные наностержни размерами ~70 × 12 нм [25].
Намного более сложным объектом для НММА являются клетки. Тем не менее, возможности управления процессами их жизнедеятельности через механочувствительные рецепторы (трансмембранные белки) были продемонстрированы, например, в [30]. Успехи наномеханической манипуляции жизнедеятельностью клеток подтолкнули к поиску методов запуска апоптоза или других способов умерщвления больных клеток, например, раковых. По-видимому, первой демонстрацией таких возможностей является работа [31], в которой магнитные диски диаметром ~1 мкм механически разрушали раковые клетки в поле ~2–10 мТл. Более аккуратные эксперименты с использованием небольших частиц магнетита размерами до 10 нм были проведены на линиях клеток рака груди [32]. В работе МНЧ успешно проникали в клетки и под действием НЧ МП индуцировали механостимулированный апоптоз раковых клеток.
Наномеханическая стимуляция является перспективным средством модуляции функций нервных тканей (рис. 4). Так, например, МНЧ, управляемые НЧ МП с частотой ~50 Гц, применяются для стимуляции ионных каналов и дифференциации стволовых клеток, что представляет большой интерес для неинвазивного лечения болезни Паркинсона, аутизма, деменции, синдрома Мартина–Белла [33–36].
Рис. 4.
Экспериментально определенные диапазоны сил, вызывающие специфические отклики в нейронах [18].

Другим перспективным приложением МНЧ для нейромедицины является регенерация и инжиниринг роста нейронов [33, 37, 38]. Так, в [37] было показано, что внедрение МНЧ в нейроны позволяет управлять направлением роста аксонов с помощью градиентного МП. Аналогичный результат с одновременным ускорением процессов дифференциации клеток был достигнут в [38] за счет стимуляции рецепторов роста.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изложенное выше свидетельствует о перспективности НММА для наномедицинских целей. Подход экспериментально апробирован на клеточных моделях и имеет ряд серьезных преимуществ по сравнению с другими методами терапии (табл. 2). Однако к настоящему моменту фундаментальные механизмы ММ-стрейнтроники с помощью МНЧ изучены слабо, что ограничивает развитие и применение НММА. Потенциально НММА имеет гораздо большее количество модальностей в сравнении, например, с тепловыми подходами, как минимум, благодаря фундаментальному отличию тензорного характера создаваемых деформаций от скалярного теплового поля, которое действует не избирательно и имеет единственную моду действия. Деформация ММ, в свою очередь, вызывает различные биохимические отклики в зависимости от пространственных характеристик создающей деформацию силы и, соответственно, пространственных характеристик МП, вызывающего механическое движение МНЧ. Ряд работ указывает на количественное отличие эффектов, обнаруживаемых в непрерывно генерируемом и прерывистом НЧ МП [28, 32], что, по-видимому, связано с наличием времязависимых релаксационных процессов в ММ или их связей с МНЧ. Перечисленные особенности НММА обусловливают необходимость построения продвинутых моделей деформационных процессов, протекающих в ММ, а также определения условий, обеспечивающих повышение эффективности НММА, как, например, в случае с агрегацией МНЧ внутри мембраны [29].
Таблица 2.
Сравнение различных методов магнитного воздействия на биохимические системы
| Метод | Преимущества | Недостатки | Характерные параметры МП |
|---|---|---|---|
| Магнитная гипертермия | Универсальность, простота реализации | Необходимость введения МНЧ, сложность контроля температуры и дозировки, невысокая локальность, неспецифичность, риск повреждения здоровых тканей | f = 100–600 кГц B = 10– 30 мТл |
| УВЧ-физиотерапия | Простота реализации, неинвазивность | Небезопасные частоты поля, неспецифичность | f = 26–40 МГц B < 0.1 мТл |
| Транскраниальная магнитная стимуляция | Неинвазивность | Неспецифичность, узкая направленность | f = 1–10 кГц B = 1–3 Тл |
| Нано-магнито-механическая актуация | Молекулярная локальность, высокая специфичность, безопасные частоты, мультимодальность | Необходимость введения МНЧ | f < 1 кГц B = 10–500 мТл |
| Спин-зависимая химия | Отсутствие необходимости введения медиаторов | Сложность контроля, способность регулировать лишь некоторые реакции | f = 0–100 Гц B < 10 мТл |
ЗАКЛЮЧЕНИЕ
Стратегия стрейнтроники для наномедицины, реализуемая через НММА в негреющем НЧ МП, предоставляет большие возможности для адресной доставки и выгрузки лекарств, неинвазивного дистанционного управления функциями клеток и даже отдельных молекул в целях безлекарственной терапии, тканевой инженерии и регенеративной медицины посредством избирательной механической стимуляции биохимических систем на макромолекулярном уровне. К числу достоинств НММА можно отнести молекулярную локальность, специфичность, мультимодальность, а также малые риски побочных эффектов, поскольку используемые негреющие НЧ МП существенно безопаснее, чем высокочастотные греющие, используемые для других приложений (магнитная гипертермия и др.).
Работа выполнена при поддержке РФФИ (проекты №№ 17-42-680803, 17-54-33027, 18-29-09154).
Список литературы
Бухараев А.А., Звездин А.К., Пятаков А.П. и др. // УФН. 2018. Т. 188. № 12. С. 1288; Bukharaev A.A., Zvezdin A.K., Pyatakov A.P. et al. // Phys. Usp. 2018. V. 61. № 12. P. 1175.
Noy A. Handbook of molecular force spectroscopy. N.Y.: Springer, 2008. 292 p.
Yanagida T., Ishii Y. Single molecule dynamics in life science. Weinheim: Wiley-VCH, 2009. 328 p.
Oberhauser A.F. Single-molecule studies of proteins. N.Y.: Springer, 2013. 274 p.
Hoffman B.D., Grashoff C., Schwartz M.A. // Nature. 2019. V. 475. № 7356. P. 316.
Hughes S., McBain S., Dobson J. et al. // J. R. Soc. Interf. 2008. V. 5. № 25. P. 855.
Hoffman B.D., Grashoff C., Schwartz M.A. // Nature. 2011. V. 475. № 7356. P. 316.
Suresh S. // Acta Biomater. 2007. V. 3. № 4. P. 413.
Roca-Cusachs P., Conte V., Trepat X. // Nat. Cell. Biol. 2017. V. 19. № 7. P. 742.
Hughes M.L., Dougan L. // Rep. Prog. Phys. 2016. V. 79. № 7. Art. № 076601.
Schmidt S.W., Kersch A., Beyer M.K. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. № 13. P. 5994.
Orr A.W., Helmke B.P., Blackman B.R. et al. // Dev. Cell. 2006. V. 10. № 1. P. 11.
Jaalouk D.E., Lammerding J. // Nat. Rev. Mol. Cell. Bio. 2009. V. 10. № 1. P. 63.
Golovin Y.I., Gribanovsky S.L., Golovin D.Y. et al. // J. Control. Release. 2015. V. 219. P. 43.
Golovin Y.I., Klyachko N.L., Majouga A.G. et al. // J. Nanopart. Res. 2017. V. 19. P. 63.
Головин Ю.И., Жигачев А.О., Ефремова М.В. и др. // Рос. нанотехнол. 2018. Т. 13. № 5–6. С. 82; Golovin Y.I., Zhigachev A.O., Efremova M.V. et al. // Nanotechol. Russ. 2018. V. 13. № 5–6. P. 295.
Efremova M.V., Veselov M.M., Barulin A.V. et al. // ACS Nano. 2018. V. 12. № 12. P. 3190.
Gahl T.J., Kunze A. // Front. Neurosci. Switz. 2018. V. 12. P. 299.
Kunjachan S., Ehling J., Storm G. et al. // Chem. Rev. 2015. V. 115. № 19. P. 10907.
Sonali M.K.V., Singh R.P., Agrawal P. et al. // Nanotheranostics. 2018. V. 2. № 1. P. 70.
Alcaraz J., Buscemi L., Grabulosa M. et al. // Biophys. J. 2003. V. 84. P. 2071.
Evans E., Heinrich V., Ludwig F. et al. // Biophys. J. 2003. V. 85. P. 2342.
Ritort F. // J. Phys. Cond. Mat. 2006. V. 18. P. R531.
Головин Ю.И., Клячко Н.Л., Грибановский С.Л. и др. // ПЖТФ. 2015. Т. 41. № 9. С. 96; Golovin Y.I., Klyachko N.L., Gribanovsky S.L. et al. // Tech. Phys. Lett. 2015. Т. 41. № 5. P. 455.
Le-Deygen I.M., Vlasova K.Y., Kutsenok E.O. et al. // Nanomed. Nanotechnol. 2019. V. 21. Art. № 102065.
Le T.C., Zhai J., Chiu W.H. et al. // Int. J. Nanomed. 2019. V. 14. P. 6749.
Golovin Y.I., Gribanovsky S.L., Golovin D.Y. et al. // J. Nanopart. Res. 2017. V. 19. № 2. P. 59.
Klyachko N.L., Sokolsky–Papkov M., Pothayee N. et al. // Ang. Chem. Int. Ed. 2012. V. 51. № 48. P. 12016.
Vlasova K.Y., Piroyan A., Le-Deygen I.M. et al. // J. Colloid Interf. Sci. 2019. V. 552. P. 689.
Hughes S., El Haj A.J., Dobson J. // Med. Eng. Phys. 2005. V. 27. № 9. P. 754.
Kim D.H., Rozhkova E.A., Ulasov I.V. et al. // Nat. Mater. 2010. V. 9. № 2. P. 165.
Master A.M., Williams P.N., Pothayee N. et al. // Sci. Rep. 2016. V. 6. Art. № 33560.
Xie J., Chen L., Varadan V.K. et al. // Nanotechn. 2008. V. 19. № 10. Art. № 105101.
Choi Y.-K., Lee D.H., Seo Y.-K. et al. // Appl. Biochem. Biotech. 2014. V. 174. № 4. P. 1233.
Tay A.K.P. Acute and chronic neural stimulation via mechano-sensitive ion channels. Cham: Springer, 2018. 119 p.
Tay A., Di Carlo D. // Nano Lett. 2017. V. 17. № 2. P. 886.
Falconieri A., De Vincentiis S., Raffa V. // Nanomed. 2019. V. 14. № 9. P. 1073.
Yuan M., Wang Y., Qin Y.-X. // Nanomed. Nanotechnol. 2018. V. 14. № 4. P. 1337.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


