Известия РАН. Серия физическая, 2021, T. 85, № 2, стр. 175-181
Исследование функционализированных аптамерами наночастиц серебра в качестве SERS-субстратов для селективного детектирования белков
Д. А. Грибанев 1, *, Е. Г. Завьялова 2, А. С. Гамбарян 3, В. И. Кукушкин 1, Е. В. Рудакова 4, О. А. Амбарцумян 5
1 Федеральное государственное бюджетное учреждение науки
Институт физики твердого тела Российской академии наук
Черноголовка, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, Химический факультет
Москва, Россия
3 Федеральное государственное бюджетное научное учреждение
Федеральный научный центр исследований и разработки иммунобиологических препаратов
имени М.П. Чумакова Российской академии наук
Москва, Россия
4 Федеральное государственное бюджетное учреждение науки
“Институт физиологически активных веществ Российской академии наук”
Москва, Россия
5 Закрытое акционерное общество “Южполиметалл-Холдинг”
Москва, Россия
* E-mail: digrib@gmail.com
Поступила в редакцию 28.08.2020
После доработки 25.09.2020
Принята к публикации 28.10.2020
Аннотация
Разработаны методы количественного определения белков, рекомбинантного тромбина и гемагглютинина в составе вирусных частиц гриппа А, на основе эффекта SERS, возникающего на агрегатах наночастиц серебра, модифицированных аптамерами к тромбину и гемагглютинину, соответственно.
ВВЕДЕНИЕ
Рамановская спектроскопия получила распространение в различных областях промышленности, агрокомплексе, биомедицинской сфере и криминалистике благодаря возможности быстрой оценки химического состава исследуемых объектов и создания уникальных баз спектральных данных. Однако методы объемной рамановской спектроскопии имеют ряд существенных ограничений для применения в медицине и биотехнологиях в связи с низкой чувствительностью метода. Явление поверхностно-усиленного рамановского рассеяния (SERS – Surface-Enhanced Raman Scattering) [1] позволяет повысить интенсивность сигнала рамановского рассеяния и, таким образом, расширить области применения SERS, включая прямое биомолекулярное количественное определение и биофизическую аналитику. На сегодняшний день в мировой практике используется два основных подхода повышения интенсивности сигнала рамановского рассеяния от исследуемых аналитов.
Первый подход основан на формировании бегущих поверхностных плазмон-поляритонов вблизи поверхности твердотельных наноструктурированных металл-диэлектрических подложек [2]. Второй подход, реализованный в том числе и в данной работе, заключается в образовании локализованных плазмонов и “горячих точек” с высокой плотностью электромагнитного поля в растворах агрегатов металлических наночастиц [3]. Оба эти подхода имеют электромагнитную природу усиления интенсивности рамановского рассеяния, однако, они существенно отличаются по следующим параметрам: масштабу дальнодействия усиления электромагнитного поля, влиянию состава раствора на интенсивность сигнала. Таким образом, указанные методы усиления рамановского сигнала отличаются и по возможностям подстройки пика плазмонного поглощения под частоту лазерного возбуждения.
В настоящее время SERS-технология является перспективным аналитическим инструментом для биомолекулярного анализа малых молекул, макромолекулярных белков и даже таких крупных структур, как вирусы и клетки. Технология SERS позволяет осуществить прямое обнаружение молекул, без применения меток, за счет их собственного спектра рамановского рассеяния, аналогичного “отпечатку пальца” [4, 5].
Для создания высокоэффективных сверхчувствительных биосенсоров на основе SERS необходимо преодолеть ограниченную стабильность, и, как следствие, низкую воспроизводимость SERS-систем [6], что успешно решается благодаря разработке новых субстратов. Коллоидные растворы серебра являются одним из наиболее распространенных высокоэффективных SERS-субстратов. Основная проблема данного типа субстратов связана с коллоидной стабильностью, поскольку эти системы часто склонны к необратимой неконтролируемой агрегации, особенно в многокомпонентных смесях [7].
Метод детекции белков с использованием растворов наночастиц благородных металлов в качестве SERS-субстрата основан на том, что большинство биополимеров, даже в малых концентрациях, способствуют разрушению агрегатов металлических НЧ. При этом белковые молекулы способствуют формированию вокруг НЧ “белковой короны” [8], а в случае вирусных частиц эффект разрушения агрегированных коллоидов наблюдается в большей степени за счет дополнительного взаимодействия НЧ с гликопротеинами на оболочке вируса [9].
Модификация поверхности наночастиц аптамерами на основе нуклеиновых кислот (далее – аптамеры), специфичными к определенному белку, обеспечивает селективную сорбцию соответствующего белка на наночастицах за счет специфических взаимодействий. Скорость и стабильность специфических и неспецифических взаимодействий отличается, что может быть использовано для детекции определенных белков в биологических жидкостях сложного состава.
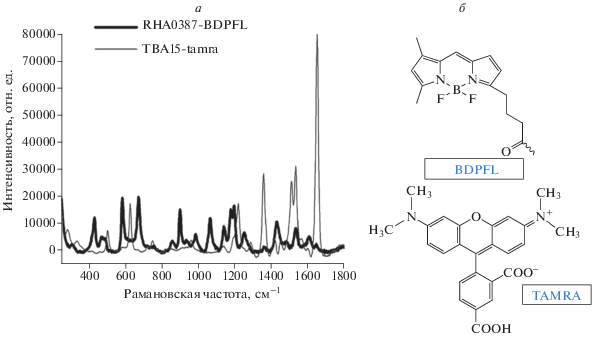
В ходе настоящего исследования были синтезированы серебряные наночастицы по методу Н. Леопольда и Б. Лендла [10]. Для детекции тромбина наночастицы модифицировались карбоксилированным производным аптамера к тромбину TBA15 [11–13], а в качестве метки использовался аптамер 5'-tamra-TBA15. Для определения гемагглютинина на поверхности вирусных частиц гриппа А использовалось тиольное производное аптамера RHA0385, показавшее ранее свою специфичность к гемагглютининам (HA) на поверхности вирусных частиц гриппа А [14, 15], в качестве метки в этой системе использовался аптамер 5'‑BDPFL-RHA0385.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Синтез серебряных наночастиц, модифицированных аптамерами
К водному раствору (9 мл), содержащему гидроксиламина гидрохлорид NH2OH . HCl (0.015 ммоль, 1.04 мг), гидроксид натрия NaOH (0.03 ммоль, 1.2 мг) при комнатной температуре и при интенсивном перемешивании быстро добавляли 1 мл водного раствора AgNO3 (0.01 ммоль, 1.08 г). После часа интенсивного перемешивания, к образовавшемуся коллоидному раствору серебра (AgNP, pH ~ 7) добавляли раствор соответствующего аптамера (0.1 мл 4 мкМ RHA0385-SH или 1 мл 7 мкМ TBA15COOH). После добавления раствора аптамера RHA0385-SH реакционная смесь перемешивалась еще 1 ч, а в случае использования раствора аптамера TBA15COOH реакционную смесь выдерживали сутки при комнатной температуре. К полученным смесям было добавлено соответствующее количество 0.2 М водного раствора буферного агента Tris-HCl (pH 7.5) до конечной концентрации 10 мМ и 0.1 мл 2 мкМ раствора аптамера, меченного SERS-активной меткой (TBA15-tamra и RHA0385-BDPFL, соответственно).
Ниже приведены нуклеотидные последовательности используемых в работе аптамеров TBA15 и RHA0385.
TBA15-tamra: 5'-tamra-GGTTGGTGTGGTTGG-3';
TBA15COOH: 5'-GGTTGGTGTGGTTGG-COOH-3';
RHA0385-SH: (5'-HS–(CH2)6–TTGGGGTTATTTTGGGAGGGCGGGGGTT-3'); RHA0385-BDPFL: (5'-BodipyFL–TTGGGGTTATTTTGGGAGGGCGGGGGTT-3').
На рис. 1 продемонстрированы структурные формулы и SERS-спектры меток tamra и BDPFL. SERS-спектры полученных растворов записывались на рамановском спектрометре ХИМЭКСПЕРТ-Т (ЗАО “Южполиметалл-Холдинг”) с длиной волны лазерного излучения 532 нм, имеющим спектральное разрешение 5–8 см–1. Спектры поглощения были записаны в спектральном диапазоне 300–900 нм на микропланшетном спектрофлуориметре SPARK (Tecan Group Ltd.), и было измерено значение флуоресценции при λex = = 495 ± 25 нм и λem = 520 ± 10 нм.
Определение тромбина
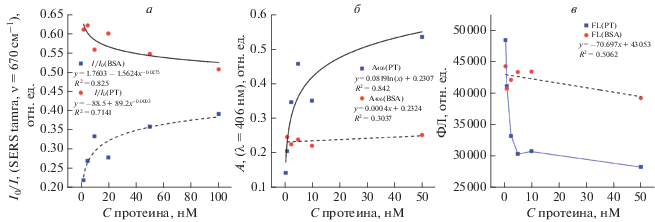
К серии аликвот по 0.2 мл, содержащих AgNP@TBA15COOH и TBA15-tamra с 10 мМ буфером Tris-HCl (pH 7.5), для медленного агрегирования НЧ добавляли по 0.2 мл буферного солевого раствора (10 мМ Tris-HCl + 140 мМ NaCl + + 10 мМ KСl) и 0.1 мл буферного солевого раствора (10 мМ Tris-HCl + 70 мМ NaCl + 5 мМ KСl), содержащего 0–500 нМ тромбина (свиной тромбин производства RayBiotech). Измерялись спектры SERS (при λex = 532 нм) меченых аптамеров (TBA15-tamra) в агрегатах серебряных НЧ до добавления тромбина (I0) и через 10 мин после добавления тромбина (I). Контрольные эксперименты проводились по аналогичному протоколу, однако в качестве контроля был использован раствор неспецифичного к TBA15-аптамеру белка – бычьего сывороточного альбумина (BSA, Sigma Aldrich). На рис. 2a приведены зависимости I/I0 от концентрации (C) белка (сплошная линия – тромбин (PT), пунктирная – BSA). Через 0.5 ч полученные смеси переносили в микропланшеты и разбавляли в 2 раза соляным буферным раствором (10 мМ Tris-HCl + + 70 мМ NaCl + 5 мМ KСl), затем снимали спектры поглощения (300–900 нм) и измеряли интенсивность флуоресценции при λex = 495 ± 25 нм и λem = 520 ± 10 нм (рис. 2б, 2в).
Рис. 2.
Зависимость отношения интенсивностей основной рамановской линии метки tamra (при ν ~ 1650 см–1) аптамера TBA15 до добавления белка I0 к агрегатам наночастиц AgNP@TBA15COOH и после добавления I от концентрации белка (в скобках указан белок BSA – бычий сывороточный альбумин, PT – свиной тромбин). Диапазон концентраций белков 2–100 нМ (а). Зависимость поглощения системы “агрегаты наночастиц AgNP@TBA15COOH–белок” при λ = = 406 нм (A406) от концентрации белка (в скобках указан белок BSA – бычий сывороточный альбумин, PT – свиной тромбин) (б). Зависимость значения флуоресценции системы “агрегаты наночастиц AgNP@TBA15COOH–белок” при λex = 495 ± 25 нм и λem = 520 ± 10 нм (FL) от концентрации белка (в скобках указан белок BSA – бычий сывороточный альбумин, PT – свиной тромбин). Диапазон концентраций белков 0.5–50 нМ. Среда – 10 мМ TrisHCl + 70 мМ NaCl + + 5 мМ KCl (pH 7.5) (в).
Определение гемагглютинина (НА) в системах, содержащих вирусные частицы гриппа А
К серии аликвот по 0.2 мл, содержащих AgNP@RHA0385-SHиRHA0385-BDPFLс 10 мМ буфером Tris-HCl (pH 7.5), для медленного агрегирования НЧ добавляли по 0.2 мл буферного солевого раствора (10 мМ Tris-HCl + 280 мМ NaCl + + 20 мМ KСl) и 0.1 мл буферного солевого раствора (10 мМ Tris-HCl + 140 мМ NaCl + 10 мМ KСl), содержащего 0–5 ∙ 107 вирусных частиц гриппа А (А/H5N1/Ku-at; инактивированные вирусы гриппа были предоставлены д. б. н. А.С. Гамбарян). Далее были получены SERS-спектры (при λex = 532 нм) меченых аптамеров (RHA0385-BODIPYFL) в агрегатах серебряных НЧ до добавления вируса гриппа А (А/H5N1/Ku-at = A-H5N1) (I0) и через 10 мин после добавления вируса (I). Контрольные эксперименты проводились по аналогичному протоколу, однако в качестве контроля были использованы растворы вирусных частиц гриппа B (B/Victoria/87 = BV87). На рис. 3a приведены зависимости I/I0 от концентрации вирусных частиц (сплошная линия – вирус гриппа А-H5N1, пунктирная – вирус гриппа ВV87). Через 0.5 ч полученные смеси переносили в микропланшеты и разбавляли в 2 раза соляным буферным раствором (10 мМ Tris-HCl + 140 мМ NaCl + 10 мМ KСl), снимали спектры поглощения (300–900 нм) и измеряли интенсивность флуоресценции при λex = = 495 ± 25 нм и λem = 520 ± 10 нм (рис. 4a, 4б).
Рис. 3.
Зависимость отношения интенсивностей основной рамановской линии метки BODIPYFL (при ν ~ 670 см–1) аптамера RHA0385 до добавления вирусов гриппа (А или В) I0 к агрегатам наночастиц AgNP@RHA0385-SH и после добавления I от объемной доли биоаналита в соляном буферном растворе (степени разбавления, где I – чистая аллантоисная жидкость, содержащая 1010 вирусных частиц в 1 мл). Исследуемый диапазон концентраций вирусных частиц 2 × 105–2 × 107 частиц/мл). Среда – 10 мМ Tris-HCl + 140 мМ NaCl + 10 мМ KCl (pH 7.5) (а). УФ-видимые-ближние ИК спектры свежеприготовленных (синий) растворов серебряных НЧ в воде, выдержанных в течении недели в темноте при 25°С (красный) (б).
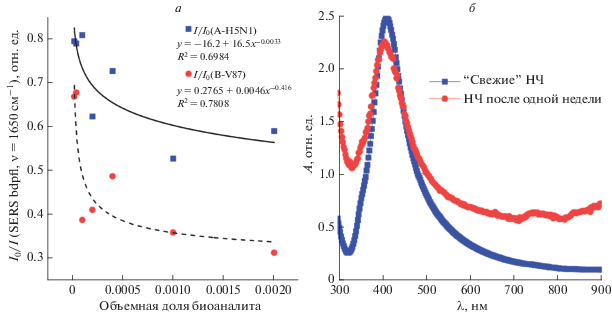
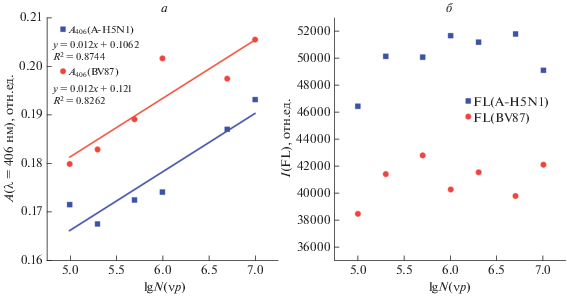
Рис. 4.
Зависимость поглощения системы при λ = 406 нм (A406) (а). Зависимость интенсивности флуоресценции системы при λex = 495 ± 25 нм и λem = 520 ± 10 нм (Ifl) агрегатов AgNP@RHA0385-SH@VPflu от концентрации вирусных частиц lgN(νp) гриппа A (A/H5N1/Ku-at = A-H5N1) или гриппа В (B/Victoria/87 = BV87). Диапазон концентраций вирусных частиц 105–107 частиц/мл. Среда – 10 мМTrisHCl + 140 мМ NaCl + 10 мМ KCl (pH 7.5) (б).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
Основными достоинствами коллоидных растворов серебра, полученных восстановлением AgNO3 гидроксиламином, является однородность размера серебряных наночастиц (средний размер НЧ – 23 нм) [10], отсутствие стабилизаторов (фактически двойной электрический слой на поверхности частиц образуют только катионы серебра и хлорид-анионы) и, как следствие, возможность модификации полученных AgNPs любыми стабилизаторами-непосредственно во время синтеза (“one-pot reaction”). Следует отметить, что полученные серебряные коллоиды обладают большим коэффициентом усиления по сравнению с серебряными коллоидами аналогичных форм и размеров, полученных другими способами [16]. Более того, полученные коллоидные растворы демонстрируют низкую самоагрегацию с течением времени (рис. 3б).
В экспериментах по определению белков в биологических жидкостях важно сохранение ионной силы (концентрации солей и буферных агентов) как до, так и после добавления аналита к раствору коллоидных НЧ. Так, в работе по детекции тромбина по спектрам двухфотонной флуоресценции TBA15-модифицированных серебряных НЧ [12] трудно оценить, какой фактор сильнее влияет на степень агрегации НЧ (следовательно, и на рост сигнала флуоресценции) – удаление аптамера с поверхности и возрастающая степень агрегации или простое увеличение ионной силы при добавлении раствора тромбина в фетальной телячьей сыворотке (FCS), имеющей высокую концентрацию солей и, следовательно, высокую ионную силу.
Измерения белков проводились в более разбавленном растворе по сравнению с соляным буферным раствором, в котором исследовались вирусы, в связи с тем, что при высоких концентрациях солей сложнее было бы наблюдать разрушение агрегатов серебряных НЧ и, таким образом, оптические свойства систем НЧ-аптамер-белок изменялись бы в значительно меньших масштабах.
Как было показано ранее, SERS-сигнал в растворах НЧ является нестабильным и плохо воспроизводится, этот недостаток особенно сильно проявляется в агрегированных путем увеличения ионной силы растворах серебряных НЧ. Иными словами, если добавить слишком много агрегирующего агента, коллоидные частицы быстро выпадут в осадок из раствора, и SERS не будет наблюдаться. В случае низкой концентрации соли невозможно достижение достаточного количества “горячих точек” в растворе и в результате SERS-сигнал также будет слаб [3]. Поскольку агрегация НЧ приводит к снижению стабильности коллоидной системы, состав и изменение ионной силы раствора необходимо тщательно контролировать для получения воспроизводимых SERS-спектров [17]. Однако исследование влияния агрегирующих агентов и скорости их добавленияк растворам серебряных НЧ в биологических средах выходит за рамки данного исследования.
В настоящей работе предложен простой метод корректной оценки изменений SERS-сигналов при добавлении биоаналитов к раствору НЧ. В качестве изменяющегося параметра мы использовали не абсолютные, а относительные значения SERS-сигналов, т.е. отношение значения интенсивности основной Рамановской линии SERS-метки после добавления раствора белка (или вируса) к аналогичному показателю до добавления аналита.
Для корректного построения зависимостей относительного SERS-сигнала от концентрации белка параллельно использовали и другие оптические методы, в частности для каждого образа были получены спектры поглощения в диапазоне (300–900 нм) и значения флуоресценции при λex = 495 ± 25 нм и λem = 520 ± 10 нм. Затем были построены соответствующие зависимости изменения величин поглощения и флуоресценции от концентрации белка и вирусных частиц.
Так, значения величин поглощения при λ = 406 нм системы “агрегаты наночастиц AgNP@TBA15COOH–белок” в присутствии специфичного к TBA15-аптамеру белка, тромбина, хорошо согласуются с зависимостями AgNP@citrate-protein [18] в диапазоне концентраций протеинов 0.5–50 нМ. В случае неспецифичного к данному аптамеру белка (BSA) похожей зависимости не наблюдается вследствие отсутствия взаимодействия аптамер-модифицированных НЧ с неспецифичным белком.
Кроме этого, необычным является и поведение интенсивности флуоресценции в этих системах. Похожая, но более чувствительная детекция тромбина флуоресцирующими аптамер-модифицированными серебряными нано-частицами была осуществлена в [19]. Однако в описываемой системе наночастицы серебра были конъюгированы с парамагнитными частицами (MPs-Ag), что позволяло разделять и концентрировать белки более эффективно.
Зависимость относительного значения SERS-сигнала метки от концентрации белка в системе “агрегаты серебряных НЧ-аптамер–белок” также имеет различный характер для специфичного к TBA15-аптамеру белку (тромбин-PT) и для неспецифичного к TBA15-аптамеру белку (BSA) (рис. 2a), что можно объяснить разной степенью взаимодействия НЧ, функционализированных аптамером, со специфичным и неспецифичным к данному аптамеру белком. Данное различие характера концентрационных зависимостей (снижение сигнала SERS в зависимости от концентрации белка) хорошо согласуется со степенью агрегации заряженных металлических НЧ в зависимости от наличия специфических взаимодействий агрегатов НЧ с полимерами в соляных буферах [20].
В случае смесей аптамер-модифицированных серебряных НЧ и идентично организованных вирусных частиц, различающихся лишь отдельными участками (эпитопами) поверхностных белков (гемагглютининов – HA) [21], обычные оптические методы (УФ-видимые-ближние ИК спектры) не позволяют выявить существенных различий (рис. 4a, 4б) и, соответственно, не могут быть использованы для качественного и количественного анализа вирусных белков и, соответственно, вирусов. SERS-отклик таких систем является более специфичным (рис. 3a), как за счет различной степени взаимодействия аптамеров с SERS-активной меткой в агрегатах серебряных НЧ с вирусными липопротеинами, так и за счет различной степени разрушения агрегатов НЧ (как следствие, различное расстояние между отдельными НЧ и от НЧ до SERS-метки) по мере добавления вирусных частиц, содержащих на поверхности специфичный или неспецифичный к данному аптамеру белок.
Полученные в ходе настоящей работы устойчивые и воспроизводящиеся зависимости дают основания для разработки систем и протоколов селективной детекции белков и вирусов в биологических средах. В связи с этим основной задачей дальнейших исследований является оптимизация условий проведения аналогичных экспериментов (например, за счет изменения состава солевого буфера и/или дополнительной поверхностной модификации серебряных НЧ) с целью получения более чувствительных сенсоров к вирусам на основе растворов серебряных коллоидов.
ЗАКЛЮЧЕНИЕ
Обнаружен различный характер разрушения агрегатов аптамер-моди-фицированными серебряных НЧ в присутствии аптамер-специфичного белка, тромбина, и аптамер-неспецифичного альбумина. Получена концентрационная зависимость степени агрегации аптамер-модифицированных НЧ от концентрации каждого из указанных модельных белков. Это позволяет рассматривать аптамер-модифицированные коллоидные НЧ серебра в качестве перспективного субстрата для селективной SERS-детекции белков.
Для смесей аптамер-модифицированных серебряных НЧ и идентично организованных вирусных частиц, различающихся эпитопами поверхностных белков гемагглютининов, выявлены близкие по характеру зависимости SERS-сигнала от концентрации вирусов, которые, однако, заметно различаются по числовым значениям. Таким образом, как и в случае с детекцией белков, система модифицированных аптамерами коллоидных НЧ серебра позволяет в перспективе создать сенсорную платформу, специфичную к определенным типам вирусов.
Работа по детекции белков (тромбина и альбумина) выполнена за счет гранта Российского научного фонда № 19-72-30003.
Список литературы
Fleischmann M., Hendra P.J., McQuillan A.J. // Chem. Phys. Lett. 1974. V. 26. No 2. P. 163.
Ko H., Singamaneni S., Tsukruk V.V. // Small. 2008. V. 4. No 10. P. 1576.
Aroca R.F., Alvarez-Puebla R.A., Pieczonka N. et al. // Adv. Coll. Interf. Sci. 2005. V. 116. P. 45.
Bruzas I., Lum W., Gorunmez Z. et al. // Analyst. 2018. V. 143. P. 3990.
Joseph M.M., Narayanan N., Nair J.B. et al. // Biomaterials. 2018. V. 181. P. 140.
Cialla D., März A., Böhme R. et al. // Anal. Bioanal. Chem. 2012. V. 403. P. 27.
Kahraman M., Mullen E.R., Korkmaz A. et al. // Nanophoton. 2017. V. 6. No 5. P. 831.
Banerjee V., Das K.P. // Colloids Surf. B. 2013. V. 111. P. 71.
Elechiguerra J.L., Burt J.L., Morones J.R. et al. // J. Nanobiotech. 2005. V. 3. No 6. P. 1665.
Leopold N., Lendl B. // J. Phys. Chem. B. 2003. V. 107. No 24. P. 5723.
Yang C., Kim E., Pak Y. // Bull. Korean Chem. Soc. V. 33. No 11. P. 3597.
Jiang C., Zhao T., Li S. et al. // Appl. Mater. Interfaces. 2013. V. 5. No 21. Art. No 10853.
Zavyalova E., Golovin A., Pavlova G. et al. // Curr. Pharm. Des. 2016. V. 22. No 33. P. 5163.
Shiratori I., Akitomi J., Boltz D.A. et al. // Biochem. Biophys. Res. Commun. 2014. V. 443. No 1. P. 37.
Kukushkin V.I., Ivanov N.M., Novoseltseva A.A. et al. // PLoS ONE. 2019. V. 14. No 4. Art. No e0216247.
Canamares M.V., Garcia-Ramos J.V., Sanchez-Cortes S. et al. // J. Coll. Int. Sci. 2008. V. 326. P. 103.
Yaffe N.R., Blanch E.W. // Vibrat. Spectrosc. 2008. V. 48. P. 196.
Shrivastava S., Dash D. // Nano-Micro Lett. 2010. V. 2. P. 164.
Li H., Qiang W., Wang C. et al. // Analyst. 2013. V. 138. P. 7376.
Lebovka N.I. // Adv. Polymer. Sci. 2012. V. 255. P. 57.
Chen R., Holmes E.C. // J. Mol. Evol. 2008. V. 66. P. 655.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая