Известия РАН. Серия физическая, 2021, T. 85, № 6, стр. 829-835
Акустическая структура низкочастотных вокализаций домовой мыши (Mus musculus). Онтогенетический аспект
А. С. Лупанова 1, М. А. Егорова 1, *
1 Федеральное государственное бюджетное учреждение науки
Институт эволюционной физиологии и биохимии имени И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: ema6913@yandex.ru
Поступила в редакцию 09.12.2020
После доработки 25.01.2021
Принята к публикации 26.02.2021
Аннотация
Представлены результаты исследования акустического поведения половозрелых домовых мышей при имитации элементов агонистического и полового поведения и мышат при излучении ими гнездового крика дискомфорта. По результатам спектрально-временного анализа низкочастотных вокализаций, сопровождающих исследованные типы поведения, выявлены их наиболее стабильные характеристики: высокая интенсивность, гармонический каркас, число основных формант (3–5), сосредоточение основной энергии сигнала в полосе частот до 35 кГц, расположение основной частоты в низкочастотном диапазоне слуховой чувствительности мыши (2–5 кГц). Обсуждаются онтогенетические аспекты формирования низкочастотных вокализаций.
ВВЕДЕНИЕ
Вторая половина двадцатого столетия в физиологии слуха характеризуется повышенным интересом к нейронным механизмам обработки коммуникационных акустических сигналов. Одним из традиционных объектов подобных исследований является домовая мышь (Mus musculus) [1–3]. Так как подавляющее большинство исследователей рассматривали механизмы кодирования тональных ультразвуковых вокализаций, именно на изучении акустической структуры этих высокочастотных сигналов и было сконцентрировано внимание [4–10]. Однако в последнее десятилетие в качестве модели для изучения нейрофизиологических механизмов обработки сложных коммуникационных сигналов стали использовать и низкочастотные гармонические крики [11], сведения о которых в литературе весьма отрывочны и не дают полного представления об акустических характеристиках и смысловой нагрузке этих сигналов [12, 13].
Поскольку акустические характеристики и поведенческая значимость низкочастотных вокализаций у домовых мышей исследованы фрагментарно, а вокализации мышей подвержены изменениям в зависимости от их видовой и линейной принадлежности, в настоящей работе выполнено сравнительное исследование спектрально-временной структуры крика дискомфорта мышат “wriggling call”, крика подчиненного самца при агонистическом поведении и оборонительного крика самки домовых мышей (Mus musculus) – гибридов линий СВА и С57BL\6.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты проводились в дневное время, в условиях лабораторного содержания домовых мышей (Mus musculus) – гибридов линий СВА и С57BL\6. Проведена аудио-видео регистрация акустического поведения половозрелых мышей при имитации элементов агонистического и полового поведения, а также мышат при излучении ими гнездового крика дискомфорта. Во время эксперимента животные располагались в звукозаглушенной камере с затененным освещением (звукозаглушение на частоте 1000 Гц составляло 40 дБ).
При исследовании криков взрослых животных пару мышей помещали в разные отсеки стеклянного бокса (размером 45 × 25 × 30 см), разделенного на две части подвижной перегородкой, которую убирали с началом аудио и видеозаписи. Подстилка во время экспериментов отсутствовала. Перед началом каждого эксперимента бокс промывали водой и протирали спиртовым раствором.
Запись крика дискомфорта мышат “wriggling call” проводили в условиях естественного пребывания детенышей в гнезде вместе с матерью от возникновения вокализаций (2-е сутки онтогенеза) до полного их исчезновения после 14–16-го дня [14, 15].
Регистрацию вокализаций производили при помощи 6.5 мм конденсаторного микрофона 4135, предусилителя 2633, измерительного усилителя 2606 фирмы Bruel & Kjaer на звуковую карту (Roland UA-55 Quad-Capture). Микрофон фиксировали в крышке бокса или клетки в 25 см над дном.
Спектральный анализ звуковых сигналов выполняли на основе быстрого преобразования Фурье, данные взвешивались с помощью окна Хемминга с числом отсчетов 2048 (программы “Waterfall” и “Cool Edit Pro 2.1”). Записанные сигналы оцифровывали с частотой дискретизации 125 кГц, шумы в частотном диапазоне до 1 кГц были отфильтрованы.
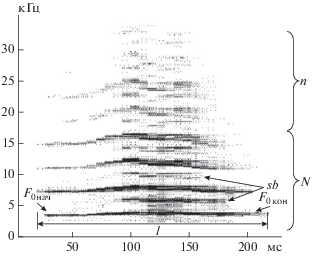
В рамках исследования проводили измерения следующих акустических характеристик вокализаций: основной частоты в начале и конце сигнала, ее минимального и максимального значения, длительности сигналов, глубины и направления частотной модуляции, наличия шумовых компонентов, субгармоник, частотных скачков и разрывов в спектре (рис. 1). Всего было зарегистрировано более 1500 криков 32 половозрелых мышей (14 самцов и 18 самок) и 28 мышат.
Рис. 1.
Измеряемые параметры исследуемых криков домовых мышей: F0нач, F0кон – частота основного тона в начале и конце сигнала; l – длительность крика; sb – субгармоники; N и n – основные и дополнительные гармоники соответственно. На рисунке приведена сонограмма оборонительного крика самки.
Видеорегистрация акустического поведения мышей осуществлялась с помощью веб-камеры Logitech Pro 9000 (разрешение 1600 × 1200, 30 кадров в секунду) на персональный компьютер. Анализ поведения мышей проводили методом временных срезов с интервалом в 1 с [16] с помощью покадрового анализа видеозаписи в компьютерной программе VirtualDub 1.10.4. Во время взаимодействия взрослых мышей регистрировали положение животных в экспериментальном боксе и следующие элементы их поведения: назо-назальный контакт, назо-анальный контакт, обнюхивание различных участков тела, преследование, убегание от партнера, оборонительные боковую и вертикальную стойки, отталкивание партнера, груминг, садки, позу подчинения, исследование территории [17, 18]. Всего было проанализировано 3954 видеофрагмента.
Полученные результаты обрабатывали статистически с использованием пакета программ Statistica v.6.
РЕЗУЛЬТАТЫ
Спектрально-временной анализ вокализаций показал, что принципиальной особенностью всех исследуемых криков является их гармоническая структура (рис. 1–3). Основные акустические характеристики сигналов представлены в табл. 1.
Видеорегистрация агонистического поведения самцов и анализ полученных видеозаписей позволили установить, что при взаимодействии крик издает подчиненный самец в момент признания своего поражения. Обусловленный эмоционально насыщенной обстановкой драки, крик был самым громким среди всех зарегистрированных низкочастотных вокализаций (табл. 1). Среди криков преобладали сигналы, имеющие три–шесть гармонических составляющих, которые превышали уровень шума не менее чем на 10 дБ, а, как правило, на 17–20 дБ (рис. 2а). В структуре около одной трети криков (190 сигналов) отмечалась частотная модуляция основного тона в начале (43%), середине (44%) и конце (13%) сигнала, преимущественно в сторону повышения частоты основного тона. Все крики имели амплитудную модуляцию на всем их протяжении (рис. 2а). Субгармоники были отмечены у 39.5% криков. Они располагались в начале (18.1%), середине (27%: рис. 2а), в конце крика (26.6%) или на всей его протяженности (28.3%). В 26% криков наблюдались разрывы в спектрах, причем у половины сигналов они находились в средней части. Реже встречались разрывы спектра в конце сигнала (12.8%).
Рис. 2.
Акустические характеристики криков подчинения двух самцов при агонистическом поведении (а), оборонительных криков двух самок при половом поведении (б) и гнездовых криков дискомфорта двух мышат (в). В верхней части фрагментов – осциллограмма крика (по оси абсцисс – время, мс); в нижней левой части – сонограмма (по оси абсцисс – время, мс; по оси ординат – частота, кГц); в нижней правой – амплитудный спектр крика (по оси абсцисс – частота, кГц; по оси ординат – относительный уровень звукового давления, дБ).
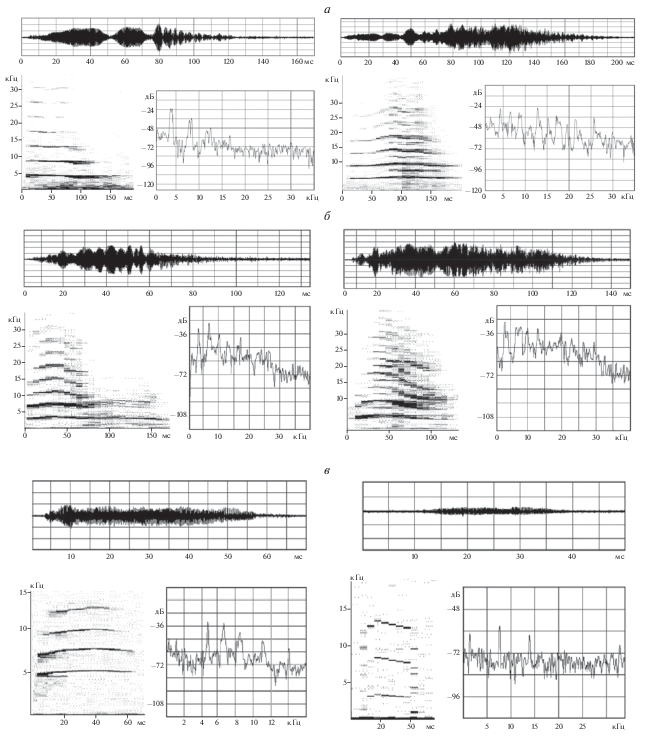
Рис. 3.
Онтогенетические изменения акустической структуры гнездового крика дискомфорта “wriggling call” четырех мышат, зарегистрированные на второй (а), шестой (б), десятый (в) и четырнадцатый (г) день онтогенеза. В верхней части каждого фрагмента – осциллограмма крика; в нижней – сонограмма.

Несмотря на то, что половое поведение мышей также эмоционально насыщенно, оборонительный крик самки уступал по интенсивности крику подчиненного самца. Его уровень достигал 80 дБ УЗД (табл. 1). Как показал анализ видеонаблюдений, оборонительные крики издавали самки, пресекавшие попытки самцов к спариванию. Число основных гармоник варьировало от трех до одиннадцати, но преобладали сигналы, имеющие три–пять гармонических составляющих, превышающих уровень шума не менее чем на 8 дБ. Основная энергия сигнала была сосредоточена в области частот до 25 кГц (рис. 2б). Почти 40% сигналов (238 криков) имели частотную модуляцию основного тона в начале (37%), середине (43.3%), в конце (17.2%) сигнала или по всей его протяженности (2.5%). Все зарегистрированные крики имели амплитудную модуляцию. Три четверти криков (450 сигналов, 75%) имели в своем составе шумовые компоненты, представляющие собой включения широкополосного шума преимущественно в начале и конце сигнала (рис. 2б). Субгармоники были отмечены у 37% криков. Реже всего встречались разрывы спектра в конце сигнала (7.4%).
Таблица 1.
Основные акустические параметры исследуемых сигналов
| Акустические параметры | Гнездовой крик дискомфорта (wriggling call) | Оборонительный крик самки | Крик подчиненного самца |
|---|---|---|---|
| Длительность, мс (M ± SD) | 69.3 ± 27.09 | 180 ± 70 | 176 ± 58 |
| F0, кГц (M ± SD) | 5.17 ± 0.83 | 3.1 ± 0.5 | 3.5 ± 0.7 |
| F0max, кГц (M ± SD) | 42.4 ± 15.6 | 23.5 ± 8.9 | 24.9 ± 11.2 |
| Уровень сигнала, дБ УЗД (относительно 2 ⋅ 10–5 Н/м2) | 70 (на расстоянии 15–20 см) | 80 (на расстоянии 20–25 см) | 90 (на расстоянии 20–25 см) |
Гнездовой крик раннего онтогенеза “wriggling call” был зарегистрирован как во время бодрствования, так и во время сна мышат. К типичным ситуациям, в которых излучался крик, относятся: кормление, достройка самкой гнезда, перетаскивание детенышей.
Анализ акустической структуры крика показал, что “wriggling call” является тихим контактным криком (табл. 1). Он представляет собой гармонический низкочастотный сигнал (рис. 2в). Частота основного тона варьировала в диапазоне от 3 до 9 кГц и составляла в среднем 5.1 ± 0.4 кГц (рис. 2в). Этот показатель не изменялся с возрастом мышат (рис. 4а). Длительность всех зарегистрированных криков варьировала от 20 до 180 мс. Ее среднее значение составляло 69.3 ± 9.8 мс (табл. 1). Анализ динамики длительности сигналов в ходе онтогенеза выявил достоверное ее уменьшение от 2 к 14 дню жизни (регрессионный анализ, p < 0.05; рис. 4б). Число гармонических составляющих варьировало от двух до семнадцати. Однако к концу второй недели жизни мышат преобладали сигналы, имеющие три, четыре или пять основных гармонических составляющих: три гармоники имели 30.7% криков; четыре – 15.8%; пять – 13% (рис. 3). Анализ динамики максимальной частоты криков в ходе онтогенеза выявил достоверное ее уменьшение (регрессионный анализ, p < 0.05; рис. 4в–4г).
Рис. 4.
Возрастная динамика акустических характеристик “wriggling call” 28 мышат: а – основная частота, б – длительность криков, в – максимальная частота, г – количество гармоник. Сплошные линии соответствуют уравнениям линейной регрессии, приведенным на рисунке.

Половина всех сигналов отличалась чисто гармонической структурой. Такие крики состояли исключительно из гармоник, постоянных по частоте и амплитуде. В структуре 50% криков отмечалась частотная модуляция основного тона в начале, середине или конце сигнала (рис. 3б–3г). С возрастом данный показатель достоверно не изменялся. В то же время, наблюдалось достоверное увеличение количества разрывов в спектре и субгармонических составляющих вокализаций (регрессионный анализ, p < 0.001), а шумовой компонент, напротив, в криках более взрослых детенышей встречался реже.
ОБСУЖДЕНИЕ
Как видно из полученных результатов, оборонительный крик самок по своей акустической структуре очень близок крику подчиненного самца. Различия связаны только с меньшей энергетической насыщенностью крика самок, с более низкой основной частотой оборонительного крика и большим числом основных формант в нем. Меньшие значения основной частоты крика самок были обусловлены, очевидно, их более крупными по сравнению с самцами размерами. А большее число формант в крике самца связано с большей интенсивностью его вокализаций.
Сопоставление акустической структуры звуковых гармонических вокализаций взрослых мышей и детенышей, т.е. крика подчиненного самца и оборонительного крика самки с криком дискомфорта мышат, также выявляет большое сходство фундаментальных характеристик всех трех сигналов. В то же время, крик мышат имеет меньшую длительность (табл. 1), что, вероятно, связано с меньшим объемом их легких. Крик мышат отличает также более высокая частота основной форманты, что, очевидно, обусловлено маленькими размерами тела мышонка, а также меньшая интенсивность крика и, как следствие, меньшее количество основных формант в крике и малая выраженность амплитудной модуляции сигнала. Иными словами, гармонический крик мышат имеет более простую акустическую структуру, чем крики взрослых животных. Такая упрощенность сигнала, по-видимому, обусловлена незаконченным процессом формирования голосового аппарата в раннем постнатальном онтогенезе мышат. Усложнения в структуре “wriggling call” (субгармоники, разрывы спектра), наблюдали на исходе первого месяца жизни, когда мышата переходили к самостоятельной жизни, и крик утрачивал свою значимость гнездового крика общения матери и детенышей [4]. Очевидно, что выявленные в данной работе изменения акустической структуры вокализаций мышат к исходу 14 дня постнатального онтогенеза свидетельствуют об усложнении голосового аппарата животных, показанном в ряде работ [14, 19] . В ходе такого усложнения низкочастотный гармонический крик дискомфорта мышат, по-видимому, изменяет свое сигнальное значение и у самцов становится акустическим компонентом агонистического поведения, а у самок – оборонительным криком полового поведения. Таким образом, коммуникационный сигнал раннего онтогенеза мышат становится основой формирования вокализаций взрослых особей.
Работа выполнена на средства федерального бюджета в рамках темы государственного задания на 2019–2021 гг. № АААА-А18-118013090245-6.
Список литературы
Ehret G. // Handbook of ultrasonic vocalization. 2018. V. 25. P. 187.
Ehret G., Haack B. // J. Comp. Physiol. 1982. V. 148. P. 245.
Roberts P.D., Portfors C.V. // Front. Syst. Neurosci. 2015. No. 9. P.172.
Егорова М.А., Акимов А.Г. // Акуст. журн. 2010. Т. 56. № 2. С. 307.
Musolf K., Hoffmann F., Penn D.J. // Anim. Behav. 2010. V. 79. P. 757.
Hoffmann F., Musolf K., Penn D.J. // Physiol. Behav. 2012. V. 105. P. 766.
Lahvis G.P., Alleva E., Scattoni M.L. // Genes. Brain Behav. 2011. V. 10. P. 4.
Guo Z., Holy T.E. // Chem. Senses. 2007. V. 32. No. 5. P. 463.
Portfors C.V. // J. Amer. Assoc. Lab. Anim. Sci. 2007. V. 46. No. 1. P. 28.
Musolf K., Meindl S., Larsen A.L. et al. // PLOS One. 2015. V. 10. Art. No. e0134123.
Haack B., Markl H., Ehret G. The auditory psychobiology of the mouse. Springfield: Charles C. Thomas Pub. Ltd., 1983. P. 57.
Whytney G., Nyby J. The auditory psychobiology of the mouse. Springfield: Charles C. Thomas Pub. Ltd., 1983. P. 98.
Nyby J. // Handbook of mouse auditory research: from behavior to molecular biology. Ch. 1. Boca Raton: CRC Press, 2001. P. 3.
Elwood R.W., Keeling F. // Dev. Psychobiol. 1982. V. 15. P. 221.
Nyby J. // Behav. Biol. 1976. V. 18. P. 285.
Володин И.А., Гольцман М.Е., Калашникова М.В. // ДАН. 1998. Т. 363. № 4. С. 570.
Котенкова Е.В., Осипова О.В., Лялюхина С.И. Домовая мышь. М.: ИЭМЭЖ, 1989. 256 с.
Володин И.А., Ильченко О.Г., Попов С.В. Песчанки: содержание и демография популяций разных видов в неволе. М., 1996. 228 с.
Engler S., Rose A., Knornschild M. // Behaviour. 2017. V. 154. P. 267.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


