Известия РАН. Серия физическая, 2022, T. 86, № 10, стр. 1411-1417
Лазерный синтез титаната висмута Bi12TiO20 для применения в фотокатализе
Е. Д. Фахрутдинова 1, *, Л. С. Егорова 1, В. А. Светличный 1
1 Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский Томский государственный университет”
Томск, Россия
* E-mail: fakhrutdinovaed@gmail.com
Поступила в редакцию 01.06.2022
После доработки 15.06.2022
Принята к публикации 22.06.2022
- EDN: GKXXBK
- DOI: 10.31857/S0367676522100064
Аннотация
Разработана методика получения смешанных оксидов титана и висмута на основе метода импульсной лазерной абляции в жидкости. Выявлены основные условия синтеза, влияющие на фазовый состав материалов, получена монофаза со структурой Bi12TiO20. Исследована фотокаталитическая активность синтезированных материалов в процессе фоторазложения Родамина Б под действием излучения светодиодного источника (375 нм).
ВВЕДЕНИЕ
Семейство титанатов висмута (BTO), соединений, образующиеся в системе Bi2O3–TiO2, включает четыре основных соединения со стехиометрией Bi4Ti3O12, Bi2Ti2O7, Bi12TiO20 и Bi20TiO32. Первоначальный интерес к BTO был связан с их сегнетоэлектрическими, пьезоэлектрическими, диэлектрическими свойствами. Эти материалы исследовались в качестве замены керамики на основе свинца в конденсаторах, датчиках и прочих электронных приборах и устройствах хранения информации нового поколения [1–3]. В последние годы значительный интерес вызывают фотокаталитические (ФК) свойства BTO. Для ФК процессов при УФ и видимом возбуждении интерес представляют как широкозонный Bi4Ti3O12 (~3.0 эВ), так и узкозонный Bi12TiO20 (~2.65 эВ). Эти материалы из ряда BTO обладают наибольшей фотокаталитической активностью и стабильностью [4]. Считается, что BTO Bi12TiO20 со структурой силленита, имеющее в структуре полиэдры с неподеленной парой электронов Bi–O, которые служат донорами электронов и позволяют лучше разделять фотогенерированные электронно-дырочные пары [5], является перспективным кандидатом в качестве высокоактивного фотокатализатора в области видимого света.
Получают BTO обычно твердофазным синтезом [6], совместным осаждением растворов солей [7] или золь-гель методом [8]. К недостаткам существующих методов синтеза ВТО структур можно отнести технологические проблемы, связанные с длительностью синтеза порошков определенного фазового состава, а также трудности формирования материала с заданной микроструктурой. В данной работе предлагается использовать для синтеза титанатов висмута со структурой Bi12TiO20 метод, основанный на импульсной лазерной абляции (ИЛА) в жидкости. ИЛА представляет особый интерес, так как при синтезе материалов не используются дополнительные химические прекурсоры, что позволяет получать “чистые” наноколлоиды или порошки при абляции в жидкости или газе [9, 10]. Варьируя состав мишеней, параметры лазерного излучения и реакционную среду можно получать уникальные материалы с желаемыми физико-химическими свойствами [10].
Цель настоящей работы – исследование влияния условий синтеза при импульсной лазерной абляции в жидкости на фазовый состав титанатов висмута (в том числе ставилась задача получения монофазы силленита Bi12TiO20) и исследование оптических и фотокаталитических свойств полученных систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез материалов
Синтез материалов осуществляли по следующей методике. Первоначально проводили ИЛА металлических мишеней Bi (99.9% чистоты) и Ti (99.9% чистоты) в дистиллированной воде при воздействии сфокусированного излучения Nd:YAG лазера (LS2131M-20, LOTIS TII, Республика Беларусь; λ = 1064 нм, Eимп = 150 мДж, τимп = = 7 нс и f = 20 Гц). Свежеприготовленные коллоидные растворы смешивались в молярном соотношении Bi : Ti = 12 : 1 и 24 : 1 (нестехиометрическое соотношение) и сушились в открытых стеклянных емкостях при 60°С до порошкового состояния (образцы BTO и BTxO). Далее образцы отжигались на воздухе при 600°С в течение 4 ч (образцы BTO_600, BTxO_600).
Часть свежеприготовленных коллоидов с молярным соотношением Bi : Ti = 12 : 1 перед сушкой и отжигом подвергалась дополнительной обработке: (1) лазерному облучению в течении 2.5 ч при тех же параметрах лазерного излучения при которых велась абляция; (2) продувке газом СO2 30 мл/мин в течении 15 мин. Образцы были обозначены BTO_hv, BTOhv_600 и BTO_CO2 и BTO_CO2_600, соответственно. Методика лазерного синтеза двойных оксидов подробно описана в работе [11] на примере силикатов висмута.
Методы исследования материалов
Морфология поверхности материалов изучалась на сканирующем электронном микроскопе (СЭМ) Vega 3 SBH (Tescan, Чехия).
Удельную поверхность и пористость определяли по низкотемпературной адсорбции азота с использованием анализатора TriStar II 3020 (Micromeritics, США). Удельная площадь поверхности рассчитывалась по методу Брунауэра–Эммета–Теллера (БЭТ).
Фазовый состав материалов исследовали с помощью рентгеновского дифрактометра XRD-7000 (Shimadzu, Япония) с монохроматическим CuKα-излучением (1.54 Å) в диапазоне углов 2θ от 10 до 80°. Содержание фаз рассчитывалось с помощью программы POWDER CELL 2.4.
Оптические свойства материалов исследовали методом спектроскопии диффузного отражения (СДО) на спектрофотометре Cary 100 с приставкой DRA-CA-30I, Labsphere в интервале длин волн 230–800 нм. В качестве эталона измерения использовался MgO. По краю полосы поглощения методом Тауца была оценена ширина запрещенной зоны. Для этого строилась графическая зависимость в координатах (1):
где n = 1/2 для прямозонного и n = 2 – для не прямозонного переходов.Фотокаталитические свойства материалов были оценены по фоторазложению водного раствора модельного органического красителя Родамина Б (5 ⋅ 10–6 М) при облучении светодиодным источником (LED) с длиной волны 375 нм и мощностью 51 мВт. Загрузка катализатора составляла 0.5 г/л, объем облучаемой смеси – 30 мл. Эксперимент проводился с учетом темновой стадии для установления адсорбционно-десорбционного равновесия. Концентрация раствора родамина Б определялась фотометрически с помощью спектрофотометра Cary 100. Константа скорости реакции k (кинетика реакций первого порядка) определялась по тангенсу угла наклона из формулы (2):
где C0 – начальное, C – текущее значение концентрации красителя, t – время реакции.РЕЗУЛЬТАТЫ
Согласно данным рентгеновской дифракции (табл. 1) образец BTO состоит преимущественно из фазы оксикарбоната висмутила (орторомбическая сингония, PDF#04-014-4950) с присутствием фазы гидроксикарбоната висмутила (BiO)4CO3(OH)2 (орторомбическая сингония PDF#00-038-0579) и фазы оксида висмута α-Bi2O3 (моноклинная сингония PDF#04-016-7495). Появление углеродсодержащих фаз в структуре можно объяснить сушкой коллоидного раствора на воздухе и большим сродством висмута к углероду [11]. Титан содержащих фаз на рентгенограмме обнаружено не было, формируемый оксид титана предположительно находится в аморфном состоянии. Это следует из [12], где при ИЛА титана в воде показало, что получаемые наночастицы оксидных форм титана находятся в аморфном состоянии и только после отжига при 400°С структура приобретает дальний порядок. Данные СЭМ, представленные на рис. 1а показывают, что исходный материал состоит из пластинчатых (ламеллярных) образований, которые могут быть собраны в агломераты микронного размера. Пластинчатая структура обычно характерна для окси- и гидроксикарбонатов висмутила [13, 14]. Удельная поверхность BTO – максимальная из всех полученных образцов – 103 м2/г. После отжига при 600°С оксикарбонат висмутила разлагается и формируется титанат висмута со структурой Bi12TiO20 (кубическая сингония, PDF#00-034-0097), фаза α-оксида висмута остается в том же процентном соотношении. Согласно СЭМ поверхность образца после отжига состоит из частиц сложной формы размером несколько сотен нм (рис. 1б). Удельная поверхность после отжига значительно сокращается (<1 м2/г).
Таблица 1.
Фазовый состав, удельная поверхность и ширина запрещенной зоны исследуемых образцов
| Образец | Фазовый состав | SБЭT, м2/г | Eg, эВ | |
|---|---|---|---|---|
| фаза | содержание, % | |||
| BTO | Bi2O2CO3* | 85 | 103 | 3.39 |
| α-Bi2O3 | 15 | 2.95 | ||
| BTO_600 | Bi12TiO20 | 85 | <1 | 2.72 |
| α-Bi2O3 | 15 | – | ||
| BTO_hv | Bi2O2CO3* | 93 | 24 | 3.24 |
| α-Bi2O3 | 7 | – | ||
| BTOhv_600 | Bi12TiO20 | 93 | <1 | 2.80 |
| α-Bi2O3 | 7 | – | ||
| BTO_CO2 | Bi2O2CO3 | 90 | 18 | 3.42 |
| Bi (метал.) | 10 | – | ||
| BTO_CO2_600 | Bi12TiO20 | 100 | <1 | 2.86 |
| BTXO | Bi2O2CO3* | 85 | 10 | 3.41 |
| α-Bi2O3 | 15 | 2.95 | ||
| BTXO_600 | Bi12TiO20 | 80 | <1 | 2.76 |
| α-Bi2O3 | 20 | – | ||
Рис. 1.
СЭМ микрофотографии образцов, полученных при различных условиях синтеза: BTO (а); BTO_600 (б), BTO_hv (в), BTO_CO2 (г).

Для усиления взаимодействия индивидуальных коллоидов и формирования титаната висмута была проведена дополнительная лазерная обработкой смеси коллоидов. Лазерная обработка коллоидов может инициировать взаимодействие между частицами, влиять на фазовый состав и приводить к различным морфологическим изменениям [15, 16]. В данном случае лазерное облучение не привело к значительным изменениям фазового состава. У образца BTO_hv формируются те же фазы, но содержание оксида висмута уменьшается до 7%. Дополнительное лазерное облучение ведет к уменьшению площади удельной поверхности до 24 м2/г. Согласно СЭМ (рис. 1в) образец BTO_hv также состоит из ламеллярных образований, которые собраны в более крупные агломераты, по сравнению с образцом без лазерной обработки. После отжига при 600ºС в образце также формируется титанат висмута Bi12TiO20 и сохраняется 7% стабильного α-Bi2O3. Морфология образца BTOhv_600 аналогична морфологии образца BTO_600, а удельная поверхность <1 м2/г.
Так как образующийся в коллоидных растворах α-Bi2O3 является устойчивым соединением и не участвует в формировании структуры Bi12TiO20 для увеличения содержания фазы оксикарбоната висмута и уменьшении доли оксида висмута свежеприготовленная смесь коллоидов была обработана углекислым газом. В образце BTO_CO2 качестве основной фазы в структуре формируется оксикарбонат висмутила без примеси гидроксикарбоната и сохраняется металлический Bi (тригональная сингония, PDF#01-071-4643) в количестве 10%. Удельная поверхность образца составляет 63 м2/г. Согласно СЭМ, образец также представлен пластинчатыми образованиями (рис. 1г), которые собраны в агломераты. После отжига образец BTO_CO2_600 состоит только из монофазы Bi12TiO20 (кубическая сингония, PDF#00-034-0097). Согласно СЭМ, морфология образца BTO_CO2_600 аналогична морфологии BTO_600, представленной на рис. 1б. Отжиг образца также ведет к значительному сокращению удельной поверхности до <1 м2/г.
Для оценки влияния содержания α-Bi2O3 на оптические и фотокаталитические свойства BTO дополнительно был синтезирован образец с бóльшим содержанием α-Bi2O3. Для этого концентрация титана при синтезе была уменьшена в 2 раза и соотношение Bi : Ti составило 24 : 1. После сушки образец BTxO также как и BTO состоял из оксикарбоната висмутила с примесью гидроксикарбоната висмутила и α-Bi2O3. Количество α-оксида увеличилось до 15%. После отжига в образце BTxO_600 содержание α-Bi2O3 увеличивается до 20% (табл. 1). Увеличение содержания α-Bi2O3 при отжиге можно связать с тем, что при недостатке титана, часть разложившегося Bi2O2CO3 идет на формирование структуры Bi12TiO20, а часть разлагается с формированием α-Bi2O3. В пользу данного предположения также свидетельствует исследование фазовых превращений при абляции висмута в воде [17].
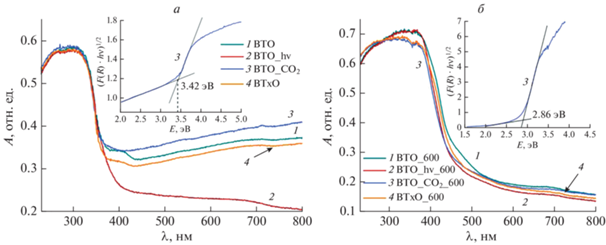
На рис. 2а и 2б представлены спектры поглощения полученных образцов. Все исходные образцы имеют один ярко выраженный край полосы поглощения в области 350 нм, который можно отнести к поглощению карбонатов висмутила с шириной запрещенной зоны от 3.14–3.45 эВ в зависимости от способа организации структуры [13]. В нашем случае рассчитанная ширина запрещенной зоны, оцененная для непрямозонного перехода, составила ~3.4 эВ (рис. 2а, вкладка). Для образцов BTO и BTxO в длинноволновой части спектра в области 400–450 нм поглощения наблюдается плечо, которое можно отнести к поглощению α-Bi2O3. α-оксид висмута, непрямозонный полупроводник с шириной запрещенной зоны 2.85–3.00 эВ. В данном случае ширина запрещенной зоны α-Bi2O3 составила 2.95 эВ. После отжига (рис. 2б) в спектрах поглощения образцов присутствует только выраженный длинноволновый край полосы поглощения в области 400–450 нм, рассчитанная ширина запрещенной зоны образцов варьируется от 2.72–2.86 эВ для прямозонного перехода (рис. 2б, вкладка). Эта Eg соответствует титанату висмута со структурой Bi12TiO20. Необходимо отметить, что ширины запрещенной зоны Bi12TiO20 и α-Bi2O3 близки, поэтому разделить их в спектре затруднительно. Можно предположить, что α-оксид приводит к размытию края полосы поглощения и появлению малоинтенсивного плеча в области 450 нм, для образцов BTO_600 и BTxO_600.
Рис. 2.
Спектры поглощения исходных образцов (а) и образцов после отжига 600°С (б). На вставках пример расчета ширины запрещенной зоны по методу Тауца.
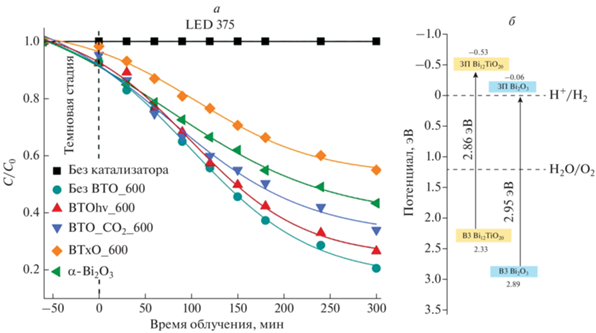
Результаты исследования ФК активности полученных материалов представлены в виде кинетических кривых (рис. 3а) и констант скорости разложения Родамина Б (табл. 2). В отсутствие катализатора разложение Родамина Б при облучении не происходит. Образец BTO_CO2_600 состоящий из монофазы Bi12TiO20 не показывает высокой ФК активности и разрушает краситель на 67% за пять часов облучения (k = 0.0035 мин–1). Более эффективно фоторазложение красителя происходит на катализаторах, содержащих примесь α-Bi2O3 до 15%. Для образцов BTO_600 и BTOhv_600, содержащих 7 и 15% α-Bi2O3, константы скорости разложения Родамина Б составили 0.0043 и 0.0051 мин–1, соответственно. Увеличение ФК активности BTO_600 и BTOhv_600 можно связать с формированием гетеропереходов II типа между Bi12TiO20 и α-Bi2O3 [18]. Основанием для данного предположения послужила теоретическая оценка положения валентной зоны и зоны проводимости согласно методике, представленной в [19–21]. С учетом экспериментально определенной по методу Тауца ширины запрещенной зоны (табл. 1), положение валентных зон и зон проводимости Bi12TiO20 и α-Bi2O3 (рис. 3б) близки к данным авторов [21]. Такой сформированный гетеропереход, относящийся ко II типу, благоприятен для разделения фотогенерированных носителей заряда и позволяет увеличивать эффективность ФК процесса [18]. Однако, при дальнейшем увеличении содержания α-Bi2O3 до 20% образец BTxO_600 ФК активность образца значительно падает. Сам α-Bi2O3 также имеет невысокую ФК активность (k = 0,0024 мин–1). Увеличение содержания α-Bi2O3 может уменьшить у поверхности площадь гетеропереходов II типа и/или увеличить число центров рекомбинации, что приведет к снижению ФК активности.
ЗАКЛЮЧЕНИЕ
Изучено влияние условий синтеза на структуру и морфологию титаната висмута, получаемого из индивидуальных коллоидов, синтезированных импульсной лазерной абляцией титана и висмута.
Показано, что дополнительное лазерное облучение коллоидов ведет к уменьшению площади удельной поверхности с 103 до 24 м2/г за счет укрупнения и агломерирования частиц и уменьшению содержания α-оксида висмута в образцах. Полностью избавиться от α-Bi2O3 помогает продувка свежеполученной смеси коллоидов углекислым газом. С другой стороны, увеличить количество α-Bi2O3 в конечном образце можно за счет уменьшения доли титана в образцах при синтезе.
Исследование ФК активности показало, что лучшую активность проявляют образцы, которые помимо фазы силленита Bi12TiO20 содержат до 15% α-Bi2O3 за счет формирования гетероструктуры между Bi12TiO20 и α-Bi2O3. Монофазный образец Bi12TiO20 и образец Bi12TiO20 с большим с содержанием α-оксида висмута (20%) наименее активны при разложении Родамина Б.
Работа выполнена при поддержке Российского научного фонда (проект № 19-73-30026).
Список литературы
Bubbarao E.C. // Phys. Rev. 1961. V. 122. No. 3. P. 804.
Fouskova A., Cross L.E. // J. Appl. Phys. 1970. V. 41. No. 7. P. 1834.
Chiang Y.M., Farrey G.W., Soukhojak A.N. // Appl. Phys. Lett. 1998. V. 73. No. 25. P. 3683.
Naciri Y., Hsini A., Ahdour A. et al. // Chemosphere. 2022. V. 300. Art. No. 134622.
Wei W., Dai Y., Huang B.B. // J. Phys. Chem. C. 2009. V. 113. P. 5658.
Subohi O., Kumar G.S., Malik M.M. // Optik. 2013. V. 124. P. 2963.
Xu S., Shangguan W., Yuan J. et al. // Mater. Sci. Engin. B. 2007. V. 137. P. 108.
Fang G., Wang L., Zhang G. et al. // Ceram. Int. 2018. V. 44. Art. No. 16388.
Mihailescu I.N., Caricato A.P. Pulsed laser ablation: advances and applications in nanoparticles and nanostructuring thin films. Singapore: Jenny Stanford Publishing, 2018. 580 p.
Zeng H., Du X.-W., Singh S.C. et al. // Adv. Funct. Mater. 2012. V. 22. P. 1333.
Shabalina A.V., Fakhrutdinova E.D., Golubovskaya A.G. et al. // Appl. Surf. Sci. 2022. V. 575. Art. No. 151732.
Fakhrutdinova E.D., Shabalina A.V., Gerasimova M.A. et al. // Materials. 2020. V. 13. Art. No. 2054.
Cen W., Xiong T., Tang C. et al. // Ind. Engin. Chem. Res. 2014. V. 53. Art. No. 15002.
Dong F., Xiong T., Wang R. et al. // Dalton Trans. 2014. V. 43. P. 6631.
Izgaliev A.T., Simakin A.V., Shafeev G.A. et al. // Quantum Electron. 2004. V. 34. No. 1. P. 47.
Adams D.P., Murphy R.D., Saiz D.J. et al. // Surf. Coat. 2014. V. 248. P. 38.
Svetlichnyi V.A., Fakhrutdinova E.D., Nazarova T.S. et al. // Solid State Phenom. 2020. V. 312. P. 172.
Wang Y., Wang Q., Zhan X. et al. // Nanoscale. 2013. V. 5. P. 8326.
Butler M.A., Ginley D.S. // J. Electrochem. Soc. 1978. V. 125. P. 228.
Nethercot Jr. A.H. // Phys. Rev. Lett. 1974. V. 33. P. 1088.
Wang L., Li H., Zhang S. et al. // Solid State Sci. 2020. V. 100. Art. No. 106098.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая